ген s белка коронавируса что это такое
Мутации коронавируса в свете третьей волны пандемии инфекции COVID-19
6 мая
Неблагополучная эпидемиологическая обстановка в мире, резкое увеличение заболеваемости в станах Европы и Америки, наличие новых, мутировавших штаммов вируса SARS-CoV-2 свидетельствуют о возможных рисках начала 3-й волны пандемии и в Российской Федерации.
По данным на конец апреля 2021 года, общее количество зараженных вирусом SARS-CoV-2 в мире составляет более 142 млн. человек, число погибших – более 3 млн. Таким образом, количество случаев заражения за последние 2 недели – с 06.04.21 по 19.04.21 увеличилось на 10 млн. человек. В России на эту же дату общее число заболевших составляет более 4,5 млн. человек, погибших – более 105 тысяч человек.
Приведенные сведения убедительно свидетельствуют о 3-й волне пандемии, которая официально зафиксирована во многих странах мира. Данные обстоятельства связаны с формированием и широким распространением штаммов коронавируса SARS-CoV-2, подвергшимся генетическим мутациям.
Мутация представляет собой молекулярно-биологический процесс, когда в процессе вирусной репликации происходят «сбивки» на этапах транскрипции и трансляции, т.е. во время «перезаписи» генетического кода с РНК вируса на ДНК клетки хозяина. Такие ошибки в ДНК приводят к формированию измененных генов, кодирующих белки вируса, вследствие чего появляются такие новые вирусы-мутанты, с измененными свойствами собственных белков.
Главные мутации короновируса происходят в гене гликопротеинового S-белка. Так, мутация в S белке приводит к замене аспарагиновой аминокислоты (сокращенно D) на аминокислоту глицин (сокращенно G). Американские исследователи экспериментально показали, что давно обсуждаемая мутация D614G в гене S-белка коронавируса SARS-CoV-2 повышает его инфекционность, поэтому данный вариант вируса распространяется быстрее. Вирусный белок с такой мутацией также и более стабилен. Мутации в рецептор-связывающем домене (RBD-receptor binding domain), обладают более высоким сродством к рецептору ангиотензин-превращающего фермента 2 типа (АСЕ2) эпителиальных клеток человека, что позволяет коронавирусу увереннее в них проникать.
Основные мутационные линии вируса SARS-CoV-2:
3. «Бразильский» штамм коронавируса. Название: B.1.1.248. «Бразильский» штамм наиболее заразный на сегодняшний день. Он обладает устойчивостью к иммунитету, приобретенному после первой волны коронавируса. Итак, основная мутация коронавируса содержится в гене, кодирующем синтез S-белка («шипа», Spike). Данная мутация характерна и для двух других штаммов — «южноафриканского» и «бразильского». Эта мутация, изменяет форму «шипа» (S-белка), с помощью которого он эффективнее прикрепляется к рецептору ACE2. По данным авторов, «британский» штамм с указанной мутацией на 50-70% заразнее, чем классический вирус SARS-CoV-2.
7. Сибирский и Северо-западный штамм короновируса. Это вновь формируемые новые мутации на территории России. Пока данных об этих штаммах немного, но известно, что мутации также происходят в зоне гена, ответственного за S-белок.
По данным Роспотребнадзора на 16 апреля 2021 года в РФ идентифицированы 192 образца британского штамма, 21 – южноафриканского штамма.
Исследователи из Великобритании сообщили, что риск смерти у людей, зараженных «британским» штаммом B.1.1.7, выше, чем у зараженных другими штаммами, в среднем на 64%. Абсолютный риск смерти возрастает от 2,5 до 4,1 смертей на 1000 случаев заражения.
Ученые из Кейптауна и Йоханнесбурга (ЮАР) исследовали антитела у 89 человек, госпитализированных с COVID-19 в начале 2021 года. Авторы показали, что COVID-19, перенесенный во время первой волны, не дает защиты от некоторых новых вариантов вируса. Однако у людей, инфицированных «южноафриканским» штаммом SARS-CoV-2, есть нейтрализующие антитела против старых вариантов вируса, а также против «бразильского» штамма.
Ученые из США исследовали когорту беременных и кормящих матерей, получивших вакцину Pfizer/BioNTech или Moderna. Они показали, что уровни IgG, IgA и IgM к S-белку и рецептор-связывающему домену (RBD) увеличивались в крови женщин из обеих групп. Антитела, особенно IgG, передавались ребенку через плаценту и материнское молоко. Авторы показали, что материнские IgG могут преодолевать плацентарный барьер. IgG к S-белку и RBD-домену были обнаружены во всех десяти образцах пуповинной крови. Уровень антител к SARS-CoV-2 был значительно выше у вакцинированных женщин, чем у переболевших COVID-19 а концентрация IgG в крови матери увеличивалась после второй дозы вакцины.
Данный факт свидетельствует в пользу проведения вакцинации данного контингента.
Японские ученые, в частности Yoriyuki Konno с соавторами в работе 20 года показали, что белок, экспрессируемый с гена ORF3b нового коронавируса SARS-CoV-2 сильно подавляет синтез интерферонов I типа у пациентов с COVID-19./ При этом вирус чувствителен к интерферонам, что говорит об их потенциальной эффективности для терапии коронавирусной инфекции [13].
В этой связи, в клиническом плане представляется целесообразным в качестве мер активной противовирусной защиты обеспечить пациентам назначение препаратов рекомбинантного интерферона –α2b с антиоксидантами, как в довакцинный период, когда идет процесс образования вируснейтрализующих антител, так и в поздний поствакцинный период, когда титр антител после проведенной вакцинации начинает снижаться.
Новые ущербы от инфекции SARS-CoV-2 за пределами дыхательной системы
Автор
Редакторы
Статья на конкурс «Био/Мол/Текст»: Все мы помним, как с начала декабря 2019 года в китайском городе Ухань был выявлен ряд случаев пневмонии, связанных с коронавирусной инфекцией COVID-19 c серьезными симптомами, такими как респираторные проблемы (кашель, одышка, поражение легких) и лихорадка. Но вы когда-нибудь задумывались о том, что же происходит с остальными органами нашего тела? Так давайте разберём, как крошечный вирус может поражать не только дыхательную систему, но и вызвать повреждение других систем человеческого организма.
Конкурс «Био/Мол/Текст»-2020/2021
Эта работа опубликована в номинации «Школьная» конкурса «Био/Мол/Текст»-2020/2021.
Генеральный партнер конкурса — ежегодная биотехнологическая конференция BiotechClub, организованная международной инновационной биотехнологической компанией BIOCAD.

Партнеры номинации — медико-биологическая школа «Вита» и «Новая школа».
Спонсор конкурса — компания SkyGen: передовой дистрибьютор продукции для life science на российском рынке.
Спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.
Введение
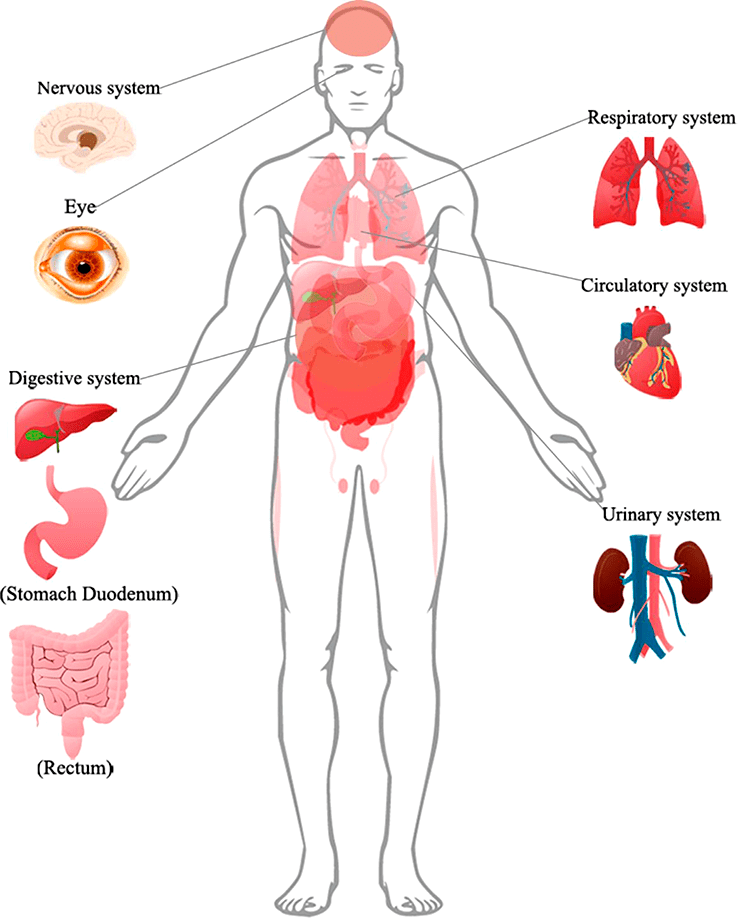
Согласно исследованиям немецких ученых, SARS-CoV-2 проникает внутрь организма с помощью клеточного рецептора — ангиотензинпревращающего фермента 2 (АПФ2; ACE2 — англ.), который специфически синтезируется в определенных органах и тканях. Соответственно, ACE2 играет важную роль в регуляции сердечно-сосудистой, кишечной, почечной и репродуктивной функций [1]. Попав в систему кровообращения, коронавирус, вероятнее всего, распространяется через кровоток [2]. Следуя этим данным, мы можем понять, как SARS-CoV-2 заражает не только дыхательную систему, но и представляет потенциальную угрозу для пищеварительной и мочеполовой систем, ЦНС и системы кровообращения.
Рисунок 1. Поражения органов, подтвержденные клиническими признаками или биопсией, у пациентов с COVID-19
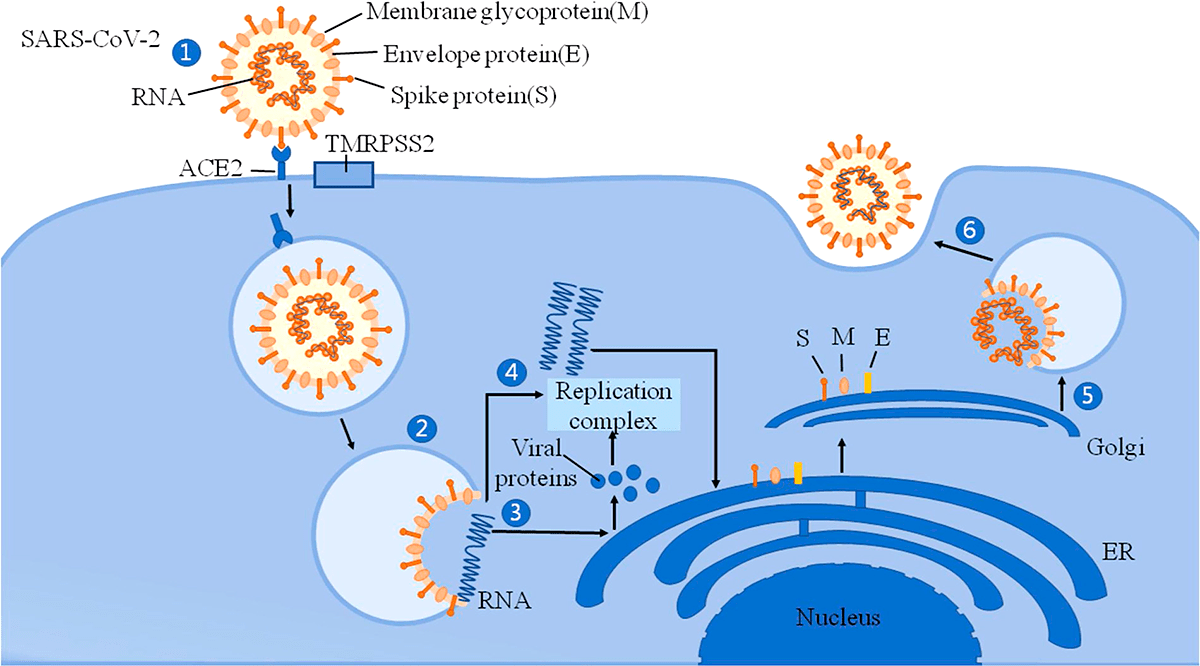
Рисунок 2. Механизм вторжения SARS-CoV-2 в клетку
SARS-CoV-2 и пищеварительная система
Помимо главного рецептора ACE2, SARS-CoV-2 использует трансмембранную сериновую протеазу 2 (TMRPSS2), фермент, который также экспонируется на эпителиальных клетках тонкой кишки. Он способствует проникновению вируса в клетки [3]. Активность SARS-CoV-2 может вызывать модификации ACE2 в кишечнике, которые повышают восприимчивость к воспалению кишечника и диарее. ACE2 оказывает значительное влияние на состав кишечной микробиоты [4]. Первичные воспалительные стимулы вызывают высвобождение в систему кровообращения микробных продуктов и цитокинов, которые могут вызвать микробный дисбиоз и воспалительную реакцию.
Изменения микробиоты кишечника могут быть связаны с изменениями в иммунной системе и предрасположенностью к более серьезным последствиям COVID-19. Наш микробиом меняется с возрастом: в первые несколько лет жизни микробиота малоразнообразна и нестабильна [5], [6]; во взрослом возрасте стабильна и разнообразна, а к пожилому возрасту разнообразие микробиоты уменьшается, а дисбиоз увеличивается, что связывают с когнитивным дефицитом, депрессией и воспалением [7]. Сниженное разнообразие микробиоты — еще один фактор риска заражения COVID-19 для пожилых людей.
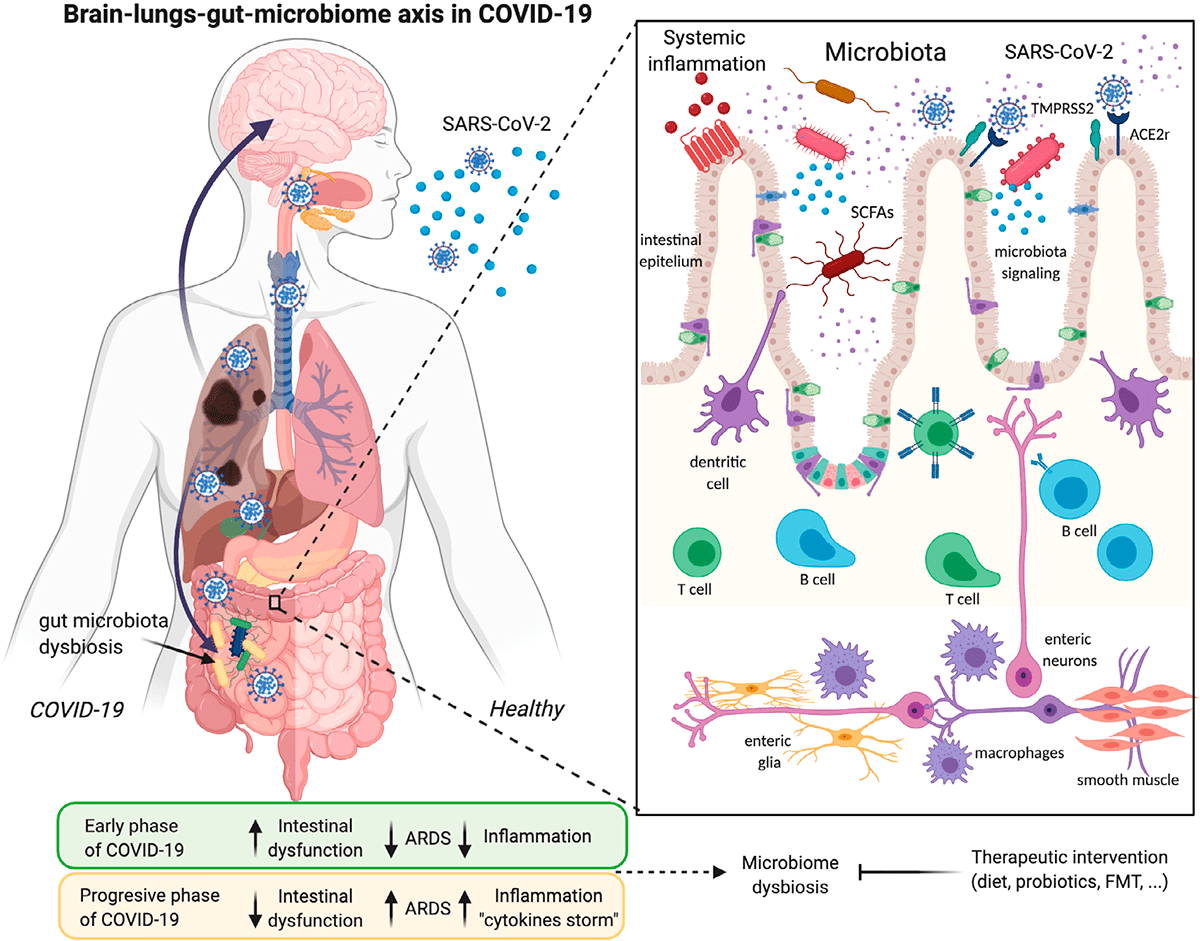
Рисунок 3. Инфекция SARS-CoV-2 и ее связи с осью легких—кишечника—мозга и дисбиозом микробиома
Изменение кишечной флоры также связано с ожирением, еще одним фактором риска для тяжелого течения COVID-19 [8], [9]. Жировая ткань может служить резервуаром для распространения SARS-CoV-2 и активации системного иммунитета [10]. Коронавирусная инфекция вызывает изменения в кишечной бактериальной флоре, которые могут повлиять на ось «кишечник—мозг». Таким образом, кишечная флора играет решающую роль в регуляции неврологических функций, таких как депрессия или тревога [11].
Следовательно, режим питания играет значительную роль во время заражения вирусом SARS-CoV-2. Из-за вирусной инфекции иногда начинается дисбиоз, который может быть скомпенсирован компонентами диеты и пробиотиками [12]. Несколько исследований показывают, что оптимальный иммунный ответ зависит от правильного питания [13], [14]. Недоедание может поставить под угрозу иммунитет, тем самым влияя на уязвимость ответа на COVID-19. Потребление достаточного количества белка имеет решающее значение для выработки антител, поддержания ворсинчатой морфологии кишечника и уровня кишечного иммуноглобулина, что улучшает кишечный барьер [15–17]. Таким образом, высококачественные белки являются важным компонентом противовоспалительной диеты, которая включает омега-3 жирные кислоты, витамины С и Е, фитохимические вещества, которые широко присутствуют в продуктах растительного происхождения (фруктах, овощах, орехах, злаках и т.д.) [18–21]. Правильная диета укрепляет иммунную систему и способствует защите организма от тяжелого течения COVID-19.
SARS-CoV-2 и центральная нервная система (ЦНС)
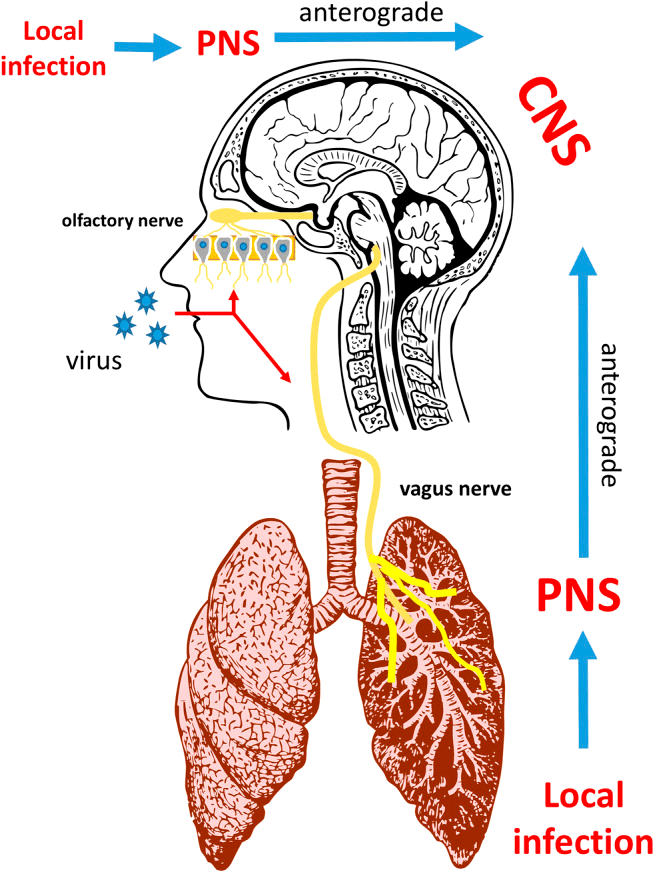
Кроме пищеварительной системы, коронавирусная инфекция (COVID-19) также затрагивает центральную и периферическую нервную систему. Неврологические проявления могут возникать по разным причинам, включая прямое вирусное поражение центральной нервной системы (ЦНС) и иммунноопосредованные процессы. Примеры заболеваний ЦНС при COVID-19 могут включать энцефалит (воспаление головного мозга), менингит и инсульт. В периферической нервной системе COVID-19 ассоциируется с дисфункцией обоняния и вкуса, повреждением мышц и синдромом Гийена—Барре, при котором иммунная система человека поражает собственные периферические нервы.
Рисунок 4. Коронавирусная инфекция и нервная система
Ученые Университета Гонконга отметили, что механизмы инфекции SARS-CoV-2 могут быть аналогичны механизмам инфекции SARS-CoV из-за 79,5% сходства последовательностей РНК этих двух коронавирусов [22]. Однако SARS-CoV-2 обладает более мощной способностью к распространению, чем SARS-CoV и MERS-CoV. Причина в том, что SARS-CoV-2 и ACE2 обладают более сильной связывающей способностью [23]. S-белок (спайк-белок) на поверхности коронавируса связывается с ACE2 и прикрепляется к поверхности клетки; затем сериновая протеаза (TMPRSS2) активирует S-белок, что помогает вирусу проникать в нейрон [1]. Так как клетки кровеносных сосудов экспонируют ACE2 в большом количестве, SARS-CoV-2 может атаковать эндотелиальные клетки в кровеносных сосудах головного мозга через этот рецептор и нарушить гематоэнцефалический барьер (ГЭБ — барьер между кровеносной системой и центральной нервной системой). Нарушенный ГЭБ может способствовать вторжению вируса в ткани мозга и нейроны и привести к серьезным неврологическим осложнениям [24].
SARS-CoV-2 и система кровообращения
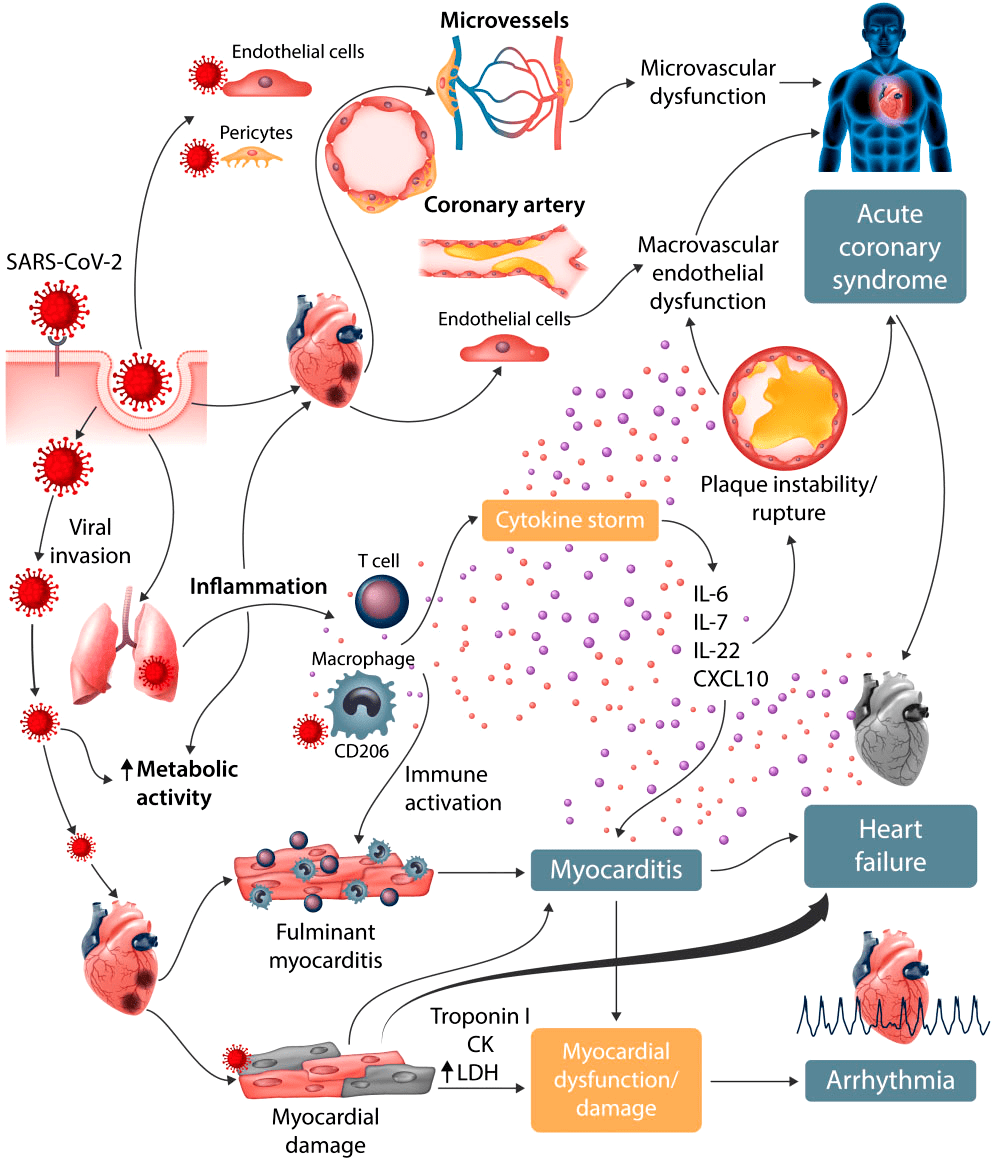
Помимо дыхательных путей, SARS-CoV-2 поражает сердечно-сосудистую систему. Это приводит к высвобождению высокочувствительных сердечных тропонинов (hs-cTnl) — белков, содержащихся в сердце и скелетных мышцах человека. В процессе заражения мембраносвязанный белок ACE2 может расщепляться трансмембранным дезинтегрином ADAM17, высвобождая ACE2 в кровоток. Таким образом, вирус циркулирует в крови зараженного организма. Воспаление сосудистой системы и миокарда может привести к миокардиту, сердечной недостаточности и быстрому ухудшению состояния больного [25].
Рисунок 5. Сердечно-сосудистое поражение при COVID-19
SARS-CoV-2 и мочеполовая система
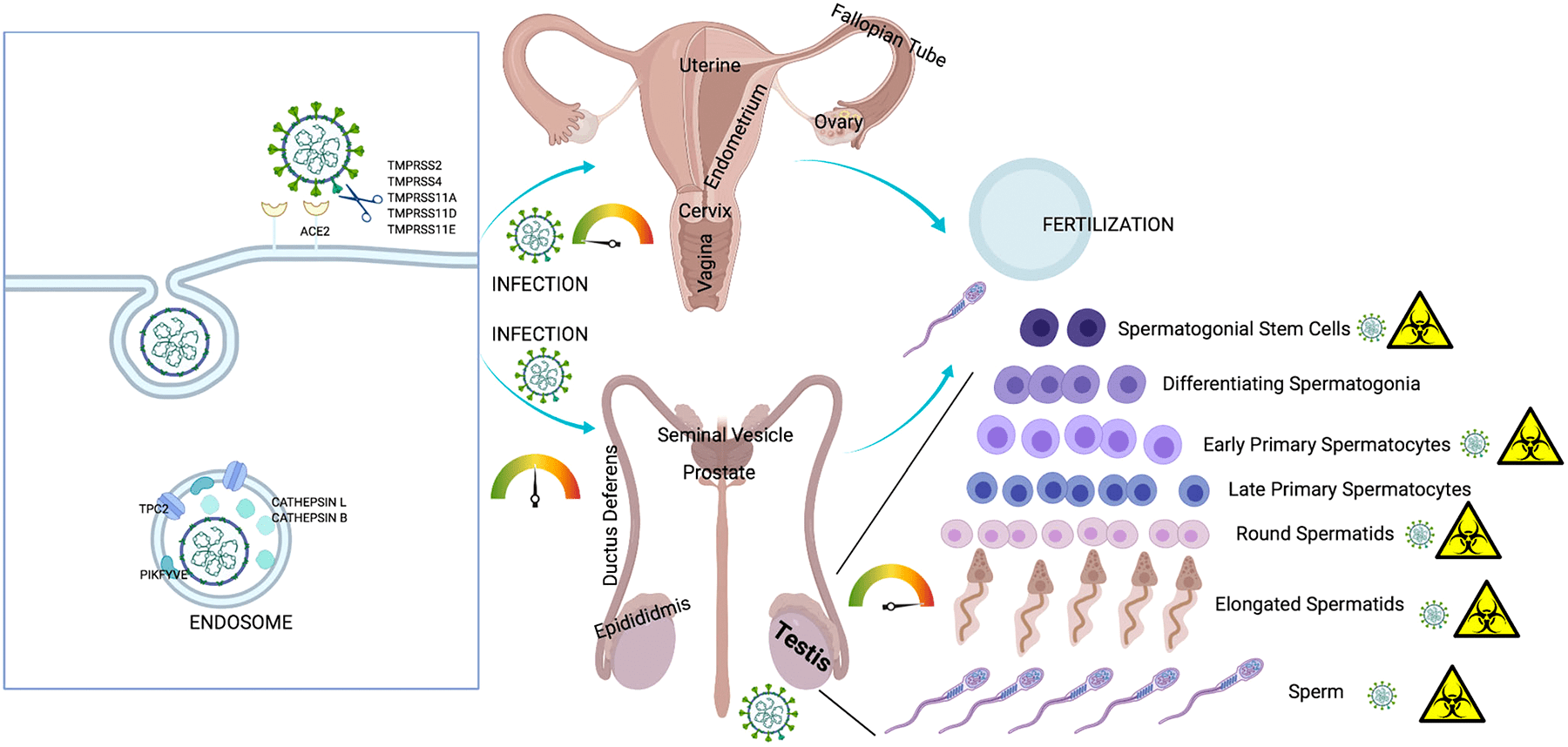
Инфекция репродуктивной системы требует большего внимания, потому что она не только влияет на нынешнее поколение, но также может распространяться на потомство через поврежденные гаметы. На сегодняшний день несколько исследований подтвердили влияние SARS-CoV-2 как на мужскую, так и на женскую репродуктивную систему [26], [27]. В настоящее время хорошо известен факт, что мужчины более восприимчивы к инфекции SARS-CoV-2 и у них выше уровень смертности, чем у женщин. Это объясняется тем, что клетки семенного протока и сперматогонии синтезируют много ACE2 [28–30].
По мнению ученых, SARS-CoV-2 нарушает репродуктивные функции мужчин через несколько механизмов, таких как воспалительные реакции, окислительный стресс и апоптоз [31–33]. Инфекция SARS-CoV-2 приводит к перепроизводству активных форм кислорода, которые могут усиливать внутриклеточные сигнальные пути (NF-κB-TLR). Это приводит к высвобождению цитокинов, что еще больше усиливает воспалительный ответ. К примеру, орхит, вызванный инфекцией SARS-CoV-2, может привести к окислительному стрессу в тканях яичка. Окислительный стресс может вызвать внутриклеточное окислительное повреждение сперматозоидов, что приводит к ухудшению их качества и мужскому бесплодию.
Рисунок 6. Инфекция SARS-CoV-2 и репродуктивная система
Рецепторы ACE2 были также обнаружены в женских яичниках [34], [35]. Можно предположить, что SARS-CoV-2 поражает ткань яичников и клетки гранулезы и таким образом ухудшает функцию яичников и жизнеспособность ооцитов, что может привести к бесплодию или невынашиванию [33]. Недавно ученые (Виванти и др.) сообщили о трансплацентарной передаче вируса от матери, инфицированной COVID-19, новорожденному. Мать была инфицирована в последнем триместре беременности, и гены SARS-CoV-2 были обнаружены в ткани плаценты. Согласно этому отчету, трансплацентарная передача может привести к воспалению плаценты [36]. Однако стоит отметить, что плацента имеет плацентарный барьер, который не смешивает кровь матери и плода, тем самым защищая плод от всех видов материнской инфекции. Невосприимчивые клетки плаценты обладают противовирусными свойствами, которые дополнительно предотвращают проникновение SARS-CoV-2 в клетки ребенка [37].
Вывод
Прочитав эту статью, мы с вами узнали, как вирус поражает не только дыхательную систему, но и другие системы человека. Это осложняет потенциальные клинические проявления и затрудняет лечение случаев COVID-19. Однако биомедицинские исследования могут помочь нам больше узнать о способностях нового коронавируса и о том, как с ним бороться, чтобы определить важные ориентиры для дальнейших исследований, диагностики и лечения. Также стоит всегда помнить, что соблюдая правильную диету и карантинные меры, мы снижаем риски заражения и ухудшения состояния здоровья во время COVID-19. Ведь вирус не всегда может вызвать вышеуказанные осложнения, если мы будем правильно заботиться о своем здоровье.
Поствакцинальный иммунитет к Коронавирусу
При введении вакцины в организм человека попадают отдельные белки вируса (безопасная часть), стимулирующие синтез антител еще до контакта с вирулентным микроорганизмом. При правильной реакции иммунитета на вакцинацию или вирусное вторжение в организме вырабатывается достаточный уровень иммуноглобулинов для дальнейшей защиты.
Вакцинальные препараты, зарегистрированные в 2020 году, содержат ген гликопротеина S. Спустя время у привитых людей ожидается появление антител, специфичных к S-протеину SARS-CoV-2. С учетом этого напряженность (степень защиты) поствакцинального иммунитета определяют при помощи теста на антитела класса IgG к спайковому (S) белку коронавируса.
Что представляет собой спайковый протеин (S)?
Одним из 4-х структурных белков коронавирусной оболочки является спайковый (spike — S). Именно он придает коронообразное очертание («шипики») этой вирусной частице. Хорошо рассмотреть его можно при электронной криомикроскопии. Протеин S обеспечивает проникновение вируса в клеточные структуры, что приводит к заражению.
Формирование иммунного ответа
После проникновения вирулентного агента в организм, иммунитет инициирует выработку иммуноглобулинов. Они необходимы для распознавания и связывания потенциально опасных антигенов. Если человек заболел недавно, во время острой стадии инфицирования в его организме первыми синтезируются IgM-антитела. Спустя 2-3 недели в ответ на антигенный стимул синтезируются антитела класса IgG.
Особенно активный ответ иммунитета вызывают 2 иммуногенных протеина коронавируса:
Для тех, кто провакцинировался и хочет проверить эффективность проведенной процедуры, целесообразно выбрать тип теста, который определяет антитела к спайковому (S) антигену вируса.
Механизм действия вакцины «Спутник V»
«Спутник V» — это российская вакцина с двухвекторной структурой. Вирусные векторы не способны размножаться и провоцировать заболевание. Но с их помощью можно доставить внутрь клетки вирусный генетический материал. Когда вектор с геном, кодирующим спайковый протеин, оказывается внутри человеческой клетки, начинается выработка S-белка.
Иммунитет человека, получившего вакцину, синтезирует иммуноглобулины класса G к антигену белка Spike SARS-CoV-2. Если в будущем такое лицо окажется в зоне воздействия коронавирусной инфекции, то в его крови уже будут присутствовать антитела. Именно они являются показателями поствакцинального иммунитета. После применения российского препарата судить об иммунитете можно после введения 2-х доз вакцины с интервалом в 21 день.
Оценка поствакцинального иммунного ответа
Антитела, нейтрализующие активность коронавируса, препятствуют связыванию гликопротеина S с ACE2. Последний является мембранным белком человека, который служит рецептором и точкой входа для коронавируса. RBD — структурный домен гликопротеина S принимает в этом непосредственное участие. Когда антитела его связывают, то контакт вируса с мембранным белком ACE2 блокируется.
Защищают от COVID не любые IgG-антитела, а именно анти-RBD. Даже после перенесенной болезни их может быть недостаточно в организме. Или же они могут полностью исчезнуть через полгода после инфицирования. Для оценки реальной устойчивости к COVID у пациента на момент тестирования, необходимо использовать только тест-системы нового поколения, которые выявляют наличие нейтрализующих антител к RBD (Anti-SARS-CoV-2).
В результате исследования можно подтвердить или опровергнуть наличие защитных свойств приобретенного иммунитета. А также такой тест позволяет увидеть динамику роста нейтрализующих антител к RBD и оценить степень защиты поствакцинального иммунитета. Для динамического наблюдения за показателями иммунитета рекомендуется выполнять исследование в одной лаборатории и по одной технологии.
В нашей клинике Вы можете сдать все анализы, в том числе и на АТ к новой Коронавирусной инфекции. Посмотреть цены
Спайк-белок коронавируса сам по себе вызвал нарушения свертываемости крови
Lize M. Grobbelaar et al. / medRxiv, 2021
Биологи провели микроскопические исследования образцов крови здоровых людей с добавленным спайковым белком коронавируса и без него, а также пациентов, больных ковидом. Исследователи заметили, что добавление в кровь свободного S-белка вызывало формирование амилоидных сгустков и изменения формы клеток крови. Кроме того, ученые смоделировали ток плазмы в сосудах и экспериментально показали, что у пациентов с ковидом он может быть сильно затруднен. Препринт статьи опубликован на портале medRxiv.
Вызываемую SARS-Cov-2 инфекцию можно охарактеризовать беспрецедентными для других респираторных инфекций патологиями. Среди них – нарушения свертываемости крови (коагулопатии), которые могут приводить либо к кровотечениям, либо тромбозам. Связывание спайкового S-белка с рецепторами в момент проникновения вируса в клетку может вызывать клеточные патологии, но само по себе не может объяснить такую распространенность коагулопатии у пациентов. Однако S-белок путешествует в организме и сам по себе отдельно от вируса, высвобождаясь из инфицированных клеток: его, например, находили в мочеиспускательном канале. Частицы этого белка также могут проникать сквозь гематоэнцефалический барьер.
Ученые из Университета Стелленбоша под руководством Итерезии Преториус (Etheresia Pretorius) изучили способность частиц S-белка взаимодействовать напрямую с тромбоцитами и белком фибриногеном, вызывая в нем изменения и, как следствие, нарушения свертываемости крови. Сначала исследователи при помощи флуоресцентной микроскопии проверили, накапливаются ли аномальные амилоидные комплексы в плазме здоровых людей с добавлением частиц S-белка и без них. В образцы с добавлением одного нанограмма на миллилитр S-белка добавляли тромбин (активатор коагуляции) и делали микрофотографии. В тех образцах, куда попал вирусный белок, формировались более плотные фибриновые сгустки. В образцах цельной крови спайковый белок вируса вызывал гиперактивацию тромбоцитов.
Плазма здоровых людей без добавления спайк-белка (А) и с ним (В). После добавления тромбина в образцах с S-белком формируются более плотные сгустки.
Генетические варианты SARS-CoV-2: что они означают?
В ходе пандемии, вызванной коронавирусом тяжелого острого респираторного синдрома 2 (SARS-CoV-2), клинические и научные сообщества и системы общественного здравоохранения были вынуждены реагировать на новые генетические варианты вируса. Каждый новый вариант вызвал шквал внимания со стороны средств массовой информации, различные реакции научного сообщества и призывы правительств либо «сохранять спокойствие», либо принять немедленные контрмеры. Хотя многие ученые первоначально скептически относились к значимости мутации D614G, появление нового «британского варианта» — линии B.1.1.7 — вызвало широкую озабоченность. Чтобы понять, какие именно варианты вызывают обеспокоенность и почему, необходимо разобраться в эволюции вируса и геномной эпидемиологии SARS-CoV-2.
Дорогие коллеги, компания BestDoctor ищет среди наших подписчиков людей на позиции врача-консультанта, врача-куратора и врача-терапевта для онлайн-консультаций.
Мутации, варианты и распространение
Мутации возникают как естественный побочный продукт репликации вирусов [1]. Частота мутаций у РНК-вирусов обычно выше, чем у ДНК-вирусов. Однако у коронавирусов происходит меньше мутаций, чем у большинства других РНК-вирусов, потому что они кодируют фермент, который исправляет некоторые ошибки, возникающие во время репликации. Как правило, судьба вновь возникшей мутации определяется естественным отбором. Частота тех мутаций, которые дают вирусу конкурентное преимущество в отношении репликации, распространения или ухода от иммунитета, будет увеличиваться, а те, которые снижают приспособленность вируса, склонны отбраковываться из популяции циркулирующих вирусов. Однако частота мутаций также может увеличиваться и уменьшаться в результате случайных событий. Например, «эффект основателя» возникает, когда в ходе распространения ограниченное число отдельных вирусов создает новую популяцию. Мутации, присутствующие в геномах этих вирусов-предков, будут доминировать в популяции независимо от их влияния на приспособленность. Такое же взаимодействие естественного отбора и случайных событий формирует эволюцию вируса внутри хозяев, в различных сообществах и странах.
Хотя термины «мутация», «вариант» и «штамм» при описании эпидемиологии SARS-CoV-2 часто используются как взаимозаменяемые, важно понимать различия между ними. Термин «мутация» относится к фактическому изменению последовательности (ДНК или белка): D614G обозначает замену аспарагиновой кислоты на глицин в положении 614 гликопротеина шиповидных отростков (S-белка). Геномы, последовательности которых различаются, часто называют вариантами. Этот термин несколько менее точен, поскольку два варианта вируса могут отличаться одной или несколькими мутациями. Строго говоря, вариант — это штамм, обладающий явно отличающимся фенотипом (например, различиями в антигенности, трансмиссивности или вирулентности).
Оценка нового варианта SARS-CoV-2 должна включать в себя ответы на следующие вопросы: достиг ли вариант доминирующего положения в результате естественного отбора или случайных событий? Если имеющиеся данные свидетельствуют о естественном отборе, то какие мутации подверглись отбору? Каково адаптивное преимущество этих мутаций? Какое влияние эти мутации оказывают на трансмиссивность и распространение, антигенность или вирулентность?
Мутация D614G S-белка
Мутация D614G гликопротеина шиповидных отростков (S-белка) SARS-CoV-2 была впервые обнаружена на значительном уровне в начале марта 2020 года и в течение следующего месяца достигла глобального доминирования [2]. По-видимому, изначально мутация возникла независимо и одновременно распространилась по нескольким географическим регионам. Эта очевидная конвергентная эволюция наводит на мысль о естественном отборе и адаптивном преимуществе D614G. Однако при последующих секвенированиях мутация D614G была выявлена в вирусах, которые были распространены в нескольких китайских провинциях в конце января. Это свидетельствует в пользу того, что глобальное распространение этой мутации могло быть результатом случайных событий с «эффектом основателя», когда вирусы, несущие 614G, просто инициировали большинство ранних случаев передачи в нескольких местах.
Такая правдоподобная нулевая гипотеза заставила многих в эволюционном сообществе усомниться, что мутация D614G была адаптивной, несмотря на данные, полученные in vitro, которые показывают ее влияние на связывание с рецепторами. Недавний популяционно-генетический и филодинамический анализ более 25 000 последовательностей из Великобритании показал, что вирусы, несущие 614G, по-видимому, действительно распространяются быстрее и дают начало более крупным филогенетическим кластерам, чем вирусы, несущие 614D [3]. Величина эффекта в данном анализе была умеренной, и различные модели не всегда достигали статистической значимости. Совсем недавно дополнительное исследование на животных показало, что вирусы, несущие 614G, передаются более эффективно [4, 5].
Мутация N453Y S-белка и норки
Тревожные вспышки SARS-CoV-2 начали происходить на норковых фермах в Нидерландах и Дании в конце весны и начале лета 2020 года [6]. Геномные и эпидемиологические исследования ранней вспышки в Нидерландах показали передачу вируса от человека к норке, от норки к норке и от норки к человеку [7]. В начале ноября 2020 года датские власти сообщили о 214 случаях заболевания человека коронавирусной инфекцией (COVID-19), связанных с норковыми фермами. Многие последовательности SARS-CoV-2 в Нидерландах и Дании несли мутацию Y453F в рецептор-связывающем домене S-белка, которая может усиливать его способность связываться с АПФ2 (ангиотензинпревращающим ферментом 2) у норок. У одиннадцати человек, заразившихся во время датской вспышки, обнаружен вариант вируса под названием «кластер 5», несущий в гене S-белка три дополнительные мутации (del69_70, I692V и M1229I). Первоначальное исследование девяти образцов сыворотки выздоравливающих людей показало умеренное и статистически значимое снижение нейтрализующей активности антител против вирусов из кластера 5 (в среднем в 3,58 раза; диапазон 0–13,5). Очевидная адаптация SARS-CoV-2 к норке, тем не менее, вызывает беспокойство, поскольку продолжающаяся эволюция вируса в организме животных-носителей потенциально может привести к повторным передачам нового SARS-CoV-2 от норки к человеку и другим млекопитающим. По этой причине многие страны активизировали усилия по эпиднадзору и в некоторых случаях осуществили крупномасштабные выбраковки (то есть выборочный забой) норок на фермах.
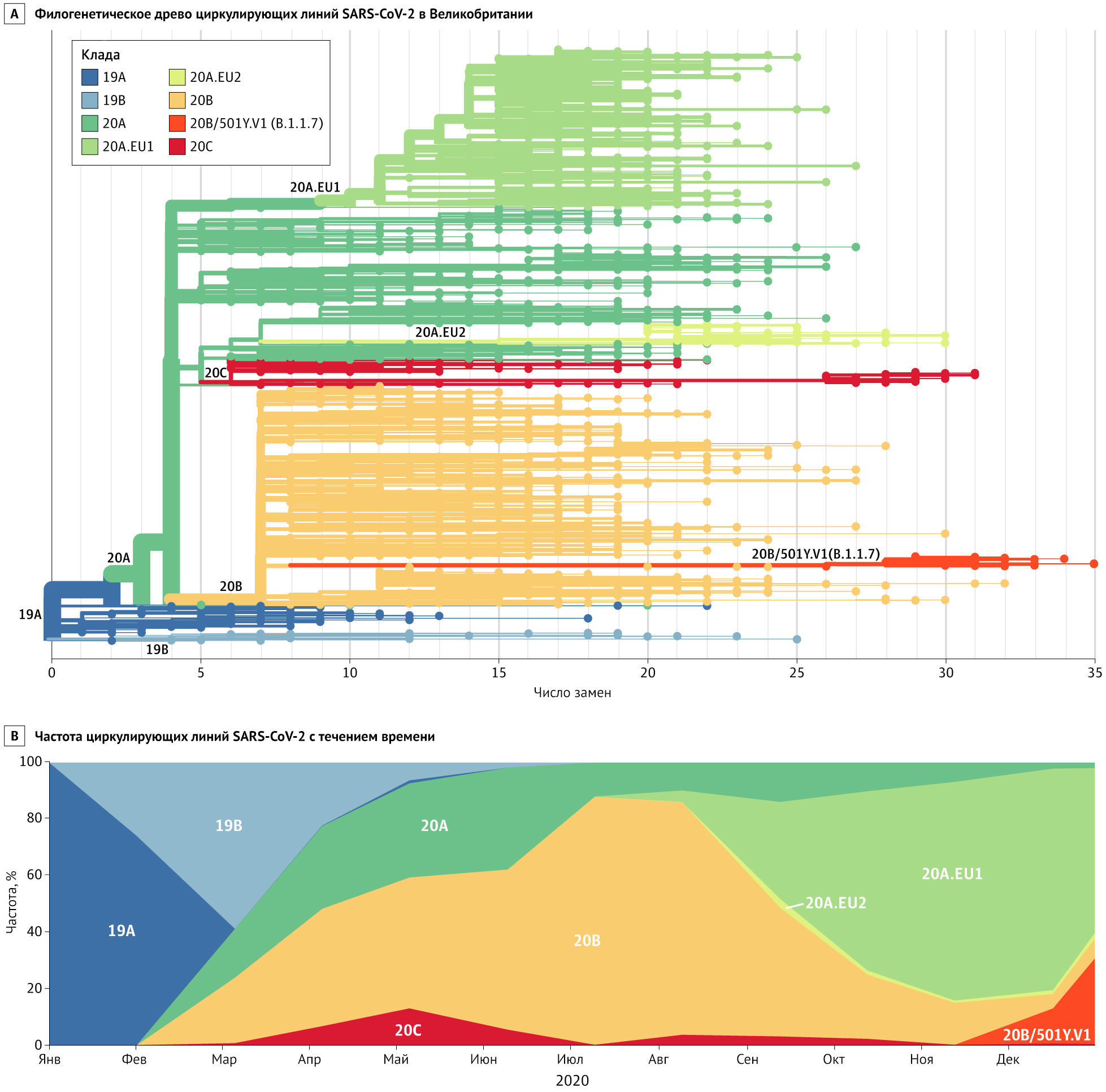
Линия B.1.1.7 и мутация N501Y
Линия B.1.1.7 (также называемая 501Y.V1) представляет собой филогенетический кластер, который быстро распространяется на юго-востоке Англии [8] (Рисунок). До его обнаружения в начале сентября эта линия накопила 17 специфических мутаций, что свидетельствует о значительной предшествующей эволюции, возможно, в хронически инфицированном хозяине. По состоянию на 28 декабря 2020 года на этот вариант приходилось примерно 28 % случаев заражения SARS-CoV-2 в Англии, и популяционно-генетические модели позволяют предположить, что данная линия распространяется на 56 % быстрее других. В отличие от D614G, для которой, вероятно, могли быть выгодными ранние случайные события, линия B.1.1.7 распространилась, когда SARS-CoV-2 выявлялся уже повсеместно, и, по-видимому, достигла доминирующего положения, превзойдя существующую популяцию циркулирующих вариантов. Это убедительно говорит о естественном отборе вируса с большей трансмиссивностью на популяционном уровне. В то время как меры общественного здравоохранения, такие как маски, соблюдение дистанции и ограничение больших скоплений людей, должны оставаться эффективными, но борьба с более трансмиссивным («более заразным») вариантом, вероятно, потребует более строгого применения и повсеместного принятия этих мер.
Восемь мутаций линии B.1.1.7 затрагивают гликопротеин шиповидных отростков (S-белок), в числе которых N501Y в рецептор-связывающем домене, делеция 69_70 и P681H в сайте расщепления фурином. Все эти мутации могут влиять на связывание АПФ2 и репликацию вируса. Предполагается, что варианты с заменой 501Y в S-белке обладают более высоким сродством к АПФ2 человека. Другой вариант, также с мутацией N501Y, быстро распространяется в Южной Африке. Влияние этих мутаций на антигенность в настоящее время не ясно.
Иммуногенность и эффективность вакцины
Наблюдение за вариантами SARS-CoV-2 в основном сосредоточено на мутациях в гликопротеине шиповидных отростков (S-белке), который опосредует прикрепление к клеткам и является основной мишенью нейтрализующих антител. Существует большой интерес к тому, способствуют ли мутации в S-белке ускользанию от антител хозяина и могут ли они потенциально поставить под угрозу эффективность вакцин, поскольку в современных вакцинах именно S-белок является основным вирусным антигеном. На данном этапе строгий отбор вариантов на уровне популяции, вероятно, не обусловлен антителами хозяина, поскольку на данный момент нет достаточного количества иммунных индивидов для систематического продвижения эволюции вируса в каком-либо определенном направлении. Напротив, если у варианта в S-белке есть одна или несколько мутаций, повышающих трансмиссивность, он может быстро превзойти и вытеснить другие циркулирующие варианты. Поскольку современные вакцины вызывают иммунный ответ на весь S-белок, все еще есть надежда на эффективную защиту, несмотря на некоторые изменения в антигенных участках у различных вариантов SARS-CoV-2.
Разделение причины и следствия важно при оценке данных по нейтрализации антителами вариантов S-белка. Независимо от причины отбора мутации, разумно ожидать, что многие мутации в S-белке могут повлиять на нейтрализацию антителами. Поэтому важно учитывать как уровень изменения нейтрализации, так и количество проанализированных образцов сыворотки. Другая проблема заключается в том, что вирусные гликопротеины подвержены эволюционным компромиссам. Иногда мутация, усиливающая одно свойство вируса, например, связывание с рецептором, может ослабить другое свойство, такое как избегание антител хозяина. Действительно, недавние данные указывают на то, что это может иметь место в случае D614G [10]. Возможно, что мутации в S-белке, которые «полезны» для вируса прямо сейчас, также могут сделать его менее приспособленным к преодолению популяционного иммунитета в будущем. Определение этой динамики и ее потенциального влияния на эффективность вакцин потребует широкомасштабного мониторинга эволюции SARS-CoV-2 и иммунитета хозяина в течение длительного времени.