ген арое что такое
Ген арое что такое
Маркер связан с изменением метаболизма липопротеинов. Исследуется для выявления генетической предрасположенности к атеросклерозу, гиперхолестеринемии, болезни Альцгеймера, гиперлипопротеинемии (ГЛП), тип 3, ишемической болезни сердца, нарушениям памяти у пожилых, рассеянному склерозу. Используется для подбора диеты, решения вопроса о целесообразности назначения статинов. Имеет прогностическую значимость при черепно-мозговых травмах.
Полиморфизм длин рестрикционных фрагментов.
Какой биоматериал можно использовать для исследования?
Буккальный (щечный) эпителий, венозную кровь.
Как правильно подготовиться к исследованию?
Подготовки не требуется.
OMIM
Локализация гена на хромосоме
Генетический маркер APOE (E2-E3-E4)
ApoE3 аллель гена характеризуется наличием аминокислоты цистеина в положении 130 и аргинина в положении 176: ApoE3 (cys130, arg176).
ApoE2 имеет цистеин как в положении 130, так и 176: ApoE2 (cys130, cys176).
ApoE4 имеет аргинин и в положении 130, и в 176: ApoE4 (arg130, arg176).
Возможные генотипы
Встречаемость в популяции
Встречаемость аллеля Е2 составляет 11 %, Е4 – 17 %.
Ассоциация маркера с заболеваниями
Общая информация об исследовании
Жирные кислоты и холестерин являются компонентами клеточных мембран, предшественниками для стероидных гормонов, витамина D и желчных кислот. Также играют важную роль в функционировании центральной нервной системы.
Липопротеины различаются по размерам, строению, функции, их разделяют в основном на четыре группы: хиломикроны, ЛПОНП (ЛП очень низкой плотности), ЛПНП (ЛП низкой плотности) и ЛПВП (ЛП высокой плотности).
Важным компонентом липопротеинов является АпоЕ (аполипопротеин Е), который синтезируется в основном в печени и головном мозге и регулирует метаболизм липопротеинов. Основная функция АпоЕ – участие в транспортировке холестерина к тканям от мест его синтеза или всасывания в составе липопротеинов.
Белок АпоЕ человека состоит из 299 аминокислот и двух доменов: один связывается с липидом, а второй определяет связывание с АпоЕ-рецепторами на клетках печени и клетках периферических тканей, удаляя избыток ЛПНП, хиломикронов из крови.
В мозге АпоЕ синтезируется астроцитами и микроглией, а рецепторы к нему экспрессируются нейронами. Таким образом, АпоЕ доставляет холестерин от глиальных клеток мозга к нейронам.
Белок аполипопротеин Е кодируется геном ApoE, который локализуется в хромосоме 19 и находится в кластере с другими аполипопротеинами АpоС1 и ApоС2. Ген состоит из 4 экзонов, 3 интронов, 3597 пар нуклеотидов и характеризуется полиморфизмом – существует порядка 30 вариантов гена АpоЕ.
APOE3 характеризуется наличием аминокислоты цистеина в положении 130 и аргинина в положении 176: ApoE3 (cys130, arg176).
APOE2 имеет цистеин как в положении 130, так и 176: ApoE2 (cys130, cys176).
APOE4 имеет аргинин и в положении 130, и в 176: ApoE4 (arg130, arg176).
Аминокислотные замены влияют на структуру АпоЕ, его стабильность и родство с рецепторами. В результате меняется метаболизм липопротеинов, что может предрасполагать к липидным нарушениям и их последствиям.
Варианты гена аполипопротеина Е хорошо изучены. Все гены представлены парами, по одному от каждого из родителей. Таким образом, существует шесть возможных комбинаций гена APOE: Е2/2, Е2/3, Е3/3, Е4/2, Е4/3, Е4/4.
Генотип ApoE3/Е3 наиболее распространен (
60 % популяции) и считается нормальным, то есть не способствует повышению риска развития атеросклероза. Остальные 40 % людей несут по крайней мере один E2 или E4 вариант, связанные с разной степенью нарушений в обмене холестерина. Это может приводить к развитию патологических состояний и быть фактором, влияющим на эффективность диеты, применяемой в качестве профилактики.
Наличие аллеля ApoE2 значительно увеличивает риск развития такого редкого заболевания, как гиперлипопротеинемия (ГЛП), тип 3. Большинство людей с этим расстройством имеют две копии Е2. Заболевание характеризуется повышенным уровнем в крови холестерина и триглицеридов.
Присутствие аллеля ApoE4 влияет на риск сердечно-сосудистых заболеваний. При наличии хотя бы одного аллеля ApoE4 возрастает вероятность развития атеросклероза. Это заболевание, характеризующееся прогрессирующим сужением кровеносных сосудов за счет холестериновых бляшек, повышает риск ишемической болезни сердца, инфаркта миокарда и инсульта.
ApoE4 ассоциирован с развитием болезни Альцгеймера. При наличии двух копий Е4 риск выше, чем при одной копии Е4.
Носительство ApoE4 также связано с плохим восстановлением после черепно-мозговой травмы и инсульта.
Знание генотипа по АроЕ позволит не только оценить риск развития патологических состояний, но и правильно определить тактику их профилактики.
Для чего используется исследование?
Когда назначается исследование?
Что означают результаты?
В зависимости от генотипа врач сможет прогнозировать риск развития гиперлипопротеинемии 3-го типа, повышения уровня холестерина, триглицеридов, развития атеросклероза и его осложнений, болезни Альцгеймера.
Интерпретация результатов исследования должна проводиться врачом в комплексе с другими генетическими, анамнестическими, клиническими и лабораторными данными.
389 Метаболический баланс
119 Развернутая лабораторная диагностика атеросклероза
379 Расширенное лабораторное обследование сердца и сосудов
Для данного маркера не существует понятия «норма» и «патология», т. к. исследуется полиморфизм гена (различные варианты гена, каждый из которых встречается в популяции чаще 1 %).
Генетическая предрасположенность к болезни Альцгеймера. Исследование полиморфизмов в гене APOE (C112R T>C), (R158C C>T)
Биоматериал
Для данного исследования лаборатория принимает следующий биоматериал:
Подготовка к исследованию
Не менее 3 часов после последнего приема пищи, можно пить воду без газа.
Метод исследования
Исследование полиморфизмов в гене APOE (C112R T>C), (R158C C>T).
Болезнь Альцгеймера (БА) представляет собой неуклонно прогрессирующий дегенеративный процесс, приводящий к тотальной деменции. Атрофия коры и лимбической системы головного мозга сопровождается необратимыми нарушениями неврологических и психических функций преимущественно дефицитарного характера. При БА происходит нарастающий распад памяти, интеллекта и высших корковых функций, приводящий к тотальному слабоумию с развитием беспомощности и необходимостью ухода и постоянного наблюдения за пациентом.
Несмотря на существование многочисленных гипотез этиологии БА, истинные причины возникновения БА и деменции альцгеймеровского типа в настоящее время неизвестны. Накопленные в последние десятилетия данные разных исследований в определенной степени проясняют механизм образования специфических структурных элементов – нейритических (сенильных) бляшек и нейрофибриллярных клубков, описанных А. Альцгемером еще в 1906 г.
Вариации гена APOE (apolipoproteinE) ассоциируются с деменцией альцгеймеровского типа с поздним началом. Ген АРОЕ кодирует АроЕ, белковый компонент нескольких плазменных липопротеинов. Мутации в АРОЕ не связаны с моногенными формами болезни Альцгеймера. Аллель Е4 АРОЕ увеличивает восприимчивость к несемейной болезни Альцгеймера и влияет на возраст начала, по крайней мере, при некоторых моногенных формах.
E4 аллель гена АРОЕ — основной фактор риска развития болезни Альцгеймера.
Белок АроЕ имеет три частых формы, кодируемые соответствующими аллелями АРОЕ. Аллель Е4 значительно преобладает среди пациентов с болезнью Альцгеймера (40% по сравнению с 15% в общей популяции) и связан с ранним началом болезни. В отличие от этого, Е2 аллель имеет защитный эффект и, соответственно чаще встречается у пожилых, незатронутых болезнью Альцгеймера.
Механизмы, лежащие в основе данных эффектов, неизвестны, но полиморфные варианты АроЕ могут влиять на процессинг бета-АРР и плотность амилоидных отложений в мозге пациентов с болезнью. Важно иметь в виду, что Е4 аллель АроЕ неоднозначно связан с повышенным риском болезни Альцгеймера. Таким образом, носители аллелей Е4 имеют неблагоприятный неврологический прогноз после черепно-мозговых травм, инсультов и других неврологических нарушений.
Клиническая значимость: Генетическая предрасположенность является четко установленным фактором риска болезни Альцгеймера. Более того, показано, что БА включает в себя несколько генетически гетерогенных форм, объединенных сходными клиническими и гистопатологическими признаками. Причиной или фактором риска развития некоторых (если не всех) форм БА являются мутации или полиморфизмы в ряде генов.
Прорывом в понимании этиологии БА явилось использование генетических подходов. При более распространенных поздних формах БА (у людей старше 65 лет) важна роль генетических факторов, проявление которых, однако, зависит и от воздействий среды. Исследование генетических маркеров позволяет выявить группу риска пациентов с болезнью Альцгеймера для принятия возможных корректирующих мероприятий.
Показания к исследованию:
Ген аполипопротеина Е (APO E)
Исследование аллельного полиморфизма гена ApoE имеет прогностическое значение, позволяющее определить риск развития ишемической болезни сердца вследствие нарушения липидного обмена.
Ген ApoE кодирует аминокислотную последовательность белка aполипопротеина Е. Aполипопротеин Е синтезируется в печени и головном мозге, и играет существенную роль в метаболизме липидов. Aполипопротеин Е входит в состав жировых частиц хиломикронов и липопротеинов очень низкой плотности (ЛПОНП), инициируя их захват и удаление из крови через взаимодействие со специфическим рецептором на поверхности клеток печени. АроЕ участвует в некоторых других процессах, таких как иммунорегуляция, нервная регенерация и активация некоторых липолитических ферментов (липазы печени, липазы липопротеинов и лецитин-холестерин ацилтрансферазы). Он необходим для доставки холестерина от глиальных клеток мозга до нейронов. Эффективность взаимодействия ApoE с рецепторами определяется уникальным строением белковой молекулы.
Выделяют три изоформы ApoE: Е2, ЕЗ, Е4, которые определяются аллельным полиморфизмом (разнообразием) гена АpoЕ. Аллельный полиморфизм гена ApoE обусловлен заменой по двум аминокислотным остаткам, что приводит к изменению биологических свойств aполипопротеина Е.
Вариант Е3 является наиболее распространенным. Частота аллеля в Европейской популяции составляет 70-80%.
Вариант Е2 в гетерозиготном состоянии связан со снижением уровней холестерина и бета-липополипротеинов в сыворотке крови. Частота этого варианта выше у долгожителей. В гомозиготном состоянии аллель Е2 встречается в популяции с частотой около 1%. Обычно у лиц, гомозиготных по аллелю Е2 голодовой гиперлипидемии не выявляется, но увеличение липидов плазмы крови становится значительным после приема пищи. Приблизительно у 1 из 50 носителей сочетания Е2//Е2 развивается голодовое увеличение уровня липидов, характерное гиперлипопротеинемии III типа.
Вариант Е4 связан с увеличением общего холестерина и бета-липополипротеинов, снижением антиоксидантной клеточной активности, что является фактором риска сердечно-сосудистых заболеваний. Аллель Е4 рассматривается в качестве фактора риска болезни Альцгеймера. Механизм влияния мутации, возможно, следующий. ApoE необходим для доставки холестерина от производящих его глиальных клеток мозга (холестерин не может попасть из крови в мозг) до нейронов. Мутации ApoE нарушают этот процесс. Это также объясняет, почему при развитии этой болезни наблюдается разрушение синапсов, то есть связей между нервными клетками, и уменьшается количества холестерина в мозгу.
Болезнь Альцгеймера: ген, от которого я без ума
Болезнь Альцгеймера, настигающая большинство людей в старости, является одной из самых острых проблем здравоохранения
Автор
Редакторы
В начале XX века с помощью немецкого психиатра Алоиса Альцгеймера мир узнал о существовании новой нейродегенеративной болезни. И хотя долгое время исследователи не воспринимали генетическую предрасположенность в качестве важного фактора для развития болезни Альцгеймера, вскоре ситуация изменилась. Однако и сейчас о природе этого заболевания идут ожесточенные споры: кто же во всем виноват — β-амилоид или APOE4?
Бета-амилоид, образующий при болезни Альцгеймера нерастворимые бляшки в нервных клетках, традиционно считался основной причиной нейротоксичности при этом заболевании, однако в действительности дело обстоит не так просто. В частности, токсичными могут быть не только фибриллярные, но и промежуточные сферические агрегаты Aβ (см. «Альцгеймеровский нейротоксин: ядовиты не только фибриллы» [14]), на вероятность развития БА положительно влияет недосып (см. «Новый шаг к пониманию болезни Альцгеймера: возможно, недосыпание является одним из факторов риска» [15]), ну а на сладкое — в реальности бета-амилоид может быть вообще не нейротоксином, а компонентом врождённого иммунитета в нервной системе человека (см. «Возможно, β-амилоид болезни Альцгеймера — часть врождённого иммунитета» [16]). — Ред.
Профессор Роузес сразу понял, что его коллега нашел нечто важное. Двумя годами ранее ими было обнаружено, что экспрессия некоторых генов из хромосомы 19 способствует развитию деменции, а поскольку Роузес знал, что ген, кодирующий ApoE, также находится на этой хромосоме, его молниеносно осенила идея участия ApoE в развитии болезни Альцгеймера (БА).
В организме человека есть три варианта гена APOE, кодирующих изоформы белка Е2, Е3 и Е4, и Роузес решил выяснить их влияние на развитие болезни Альцгеймера. Для определения отдельных аллелей нужно было провести полимеразную цепную реакцию (ПЦР) [17]. Так как ученый имел весьма скромный опыт работы с ПЦР, он хотел привлечь в свою команду нейрофизиологов, но получил отказ: хотя они и были заняты охотой за генами, которые лежат в основе болезни Альцгеймера, АРОЕ показался им неподходящим кандидатом. Роузес вспоминает, как позже в лаборатории ходили разговоры: «. начальник совсем потерял голову от своих безумных идей».
Но Роузес не сдавался. Он попросил помощи у своей жены, генетика Энн Сондерс (Ann Saunders), которая использовала ПЦР в своих исследованиях. Она только что родила дочь и была в декретном отпуске, и потому они заключили соглашение. «Она сделала все эксперименты, пока я присматривал за ребенком», — говорит профессор. В течение трех недель супруги собрали данные, которые в дальнейшем легли в основу серии знаковых публикаций. Они выяснили, что аллель APOE4 способствует развитию БА [1].
Сегодня, двадцать лет спустя, APOE4 остается ведущим фактором риска для наиболее распространенной формы деменции. Наследование одной копии APOE4 вчетверо повышает риск возникновения заболевания, двух копий — в 12 раз (рис. 1). Однако данные Роузеса в основном не воспринимали всерьез или критиковали. Впоследствии, даже когда мнение об ApoE поменялось, большинство ученых все равно продолжали работать с β-амилоидом, как бы «зациклившись» на классике. Но некоторые лаборатории все равно исследовали ApoE, несмотря на равнодушие финансирующих учреждений и научного сообщества и на отсутствие ресурсов, необходимых для проведения масштабных экспериментов.
Рисунок 1. Носители аллеля APOE4 более подвержены развитию болезни Альцгеймера по сравнению с теми, кто унаследовал две копии аллеля APOE3
Долгое время было неизвестно, какие функции белок ApoE выполняет в головном мозге, и постепенно эта головоломка стала интересовать многих нейрофизиологов. Интерес к липопротеинам продолжал расти, — отчасти потому, что клинические испытания лекарств, нацеленных на β-амилоид, часто заканчивались неудачей. Многие исследователи начали скрупулезно изучать белок ApoE4 и, как следствие, привлекли внимание фармацевтических компаний. «Амилоидные подходы» постепенно перестали использовать, зато начали разрабатывать препараты, направленные на аполипопротеин.
«Несмотря на отсутствие уверенных доказательств, амилоидная гипотеза стала в свое время сильным научным постулатом», — говорит Завен Хачатурян, президент некоммерческой компании «Предотвратим Болезнь Альцгеймера» (Prevent Alzheimer’s Disease 2020) и бывший координатор деятельности, связанной с исследованием БА в Национальных институтах здоровья США. До недавнего времени, по его словам «никто не пытался задать фундаментальный вопрос — правильно ли мы определили основную предпосылку болезни?».
Жесткая конкуренция
Существуют разные доводы относительно того, почему открытие Роузеса было проигнорировано. Многие сходятся во мнении, что генетик выбрал неудачное время для обнародования своих результатов. В 1991 году Джон Харди (John Hardy) и Дэвид Олсоп (David Allsop) предложили «гипотезу амилоидного каскада». Они утверждали, что болезнь Альцгеймера является результатом аномального накопления β-амилоидных бляшек в тканях мозга [3]. Научное сообщество поддержало предложенную идею, которую вскоре начали активно финансировать.
Но Роузес не подписался под этой теорией: «. амилоиды являются одними из многих веществ, которые формируют бляшки; в конечном итоге они разрушают клетки и вызывают атрофию мозга. У меня и мысли не было, что это было причиной деменции». Говоря так, он, возможно, хотел скрыть возможную связь ApoE/Аβ, и случайно создал конкуренцию между двумя гипотезами за финансирование. К сожалению, Роузес так и не получил гранты для работы с ApoE.
Были и технические препятствия для изучения ApoE. Белок входит в состав различных липопротеинов плазмы крови и является довольно сложной фармакологической мишенью при работе с головным мозгом. ApoE имеет липофильную часть и поэтому при биохимическом анализе может агрегировать с другими молекулами. Работа с такими белками требует глубокого понимания биохимии липопротеинов и методик работы с ними.
Три оставшихся препарата, которые нацелены на β-амилоид, в настоящее время проходят испытания на больных, а также на людях с высоким риском БА, у которых еще не развились симптомы. Позитронно-эмиссионная томография показала, что мозг подопытных с высоким риском развития БА отличается от здорового мозга за десятилетия (!) до того, как начинает накапливаться β-амилоид или разрушаться нейроны [4]. В результате исследований, которые будут проводиться в течение следующих шести лет, ученые поймут, способны ли данные лекарства отсрочить наступление заболевания или нет. Среди исследователей и представителей фармацевтической индустрии появилось ощущение, что это — последний шанс для амилоидной гипотезы. На фоне этих сомнений ApoE вновь оказался в центре внимания.
По словам Мака, если испытания закончатся неудачей, ученые будут отчитываться перед инвесторами, предоставляя все данные доклинических и ранних клинических испытаний. Он надеется, что исследователи АроЕ вскоре получат большое преимущество. Несмотря на препятствия в этой области, у ученых продолжает крепнуть подозрение, что именно ApoE4 является предпосылкой для возникновения болезни. Этот факт подтверждают группы Мака и Гольцмана (Holtzman) в опытах на трансгенных мышах, которые несут в себе изоформы ApoE человека.
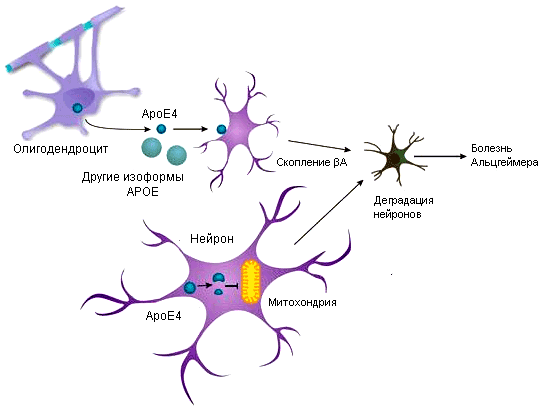
Скорее всего, ApoE участвует в развитии БА двумя различными путями, один из которых — амилоид-зависимый. И у животных, и у человека ApoE4 способствует отложению Aβ в мозговом веществе, в то время как ApoE3 считается «нейтральной» изоформой, а ApoE2 — «защитной» формой, уменьшающей накопление бляшек [5]. «Это достаточно убедительные данные», — говорит Хольцман.
Другой механизм не предусматривает взаимосвязи с амилоидом. Когда нейроны находятся в состоянии стресса, они экспрессируют ApoE для своего восстановления. «Плохая» форма — ApoE4, — как правило, разрушается на токсичные фрагменты, которые повреждают митохондрии и модифицируют цитоскелет.
Рисунок 2. Две расходящиеся гипотезы о том, как АроЕ способствует болезни
Оценить вклад этих двух механизмов в риск развития болезни Альцгеймера крайне сложно, говорит Хольцман, но он и его коллеги считают, что трансформация вредоносной изоформы ApoE в «нейтральную» может стать перспективным подходом для лечения БА. В Гладстоне исследователи начали изучать этот вопрос, и уже найдены небольшие регуляторные молекулы, которые трансформируют ApoE4 в ApoE3-образный белок и тем самым снижают аномальную фрагментацию первого [7]. В культуре клеток даже низкие концентрации этих молекул могут уменьшить разрушение митохондрий и дисфункцию нейронов [8]. В настоящее время эти молекулы проходят испытания на животных, и если они в конечном счете окажутся безопасными и эффективными, врачи будут назначать их пациентам, предрасположенных к БА, так же, как статины — больным с высоким уровнем холестерина и с повышенным риском сердечно-сосудистых заболеваний.
Более чем достаточно
Несмотря на отсутствие грантов на исследования ApoE, Роузес никогда не сдавался. Но через несколько лет, когда его группа обнаружила связь между ApoE и болезнью Альцгеймера, он устал от постоянного денежного противостояния и оставил науку. Проработав в фармацевтической индустрии десять лет, в течение которых он не переставал исследовать ApoE, в 2008 году он снова возвращается в Дьюковский университет.
В 2009 году его группа описала участок некодирующей ДНК с геном TOMM40, который располагается рядом с APOE на девятнадцатой хромосоме. Этот участок ДНК (сокращенно — 523) варьирует по длине и, в зависимости от этого, может определять уровень экспрессии генов TOMM40 и АРОЕ [9].
По словам Роузеса, это было важное открытие, так как белок, кодируемый геном TOMM40 — Tom40, — является необходимым для «здоровых» митохондрий. Tom40 образует канал во внешней митохондриальной мембране, через который импортируются белки, необходимые для нормального деления этой органеллы. «Мы знали о существовании такого механизма в течении 10 лет, — говорит ученый, — но то, что он приводит к болезни Альцгеймера, мы и не подозревали».
Роузес продолжал утверждать, что участок 523 можно использовать для разработки терапии и более точного предсказания болезни. Подавляющее большинство людей рискует встретиться со своим Альцгеймером, если только проживет достаточно долго, а ведь носителями аллеля APOE4 являются только 25% населения. Значит, тест на носительство этого аллеля никогда не будет до конца точным предиктором. Но генотипирование по обоим генам — АРОЕ и TOMM40 — может существенно увеличить точность, как говорит Роузес. В его лаборатории открыли, что APOE3 — наиболее частая изоформа — обычно наследуется вместе или с коротким, или с очень длинным участком 523. И у носителей двух аллелей APOE3 возраст наступления заболевания будет зависеть от конкретного варианта участка 523, наследуемого вместе с APOE.
Некоторым лабораториям удалось найти доказательства, подтверждающие гипотезу Роузеса, однако у других повторить исследования на TOMM40 так и не удалось, и возникли сомнения в реальности влияния этого гена на риск развития БА [10]. Однако Роузес не сомневается в правильности своих гипотез и считает, что геномные исследования, не подтвердившие его результатов, обладали недостаточной силой для выявления сцепливания TOMM40 и болезни Альцгеймера.
Роузес надеется, что вскоре он сможет подкрепить свои результаты клиническими исследованиями, которые будут проводиться в основанной им компании Zinfandel Pharmaceuticals. Вместе с японской фармацевтической компанией Takeda Зинфандель в настоящее время финансирует фазу III клинических испытаний (под названием TOMMORROW), призванную проверить идеи Роузеса на деле. TOMMORROW должна оценить риски развития БА в зависимости от возраста пациента и вариантов APOE и TOMM40. Для запуска программы будут отобраны около 6000 здоровых пожилых людей, и исследования будут продолжаться около 5 лет.
Программа будет также исследовать возможность того, что пиоглитазон — препарат для лечения пациентов с сахарным диабетом 2 типа, — в малых дозах будет задерживать развитие БА у лиц, отнесенных к группе высокого риска развития болезни Альцгеймера. Проверка этой идеи вызвана тем, что опубликованы результаты опытов на животных и даже на людях, которые говорят о способности пиоглитазона предотвращать или уменьшить патологию и симптомы, связанные с болезнью Альцгеймера [11]. Роузес думает, возможный механизм этого — стимуляция деления митохондрий.
Даже если получить мощное лекарство против болезни Альцгеймера так и не удастся, толк в этих испытаниях все равно будет: научившись задерживать развитие БА хотя бы на два года, можно уменьшить число больных в США через 50 лет на 2 млн. человек, что очень и очень неплохо [12]. Кроме того, результаты этих испытаний заставят исследователей всего мира по-новому взглянуть на деменцию. Такое сложное расстройство, как болезнь Альцгеймера, нельзя изучать только с одной стороны, — пусть и включающей ApoE4 или еще что-нибудь. По-видимому, нейрофизиологи близки к тому, чтобы признать ограниченность своих прежних взглядов и частично пересмотреть их, направив исследования по новым дорожкам, в конце которых будет разгадка проблемы, лишающей нас ума.
По материалам рубрики News Feature в Nature [13].