Кто доказал что вирусные белки не попадают в клетку бактерии при заражении
Неприятно познакомиться: как появились вирусы и почему в России их меньше, чем в Китае
В любой энциклопедии написано: «вирус» в переводе с латинского языка означает « яд». С тех пор как в XIX веке исследователи впервые столкнулись с заражением одного организма другим, знания о вирусах множились. К настоящему времени ученые изучили порядка пяти тысяч видов вирусов, но сказать, что науке доподлинно известно и с чем она имеет дело, нельзя. В двадцать первом веке все еще остаются вопросы, на которые у ученых-вирусологов нет ответов. Ведь количество неизученных вирусов, которые «свободно парят» вокруг нас, находятся в воде, земле, в организмах животных, в стеблях растений, исчисляется миллионами!
— За всю историю исследований в основном изучались вирусы человека и сельскохозяйственных животных, — поясняет «Вечерке» вирусолог, директор Института медицинской паразитологии, тропических и трансмиссивных заболеваний им. Е. И. Марциновского Сеченовского университета Александр Лукашев. — А вирусы есть у каждого вида живых существ на Земле, в том числе у грибов, мхов, бактерий, простейших. И многие могут перейти к человеку.
Когда и при каких условиях тому или иному вирусу приспичит активизироваться — вопрос, не поддающийся прогнозам. Точнее, «паразиты» бомбардируют все живое постоянно. Вирусная атака — это процесс в природе непрекращающийся. Ведь вирус не бактерия и не микроорганизм. Это фрагмент генетической информации, упакованный в белковую оболочку. У него нет клетки, а значит, вне живого организма он как бы не живет, а находится в замершем состоянии. Поэтому если вы спросите у специалиста, живые вирусы или нет, он ответит уклончиво: как бы нет, но в общем-то да. Делиться самостоятельно вирус не может, и чужая клетка нужна ему, чтобы жить.
— Любая живая информация старается выжить в биосфере, — говорит вирусолог Александр Лукашев. — Главная эволюционная задача вируса — не уничтожить живую клетку, а, используя ее ресурсы, размножиться как можно в большем количестве своих копий. У вируса нет задачи быть «плохим». Наоборот, «хороший» вирус имеет преимущества. Например, вирус герпеса большинству людей практически не наносит вреда. Им заражены все, он распространен повсеместно, и свою функцию — максимально размножиться — он выполняет. А, скажем, вирус Эболы убивает примерно половину своих жертв, и в том числе и поэтому он не может размножиться в популяции человека. С точки зрения эволюции убивать своего носителя вирусу невыгодно. Клеткам живых организмов приходится держать глухую оборону практически постоянно. Но человек и не знает, что находится под обстрелом фрагментов генетической информации, потому что в подавляющем большинстве случаев клетки самостоятельно разбираются с захватчиком, не допуская заражения. Только с воздухом мы вдыхаем едва ли не ежесекундно десятки вирусов, и ничего.
— Вирусы редко переходят между видами нечасто, — говорит вирусолог Александр Лукашев. — Скажем, вирусы от растений к животным переходят, наверное, раз в один миллион лет. Бомбардировка новых видов происходит постоянно, но чаще всего безуспешно. Легче перейти к близкому виду. Например, от приматов к человеку вирусы переходят много раз в год. От млекопитающих — примерно раз в 10 лет. Ту же Эболу человек подхватывает от летучих лисиц. И вспомним свиной грипп и другие «болячки», перешедшие от животных. Случаи могут регистрироваться, например, и два года подряд, а потом 20 лет будет затишье, но я говорю о средней периодичности. Но на каждый успешный переход приходится, условно, миллион безуспешных.
— Скученность населения и, скажем так, очень близкий контакт между людьми и животными — в Китае совпали все условия. Из-за особенностей пищевых рынков и, возможно, более высокой восприимчивости населения «чужой» вирус «зацепился», а дальше из-за высокой плотности китайского населения смог распространиться, — рассуждает вирусолог Александр Лукашев. — У нас в стране совсем другие условия, хотя известно, что зараженные примерно такими же опасными вирусами летучие мыши обитают на юге России. Кроме того, мы летучих мышей и панголинов не едим, не разделываем и на рынках не продаем, а значит, и попыток перейти от животного к человеку их вирус может предпринимать значительно меньше. Гипотетически же к человеку может перейти огромное число вирусов — умножьте число всех видов млекопитающих на 1000 и примерно узнаете, сколько. Но если нет условий, выгодных для распространения заразы, бояться нечего.
Вместе с тем наука признала, что вирусы — это наследие древнего мира, существовавшего до появления первой живой клетки, четыре миллиарда лет назад. Более того, из вирусов или их остатков по большей части состоит геном человека. Это значит, что они были основой развития жизни на Земле. Доказано, что человек, как млекопитающее, обязан существованием именно им, поскольку благодаря вирусам у наших предков начала формироваться плацента. Как? Они привнесли в человеческий геном белок, отвечающий за ее функцию. Кроме того, вирусы сильно повысили эффективность эволюции. Они переносили генетическую информацию намного эффективнее, чем это делалось только в ходе естественного размножения. То есть удачные гены они передавали не потомству вида, а сразу в новый организм.
Вирусы мутируют. Ученые говорят, что у многих из них каждый новый геном имеет дополнительную мутацию. Изменяется вирус иногда в течение нескольких часов. Внутри одной клетки, внутри одного цикла размножения одинаковых вирусов нет! Чтобы иметь возможность приспособиться к новым условиям, вирус меняется, производя в популяции самые разные варианты. Мутация для вирусов — обязательная часть их жизненного цикла. Собственный геном вирусов в миллион раз меньше человеческого, и чтобы с нами конкурировать, они мутируют, создавая множество вариантов, которые могут «пригодиться» в разных условиях.
Кто доказал что вирусные белки не попадают в клетку бактерии при заражении
В журнале Nature опубликован очень подробный обзор, характеризующих особенности строения и жизненный цикл SARS-CoV2, механизмы инфицирования и избегания своевременного иммунного ответа, обозначены потенциальные мишени для создания противовирусных препаратов. Также представлены результаты компьютерного моделирования строения вируса и механизмов проникновения в клетку.
Особенностью данного вируса является наличие очень большого количества гликанов на поверхности спайк-протеина, маскирующих его от иммунной системы человека. Поэтому на первом этапе заболевания вирус подобен «волку в овечьей шкуре» и остается невидим для иммунной системы. В дальнейшем, когда вирус уже размножился, иммунный ответ может развиться даже избыточно, что, по-видимому, лежит в основе тяжелого течения заболевания.
В S2- субъединице спайк-протеина есть три участка, делающих «ножку» спайк-протеина гибкой, что позволяет ей «искать» рецепторы на клетках хозяина более эффективно. Такая структура довольно редка для вирусов, обычно аналогичные «шипики» на поверхности вириона ригидны (такова, например, ситуация у вируса гриппа).
Важной частью спайк-протеина является RBD-домен, функцией которого является связь с рецептором ACE2 на поверхности клетки-хозяина. У SARS-CoV2 эта связь в 2-4 раза сильнее, чем у вируса SARS. Во время взаимодействия с рецептором этот домен «выдвигается» из-за двух маскирующих его молекул гликанов. Исследования in vitro показали, что мутации в этих двух гликанах могут полностью нарушать процессы проникновения вируса в клетку. Для эффективного взаимодействия RDB и ACE2 предпочтительна более «высокая» позиция этого домена на остальными структурами. У альфа варианта вируса найдено 10 дополнительных мутаций, приводящих RBD – домен в более «высокое» положение, а у дельта вируса – еще 3 мутации.
Попав в клетку, вирус подавляет экспрессию генов клетки-хозяина, в том числе – образование интерферонов, сигнализирующих о вирусной инфекции. Для ковидной инфекции типична очень низкая концентрация интерферонов в крови.
В дальнейшем может происходить формирование синцитиев из клеток легочной ткани. Считается, что синцитии позволяют дольше и эффективнее вырабатывать вирусные белки. Такой тип агрессии типичен для персистирующих вирусов – например, ВИЧ. SARS-CoV2 индуцирует даже формирование синцитиев клеток респираторного эпителия с лимфоцитами, что мешает нормальному иммунному ответу. Такой тип «маскировки» от иммунитета типичен для опухолей, а не вирусов.
В дальнейшем перестраивается эндоплазматический ретикулум с формированием шарообразных двухмембранных структур, в которых происходит активный синтез белков вируса. Выход вирионов наружу осуществляется в лизосомах, формирующихся в комлексе Гольджи, путем экзоцитоза. Считается, что молекулярные механизмы, ответственные за описанные процессы, могут быть мишенями для противовирусной терапии.
В месте соединения S1 и S2 субъединиц спайк-протеина есть зона, которая способна связывать и быть расщепленной фурином – протеазой клетки-хозяина, содержащейся в лизосомах. Такое предварительное расщепление значительно упрощает в дальнейшем взаимодействие с трансмембранной протеазой TMPRSS2 и значительно увеличивает проникновение вирусной частицы в следующую клетку. Для вируса SARS показано, что порядка 10% вирусных частиц на выходе из клетки – хозяина связано с фурином. У вируса SARS-CoV2 в соответствующем локусе, отвечающем за связь с фурином, идентифицированы мутации. Как следствие, до 50% вирионов альфа-разновидности SARS-CoV2, выходящих из клетки-хозяина, связаны с фурином, а в случае дельта-вируса – до 90%, что, по-видимому, и объясняет более агрессивное распространение этого варианта вируса. Есть данные, что у пациентов с дельта-формой в тканях легких и носоглотки содержание вирионов достоверно выше, чем у носителей альфа-формы.
По материалам: Megan Scudellari. How the coronavirus infects cells — and why Delta is so dangerous. Nature 595, 640-644 (2021). doi:
Вирусы и бактерии – великое противостояние
Создание современной технологии геномного редактирования, которая уже с успехом применяется на разных животных, растениях, грибах и бактериях, базируется на исследованиях бактериальных систем CRISPR-Cas. Изначально предполагалось, что они участвуют в ликвидации повреждений бактериальной ДНК, но в 2007 г. стало ясно, что истинное предназначение этих систем – борьба с вирусами бактерий, бактериофагами. Всего за девять лет наука проделала гигантский путь от раскрытия механизма бактериального иммунитета до редактирования геномов людей – в настоящее время уже проводятся первые эксперименты по редактированию ДНК человеческих эмбрионов. У бактерий имеются и другие «иммунные» механизмы, изучение которых, возможно, создаст предпосылки для новых прорывов в биомедицине
Бактериофаги – это вирусы, которые поражают только бактерий. В ходе инфекции они влияют на все процессы жизнедеятельности бактериальной клетки, фактически превращая ее в фабрику по производству вирусного потомства. В конце концов клетка разрушается, а вновь образованные вирусные частицы выходят наружу и могут заражать новые бактерии.
Несмотря на огромное число и разнообразие природных фагов, встречаемся мы с ними редко. Однако бывают ситуации, когда деятельность этих вирусов не остается незамеченной. Например, на предприятиях, где производят сыры, йогурты и другие молочно-кислые продукты, часто приходится сталкиваться с вирусной атакой на бактерии, сбраживающие молоко. В большинстве таких случаев фаговая инфекция распространяется молниеносно, и полезные бактерии гибнут, что приводит к значительным экономическим потерям (Neve et al., 1994).
Именно благодаря прикладным исследованиям в интересах молочной промышленности, направленным на получение устойчивых к бактериофагам штаммов молочно-кислых бактерий, был открыт ряд механизмов, с помощью которых бактерии избегают инфекции. Параллельно были изучены способы, с помощью которых вирусы, в свою очередь, преодолевают бактериальные системы защиты (Moineau et al., 1993).
Кто защищен – тот вооружен
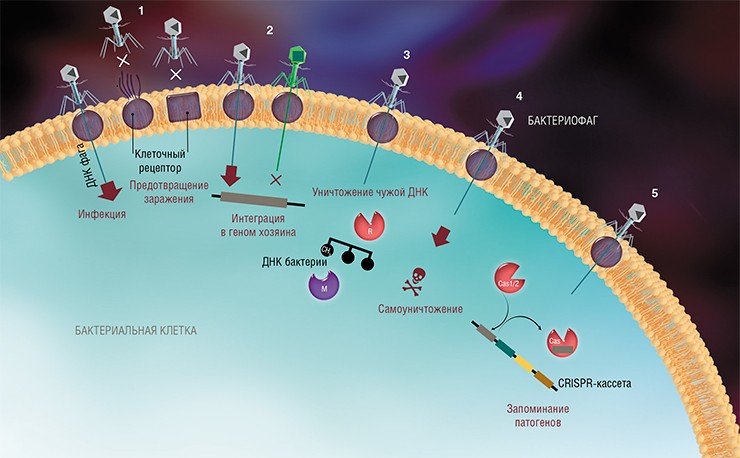
На сегодня известно пять основных, весьма хитроумных механизмов защиты, которые бактерии выработали в непрестанной борьбе с вирусами: изменение рецептора на поверхности клетки; исключение суперинфекции; системы абортивной инфекции; системы рестрикции-модификации и, наконец, системы CRISPR-Cas.
В ходе эволюции происходила и сейчас происходит селекция бактерий, способных избежать гибели при инфицировании вирусами, что, в свою очередь, служит стимулом для бактериофагов совершенствовать свои агрессивные стратегии. Эта «гонка вооружений», длящаяся несколько миллиардов лет, т. е. ровно столько, сколько существуют сами бактерии и их враги, породила целый ряд изощренных механизмов защиты и нападения
Вирусная атака начинается с прикрепления фага к специфическому рецептору на поверхности бактериальной клетки, но при потере рецептора или изменении в его структуре связывания вируса не происходит. Бактерии могут менять рецепторы в зависимости от окружающих условий, таких как плотность и разнообразие микроорганизмов в среде, а также доступность питательных веществ (Bikard et al., 2012). Любопытный пример — бактерии вида Vibrio anguillarum, которые способны формировать биопленку, т. е. плотный слой клеток, прикрепленный к какой-либо поверхности. У этой бактерии имеется своего рода «чувство кворума», за счет чего при увеличении плотности клеток у них понижается выработка рецептора, с которым может связываться вирус. В результате биопленка становится почти полностью устойчивой к заражению (Tan et al., 2015).
Однако потеря рецепторов не всегда выгодна для бактерии, поскольку они выполняют разнообразные важные функции, например, транспорт питательных веществ или формирование межклеточных контактов (Lopez-Pascua et al., 2008). В результате для каждой пары «бактерия-бактериофаг» в ходе эволюции находится оптимальное решение, обеспечивающее приемлемый уровень защиты при сохранении возможности роста бактерий в различных условиях среды.
Следующий защитный механизм – исключение суперинфекции. Для бактериофагов известны два основных пути инфекции: литический, приводящий к быстрой гибели зараженной бактерии с высвобождением вирусного потомства, и затяжной лизогенный путь, когда наследственный материал вируса находится внутри генома бактерии, удваивается только с хозяйской ДНК, не причиняя клетке вреда. Когда клетка находится в состоянии лизогенной инфекции, то, с точки зрения «домашнего» вируса (профага), ее заражение другим вирусом нежелательно.
Действительно, многие вирусы, встроившие свою ДНК в геном клетки, ограничивают вновь проникшего в клетку бактериофага («суперинфекцию») посредством специальных белков-репрессоров, не позволяющих генам «пришельца» работать (Calendar, 2006). А некоторые фаги даже препятствуют другим вирусным частицам проникнуть в инфицированную ими клетку, воздействуя на ее рецепторы. В результате бактерии – носительницы вируса имеют очевидное преимущество по сравнению с незараженными собратьями.
В 1978 г. за открытие ферментов рестриктаз швейцарский генетик В. Арбер и американские микробиологи Д. Натанс и Г. Смит были удостоены Нобелевской премии. Изучение систем рестрикции-модификации привело к созданию технологии молекулярного клонирования, которая широко применяется во всем мире. С помощью рестриктаз можно «вырезать» гены из генома одного организма и вставить в геном другого, получив химерную рекомбинантную ДНК, не существующую в природе. Различные вариации этого подхода используются учеными для изолирования отдельных генов и их дальнейшего изучения. Кроме того, он широко применяется в фармацевтике, например, для наработки инсулина или терапевтических антител: все лекарства такого рода созданы с помощью молекулярного клонирования, т. е. являются продуктом генной модификации
Во время инфекции все ресурсы бактериальной клетки направлены на производство новых вирусных частиц. Если рядом с такой клеткой будут находиться другие уязвимые бактерии, то инфекция быстро распространится и приведет к гибели большинства из них. Однако для таких случаев у бактерии имеются так называемые системы абортивной инфекции, которые приводят ее к запрограммированной гибели. Конечно, этот «альтруистичный» механизм не спасет саму зараженную клетку, но остановит распространение вирусной инфекции, что выгодно для всей популяции. Бактериальные системы абортивной инфекции очень разнообразны, но детали их функционирования пока изучены недостаточно.
К средствам противовирусной защиты бактерий относятся и системы рестрикции-модификации, в которые входят гены, кодирующие два белка-фермента – рестриктазу и метилазу. Рестриктаза узнает определенные последовательности ДНК длиной 4—6 нуклеотидов и вносит в них двуцепочечные разрывы. Метилаза, напротив, ковалентно модифицирует эти последовательности, добавляя к отдельным нуклеотидным основаниям метильные группы, что предотвращает их узнавание рестриктазой.
В ДНК бактерии, содержащей такую систему, все сайты модифицированы. И если бактерия заражается вирусом, ДНК которого не содержит подобной модификации, рестриктаза защитит от инфекции, разрушив вирусную ДНК. Многие вирусы «борются» с системами рестрикции-модификации, не используя в своих геномах последовательности, узнаваемые рестриктазой, – очевидно, что вирусные варианты с другой стратегией просто не оставили потомства.
Последней и в настоящее время самой интересной системой бактериального иммунитета является система CRISPR-Cas, с помощью которой бактерии способны «записывать» в собственный геном и передавать потомству информацию о фагах, с которыми они сталкивались в течение жизни. Наличие таких «воспоминаний» позволяет распознавать ДНК фага и эффективней противостоять ему при повторных инфекциях. В настоящее время к системам CRISPR-Cas приковано пристальное внимание, так как они стали основой революционной технологии редактирования геномов, которая в будущем, возможно, позволит лечить генетические заболевания и создавать новые породы и сорта сельскохозяйственных животных и растений.
Врага нужно знать в лицо
Системы CRISPR-Cas являются уникальным примером адаптивного иммунитета бактерий. При проникновении в клетку ДНК фага специальные белки Cas встраивают фрагменты вирусной ДНК длиной 25—40 нуклеотидов в определенный участок генома бактерии (Barrangou et al., 2007). Такие фрагменты называются спейсерами (от англ. spacer – промежуток), участок, где происходит встраивание, – CRISPR-кассета (от англ. Clustered Regularly Interspaced Short Palindromic Repeats), а сам процесс приобретения спейсеров – адаптацией.
Чтобы использовать спейсеры в борьбе с фаговой инфекцией, в клетке должен происходить еще один процесс, управляемый белками Cas, названный интерференцией. Суть его в том, что в ходе транскрипции CRISPR-кассеты образуется длинная молекула РНК, которая разрезается белками Cas на короткие фрагменты – защитные криспрРНК (крРНК), каждая из которых содержит один спейсер. Белки Cas вместе с молекулой крРНК образуют эффекторный комплекс, который сканирует всю ДНК клетки на наличие последовательностей, идентичных спейсеру (протоспейсеров). Найденные протоспейсеры расщепляются белками Cas (Westra et al., 2012; Jinek et al., 2012).
Системы CRISPR-Cas обнаружены у большинства прокариот – бактерий и архей. Хотя общий принцип действия всех известных систем CRISPR-Cas одинаков, механизмы их работы могут существенно отличаться в деталях. Наибольшие различия проявляются в строении и функционировании эффекторного комплекса, в связи с чем системы CRISPR-Cas делят на несколько типов. На сегодняшний день описаны шесть типов таких неродственных друг другу систем (Makarova et al., 2015; Shmakov et al., 2015).
Наиболее изученной является система CRISPR-Cas I типа, которой обладает излюбленный объект молекулярно-биологических исследований – бактерия кишечная палочка (Esсherichia coli). Эффекторный комплекс в этой системе состоит из нескольких небольших белков Cas, каждый из которых отвечает за разные функции: разрезание длинной некодирующей CRISPR РНК, связывание коротких крРНК, поиск, а затем разрезание ДНК-мишени.
В системах II типа эффекторный комплекс образован единственным большим белком Cas9, который в одиночку справляется со всеми задачами. Именно простота и относительная компактность таких систем послужили основой для разработки технологии редактирования ДНК. Согласно этому методу, в клетки эукариот (например, человека) доставляют бактериальный белок Сas9 и крРНК, которую называют гидовой (гРНК). Вместо спейсера вирусного происхождения такая гРНК содержит целевую последовательность, соответствующую интересному для исследователя участку генома, например, где есть мутация, вызывающая какую-то болезнь. Получить же гРНК «на любой вкус» совсем несложно.
Эффекторный комплекс Cas9-гРНК вносит двуцепочечный разрыв в последовательность ДНК, точно соответствующую «гидовой» РНК. Если вместе с Cas9 и гРНК внести в клетку и последовательность ДНК, не содержащую мутацию, то место разрыва будет восстановлено по матрице «правильной» копии! Таким образом, используя разные гРНК, можно исправлять нежелательные мутации или вводить направленные изменения в гены-мишени. Высокая точность программируемого узнавания мишеней комплексом Cas9-гРНК и простота метода привели к лавинообразному росту работ по редактированию геномов клеток животных и растений (Jiang & Marraffini, 2015).
Гонка вооружений
В ходе эволюции бактерии и бактериофаги выработали ряд приспособлений, которые должны обеспечить каждому из участников «гонки вооружений» преимущество в борьбе с противником или возможность уклониться от его атаки.
Бактериофаги, как факторы среды, вызывают направленные изменения в геноме бактерий, которые наследуются и дают бактериям явное преимущество, спасая от повторных инфекций. Поэтому системы CRISPR-Cas можно считать примером ламарковской эволюции, при которой происходит наследование благоприобретенных признаков (Koonin et al., 2009)
Что касается систем CRISPR-Cas, то если фаг обзаведется мутацией в протоспейсере, эффективность его узнавания эффекторным комплексом снижается, и фаг получает возможность заразить клетку. Но и бактерия не оставит без внимания такую попытку ускользнуть от CRISPR-Cas: в качестве ответной реакции она начинает с резко возросшей эффективностью приобретать новые дополнительные спейсеры из ДНК уже «знакомого» фага, пусть и мутировавшего. Такое явление, названное праймированной адаптацией, многократно повышает эффективность защитного действия систем CRISPR-Cas (Datsenko et al., 2012).
Некоторые бактериофаги реагируют на наличие в бактериальной клетке систем CRISPR-Cas выработкой особых анти CRISPR-белков, способных связываться с белками Cas и блокировать их функции (Bondy-Denomy et al., 2015). Еще одно ухищрение — обмен участков генома вируса, на которые нацелена система CRISPR-Cas, на участки геномов родственных вирусов, отличающихся по составу нуклеотидной последовательности (Paez-Espino et al., 2015).
Результаты работ нашей лаборатории свидетельствуют, что зараженные клетки на самом деле погибают даже при наличии защиты CRISPR-Cas, но при этом они ограничивают численность вирусного потомства. Поэтому CRISPR-Cas правильнее относить к системам абортивной инфекции, а не к «настоящим» иммунным системам.
Благодаря постоянному совершенствованию биоинформатических алгоритмов поиска, а также включению в анализ все большего количества прокариотических геномов, открытие новых типов CRISPR-Cas систем является делом недалекого будущего. Предстоит также выяснить и детальные механизмы работы многих недавно открытых систем. Так, в статье, опубликованной в 2016 г. в журнале Science и посвященной анализу системы CRISPR-Cas VI типа, описан белок С2с2, образующий эффекторный комплекс с крРНК, который нацелен на деградацию не ДНК, а РНК (Abudayyeh et al., 2016). В будущем такое необычное свойство может быть использовано в медицине для регулирования активности генов путем изменения количества кодируемых ими РНК.
Изучение стратегий борьбы бактерий с бактериофагами, несмотря на свою кажущуюся фундаментальность и отвлеченность от задач практической медицины, принесло неоценимую пользу человечеству. Примерами этого могут служить методы молекулярного клонирования и редактирования геномов – направленного внесения или удаления мутаций и изменения уровня транскрипции определенных генов.
Благодаря быстрому развитию методов молекулярной биологии всего лишь через несколько лет после открытия механизма действия систем CRISPR-Cas была создана работающая технология геномного редактирования, способная бороться с болезнями, ранее считавшимися неизлечимыми. Доступность и простота этой технологии позволяют рассматривать ее как основу для медицины, ветеринарии, сельского хозяйства и биотехнологий будущего, которые будут базироваться на направленных и безопасных генных модификациях.
Нет никаких сомнений, что дальнейшее изучение взаимодействия бактерий и их вирусов может открыть перед нами такие возможности, о которых мы сейчас даже не подозреваем.
Abudayyeh O. O., Gootenberg J. S., Konermann S. et al. C 2c2 is a single-component programmable RNA-guided RNA-targeting CRISPR effector // Science. 2016. V. 353: aaf5573.
Barrangou R., Fremaux C., Deveau H. et al. CRISPR provides acquired resistance against viruses in prokaryotes // Science. 2007. V. 315. P. 1709–1712.
Bikard D., Marraffini L. A. Innate and adaptive immunity in bacteria: mechanisms of programmed genetic variation to fight bacteriophages // Curr. Opin. Immunol. 2012. V. 1 P. 15–20.
Bondy-Denomy J., Garcia B., Strum S. et al. Multiple mechanisms for CRISPR-Cas inhibition by anti-CRISPR proteins // Nature. 2015. V. 526. P. 136–139.
Calendar R., Abedon S. T. The Bacteriophages // 2nd Ed., Oxford University Press. 2006.
Datsenko K. A., Pougach K., Tikhonov A. et al. Molecular memory of prior infections activates the CRISPR/Cas adaptive bacterial immunity system // Nat. Commun. 2012. V. 3. P. 945
Jiang W., Marraffini L. A. CRISPR-Cas: New Tools for Genetic Manipulations from Bacterial Immunity Systems // Annu. Rev. Microbiol. 2015. V. 69. P. 209–28.
Jinek M., Chylinski K., Fonfara I., et al. A programmable dual-RNA-guided DNA endonuclease in adaptive bacterial immunity // Science. 2012. V. 337. P. 816–821.
Koonin E. V., Wolf Y. I. Is evolution Darwinian or/and Lamarckian? // Biol. Direct. 2009. V. 4. P. 42.
Lopez-Pascua L., Buckling A. Increasing productivity accelerates host-parasite coevolution // J. Evol. Biol. 2008. V. 3. P. 853–860.
Makarova K. S., Wolf Y. I., et al. An updated evolutionary classification of CRISPR-Cas systems // Nat. Rev. Microbiol. 2015. V. 11. P. 722–736.
Moineau, S., Pandian S., Klaenhammer T. R. Restriction/modification systems and restriction endonucleases are more effective on lactococcal bacteriophages that have emerged recently in the dairy industry // Appl. Envir. Microbiol. 1993. V. 59. P. 197–202.
Neve H., Kemper U., et al. Monitoring and characterization of lactococcal bacteriophage in a dairy plant // Kiel. Milckwirtsch. Forschungsber. 1994. V. 46. P. 167–178.
Nuñez J. K., Harrington L. B., et al. Foreign DNA capture during CRISPR-Cas adaptive immunity // Nature. 2015a. V. 527. P. 535–538.
Nuñez J. K., Kranzusch P. J., et al. Cas1-Cas2 complex formation mediates spacer acquisition during CRISPR-Cas adaptive immunity // Nat. Struct. Mol. Biol. 2014. V. 21. P. 528–534.
Nuñez J. K., Lee A. S., Engelman A., Doudna J. A. Integrase-mediated spacer acquisition during CRISPR-Cas adaptive immunity // Nature. 2015b. V. 519. P. 193–198.
Paez-Espino D., Sharon I., et al. CRISPR Immunity Drives Rapid Phage Genome Evolution in Streptococcus thermophilus // MBio. 2015. V. 6: e00262–15.
Shmakov S., Abudayyeh O. O., Makarova K. S., et al. Discovery and Functional Characterization of Diverse Class 2 CRISPR-Cas Systems. // Mol. Cell. 2015. V. 60. P. 385–397
Tan D., Svenningsen S. L., Middelboe M. Quorum sensing determines the choice of antiphage defense strategy in Vibrio anguillarum. // mBio 2015. V. 6: e00627–15.
Westra E. R., van Erp P. B., Künne T., et al. CRISPR immunity relies on the consecutive binding and degradation of negatively supercoiled invader DNA by Cascade and Cas3 // Mol. Cell. 2012. V. 46. P. 595–605.
Работа поддержана грантом РФФИ (№ 16-34-01176)