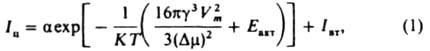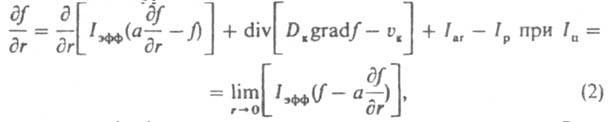Кристаллизация в химии что это
Кристаллизация
Кристаллиза́ция — процесс фазового перехода вещества из жидкого состояния в твёрдое кристаллическое с образованием кристаллов. Фазой называется однородная часть термодинамической системы отделённая от других частей системы(других фаз) поверхностью раздела, при переходе через которую химический состав, структура и свойства вещества изменяются скачками.
Кристаллизация — это процесс выделения твёрдой фазы в виде кристаллов из растворов или расплавов, в химической промышленности процесс кристаллизации используется для получения веществ в чистом виде.
Кристаллизация начинается при достижении некоторого предельного условия, например, переохлаждения жидкости или пересыщения пара, когда практически мгновенно возникает множество мелких кристалликов — центров кристаллизации. Кристаллики растут, присоединяя атомы или молекулы из жидкости или пара. Рост граней кристалла происходит послойно, края незавершённых атомных слоев (ступени) при росте движутся вдоль грани. Зависимость скорости роста от условий кристаллизации приводит к разнообразию форм роста и структуры кристаллов (многогранные, пластинчатые, игольчатые, скелетные, дендритные и другие формы, карандашные структуры и т. д.). В процессе кристаллизации неизбежно возникают различные дефекты.
На число центров кристаллизации и скорость роста значительно влияет степень переохлаждения.
Степень переохлаждения — уровень охлаждения жидкого металла ниже температуры перехода его в кристаллическую (твердую) модификацию. С.п. необходима для компенсации энергии скрытой теплоты кристаллизации. Первичной кристаллизацией называется образование кристаллов в металлах (и сплавах) при переходе из жидкого состояния в твердое.
Кристаллизация: определение, процесс, использование, примеры
Определение кристаллизации
Кристаллизация – это естественный процесс, который происходит, когда материалы затвердевают из жидкости или выпадают в осадок из жидкости или газа. Это может быть вызвано физическим изменением, таким как изменение температуры, или химическим изменением, таким как кислотность. Кристаллизация – это процесс, определяемый размером и формой вовлеченных молекул и их химическими свойствами. Кристаллы могут быть сформированы из одного вид атома, различных видов ионов или даже больших молекул, таких как белки. Некоторым крупным молекулам труднее пройти процесс кристаллизации, потому что их внутренняя химия не очень симметрична или взаимодействует сама с собой, чтобы избежать кристаллизации.
Самая маленькая единица кристалла называется единицей клетка, Это базовое образование атомов или молекул, к которому могут быть присоединены дополнительные единицы. Вы можете думать об этом как о детском строительном блоке, к которому можно прикрепить другие блоки. Кристаллизация происходит так, как будто вы прикрепляете эти блоки во всех направлениях. Некоторые материалы образуют кристаллы различной формы, что объясняет большие различия в форме, размере и цвете различных кристаллов.
Процесс кристаллизации
Зарождение
Первый шаг в процессе кристаллизации – зародышеобразование. Первые атомы в массе, которые формируют кристаллическую структуру, становятся центром, и больше атомов организуется вокруг этого ядра. Когда это происходит, вокруг ядра собирается больше элементарных ячеек, образуется маленький затравочный кристалл. Процесс зародышеобразования чрезвычайно важен при кристаллизации, поскольку ядро кристалла будет определять структуру всего кристалла. Несовершенство ядра и затравочного кристалла может привести к резким перестройкам, поскольку кристалл продолжает формироваться. Нуклеация происходит в переохлажденной жидкости или перенасыщенной растворитель.
Переохлажденная жидкость – это любая жидкость на грани превращения в твердое вещество. Для того, чтобы это произошло, должно сформироваться первоначальное ядро. Именно вокруг этого ядра процесс кристаллизации будет продолжаться. В охлаждающей жидкости ядро образуется, когда атомы или молекулы больше не имеют кинетической энергии, чтобы отскакивать друг от друга. Вместо этого они начинают взаимодействовать друг с другом и образуют стабильные кристаллические образования. Чистые элементы обычно образуют кристаллическую структуру, в то время как крупные молекулы могут быть трудно кристаллизоваться при нормальных температурах и давлениях.
В перенасыщенном решение растворитель, несущий желаемый кристалл, находится на емкости. По мере того, как температура охлаждается или изменяется кислотность, растворимость атомов или молекул в растворе изменяется, и растворитель может удерживать их меньше. Как таковые, они «выпадают» из решения, сталкиваясь друг с другом. Это также вызывает зарождение и последующую кристаллизацию.
Рост кристаллов
Поскольку другие молекулы и атомы окружают ядро, они отходят от уже установленной симметрии, добавляя к затравочному кристаллу. Этот процесс может происходить очень быстро или очень медленно, в зависимости от условий. Вода может кристаллизоваться в лед за считанные минуты, в то время как для формирования «типичных» геологических кристаллов, таких как кварц и алмазы, требуются тысячелетия. Основное образование вокруг ядра определяет всю кристаллическую структуру. Это различие в формации объясняет различия в кристаллах от уникальности снежинки до прозрачности алмаза.
Есть только несколько геометрических фигур, которые могут принимать кристаллы. Они определяются связями и взаимодействиями участвующих молекул. Разные формы обусловлены разными углами связи атомов в зависимости от исходного ядра. Примеси в растворе или материале приведут к отклонению от типичного рисунка. Как видно из снежинок, даже крошечные примеси в ядре приводят к совершенно новым и уникальным конструкциям.
Лабораторное использование кристаллизации
Кристаллизация является распространенным и полезным лабораторным методом. Он может быть использован для очистки веществ и может быть объединен с передовыми методами визуализации для понимания природы кристаллизованных веществ. При лабораторной кристаллизации вещество может быть растворено в подходящем растворителе. Тепло и изменения кислотности могут помочь материалу раствориться. Когда эти условия меняются местами, материалы в растворе осаждаются с разными скоростями. Если условия контролируются должным образом, могут быть получены чистые кристаллы желаемого вещества.
Продвинутая техника визуализации, называемая кристаллографией, рентгеновскими лучами или другими высокоэнергетическими пучками и частицами, может быть пронизана через кристаллическую структуру чистого вещества. Хотя это не создает видимого изображения, лучи и частицы дифрагируют в определенных образцах. Эти шаблоны могут быть обнаружены с помощью специальной проявочной бумаги или электронных детекторов. Образец может затем быть проанализирован математикой и компьютерами, и модель кристалла может быть сформирована. Дифракционные картины создаются, когда частицы или лучи перенаправляются плотными электронными облаками внутри кристаллической структуры. Эти плотные области представляют атомы и связи, присутствующие в кристалле, образовавшемся во время кристаллизации. Используя этот метод, ученые могут распознать практически любое вещество по его кристаллической форме.
Примеры кристаллизации
Шкала времени человека
Кристаллам может потребоваться огромное количество времени, чтобы сформироваться, или они могут сформироваться быстро. Ученые смогли изучить кристаллизацию, потому что в природе существует много событий, в которых кристаллизация происходит быстро. Как уже обсуждалось, лед и снежинки являются отличными примерами кристаллизации воды. Другой интересный пример – кристаллизация меда. Когда пчелы срыгивают мед в соты, это жидкость. Со временем молекулы сахара внутри меда начинают образовывать кристаллы в процессе кристаллизации, описанном выше. Если у вас есть старая бутылка меда, загляните внутрь. Скорее всего, в жидкости будет мало кристаллов сахара. Если вы хотите ускорить процесс, положите мед в холодильник. Охлаждение жидкости снижает растворимость сахара в жидкости, и он быстро образует кристаллы.
Геологическая шкала времени
Хотя процесс схожий, время, необходимое для формирования таких вещей, как кварц, рубин и гранит, намного больше. Эти кристаллы образуются при очень высоких давлениях в коре и магме Земли. Несмотря на то, что процесс кристаллизации одинаков, условия и атомы долго соединяются, чтобы правильно кристаллизоваться. Эти процессы могут быть воспроизведены в лаборатории в более короткие сроки путем создания идеальных условий для кристаллизации. Лаборатории также могут выращивать затравочные кристаллы, которые могут быть введены, чтобы значительно ускорить производство больших партий кристаллов одновременно.
В несколько более короткие сроки в процессе кристаллизации также образуются минеральные отложения, такие как сталактиты и сталагмиты. Когда на эти кристаллы падают небольшие капли воды, содержащиеся в них минералы интегрируются в уже имеющуюся кристаллическую структуру, и вода стекает.
викторина
1. Некоторые ученые утверждают, что кристаллы – это форма жизни. Какое из следующих утверждений поддерживает эту идею?A. Кристаллы могут свободно перемещатьсяB. Благодаря кристаллизации, кристаллы собираются и растут естественным путемC. Кристаллы – живые существа с нервной системой
Ответ на вопрос № 1
В верно. Кристаллизация – это процесс, который происходит естественным путем и во многом напоминает растущую клетку. Хотя рост кристаллов намного проще, он связан с набором правил, вытекающих из химических свойств участвующих молекул.
2. Что из перечисленного НЕ является кристаллом?A. Рубиновый каменьB. Слиток золотаC. Гелий Газ
Ответ на вопрос № 2
С верно. Очевидно, что газ не может образовывать кристалл. На самом деле, гелий должен быть переохлажден до того, как он станет жидким. Молекулы движутся слишком быстро, чтобы сформировать стабильную и правильную структуру. Большинство других веществ в твердой форме представляют собой кристаллы, за исключением нескольких исключений. К ним относятся такие вещи, как стекло, которое не образует регулярную структуру. Вместо кристаллизации такие материалы, как стекло и прозрачный пластик, замерзают, прежде чем можно будет создать структуру.
3. Вы берете немного морской воды из океана. Вы наливаете его в плоскую кастрюлю и оставляете на солнце. Когда вода испаряется, вы начинаете видеть маленькие кристаллы, формирующиеся на дне кастрюли. Что происходит?A. Ничего, они были там раньшеB. По мере испарения воды присутствующие кристаллы становятся просто более заметнымиC. Когда вода испаряется, соли кристаллизуются из раствора
Ответ на вопрос № 3
С верно. Меньше воды в кастрюле означает более высокую концентрацию соли. Когда уровень соли превышает уровень воды, она начинает выпадать из раствора и начинается процесс кристаллизации. Если оставить на несколько дней, вода полностью испарится, оставив только кристаллизованную соль. Не ешьте это все же! Существует много видов соли, и это не хлорид натрия, который вы найдете на своем столе.
Кристаллизация в чем состоит, метод разделения, типы и примеры
кристаллизация это процесс, в котором твердое тело образуется с атомами или молекулами в организованных структурах, которые называются кристаллическими сетями. Кристаллы и кристаллические сети могут образовываться в результате осаждения раствора, путем синтеза и, в некоторых случаях, путем прямого осаждения газа..
Структура и природа этой кристаллической сети будет зависеть от условий, в которых происходит процесс, включая время, прошедшее до достижения этого нового состояния. Кристаллизация как процесс разделения чрезвычайно полезна, поскольку она позволяет гарантировать, что структуры получаются только из желаемого соединения..
Кроме того, этот процесс гарантирует, что прохождение других частиц не будет разрешено, учитывая упорядоченную природу кристалла, что делает этот метод отличной альтернативой для очистки растворов. Много раз в химии и химическом машиностроении необходимо использовать процесс разделения смешения.
Эта потребность возникает либо для повышения чистоты смеси, либо для получения ее конкретного компонента, и по этой причине существует несколько методов, которые можно использовать в зависимости от фаз, в которых обнаружена эта комбинация веществ..
Из чего состоит кристаллизация??
Кристаллизация требует двух шагов, которые должны произойти, прежде чем может быть образование кристаллической сети: во-первых, должно быть достаточно накопления атомов или молекул на микроскопическом уровне, чтобы началось так называемое зародышеобразование.
Эта стадия кристаллизации может происходить только в переохлажденных жидкостях (т. Е. Охлажденных ниже точки замерзания, не делая их твердыми) или перенасыщенных растворах..
После начала зародышеобразования в системе ядра могут быть сформированы достаточно стабильными и достаточно большими, чтобы начать второй этап кристаллизации: рост кристаллов.
зарождение
На этом первом этапе определяется расположение частиц, которые будут образовывать кристаллы, и наблюдается влияние факторов окружающей среды на образовавшиеся кристаллы; например, время, необходимое для появления первого кристалла, называется временем зарождения.
Существует две стадии нуклеации: первичная и вторичная нуклеация. В первом случае новые ядра образуются, когда в середине нет других кристаллов или когда другие существующие кристаллы не влияют на их образование..
Первичное зародышеобразование может быть гомогенным, при котором нет влияния на часть твердых веществ, присутствующих в среде; или он может быть гетерогенным, когда твердые частицы внешних веществ вызывают увеличение скорости нуклеации, которое обычно не происходит.
При вторичном зародышеобразовании новые кристаллы образуются под воздействием других существующих кристаллов; это может произойти из-за сил резания, которые делают сегменты существующих кристаллов новыми кристаллами, которые также растут с собственной скоростью.
Этот тип зародышеобразования выгоден в системах с высокой энергией или в потоке, где вовлеченная жидкость вызывает столкновения между кристаллами.
Рост кристаллов
Это процесс, в котором кристалл увеличивает свой размер путем агрегации большего количества молекул или ионов в промежуточные положения своей кристаллической сети..
В отличие от жидкостей, кристаллы растут равномерно только тогда, когда молекулы или ионы входят в эти положения, хотя их форма будет зависеть от природы рассматриваемого соединения. Любое неправильное расположение этой структуры называется дефектом кристалла..
Рост кристалла зависит от ряда факторов, среди которых, среди прочего, поверхностное натяжение раствора, давление, температура, относительная скорость кристаллов в растворе и число Рейнольдса..
Кроме того, важно отметить, что с маленькими кристаллами намного сложнее манипулировать, хранить и перемещать, и их фильтрация из раствора стоит дороже, чем более крупные. В подавляющем большинстве случаев самые крупные кристаллы будут наиболее желательными по этим и другим причинам..
Как метод разделения
Необходимость в очистке растворов является общей в химии и химической инженерии, поскольку может возникнуть необходимость в получении продукта, который гомогенно смешан с другими или другими растворенными веществами..
Вот почему было разработано оборудование и методы для проведения кристаллизации как процесса промышленного разделения..
Существуют различные уровни кристаллизации, в зависимости от требований, и могут быть выполнены в небольшом или крупном масштабе. Следовательно, его можно разделить на две основные классификации:
перекристаллизация
Это называется перекристаллизацией в технику, которая используется для очистки химикатов в меньших масштабах, обычно в лаборатории.
Это делается с помощью раствора желаемого соединения вместе с его примесями в подходящем растворителе, стремясь тем самым осаждать в виде кристаллов некоторые из двух частиц, которые впоследствии будут удалены..
Существует несколько способов перекристаллизации растворов, среди которых перекристаллизация с растворителем, с несколькими растворителями или с горячей фильтрацией..
-Единый растворитель
Когда используется один растворитель, для получения насыщенного раствора готовят раствор соединения «А», примеси «В» и минимально необходимого количества растворителя (при высокой температуре)..
Затем раствор охлаждают, что приводит к падению растворимости обоих соединений и перекристаллизации соединения «А» или примеси «В». В идеале желательно, чтобы кристаллы были из чистого соединения «А». Может быть необходимо добавить ядро, чтобы начать этот процесс, который может даже быть осколком стекла.
-Различные растворители
При перекристаллизации нескольких растворителей используют два или более растворителей, и проводят тот же процесс, что и с растворителем. Преимущество этого процесса состоит в том, что соединение или примесь будут осаждаться при добавлении второго растворителя, поскольку они не растворимы в нем. В этом методе перекристаллизации нет необходимости нагревать смесь.
-Горячая фильтрация
Наконец, рекристаллизация с горячей фильтрацией используется, когда есть нерастворимое вещество «С», которое удаляется с помощью высокотемпературного фильтра после выполнения той же процедуры перекристаллизации одного растворителя..
В промышленной сфере
В промышленной области мы хотим осуществить процесс, называемый фракционной кристаллизацией, который представляет собой метод, который очищает вещества в соответствии с их различиями в растворимости..
Эти процессы напоминают процессы перекристаллизации, но используют разные технологии для обработки больших количеств продукта.
Применяются два метода, которые будут лучше объяснены в следующем утверждении: кристаллизация охлаждением и кристаллизация испарением.
Будучи крупномасштабным, этот процесс генерирует отходы, но они обычно рециркулируются системой для обеспечения абсолютной чистоты конечного продукта..
Типы кристаллизации
Как указано выше, существует два типа крупномасштабной кристаллизации: охлаждение и испарение. Также были созданы гибридные системы, где оба явления происходят одновременно.
Кристаллизация при охлаждении
В этом методе раствор охлаждают, чтобы уменьшить растворимость желаемого соединения, заставляя его начать осаждаться с желаемой скоростью..
В химическом машиностроении (или процессах) кристаллизаторы используются в форме резервуаров со смесителями, которые циркулируют хладагенты в отсеках, которые окружают смесь, так что оба вещества не вступают в контакт, пока происходит теплопередача хладагента в раствор..
Для удаления кристаллов используются скребки, которые толкают твердые фрагменты в яму.
Кристаллизация выпариванием
Это еще один вариант достижения осаждения кристаллов растворенного вещества с использованием процесса испарения растворителя (при постоянной температуре, в отличие от предыдущего метода), чтобы концентрация растворенного вещества превышала уровень растворимости..
Наиболее распространенными моделями являются так называемые модели с принудительной циркуляцией, которые удерживают раствор кристаллов в однородной суспензии через резервуар, управляя их потоком и скоростью, и обычно генерируют кристаллы большего размера, чем те, которые образуются при кристаллизации. охлаждением.
примеров
— При добыче соли из морской воды.
— В производстве сахара.
— При образовании сульфата натрия (Na2SW4).
— В фармацевтической промышленности.
— При изготовлении шоколада, мороженого, масла и маргарина, в дополнение ко многим другим продуктам.
кристаллизация
КРИСТАЛЛИЗАЦИЯ
переход вещества из газообразного (парообразного), жидкого или твердого аморфного состояния в кристаллическое, а также из одного кристаллич. состояния в другое (рекристаллизация, или вторичная К.); фазовый переход первого рода. К. из жидкой или газовой фазы-экзотермич. процесс, при котором выделяется теплота фазового перехода, или теплота К.; при этом изменение энтропии в большинстве случаев составляет [в Дж/(моль∙К)]: для простых веществ 5–12, для неорг. соед. 20 — 30, для орг. соед. 40–60. Рекристаллизация может протекать с выделением либо поглощением теплоты. В промышленности и лаб. практике К. используют для получения продуктов с заданными составом, содержанием примесей, размерами, формой и дефектностью кристаллов ( см. дефекты, кристаллическая структура, кристаллы), а также для фракционного разделения смесей ( см. кристаллизационные методы разделения смесей), выращивания монокристаллов и др.
Физико-химические основы процесса. Условия, при которых возможна К., определяются видом диаграммы состояния. Чтобы К. протекала с конечной скоростью, исходную фазу необходимо переохладить (перегреть), пересытить кристаллизующимся веществом или внести во внеш. поле, снижающее растворимость кристаллизующейся фазы. В переохлажденной (перегретой) либо пересыщенной фазе происходит зарождение новой фазы — образуются центры К., которые превращ. в кристаллы и растут, как правило, изменяя форму, содержание примесей и дефектность. Центры К. возникают гомогенно в объеме начальной фазы и гетерогенно на поверхностях посторонних твердых частиц (первичное зародышеобразование), а также вблизи поверхности ранее сформировавшихся кристаллов новой фазы (вторичное зародышеобразование). Общее число центров К., возникших в единице объема раствора или расплава в 1 с, или суммарную интенсивность их первичного и вторичного образования, находят по формуле:
где α-кинетич. коэф. первичного зародышеобразования, который рассматривают в рамках кинетич. теории образования новой фазы; R — газовая постоянная; T — температура К.; у-уд. поверхностная своб. энергия кристаллов; Vт — молярный объем новой фазы; Dm=ΔHS и S = (Т0-7)/Т0 для расплавов, am=RT1n(S + 1) и S = (c-c0)/c0 для растворов; ΔH-энтальпия К.; с — концентрация кристаллизующегося вещества; Т0 и c0 — соотв. температура плавления вещества и концентрация насыщ. раствора; Eакт — энергия активации перехода молекул из среды в центры К.; Iат — интенсивность вторичного зародышеобразования в объеме начальной фазы. Для измерения a, Eакт и Iвт находят зависимость интенсивности образования центров К. от температуры, пересыщения и концентрации посторонних твердых частиц. Величина Iи проходит через один или неск. максимумов (рис. 1) с возрастанием переохлаждения (пересыщения) и увеличивается при мех. воздействиях (перемешивание,
Рис. 1. Зависимость скорости зародышеобразования от переохлаждения расплава InSb: I расплав массой 16 г перегревался в кварцевом тигле на 15 К выше температуры плавления в течение 9 мин и затем охлаждался со скоростью 1 град/мин; 2 то же, на 55 К в течение 20 с.
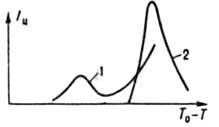
ультразвук) или под влиянием ионизирующего излучения. При росте кристаллов сначала кристаллизующееся вещество адсорбируется на поверхности сформировавшегося кристаллика, а затем встраивается в его кристаллич. решетку: при сильном переохлаждении равновероятно на любом участке поверхности (нормальный рост), при слабом — слоями тангенциально на ступенях, образованных винтовыми дислокациями или двухмерными зародышами (послойный рост). Если переохлаждение ниже некоторого значения, наз. пределом морфологич. устойчивости, нормально растущий кристалл повторяет форму (обычно округлую) теплового либо концентрац. поля вокруг него, а послойно растущий кристалл имеет форму многогранника. При превышении указанного предела растут древовидные кристаллы (дендриты). Количественно рост кристаллов характеризуют линейной скоростью, равной скорости перемещения их поверхности в нормальном к ней направлении. В промышленности используют эффективную линейную скорость роста (увеличение в 1 с радиуса шара, объем которого равен объему кристалла): Iэфф=βS n ехр(Eр/RT), где b — кинетич. коэф. роста (10 −5 –10 −14 м/с), n-параметр роста (обычно 1–3), Ер — энергия активации роста (10–150 кДж/моль). Параметры β, n и Eр находят, измеряя Iэфф при разных температурах и пересыщениях раствора или переохлаждениях расплава. С увеличением переохлаждения Iэфф проходит через максимум аналогично Im. Скорость роста может лимитироваться массо- и теплообменом кристаллов со средой ( соотв. внешнедиффузионный и теплообменный режимы роста), скоростью хим. взаимод. кристаллизующегося компонента с др. компонентами среды (внешнекинетич. режим) или процессами на поверхности кристаллов (адсорбционно-кинетич. режим). Во внешнекинетич. режиме Iэфф возрастает с повышением концентраций реагентов и катализаторов, во внешнедиффузионном и теплообменном режимах — с увеличением интенсивности перемешивания, в адсорбционно-кинетич. режиме — с возрастанием поверхностной дефектности кристаллов и уменьшением концентрации ПАВ. При высоких скоростях роста кристаллы приобретают значит. число неравновесных дефектов (вакансий, дислокаций и др.). При превышении предела морфологич. устойчивости в объем кристаллов попадают трехмерные включения среды, замурованные между ветвями дендритов (окклюзия). Состав кристаллов из-за окклюзии приближается к составу среды тем больше, чем выше Iэфф. При своем росте кристаллы захватывают любую присутствующую в среде примесь, причем концентрация захваченной примеси зависит от скорости роста. Если К. происходит в растворе и кристаллы после завершения роста продолжают контактировать со средой, то неравновесно захваченная примесь выбрасывается из кристаллов в среду, а их структура совершенствуется (структурная перекристаллизация). Одновременно в перемешиваемой среде при столкновениях кристаллов друг с другом и со стенками кристаллизатора возникают дополнит. структурные дефекты. Поэтому в системе постепенно устанавливается стационарная дефектность кристаллов, которая зависит от интенсивности перемешивания. В наиб. распространенном случае образования при К. множества кристаллов (массовая К.) выделяющаяся фаза полидисперсна, что обусловлено неодновременностью зарождения кристаллов и флуктуациями их роста. Мелкие кристаллы более растворимы, чем крупные, поэтому при убывающем пересыщении наступает момент, когда среда, оставаясь пересыщенной относительно последних, становится
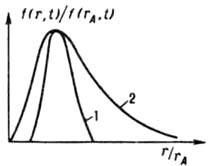
Рис. 2. Функция распределения кристаллов по размерам (обычным r и наиб. вероятным rA) при изотермической (298 К) периодич. кристаллизации из водного раствора в кристаллизаторе с мешалкой (число Re=10 4 ): 1 BaSO4, исходное пересышение S0=500. rA=7.6 мкм; 2 — K2SO4, высаливание метанолом (1∙1)rA=1 мкм; t время процесса.
насыщенной относительно мелких кристаллов. С этого момента начинаются их растворение и рост крупных кристаллов (освальдово созревание), в результате чего средний размер кристаллов возрастает, а их число уменьшается. Одновременно в перемешиваемой среде кристаллы раскалываются при соударениях и через некоторое время приобретают стационарную дисперсность, определяемую интенсивностью мех. воздействия. Осн. количеств, характеристика массовой К. — функция распределения кристаллов по размеру f(r,t)=dN/dr, где N — число кристаллов, размер которых меньше текущего размера r, в единице объема в момент t. Эта функция часто имеет колоколообразный вид (рис. 2); восходящая ее ветвь чувствительна в осн. к зародышеобразованию, росту, раскалыванию и растворению (при созревании) кристаллов, нисходящая к росту и образованию их агрегатов. Если среднее квадратичное отклонение размера кристаллов от среднего не превышает половины, последнего, упомянутая функция наз. узкой, если превышает — широкой. Изменение функции f(r,t) при К. описывается уравнением:
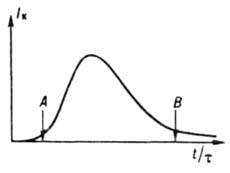
где a — коэф. флуктуации скорости роста кристаллов; Dк и vк — соотв. коэф. диффузии и скорость перемещения кристаллов в среде; Iar и Iр — соотв. интенсивность образования кристаллов данного размера за счет слипания более мелких частиц и раскалывания кристаллов. Система уравнений материального и теплового балансов, уравнения (2), а также уравнения, связывающие размеры и скорость роста кристаллов с их формой, дефектностью и содержанием примесей, — основа моделирования и расчета массовой К. и выбора оптим. условий ее реализации. Массовую К. осуществляют периодически или непрерывно. При периодич. К. охлаждают расплав или насыщ. раствор (пар), испаряют растворитель, добавляют высаливающие агенты (см. ниже) или смешивают порции реагентов, образующих продукционные кристаллы. При непрерывной К. в кристаллизатор вводят потоки расплава, пересыщенного раствора либо реагентов и непрерывно отводят кристаллич. продукт. При периодич. процессе скорость К., определяемая по формуле:
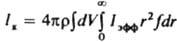
где ρ и V — соотв. плотность твердой фазы и объем системы, сначала медленно растет (период индукции), затем резко увеличивается в результате одновременного возрастания r и f и, пройдя через максимум, уменьшается (рис. 3) вследствие снижения Iэфф. В периоды индукции и увеличения скорости К. в системе преобладают зарождение и рост кристаллов, в период уменьшения скорости — их рост, агрегация и раскалывание и далее — освальдово созревание и структурная перекристаллизация. Период индукции сокращается под влиянием факторов, которые ускоряют зародышеобразование и рост кристаллов. Так, при охлаждении расплавов этот период с повышением интенсивности охлаждения сначала уменьшается, а затем
Рис. 3. Типичное изменение скорости периодич. кристаллизации: t — время процесса; t — длительность периода индукции; A — момент появления новой фазы; В — начало стадии структурной перекристаллизации и освальдова созревания.
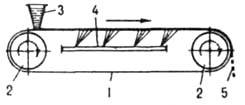
возрастает из-за экстремальной зависимости скоростей зарождения и роста кристаллов от переохлаждения; если темп охлаждения достаточно велик, расплав твердеет, оставаясь аморфным ( см. стеклообразное состояние). Для сокращения периода индукции в систему добавляют кристаллы продукта (затравку), которые растут, что приводит к увеличению скорости К. В результате выделения при росте кристаллов теплоты К. снижается переохлаждение и замедляется зародышеобразование. При малых переохлаждениях (пересыщениях) зародыши вообще не возникают, и затравка, введенная в систему в виде единичных кристаллов, может вырасти в монокристалл, а в виде порошка — в т. наз. монодисперсный продукт с узкой функцией f(r, t). При непрерывной К. функция f(r,t) в сопоставимых условиях перемешивания шире, чем при периодич. К., что объясняется разбросом времен пребывания кристаллов в кристаллизаторах непрерывного действия. Чтобы сузить эту функцию, режим К. приближают к режиму идеального вытеснения, чтобы расширить — к режиму идеального перемешивания ( см. структура потоков). При малом пересыщении системы непрерывная К. устойчива к флуктуациям внеш. условий; при высоком пересыщении его значение и размер кристаллов колеблются в ходе К. В хим. и смежных отраслях промышленности, а также в лабораториях преим. применяют К. из расплавов и растворов, реже — К. из паровой и твердой фаз. К. из расплавов используют гл. обр. для отверждения расплавленных веществ и, кроме того, для их фракционного разделения и выращивания монокристаллов. Отверждение веществ в виде отливок (блоков) осуществляют в спец. формах. В малотоннажных производствах ( напр., реактивов) обычно применяют отдельные формы определенных размеров или конфигурации, в которых расплав охлаждается путем естеств. теплообмена с окружающей средой; в крупнотоннажных производствах (нафталина и др.) К. проводят в секционированных, трубчатых, конвейерных и иных кристаллизаторах со встроенными формами, принудительно охлаждаемыми водой, жидким NH3, хладонами и т. п. Для получения продуктов в виде тонких пластинок или чешуек используют непрерывно действующие ленточные, вальцевые и дисковые кристаллизаторы, где отверждение происходит значительно интенсивнее, чем в формах. В ленточном кристаллизаторе (рис. 4) исходный расплав
Рис. 4. Ленточный кристаллизатор: 1 лента; 2 приводные барабаны; 3 питающий бункер; 4 охлаждающее устройство; 5 отверждснный продукт.
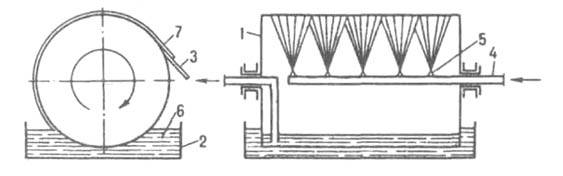
тонким слоем подается на движущуюся металлич. ленту, на которой он охлаждается до полного затвердевания. В вальцевом аппарате (рис. 5) продукт кристаллизуется на наружной поверхности охлаждаемого изнутри вращающегося полого барабана (вальца), частично погруженного в ванну с расплавом; кристаллы снимаются с барабана неподвижным ножом. В дисковых аппаратах отверждение продуктов происходит на поверхности охлаждаемых изнутри вращающихся дисков.
Рис. 5. Вальцевый кристаллизатор: 1 барабан; 2 ванна; 3 нож; 4 труба для подачи хладагента; 5 форсунка; 6 расплав; 7 отвержденный продукт.
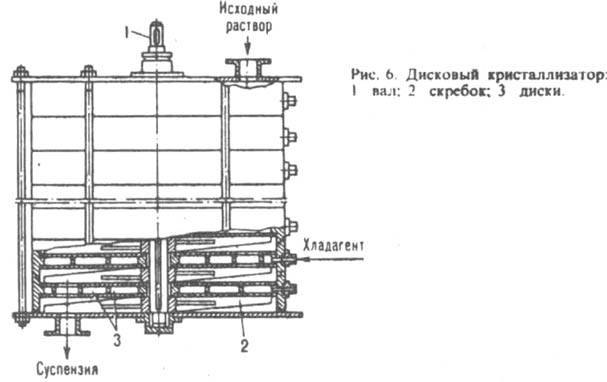
При приготовлении гранулир. продуктов расплав диспергируют непосредственно в поток хладагента газообразного, в осн. воздуха (производство аммиачной селитры, карбамида и др.), или жидкого, напр. воды либо масла (производство пластмасс, серы и т. п.) в полых башнях или аппаратах с псевдоожнженным слоем, где кристаллизуются мелкие капли расплава ( см. гранулирование). К. из растворов используют преим. для выделения ценных компонентов из растворов, а также их концентрированна ( см. вымораживание) и очистки веществ от примесей. Вещества, растворимость которых сильно зависит от температуры ( напр., KNO3 в воде), кристаллизуют охлаждением горячих растворов, при этом исходное количество растворителя, который содержится в маточной жидкости, в системе не изменяется (изогидрическая К.). В малотоннажных производствах применяют емкостные кристаллизаторы периодич. действия, снабженные охлаждаемыми рубашками. В таких аппаратах раствор охлаждают при непрерывном перемешивании по определенной программе. Для предотвращения интенсивной инкрустации поверхностей охлаждения разность температур между раствором и хладагентом должна быть не более 8–10 °C. В крупнотоннажных производствах используют, как правило, скребковые, шнековые, дисковые, барабанные и роторные кристаллизаторы непрерывного действия. Скребковые аппараты обычно состоят из неск. последовательно соединенных трубчатых секций, в каждой из которых имеется вал со скребками и которые снабжены общей или индивидуальными охлаждающими рубашками. При вращении вала скребки очищают внутр. поверхность охлаждаемых труб от осевших на них кристаллов и способствуют транспортированию образовавшейся сгущенной суспензии из секции в секцию. В шнековых кристаллизаторах раствор перемешивают и перемещают с помощью сплошных или ленточных шнеков. Дисковые кристаллизаторы снабжены неподвижными либо вращающимися дисками. В первом случае (рис. 6) по оси аппарата расположен приводной вал со скребками для очистки поверхностей дисков от осаждающихся кристаллов; исходный раствор подается в кристаллизатор сверху, а образующаяся суспензия последовательно проходит в пространстве между охлаждаемыми дисками и выгружается через ниж. штуцер. Во втором случае вал с дисками размещен внутри корыта или горизонтального цилиндрич. сосуда; кристаллы снимаются с поверхности дисков неподвижными скребками.
Рис. 7. Кристаллизатор с псевдоожиженмым слоем: I насос: 2 теплообменник: 3 циркуляционная труба; 4 кристаллорастворитель.
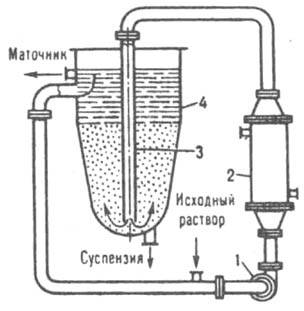
В ряде случаев К. растворов осуществляют непосредственным смешением их с жидкими, газообразными и испаряющимися хладагентами в смесительных, барботажных, распылительных и др. аппаратах. Если растворимость вещества мало изменяется с изменением температуры ( напр., NaCl в воде), К. проводят частичным или практически полным испарением растворителя путем выпаривания насыщ. раствора при почти постоянной температуре (изотермическая К.). По конструкции выпарные кристаллизаторы в значит. степени напоминают выпарные аппараты ( см. выпаривание) и могут иметь внутр. или выносную (рис. 8) греющие камеры. В таком кристаллизаторе исходный и циркулирующий растворы, проходя через камеру, нагреваются до температуры кипения. Образовавшаяся парожидкостная смесь поступает в сепаратор, где пар отделяется от раствора. Кристаллы, осаждающиеся в сепараторе, вместе с маточной жидкостью направляются в спец. аппарат, в котором отделяются от нее и выводятся в виде конц. суспензии;
Рис. 8. Выпарной кристаллита гор: 1 выносная греющая камера: 2 сепаратор: 3 циркуляционная труба; 4 отделитель кристаллов.
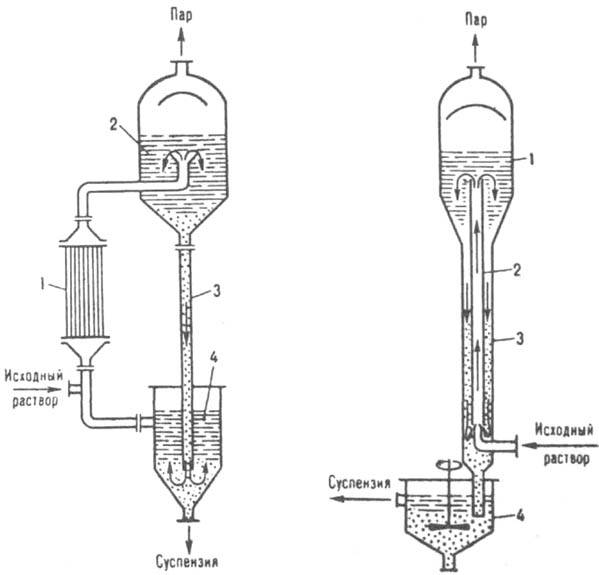
Рис. 9. Вакуум-кристаллизатор: 1 — сепаратор: 2 — циркуляционная труба: 3 — барометрическая труба; 4 — гидрозатвор.
осветленный маточник возвращается в камеру. Для предотвращения инкрустации (обрастания) поверхностей нагрева раствор должен циркулировать в кристаллизаторе с достаточно большой скоростью (до 3 м/с), что часто достигается применением осевых насосов. При одновременном охлаждении и выпаривании растворителя К. осуществляют в вакуум-кристаллизаторах периодич. или непрерывного действия, с принудительной либо естественной циркуляцией раствора. Раствор охлаждается вследствие адиабатич. испарения части растворителя при создании в таком аппарате определенного разрежения. Количество испаренного растворителя обычно составляет 8–10% от общей массы раствора. В кристаллизаторе с естеств. циркуляцией (рис. 9) исходный раствор подается в ниж. часть циркуляц. трубы и вместе с циркулирующей суспензией поднимается вверх, где в результате понижения давления вскипает. Образовавшиеся пары проходят через сепаратор и поступают в барометрич. конденсатор. Пересыщенный раствор и выделившиеся кристаллы движутся вниз по барометрич. трубе, откуда кристаллы вместе с частью маточной жидкости выводятся в гидрозатвор. Для поддержания разрежения используют вакуум-насосы или пароструйные инжекторы. В крупнотоннажных производствах широко распространены многокорпусные вакуум-кристаллизац. установки с числом корпусов 4–24, в которых глубина разрежения постепенно возрастает от первого корпуса к последнему. Вакуум-кристаллизаторы более производительны и экономичны, чем выпарные кристаллизаторы. К. некоторых веществ можно осуществить высаливанием. При выделении неорг. соед. используют орг. вещества ( напр., Na2SO4 кристаллизуют, добавляя к его водному раствору метанол, этанол либо NH3) или содержащие одинаковый ион с выделяемым соед. ( напр., FeSO4 кристаллизуют из травильных растворов добавкой конц. H2SO4); при выделении орг. соединений — воду, водные растворы неорг. солей и т. п. Введение в раствор в качестве высаливателей орг. веществ обычно удорожает процесс из-за сложности их регенерации. К. из паровой фазы позволяет кристаллизовать вещества, обладающие высоким парциальным давлением паров над твердой фазой и способные непосредственно переходить из газообразного состояния в кристаллическое ( напр., иод, фталевый ангидрид). Такую К. используют для выделения ценных компонентов из парогазовых смесей, получения аэрозолей, нанесения тонких кристаллич. слоев на поверхность разл. тел ( напр., в производстве полупроводниковых материалов) и т. д. К. аморфной твердой фазы и рекристаллизацию осуществляют, как правило, при температурах, близких к температурам плавления кристаллизуемых веществ. При этом в результате термодиффузионных процессов изменяется первичная кристаллич. структура вещества либо происходят зарождение и рост кристаллов из аморфной фазы. Такую К. применяют для получения веществ и материалов с заданными кристаллич. структурой либо степенью кристалличности (термопластичные полимеры, стекло и др.).
Лит.: Маллин Дж.У.. Кристаллизация, пер. с англ., М., 1965; Магусевич Л.Н.. Кристаллизация из растворов в химической промышленности, М., 1968; Бэмфорт А В, Промышленная кристаллизация, мер. с англ., М., 1969; Пономаренко В. Г. Ткаченко К. П., Курлянд Ю. А., Кристаллизация в псевдоожиженном слое. К., 1972; Мелихов И. В., Меркулова М.С.. Сокристаллизация, М.. 1975; Гельперин Н. И.. Носов Г. А., Основы техники кристаллизации расплавов, М., 1975; Кидяров Б. И., Кинетика образования кристаллов из жидкой фазы, Новосиб., 1979; Гельперин Н. И., Основные процессы и аппараты химической технологии, кн. 2, М., 1981, с. 678 726, Контактная кристаллизация, под ред. М.Ф. Михалева. Л., 1983; Тодес О. М., Себалло В. А.. Гольцикер А. Д., Массовая кристаллизация из растворов. Л., 1984; Гельперин Н. И., Носов Г. А.. Основы техники фракционной кристаллизации. М., 1986.