Костная терапия 2 категории что это такое
Костные блокады
Костные блокады — метод введения активных действующих веществ непосредственно в губчатое вещество кости. Внутрикостные блокады применяются для снятия болевого синдрома при компрессии нервных структур спинного мозга, их отеке и воспалении. Это эффективный и безопасный метод, позволяющий избавиться от постоянных болей в области спины. После проведения процедуры пациент быстро чувствует улучшение состояния и исчезновение болевого синдрома. Иногда для достижения положительного эффекта достаточно одной процедуры.
Техника проведения
Костные блокады — процедура безопасная и малотравматичная, проводится в амбулаторных условиях. Пациент не нуждается в длительном пребывании в стационаре.
Для достижения эффекта в губчатое вещество позвонка вводят лекарственный раствор. В блокадную смесь входят обезболивающие препараты и противовоспалительные средства. Затем игла удаляется, и ранка заклеивается асептическим пластырем.
Осложнения после процедуры наблюдаются крайне редко при правильной технике введения препарата внутрь кости. Для снижения риска осложнений игла вводится в кость под контролем системы визуализации.
В некоторых случаях процедура противопоказана: острые инфекционные заболевания, местный воспалительный процесс в месте прокола, аллергические реакции на компоненты лекарственной смеси, сердечнососудистая или дыхательная недостаточность.
Механизм действия
Внутрикостные блокады очень эффективны по нескольким причинам:
В большинстве случаев костные блокады позволяют избежать обширных операций и помочь пациенту вернуться к нормальной жизни без постоянной боли.
Введение активных веществ не устранит причину сдавления нервных образований, но это действенный симптоматический метод лечения. Благодаря процедуре болевой синдром можно устранить быстро и на длительный срок. Преимуществом метода также является малая травматичность и отсутствие длительного восстановительного периода.
Внутрикостные блокады – метод, который давно и эффективно применяется на практике, хорошо переносится пациентами и отличается высоким процентом положительных результатов.
Костная терапия 2 категории что это такое
средств, рекомендованные для внутривенного введения в периферические вены;
− дозировки препаратов при внутрикостной и внутривенной инфузии идентичны»). Однако внутрикостной путь используется в качестве парентерального введения лекарственных препаратов.Мы же 40 лет используем внутрикостное введение лекарственных препаратов для лечения конкретных заболеваний и патологических процессов: различные болевые синдромы, спастичность после инсульта и при рассеянном склерозе, диабетическая полинейропатия, спондилиты и сакроилеиты, артрозы и др.
При комплексном региональном болевом синдроме внутрикостная терапия в кости руки также приводит к быстрому регрессу боли и отёка кисти. При выраженном поясничном асептическом спондилодисците (Модик1) внутрикостная терапия в подвздошные ости и остистые отростки поясничных позвонков приводит к быстрому уменьшению отеков в мягких тканях поясничной области и нижних конечностей, форсирует диурез до 10 л в сутки.Столь выраженный противоотечный эффект внутрикостной терапии, особенно при введении препаратов в кости таза и позвоночника, объясняется тесной связью этих костных структур с бесклапанной цереброспинальной венозной системой, которая является центральной дренажной венозной системой организма и обеспечивает венозный отток от сегментарных тканей и органов организма. Кроме того, костные структуры таза и позвоночника самым тесным образом связаны с лимфатической системой туловища. Поэтому, когда при внутрикостной терапии лекарственное вещество вводится в кости таза или позвоночника это приводит к распространению этого вещества через сосудистое русло цереброспинальной венозной системы и лимфатические протоки к внутренним органам и тканям, что и обеспечивает значительное отток крови и лимфы от внутренних органов и тканей и приводят к уменьшению отека межклеточного пространства со всеми вытекающими отсюда положительными терапевтическими эффектами, как-то, регрессу воспаления, микро-ДВС синдрома, капилляропатии и т.д.
Современные подходы к диагностике и лечению остеопороза
Рисунок 1. Микроархитектоника здоровой (слева) и остеопоретической (справа) трабекулярной кости. Методы диагностики остеопороза Денситометрия. Ультразвуковая сонография. Рентгенография. Исследование биохимических маркеров костного метаболи
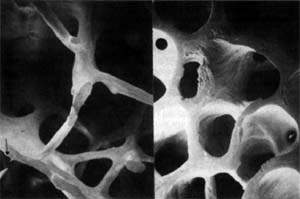 |
| Рисунок 1. Микроархитектоника здоровой (слева) и остеопоретической (справа) трабекулярной кости. |
Методы диагностики остеопороза Денситометрия. Ультразвуковая сонография. Рентгенография. Исследование биохимических маркеров костного метаболизма.
Остеопороз — это системное заболевание скелета, характеризующееся снижением костной массы и нарушением микроархитектоники костной ткани, ведущими к повышенной хрупкости костей с последующим увеличением риска их переломов (рис. 1). Помимо наиболее распространенного постменопаузального остеопороза, в настоящее время в цивилизованных странах в связи с растущей продолжительностью жизни все чаще встречается сенильный остеопороз, а также вторичный остеопороз, обусловленный различными заболеваниями (эндокринная патология, ревматические болезни, заболевания желудочно-кишечного тракта и пр.) или связанный с длительным приемом некоторых лекарственных препаратов, например кортикостероидов.
В настоящее время для диагностики остеопороза используются преимущественно неинвазивные методы, которые легковыполнимы, безопасны и могут повторяться неоднократно у одного и того же больного. К таким методам относятся рентгенографическое исследование, костная денситометрия и исследование биохимических маркеров костного метаболизма. Каждый из этих методов занимает свою нишу в диагностике заболе-вания.
С целью ранней диагностики остеопороза применяются различные технологии, объединенные под общим названием «костная денситометрия», с ее помощью можно определить минимальную плотность костной ткани (МПК), являющуюся главным критерием прочности кости. В настоящее время выделяют четыре типа и два подтипа технологий для измерения МПК:
В данном перечне отсутствует фотонная денситометрия — предшественница рентгеновской денситометрии, в последнее время используемая весьма редко.
 |
| Рисунок 2 |
Системы DXA являются наиболее изученными и широко применяются в клинической практике (рис. 2). DXA позволяет измерять МПК в центральных отделах скелета: в поясничном отделе позвоночника и в проксимальном отделе бедренной кости. В этих участках происходят наиболее тяжелые переломы. Кроме того, многие из этих приборов снабжены программой «все тело», позволяющей определить содержание минералов во всем скелете, а также исследовать мягкие ткани — мышечную и жировую. В новых модификациях приборов DXA имеется возможность латерального сканирования и морфометрического измерения позвонков,что значительно повышает информативность этого метода. Метод DXA также адаптирован для оценки состояния МПК в области периферических участков скелета, в частности в области предплечья и пяточной кости (рис. 3).
Радиографическая абсорбциометрия используется редко, поскольку требует специально оборудованного центра, где при помощи микроденситометра производится сканирование рентгеновских снимков фаланг и определяется их оптическая плотность.
 |
| Рисунок 3 |
Для определения МПК позвоночника можно использовать и QCT, которая является единственным методом, представляющим результаты исследования в трехмерном измерении. Возможность проведения измерений в поперечном сечении, заложенная в QCT, позволяет выделить этот метод среди других, так как он дает возможность дифференцированно оценивать МПК в трабекулярной и кортикальной костной ткани, фиксируя истинные значения МПК в г/см3 [1]. В отличие от DXA при QCT нет искажений МПК, связанных с тучностью пациента, а также вызванных сопутствующей патологией, например спондилоартритом и остеофитами, обызвествлением стенки аорты или участками остеосклероза, развивающимися в результате дегенеративных заболеваний или переломов позвонков. Но большие дозы облучения при QCT, а также высокая стоимость обследования ограничивают широкое применение этой технологии в диагностике остеопороза, использование ее оправданно лишь в ситуациях, требующих дифференциальной диагностики (рис. 4).
 |
| Рисунок 4 |
В последние годы активно развивается ультразвуковая сонография, которая, в отличие от рентгеновской денситометрии, позволяет обследовать другие характеристики костной ткани: SOS — скорость распространения ультразвука в кости и BUA — широковолновое рассеивание (затухание) ультразвуковой волны в исследуемом участке скелета. Эти параметры, по данным многих исследователей, отражают степень эластичности и прочности костной ткани и достаточно высоко коррелируют с МПК позвоночника и шейки бедра [2]. В настоящее время многие специалисты высказывают мнение о том, что с помощью ультразвуковой денситометрии можно предсказывать риск переломов, тем самым обосновывая ее значение как метода для скрининга. Вопрос о возможности применения этих приборов в диагностике остеопороза и оценке эффективности терапии продолжает дискутироваться.
Рентгенография довольно активно используется для диагностики остеопороза и его осложнений. Однако ее нельзя отнести к методам ранней диагностики, поскольку рентгенологические признаки остеопороза появляются тогда, когда 20 — 30% костной массы уже потеряно [3]. Наиболее сложно оценить выраженность остеопороза в позвоночнике, поскольку ни один из его рентгенологических признаков не является специфичным. Часто рентгенография позволяет выявить остеопороз лишь на поздней стадии, когда уже имеются остеопоретические переломы. Для объективной оценки степени снижения минерализации костей разработаны так называемые полуколичественные методы. В основе их лежит вычисление вертебральных, феморальных и метакарпальных индексов. Но они также не могут претендовать на достаточную точность и чувствительность при выявлении ранней стадии заболевания (остеопении), хотя успешно применяются при эпидемиологических исследованиях распространенности остеопороза в популяции [4, 5]. Таким образом, основной функцией ренгенографического метода в диагностике остеопороза является обнаружение переломов, динамическое наблюдение за появлением новых переломов и дифференциальная диагностика остеопоретических переломов от других типов деформаций позвоночника.
С помощью методов «костной денситометрии» можно судить об основных параметрах прочности костной ткани, однако эти методы не дают никакой информации об уровне костного метаболизма. Уровень формирования и резорбции костной ткани может быть оценен несколькими способами: путем измерения ферментной активности костных клеток (остеобластов и остеокластов) или определения продуктов деградации костного матрикса, которые высвобождаются в циркуляцию в процессе костного обмена (табл. 1).
Таблица 1. Биохимические маркеры костного метаболизма
маркеры
мочи
Представленные в таблице костные маркеры являются предикторами потери костной массы, переломов костей скелета и используются для мониторинга антиостеопоретической терапии. По этим биохимическим показателям можно судить об эффективности терапии, об адекватности дозы препарата и о его переносимости. Особенно полезны костные маркеры для оценки эффективности терапии в сравнительно короткие промежутки времени, когда денситометрическое исследование еще не информативно (полагают, что повторные денситометрические исследования надо выполнять не чаще одного раза в год). Уровень маркеров костного метаболизма изучался в основном у женщин постменопаузального периода. Оказалось, что уровень почти всех маркеров, за исключением IPCP, повышен и коррелирует со снижением МПК [6]. Полагают, что сочетание денситометрии и исследования биохимических маркеров костного метаболизма позволит получить более полную информацию о риске развития постменопаузального остеопороза. По мнению P. Delmas (1996) увеличение скорости костной резорбции (по оценке уровней биохимических маркеров) существенно повышает риск развития переломов независимо от исходной костной массы пациентов [7]. Это связано с тем, что хрупкость кости при остеопорозе зависит не только от МПК, но и от нарушения микроархитектоники костной ткани, выраженность которой можно оценить с помощью биохимических маркеров костной резорбции. Это предположение подтверждается данными P. Garnero et al. (1996), полученными в рамках исследования EPIDOS [6]. Доказано, что увеличение уровня СТх или свободного диоксипиридинолина на 1SD от нормы ассоциировалось с 1,3- и 1,4-кратным увеличением риска переломов шейки бедра (рис. 5).
 |
| Рисунок 5. Комбинированная оценка МПК и скрытой костной резорбции для определения риска перелома шейки бедра у пожилых. МПК определялась по критериям ВОЗ с учетом показателей ниже 2,5 SD от нормальных показателей МПК у молодых здоровых женщин (Ts core |
При этом снижение МПК шейки бедра и увеличение маркеров костной резорбции, независимо друг от друга, связаны с высоким риском переломов шейки бедра. Для оценки эффективности проводимой терапии рекомендуется исследовать биохимические маркеры через каждые три месяца после начала лечения. При исследовании биохимических маркеров необходимо принимать во внимание факторы, влияющие на воспроизводимость результатов: диета, условия хранения материала, биологические факторы (циркадные и сезонные колебания, менструальный цикл, возраст, пол, наличие сопутствующих заболеваний и т. д.).
Многолетний опыт изучения остеопороза за рубежом показывает, что ни один из существующих в настоящее время лекарственных препаратов не может надежно восстановить количество и качество кости, поэтому основной мерой в борьбе с этим заболеванием является профилактика. Профилактику остеопороза надо начинать рано и уделять особое внимание средовым факторам, влияющим на достижение пика костной массы, который наступает примерно к тридцати годам. В числе этих факторов — питание и физическая активность, адекватное поступление в организм витамина D и инсоляция. К наиболее важным периодам относятся период роста кости (юношество), беременность, лактация и перименопауза. Пик костной массы может быть значительно улучшен за счет включения в рацион продуктов с повышенным содержанием кальция (прежде всего молочные и рыбные продукты). Суточное потребление кальция должно составлять в среднем 1000 — 1500 мг, предпочтительно с пищей. Регулярные физические упражнения с весовой нагрузкой в период роста кости приводят к увеличению пика костной массы. У взрослых после достижения пика костной массы адекватное потребление кальция, постоянная физическая нагрузка и наличие регулярного менструального цикла также способствует сохранению костной массы. Профилактику остеопороза среди взрослого населения нужно проводить в «группах риска».
Проблема лечения остеопороза за рубежом изучается давно, причем особенно активно в последнее десятилетие, что связано с введением денситометрии. Однако до настоящего времени не разработаны общепринятые терапевтические программы и режимы лечения этого заболевания, что, по-видимому объясняется его многофакторной природой и сложным патогенезом. Основная цель лечебных мероприятий — сбалансирование процессов костного метаболизма и сохранение или улучшение качества жизни пациента. Для этого необходимо добиться замедления или прекращения потери костной массы; уменьшить болевой синдром в позвоночнике и периферических костях; улучшить функциональное состояние больного и предотвратить возможные падения; восстановить трудоспособность и психоэмоциональное состояние. Наряду с этиопатогенетической терапией препаратами, направленными на нормализацию процессов ремоделирования костной ткани и на сохранение минерального гомеостаза, применяется и симптоматическая терапия, включающая в себя диету с повышенным содержанием солей кальция и фосфора, нестероидные противовоспалительные средства, анальгетики, миорелаксанты, которые позволяют уменьшить болевой синдром, мышечное напряжение и тем самым расширить двигательную активность пациента и ускорить начало реабилитационных мероприятий.
Реабилитация подразумевает лечебную физкультуру, ношение корсетов, плавание, курсы легкого массажа.
Все препараты для лечения остеопороза можно разделить на три группы:
В этиопатогенетической терапии остеопороза предпочтение отдается группе препаратов, подавляющих резорбцию костной ткани, вследствие их более высокой эффективности и сравнительно небольшого побочного действия.
В целом терапия остеопороза должна быть комплексной и проводить ее следует длительно в виде непрерывного или курсового лечения. Поскольку в настоящее время нет идеального препарата для лечения остеопороза, перспективна комбинированная терапия, в которой сочетаются препараты с различным механизмом действия, что позволяет потенцировать их антиостеопоретическое действие, снизить частоту и выраженность побочных эффектов.
| Профилактика остеопороза заключается в сбалансированном питании, физической активности, и адекватном поступлении в организм витамина D |
При комбинированной терапии лекарственные средства назначают одновременно или последовательно. Их выбор осуществляется индивидуально для каждого больного в зависимости от формы остеопороза, скорости костного обмена, тяжести клинического течения, сопутствующих заболеваний. Основным критерием эффективности любого антиостеопоретического средства является снижение частоты переломов, однако в каждом конкретном случае надо ориентироваться в первую очередь на показатели МПК по данным костной денситометрии и на биохимические маркеры костного обмена. Увеличение МПК более чем на 1% и нормализация биохимических показателей, если они были изменены, свидетельствуют об эффективности проводимой терапии. Учитываться должна и положительная динамика клинической картины: уменьшение болевого синдрома, повышение функциональной активности.
Таким образом, в настоящее время имеется довольно большой выбор диагностических методов, позволяющих установить диагноз остеопороза на разных стадиях, а также эффективных лекарственных препаратов, влияющих на различные звенья патогенеза остеопороза, способных уменьшить или купировать клинически выраженные симптомы заболевания, а также предупредить развитие переломов.
Терапия нарушений метаболизма костной ткани
Лесняк О.М., Санникова О.Ю.
Остеопороз (ОП) – прогрессирующее системное заболевание скелета, характеризующееся снижением костной массы и нарушением микроархитектоники (качества) костной ткани, что приводит к хрупкости костей и повышению риска перелома. Важно подчеркнуть, что заболевание протекает асимптомно до тех пор, пока не случится низкоэнергетический перелом. Он – самое распространенное заболевание костной ткани: остеопоротические переломы отмечается у половины всех женщин, находящихся в периоде постменопаузы, а также у мужчин старших возрастных групп [1]. По данным Российской ассоциации по ОП, каждые 5 минут в России происходит перелом шейки бедра, вызванный ОП, а в год в нашей стране из–за него происходит 9 млн переломов периферического скелета и более 3 млн случаев переломов позвонков (www.osteoporoz.ru). Пациенты, перенесшие один остеопоротический перелом, имеют высокий риск повторных переломов. Следовательно, наиболее важной целью лечения ОП является предотвращение переломов [1].
Костная ткань является разновидностью соединительной и вместе с хрящевой образует скелет. Для выполнения своих функций (движение, защита внутренних органов, костного мозга и нервной системы) скелет должен быть прочным, а, следовательно, жестким и гибким одновременно. Жесткость кости придают минералы (кальций, фосфор), а гибкость – органический матрикс (коллаген I типа и неколлагеновые белки: остеокальцин, остеонектин, остеопонтин и др.). В течение всей жизни человека, начиная с рождения и дальше, с возрастом, и жесткость, и гибкость кости снижаются, поскольку происходят потеря минералов и повреждение матрикса. Для того чтобы противостоять этим проявлениям старения, в кости существует процесс постоянного обмена (ремоделирования), обеспечивающий обновление всего скелета 3–4 раза за жизнь. Способность костной ткани к самостоятельному ремоделированию способствует не только адаптации и обновлению, но и заживляет переломы, трещины, а также микропереломы. Таким образом, ремоделирование кости – это процесс, работающий в течение всей жизни и направленный на восстановление и сохранение скелета как структурного и функционального органа.
Ремоделирование выполняется двумя основными клетками костной ткани: остеокластами, резорбирующими кость, и остеобластами, формирующими новую кость. Остеокласты – многоядерные гигантские клетки, происходящие из мононуклеарных фагоцитов, продуцируемых гематопоэтической системой. Прикрепившись к кости, остеокласты начинают продуцировать множество протеолитических ферментов, разрушающих матрикс кости, а также ионы водорода, рассасывающие кристаллы гидроксиапатита. Весь процесс резорбции кости занимает обычно несколько дней.
Процесс костеобразования, продолжающийся несколько недель, выполняется остеобластами. Последние происходят из предшественников – мезенхимальных или стромальных стволовых клеток. Остеобласты значительно меньше размером, чем остеокласты, и имеют одно ядро. Они синтезируют остеоид, органический матрикс кости, и ответственны за дальнейшую его минерализацию. Примерно один из десяти остеобластов при образовании нового костного матрикса остается замурованным внутри и превращается в остеоцит. Остеоциты соединены друг с другом и с покровными клетками длинными отростками, позволяющими функционировать целой коммуникационной системе внутри кости. Благодаря этому остеоциты служат системой «быстрого реагирования» на любые внутренние и внешние стимулы и регулируют процессы резорбции и костеобразования.
Костное ремоделирование – гомеостатический процесс, вовлекающий повторные циклы резорбции и депозиции новой кости. В норме ежедневно в различных частях скелета работают от 2 до 5 млн единиц (мест) костного ремоделирования, каждая состоящая из нескольких остеокластов и множества остеобластов. Важно понимать, что их активности тесно связаны друг с другом: костная резорбция предшествует костеобразованию и связана с целым рядом сложнейших метаболических изменений. Предшественники остеобластов вырабатывают ряд веществ, способных связываться с рецепторами остеокластов и, как это ни парадоксально, усиливают дифференцировку и активацию остеокластов. Ведущую роль из них играют макрофаг–колониестимулирующий фактор (М–КСФ) и лиганд RANK (рецептора активации фактора NF–KB). Мононуклеары обеспечивают условия для работы новых остеобластов, синтезирующих компоненты органического матрикса для восстановления дефекта кости. Активация одних клеток приводит к активации других, так что количество резорбированной ткани соответствует количеству вновь образованной кости. Затем наступает период относительного покоя, сменяющийся периодом незначительной активности клеток, далее проходит новый цикл ремоделирования. Постоянный костный обмен важен для здоровья костной ткани, он предупреждает накопление старой, «усталой» кости, способствует репарации микропереломов и изменению костной архитектоники в ответ на повторные нагрузки. Не надо забывать, что кость является резервуаром кальция в организме и ремоделирование обеспечивает процесс гомеостаза кальция.
Дефицит эстрогенов после наступления менопаузы приводит к увеличению скорости костного ремоделирования, при этом увеличивается количество резорбированной кости и снижается объем вновь образованной, что приводит к потере массы кости и ее структурным нарушениям. Постменопаузальный ОП характеризуется гиперактивностью остеокластов, приводящей к столь высокой скорости потери кости, что для компенсации последствий работы нескольких аномально активированных остеокластов требуется несколько месяцев деятельности многочисленных остеобластов. В связи с указанным процессом за первые 10 лет от наступления менопаузы женщина теряет 20–30% трабекулярной и 5–10% кортикальной кости. Одновременно ухудшается качество кости: уменьшается ее объем и толщина трабекул, снижается их количество. Чрезмерная резорбция костной ткани, не компенсируемая костеобразованием, лежит в основе и других костных заболеваний, таких как болезнь Педжета, метастазирование опухолей и др.
Возможности медикаментозного воздействия на костную ткань в мировой медицинской литературе обсуждаются с 60–х годов XX столетия. В 1962 г. Н. Fleisch и S. Bisaz впервые высказали предположение о влиянии пирофосфата на физиологическую регуляцию процесса обмена кальция, что привело в дальнейшем к внедрению в клиническую практику целой группы фармакологических препаратов, получивших название бисфосфонатов. Они были синтезированы как устойчивые аналоги встречающихся в природе соединений пирофосфата, имеющие высокое сродство к гидроксиапатиту и селективно присоединяющиеся к костной ткани, влияя на процессы ремоделирования за счет снижения активности остеокластов, что подвело основу для использования их в качестве антирезорбтивных средств. В отличие от множества других лекарственных препаратов бисфосфонаты прикрепляются к активным участкам костного ремоделирования и именно там проявляют свой эффект [2].
Первенцем на этом пути стал этидронат. Синтезированный около 100 лет назад, он нашел применение как ингибитор коррозии или комплексный агент в различных отраслях промышленности при изготовлении тканей, минеральных удобрений, нефтепереработке. Первое описание медицинского применения бисфосфонатов опубликовано в 1969 г. в журнале «Ланцет», когда 16–месячного ребенка с оссифицирующим миозитом успешно лечили этидронатом с целью подавления внекостной оссификации. В 1972 г. была опубликована первая статья об эффективности этидроната при болезни Педжета [2].
В последующем было синтезировано второе поколение бисфосфонатов, содержащих атом азота, антирезорбтивная активность которых была существенно выше. Сейчас известно, что азотсодержащие бисфосфонаты подавляют метаболизм мевалоната и пренилирование белков, что приводит к структурным изменениям внутри остеокласта и нарушению его функции. Благодаря этому костный обмен возвращается к физиологическому уровню, наблюдавшемуся до менопаузы, и предупреждаются дальнейшая деструкция микроархитектоники и потеря кости. Обмен кости остается стабильным на протяжении длительного приема алендроната, по крайней мере в течение 10 лет. Это доказывает, что аккумуляция препарата в кости не приводит к гиперсупрессии ремоделирования.
В настоящее время бисфосфонаты являются признанным методом профилактики и лечения ОП у мужчин и у женщин. Исследования, успешно проведенные на десятках тысяч пациентов, показали, что бисфосфонаты безопасны, хорошо переносятся, имеют мало побочных эффектов, подавляют костную резорбцию, способствуют повышению МПК и снижают риск переломов.
В настоящее время в клинической практике используется несколько бисфосфонатов (алендронат, ризедронат, ибандронат, золедроновая кислота) с различными путями и режимами введения (таблетка 1 раз/нед. или 1 раз/мес., внутривенные введения раз в 3 месяца или раз в год).
Первое место по продолжительности изучения, количеству проведенных исследований и наличию серьезной и разнообразной доказательной базы эффективности и переносимости в клинической практике занимает алендронат. Лечение алендронатом эффективно уже к концу года приема у 95% пациентов [3].
Наиболее весомый вклад в проблему изучения эффективности алендроната внесли исследования FOSIT (Fosamax International Trial) и FIT (Fracture Intervention Trial), из которых известно, что МПК в области позвоночника уже к 3–му мес. лечения увеличивается на 3%. К концу 12–го мес. приема алендроната отмечено повышение МПК в поясничном отделе позвоночника на 13,7% и проксимальном отделе бедра на 5,4%. Риск новых переломов позвонков снизился на 47%, частота прогрессирования деформации позвонков – на 64%, риск болезненных переломов позвонков – на 55%. Продолжением исследования FIT послужило исследование FLEX по 10– либо 5–летнему приему алендроната с переводом на плацебо, показавшее снижение общего риска периферических переломов на фоне непрерывного 10–летнего лечения (частота составила 5,3% для плацебо и 2,4% для алендроната).
К настоящему времени доказано, что алендронат снижает риск не только переломов позвонков, но также других типов остеопоротических переломов, включая переломы предплечья и проксимального отдела бедра. По данным мета–анализов результатов рандомизированных контролируемых испытаний, алендронат снижает относительный риск новых переломов позвонков на 48%, внепозвоночных переломов – на 49%, перелома шейки бедра – на 55%. Кроме того, алендронат эффективен при первичной профилактике переломов позвонков. Исследование FIT продемонстрировало также уменьшение боли и повышение мобильности больных постменопаузальным ОП, принимающих алендронат. Сходные результаты были обнаружены у мужчин и пациентов со стероидным ОП.
Особенности метаболизма бисфосфонатов и их прочное длительное соединение с костной тканью позволили предположить, а затем и доказать эффективность более редкого приема. Так, алендронат, принимаемый в дозе 70 мг 1 раз/нед., так же эффективен, как принимаемый ежедневно в дозе 10 мг/сут., но при этом сопровождается лучшей приверженностью пациента проводимому лечению.
В целом бисфосфонаты хорошо переносятся и побочные эффекты встречаются редко. Тем не менее пациенты должны быть проинформированы о возможных осложнениях лечения. Началу лечения должно предшествовать обследование пациента, направленное на поиск возможных противопоказаний: состояние полости рта, функциональные пробы почек и печени, общий клинический анализ крови, уровень кальция, магния, фосфора и щелочной фосфатазы в сыворотке крови.
При приеме бисфосфонатов возможна транзиторная гипокальциемя, обычно протекающая бессимптомно. Клинически значимая гипокальциемия регистрировалась при слишком быстрой внутривенной инфузии бисфосфоната и при одновременном лечении аминогликозидами. Индуцированная бисфосфонатами гипокальциемия также наблюдается при дефиците витамина D, поэтому для ее предупреждения лечение этими препаратами всегда сопровождается назначением холекальциферола или альфакальцидола.
При пероральном приеме бисфосфонатов отмечены случаи раздражения пищевода, обычно связанные с нарушениями инструкции по приему препарата (принимать таблетку утром с полным стаканом воды, после чего 30 мин. не принимать пищу и не ложиться). Крупное рандомизированное контролируемое испытание с участием более 20 000 пациентов продемонстрировало отсутствие разницы в частоте любых побочных эффектов, включая гастроинтестинальные, между ежедневным, еженедельным приемом алендроната и плацебо.
После внутривенной инфузии бисфосфоната у 20–40% больных регистрируется лихорадка и другие проявления гриппоподобного синдрома (головная боль, миалгии и т.д.). Обычно эта реакция начинается 10 ч спустя после инфузии и продолжается 1–2 дня. Возможно назначение симптоматической терапии, которая, однако, в большинстве случаев не требуется. В целом острофазовая реакция наблюдается практически только на первую инфузию и крайне редко наблюдается при повторных вливаниях.
У больных с инфекцией полости рта, а также у пациентов после иплантации, экстракции зуба или другого вмешательства в полости рта возможно развитие остеонекроза челюсти на лечении бисфосфонатами, наблюдающееся крайне редко. В подавляющем большинстве описанные в литературе случаи касались пациентов с онкологическими заболеваниями, получавших длительно большие дозы внутривенных бисфосфонатов по поводу костных метастазов.
Оптимальной продолжительностью лечения бисфосфонатами считается 3–5 лет. Выделяются 3 фазы лечения: до 12 мес. – фаза репарации, от 6 до 36 мес. – фаза восстановления, 24–60 мес. – фаза поддержки костной ткани [2]. Лечение бисфосфонатами должно проводиться в непрерывном режиме на протяжении ряда лет, и это необходимо объяснять каждому пациенту, который начинает лечение. Наибольшая скорость повышения МПК наблюдается в течение первых 12 мес. лечения, когда лакуны резорбции начинают репарироваться и заполняются костной тканью. Во время последующих фаз повышение МПК не столь заметно, поскольку в этот период восстанавливаются структура трабекулярной ткани и ширина трабекул. Общепринято, что выраженное снижение риска перелома в течение первого года терапии бисфосфонатами обусловлено восстановлением трабекулярной сети и повышением МПК.
К настоящему времени опубликованы результаты длительных (7–10–летних) исследований по применению алендроната при постменопаузальном ОП, показавшие постоянное увеличение МПК примерно на 0,7% в год. Таким образом, за 10–летний период плотности кости в области позвоночника увеличивается на 13,7%, в области шейки бедра – на 6,7%. Это свидетельствует о том, что позитивный баланс при костном ремоделировании сохраняется на всем протяжении длительного лечения. При этом показано отсутствие значимых нарушений минерализации скелета. Биопсии костной ткани, проведенные через 7 лет после начала терапии, показали, что строение трабекул не нарушается, микропереломы не обнаруживаются, а количество нормальных кристаллов гидроксиапатита увеличивается, свидетельствуя о том, что кость становится более устойчивой к компрессии.
Показателем эффективности применения бисфосфонатов является снижение концентрации маркеров костной резорбции в сыворотке крови пациента, наблюдаемое уже через 3–6 нед. лечения. Если к концу 2–3–го мес. терапии не произошло снижения маркеров на 30–40%, следует задуматься, принимает ли пациент препарат и правильно ли он это делает. Денситометрия при приеме бисфосфонатов проводится раз в год. Интересно, что в крупных многоцентровых исследованиях бисфосфонатов было показано снижение риска переломов даже в отсутствие повышения МПК.
В последние годы на рынке появились дженерики бисфосфонатов, в частности алендроната. Для широкого внедрения в клиническую практику важно знать, были ли проведены исследования на биоэквивалентность дженерического препарата и оригинального средства.
В 2003 г. было проведено исследование биоэквивалентности Теваната оригинальному препарату, целью которого является сравнение фармакокинетических параметров Теваната и оригинального препарата (Фосамакс). На 120 здоровых добровольцах было проведено тройное перекрестное рандомизированное исследование кинетики накопления препаратов в моче, которая изучалась в течение 36 ч после однократного приема внутрь 70 мг, отмывочный период между приемами препаратов составлял 7 дней. Результаты исследования показали отсутствие достоверных различий по фармакокинетическим параметрам: максимальной концентрации в моче Rmax, времени достижения максимальной концентрации в моче Тmax, общему количеству экскретируемого неизмененного препарата в моче в течение 36 часов Тае(0–36). Другими словами, Теванат 70 мг полностью биоэквивалентен оригинальному препарату [4]. Следовательно, появление дженерического препарата алендроновой кислоты компании Teva позволяет применять Теванат для увеличения минеральной плотности кости и снижения риска переломов (в качестве первичной и вторичной профилактики), лечения ОП у мужчин, стероидного ОП. Необходимо помнить о достаточном поступлении кальция и витамина холекальциферола в комбинации с пероральными препаратами для лечения ОП.
Таким образом, хорошо изученный механизм действия бисфосфонатов наряду с опытом длительного лечения тысяч пациентов с ОП в контролируемых испытаниях свидетельствуют об их положительном влиянии на здоровье костной ткани. Они снижают скорость обмена костной ткани и повышают МПК. Эти изменения ассоциируются с достоверным статистически значимым снижением риска переломов позвонков и переломов периферического скелета. Данные клинических испытаний продолжительностью до 10 лет продемонстрировали сохраняющуюся эффективность и хорошую переносимость алендроната. Более редкий режим приема обеспечивает больных более удобной формой приема при сохраненной эффективности.
Азотсодержащие бисфосфонаты включены во все зарубежные клинические рекомендации по ОП, а также наряду со стронция ранелатом названы препаратами первой линии в лечении постменопаузального ОП в «Российских клинических рекомендациях по диагностике и лечению ОП» [5]. Алендронат также эффективен при ОП у мужчин, стероидном ОП и в качестве средства первичной профилактики ОП.