Кофакторы кальциевого обмена что это такое
Кальций и его синергисты в поддержке структуры соединительной и костной ткани
Рассмотрены результаты экспериментальных и клинических исследований, указывающие на важность компенсации дефицитов микроэлементов в профилактике и терапии остеопороза, остеопении и рахита.
Results of experimental and clinical tests are reviewed that point out importance of compensation of microelements’ deficit in prophylaxis and therapy of osteoporosis, osteopenia and rachitis.
Питание является важным модифицируемым фактором, определяющим развитие и поддержание костной массы. Диета, сбалансированная по калорийности, белку (1 г/кг/сут), жирам и углеводам (не более 60% от общей калорийности пищи) способствует нормальному метаболизму кальция (Ca) в костной ткани. В настоящее время кальций в сочетании с витамином D является основой нутрициальной коррекции для профилактики и лечения остеопороза, остеопении и рахита [1]. Тем не менее, сочетанный прием кальция и витамина D не всегда успешно профилактирует остеопороз, так как не компенсирует всех нутрициальных потребностей костной ткани.
Важность таких факторов питания, как кальций, фосфор (P) и витамин D, для целостности костей неоспорима. Рецептор витамина D, подобно эстрогеновым рецепторам, является фактором транскрипции, который, в частности, регулирует экспрессию белков, вовлеченных в гомеостаз кальция и фосфора. Экспериментальные данные показывают, что физиологические эффекты витамина D включают торможение секреции провоспалительных цитокинов, молекул адгезии и пролиферацию сосудистых гладкомышечных клеток — процессов, которые имеют важное значение для кальцификации артерий [2].
В то же время проводимые в течение последнего десятилетия исследования показали, что для поддержания структуры костной ткани также необходимы витамины A, C, E, K и микроэлементы медь (Cu), марганец (Mn), цинк, стронций, магний (Mg), железо и бор. Дефицит этих микронутриентов замедляет набор костной массы в детстве и в подростковом возрасте и способствует ускоренной потере костной массы в пожилом возрасте [3, 4]. В настоящей работе рассмотрены результаты экспериментальных и клинических исследований, указывающие на важность компенсации дефицитов этих микроэлементов в профилактике и терапии остеопороза, остеопении и рахита. Особое внимание уделяется бору — микроэлементу, оказывающему значительное влияние на структуру костной ткани и, тем не менее, пренебрегаемому в подавляющем большинстве витаминно-минеральных комплексов.
Магний и поддержка соединительной и костной ткани
Одной из принципиально важных нутрициальных потребностей кости является обеспеченность костей магнием — элементом, регулирующим минерализацию, равномерный рост, гибкость и прочность костной ткани и увеличивающим репаративный потенциал костей. И наоборот, дефицит магния в организме препятствует успешной терапии и профилактике нарушений структуры кости (остеопороз и др.). Среди различных тканей организма основным депо магния являются именно костная ткань. Помимо того, что кость является депо магния, магний также оказывает существенное влияние на минерализацию и структуру костной ткани — низкие уровни магния связаны с низкой костной массой и остеопорозом [5].
Магний является одним из принципиально важных нутриентных факторов, воздействующих на соединительную ткань. Недостаточная обеспеченность магнием является одной из важнейших причин нарушений структуры (дисплазии) соединительной ткани. Систематический анализ взаимосвязей между обеспеченностью клеток магнием и молекулярной структурой соединительной ткани указал на такие молекулярные механизмы воздействия дефицита магния, как ослабление синтеза белков вследствие дестабилизации тРНК, снижение активности гиалуронансинтетаз, повышение активности металлопротеиназ, повышенные активности гиалуронидаз и лизиноксидазы [6]. Следует напомнить, что костная ткань состоит только на 70% из кальциевых соединений, а на 22% — из коллагена, 8% составляет водная фракция.
Важность роли магния в поддержании структуры кости связана и с тем, что при хроническом дефиците магния нарушается важнейший аспект минерального обмена костной ткани — отношение Mg:Ca. При снижении соотношения Mg:Ca в сторону дефицита магния обменные процессы в кости замедлены, быстрее депонируются токсичные металлы (прежде всего, кадмий и свинец). Вследствие накопления токсичных элементов в суставе из-за нарушения пропорции Mg:Ca функция суставов постепенно ухудшается: уменьшается объем движений, происходит деформация суставов конечностей и позвоночника. Эпидемиологические исследования частоты остеопороза в различных странах показали, что более высокое значение отношения Mg:Ca в питании соответствует более низкой встречаемости остеопороза [7].
В эксперименте диета с очень низким содержанием магния (7% от нормального уровня потребления) приводила к значительной гипомагниемии, гипокальциемии, характерным для остеопороза изменениям костной ткани у цыплят. Дефицит магния приводит к разрежению костной ткани, вплоть до образования полостей; компенсация дефицита магния — к восстановлению структуры костной ткани [8].
Более высокое диетарное потребление магния соответствует повышенной минеральной плотности кости (МПК) у мужчин и женщин. В исследовании когорты из 2038 человек оценка диетарного потребления магния по опроснику коррелировала с МПК после поправок на возраст, калорийность диеты, потребление кальция и витамина D, индекс массы тела, курение, алкоголь, физическую активность, использование тиазидных диуретиков и эстроген-содержащих препаратов (р = 0,05, мужчины; p = 0,005, женщины) [9].
Материнское питание во время беременности значительно влияет на минеральную плотность костной ткани у детей. Наблюдения за 173 парами мать–ребенок в течение 8 лет после родов показали, что МПК шейки бедра у детей повышалась с повышением диетарной обеспеченности беременной магнием. МПК поясничного отдела позвоночника зависела от обеспеченности беременной магнием, калием, фосфором и калием. Дети, матери которых были адекватно обеспечены указанными минеральными веществами во время беременности, характеризовались значимо бо?льшими значениями МПК (шейка бедра +5,5%, поясничного отдела позвоночника +12%, всего тела +7%) [10].
Железо
Помимо того, что железо необходимо для поддержания достаточной обеспеченности тканей кислородом, этот микроэлемент также участвует в метаболизме коллагена — основного структурного белка всех видов соединительной ткани, в т. ч. костной. Хронический дефицит железа в эксперименте приводит к задержке созревания коллагена в бедренной кости и также к нарушениям фосфорно-кальциевого метаболизма [11]. В эксперименте железодефицитная анемия (ЖДА) приводит к нарушению минерализации и увеличению резорбции кости [12].
По данным крупных клинико-эпидемиологических исследований, ЖДА способствует значительному повышению риска остеопороза и переломов. Например, в лонгитудинальном исследовании 5286 человек (2511 мужчин и 2775 женщин, 55–74 лет) наблюдались в течение 8 лет. Низкие уровни гемоглобина были связаны с когнитивными нарушениями и более низкой костной массой. За время наблюдения у 235 мужчин и 641 женщины был установлен хотя бы один перелом (исключая переломы позвоночника). Уменьшение содержания гемоглобина в крови на одно стандартное отклонение соответствовало повышению риска переломов на 30% у мужчин (р зубной эмали > почках = легких = лимфатических узлах > печени > мышцах = семенниках > мозге [28].
С фармакологической точки зрения препараты бора характеризуются гиполипидемическим, противовоспалительным, антионкологическим эффектами. Дефицит бора стимулирует развитие таких состояний, как анемия, остео-, ревматоидный артрит, когнитивная дисфункция, остеопороз, мочекаменная болезнь и нарушение обмена половых гормонов.
Результаты экспериментальных и клинических исследований, проводимых с начала 1960-х гг., показали, что препараты бора являются безопасным и эффективным средством для лечения некоторых форм артрита. Дальнейшие исследования подтвердили важность обеспеченности бором для поддержания структуры кости. Так, костная ткань пациентов с более высоким потреблением бора характеризовалась более высокой механической прочностью. В тех географических регионах, где потребление бора составляет менее 1 мг/сут, заболеваемость артритом колеблется от 20% до 70%, в то время как в регионах с потреблением 3–10 мг/сут — не более 10%. Эксперименты с моделями артрита показали эффективность перорального или внутрибрюшинного введения препаратов бора [29].
О молекулярно-физиологических механизмах воздействия бора
Бор влияет на активность ряда ферментных каскадов, включая метаболизм стероидных гормонов и гомеостаз кальция, магния и витамина D, также способствуя снижению воспаления, улучшению профиля липидов плазмы и функционирования нейронов [30] (дефицит бора снижает электрическую активность мозга, результаты тестов на двигательную ловкость, внимание и кратковременную память [31]). Бораты могут образовывать сложные эфиры с гидроксильными группами различных соединений, что может являться одним из возможных механизмов осуществления их биологической активности [32]. Повышенное содержание бора в пище повышает экспрессию борат-транспортера (NaBCl) в тощей кишке и понижает — в ткани почек [33].
Хотя детали молекулярных механизмов воздействия бора на физиологические процессы остаются неизвестными, бор оказывает существенное воздействие на процессы роста клеток костной ткани и хряща. Так, бор повышает одонтогенную и остеогенную дифференцировку клеток ростка стволовых клеток зубов. Прием пентабората натрия оказывал дозозависимый эффект на активность щелочной фосфатазы и экспрессию генов, связанных с одонтогенезом [34]. Поэтому дефицит бора во время беременности, наряду с дефицитами кальция и других микронутриентов, также будет способствовать нарушениям развития зубов и у беременной, и у ребенка.
Бор дозозависимо влияет на процессы дифференцировки стромальных клеток костного мозга. Концентрации бора в 1, 10 и 100 нг/мл повышали, а уровни более 1000 нг/мл ингибировали дифференцировку клеток (р
* РСЦ Международного института микроэлементов ЮНЕСКО, Москва
** ГБОУ ВПО ИвГМА МЗ РФ, Иваново
Кальций в организме: нормы, дефициты и избыток
В онлайн-лаборатории Lab4U мы хотим, чтобы каждый из вас мог управлять своим здоровьем. Для этого мы просто и понятно рассказываем вам про процессы в организме!
Зачем нужен кальций?
В организме кальций содержится не только в костях и зубах (около 1 кг), но и в крови (примерно 0,0013 кг). Кальций в костях в основном нужен для того, чтобы ваш скелет был крепким и мог вас поддерживать.
В крови у него больше обязанностей. Он помогает:
Необычное свойство кальция
В Африке кальцием лечат….укусы пауков. Он уменьшает мышечные спазмы.
Что произойдет, если я не получу достаточного количества кальция?
Очень долго вы не будете замечать нехватку кальция в организме. Кальций покидает кости почти незаметно для вас.
Заподозрить у себя дефицит кальция можно, если у вас:
Также на особом контроле необходимо держать уровень кальция, если вы:
Кальций причина такого заболевания.
Оказывается, довольно распространенной причиной мужского бесплодия является нехватка кальция в организме.
Если кальций у вас не усваивается или попадает в организм в недостаточном количестве сейчас, то через 15 лет к вам скорее всего «постучится» остеопороз вместе с переломами костей.
Остеопороз
Почему это заболевание опасно?
Его редко диагностируют в начальной стадии, и еще реже лечат, из-за отсутствия симптомов. Многие считают, раз не болит, то и заболевания нет.
Согласно российским рекомендациям, оценка риска остеопороза и переломов должна проводиться у всех женщин и мужчин старше 50 лет. Однако, если есть риск развития остеопороза, врачи советуют проверяться и всем, кто моложе этого возраста, не реже раза в год.
Вас можно отнести в группу риска развития остеопороза, если:Вас можно отнести в группу риска развития остеопороза, если:
Если хотя бы один из пунктов про вас, советуем вам пройти обследование и сдать анализ, который оценит ваш минеральный обмен. Он позволит оценить процессы всасывания, переноса и выброса кальция, фосфора, магния в костях и крови. Не забудьте добавить к нему анализ на витамин Д. Сдайте анализы и отнесите врачу (терапевту или остеопату). В зависимости от результатов, он назначит вам правильное лечение или подкорректирует его.
Чем опасен избыток кальция?
Бытует мнение, что много кальция – это хорошо, а мало – плохо. Это не правда. Иногда длительное повышение уровня кальция никак не ощущается, но значительно повышает риск:
Иногда человек ощущает симптомы, но они настолько неспецифические, что по ним заподозрить диагноз весьма сложно. Симптомы могут быть такими:
Добавки кальция
К сожалению, распространенная «традиция» принимать добавки с кальцием «для профилактики» часто может наносить вред здоровью людей, так как принимающие такие добавки получают слишком большие дозы кальция. К добавкам с кальцием нужно относиться как к настоящим лекарствам. Нельзя принимать без назначения врача, не обращая внимание на дозировку и не зная, в каком количестве кальция нуждаетесь именно вы.
Сколько кальция мне нужно?
Мы не способны вырабатывать кальций как, например, витамин Д (может вырабатываться кожей). Поэтому его уровень полностью зависит от поступления с едой и всасывания его в кишечнике.
Когда еда попадает в организм, то в кишечнике кальций из нее попадает в кровь. Там кальций находиться в трех формах, одна из которых ионизированная. Именно с ней связывают большинство влияний кальция на организм. Кальций, который не попал в кровь, выводиться из организма с мочой, калом и потом.
Норма кальция в крови и моче не зависит от пола, только от возраста.
С рождения до 25 лет человек накапливает кальций, сохраняя его в костях. Проще говоря, наши кости выступают в качестве своеобразного банка для хранения кальция. Даже если вы здоровы, после 35 лет организм начинает «перекачивает» кальций из костей в кровь и к 70 годам теряет около 30% его запасов.
Так сколько нужно употреблять кальция, чтобы поддерживать его уровень в норме? Согласно клиническим рекомендациям Российской ассоциации по остеопорозу, в сутки взрослым необходимо потреблять 1000 мг. Для других лиц суточная норма варьируется от 800 до 1500.
Дневная норма потребления
| Мужчины | 1000 мг |
| Мужчины старше 60 лет | 1200 мг |
| Женщины | 1000 мг |
| Женщины старше 60 лет | 1200 мг |
| Беременные (2-я половина) | 1500 мг |
| Кормящие (1-6 мес.) | 1600 мг |
| Кормящие (7-12 мес.) | 1600 мг |
| Младенцы (0-3 мес.) | 400 мг |
| Младенцы (4-6 мес.) | 500 мг |
| Младенцы (7-12 мес.) | 600 мг |
| Дети (1-3 года) | 800 мг |
| Дети (4-7 лет) | 900 мг |
| Дети (8-11 лет) | 1100 мг |
| Мальчики (11-14 лет) | 1200 мг |
| Девочки (11-14 лет) | 1200 мг |
| Юноши (15-18 лет) | 1200 мг |
| Девушки (15-18 лет) | 1200 мг |
Кому нужно больше кальция, чем 1000 мг:
Если вы ведет здоровый образ жизни, пьете 1, 5 литра воды в день, раз в день едите молочные продукты (лучше творог и молоко), вы получаете дневную норму кальция с едой. Но это не значит, что весь он усвоиться.
На процесс усваивания кальция из пищи влияют:
Именно поэтому анализ на общий кальций не может показать реальную картину того, что происходит с вашими костями. Эксперты лаборатории Lab4U советуют сдать комплекс “Минеральный обмен” вместе с анализом на витамин Д. Эти анализы покажут, хватает вам кальция или нет.
Выводы
Нельзя принимать кальций просто так, без определения его в крови и назначения врача.
Сделать это очень просто: сдайте комплекс “Минеральный обмен” вместе с анализом на витамин Д. Отнесите результаты терапевту или остеопату. Он их оценит и, возможно назначит лечение.
Почему быстрее, удобнее и выгоднее сдавать анализы в Lab4U?
Вам не нужно долго ждать в регистратуре
Все оформление и оплата заказа происходит онлайн за 2 минуты.
Путь до медцентра не займет более 20 минут
Наша сеть вторая по величине в Москве, а еще мы есть в 23 городах России.
Сумма чека не шокирует вас
Постоянная скидка в 50% действует на большинство наших анализов.
Вам не придется приходить минута-в-минуту или ждать в очереди
Сдача анализа происходит по записи в удобный промежуток времени, например с 19 до 20.
Вам не придется долго ждать результатов или ходить за ними в лабораторию
Мы пришлем их на эл. почту в момент готовности.
Краткий обзор некоторых кофакторов, участвующих в синтезе коллагена
Качественные коллагеновые волокна — одна из
основных составляющих здоровой кожи. Поэтому
большое количество косметологических методов
направлено на восстановление ее коллагенового каркаса.
Как витамины и микроэлементы могут влиять на синтез
коллагена? И почему для достижения стойкого эффекта
необходимо учитывать их количественный состав
в организме?
Ежегодно создаются новые методики и препараты для улучшения синтеза коллагена с целью профилактики инволюционных процессов в организме и уменьшения выраженности возрастных изменений.
Но за стремлением повлиять на коллагеногенез извне порой забывают о тех веществах, без достаточного количества которых в самом
организме синтез коллагена крайне затруднен. Никто не будет отрицать, что продукция этого жизненно важного белка зависит от гормонов, гормоны, в свою очередь, от присутствия металлов, усвоение металлов — от витаминов; и эту цепочку можно продолжать долго, тем более что она замкнутая. Осветить все нюансы в одной статье не представляется возможным, но сделать шаг навстречу пониманию некоторых процессов — в наших силах.
Синтез и процессинг (созревание) коллагена включает в себя несколько этапов:
Всем известно об участии магния и кальция в синтезе соединительной ткани и коллагена, но о железе, цинке, меди, витаминах С и D часто забывают. Именно эти кофакторы рассмотрим в статье.
Железо
Железодефицитная анемия в той или иной степени присутствует у 40–60 % женщин детородного возраста по всему миру [2, 26]. И это при том, что железо — один из важнейших микроэлементов, необходимых для нормального функционирования биологических систем организма. Оно требуется для осуществления функции дыхания, кроветворения, участвует в иммунобиологических и окислительно-восстановительных реакциях.
Причины дефицита железа:
Учитывая высокую распространенность дефицита железа в популяции, сложно говорить о нормальном синтезе коллагена при таких состояниях.
Цинк — единственный металл, представленный в небелковой части ферментов каждого класса, и никаким другим металлом цинк не может быть заменен. Несмотря на малую концентрацию цинка в крови, стабильные связи с макромолекулами делают его доступным для всех тканей организма, что в дальнейшем позволяет удовлетворять потребности в нем белков и ферментов, выполняющих различные биологические функции [28].
Распространенность дефицита цинка в мире не менее значительная, чем железа и витамина С, и составляет до 60% [29].
Для транспорта эритроцитами кислорода и углекислого газа абсолютно необходим цинк, и большая часть цинка крови содержится именно в эритроцитах в составе цинковых металлоферментов — карбоангидраз. Карбоангидразы катализируют превращения углекислого газа в угольную кислоту (угольная кислота участвует в поддержании pH крови в физиологическом диапазоне (7,25–7,35). В капиллярах легких эти процессы идут в обратном направлении: угольная кислота распадается на углекислый газ и воду, и углекислый газ удаляется наружу [18].
Без нормального дыхания ни одна клетка не способна осуществлять свои функции.
В мире распространенность дефицита меди в организме, приводящего, наряду с железом, к анемии, составляет до 30%. А ведь этот микроэлемент крайне необходим для нормальной физиологии организма.
Если говорить о коже, то медь играет ключевую роль в ангиогенезе, синтезе и стабилизации белков внеклеточного матрикса [3].
В физиологически значимых концентрациях (2 мг — средняя суточная потребность) медь ускоряет заживление ран [16].
Ионы меди, которые являются кофакторами лизилоксидазы, принимают участие в последнем этапе синтеза коллагена. Медь имеет важное значение для формирования внутри- и межмолекулярных поперечных связей в коллагене, а соответственно, и прочности коллагеновых и эластиновых фибрилл [8, 13,
15]. Недостаток меди ухудшает формирование сшивок коллагена и приводит к тяжелой патологии костей, легких и сердечно-сосудистой системы [12].
Компенсация дефицита этого микроэлемента, бесспорно, улучшает синтез коллагена, в том числе в коже (рис. 4) [7, 10].
Аскорбиновая кислота (витамин С)
Аскорбиновая кислота играет в организме фундаментальную роль — нет фактически ни одного физиологического процесса, в котором бы она не принимала участия.
Роль витамина С в организме
Аскорбиновая кислота в организме человека оказывает влияние на множество важнейших биологических процессов:
Распространенность дефицита витамина С в мире по разным данным составляет 20–40% [14, 15].
В последнее время много исследований посвящено аскорбиновой кислоте и ее биодоступности для кожи [9]. При недостатке витамина С в организме его нанесение на кожу не будет иметь ожидаемого эффекта, так как не сможет восполнить нутритивный дефицит. В ходе проведенных исследований выяснилось, что витамин С ускоряет заживление ран, участвует в активизации синтеза коллагена I типа (рис. 5) и снижении параметров
окислительного стресса. Никаких значимых побочных эффектов при добавлении витамина С в питание в ходе проведенных исследований выявлено не было [5, 6].
Синтез коллагена зависит от гормонов, гормоны, в свою очередь, от присутствия металлов, усвоение металлов — от витаминов, и эту цепочку можно продолжать долго, тем более что она замкнутая.
Витамин D
Распространенность дефицита витамина D в российской популяции составляет более 90% (в мире 50–60%) [19]. Этот витамин стимулирует увеличение синтеза секретируемых белков TGF-β (регулируют деление
и дифференцировку различных типов клеток, включая фибробласты и кератиноциты) и их связывание с рецепторами на мембране клеток. Поэтому при его дефиците происходит нарушение активности сигнальных каскадов TGF-β, что ухудшает заживление кожи после любой травмы (включая косметологические манипуляции). Например, во время термолифтинга часть коллагеновых волокон дермы сжимается и уменьшается в объеме. Это приводит к повышению зернистости базального слоя и при достаточном количестве витамина D создает благоприятные условия для воздействия его активных форм на экспрессию TGF-β1, который и способствует обновлению соединительной ткани [11].
Выводы
Мы кратко обсудили лишь некоторые кофакторы, участвующие в синтезе коллагена. Но даже этот незначительный пласт информации позволяет судить о зависимости синтеза коллагена от нутритивного статуса организма, чем не следует пренебрегать, решая многие эстетические задачи. Изменение синтеза
коллагена происходит постепенно и усугубляется нутритивным дефицитом [19].
Кофакторы кальциевого обмена что это такое
Н.Ю. Карпова (1), М.А.Рашид (2), Т.В. Казакова (1), М.Е. Ядров (2)
(1) Кафедра факультетской терапии им. А.И. Нестерова ГБОУ ВПО РНИМУ им. Н.И. Пирогова Минздрава России, Москва; (2) ГБУЗ «Онкологический клинический диспансер № 1» ДЗ г. Москвы (филиал № 1)
Введение
В повседневной клинической практике врач сталкивается с необходимостью оценивать кальциево-костный гомеостаз в двух случаях: при наличии изменений концентрации минералов в биологических жидкостях организма и при получении патологических результатов денситометрии [1]. Однако нарушения минерального и костного обменов могут быть следствием различных заболеваний и патологических состояний: первичного поражения органов или систем человеческого организма (первичный гиперпаратиреоз), реакции на изменение минерального состава крови (вторичный гиперпаратиреоз), выраженных колебаний содержания минералов в сыворотке крови или моче (онкологические заболевания в целом и костные метастазы в частности), осложнения необратимого заболевания (хроническая почечная недостаточность) [2]. Для адекватной оценки состояния пациента, назначения дополнительных обследований и определения характера терапии требуется знание физиологических особенностей указанных процессов в норме и при патологии.
Механизмы регулирования костного и кальциевого обменов
Костный скелет является основным физиологическим депо для кальция и в меньшей степени – для магния и фосфора. Содержание кальция в скелете контролируется сложными взаимосвязанными механизмами, включающими участие органов желудочно-кишечного тракта (ЖКТ) и почек, действие которых на уровне костной ткани (КТ) опосредуется остеобластами и остеокластами. Источником кальция для скелета является пища. Неабсорбированный кальций выводится в основном с калом и в небольшом количестве активно секретируется в просвет ЖКТ. Незначительные потери кальция наблюдаются при потении и усиленном шелушении кожи. Значительные потери кальция наблюдаются во время беременности (через плаценту к плоду) и во время лактации (через грудное молоко). Абсорбированный из пищи кальций попадает в межклеточное пространство и встраивается в скелет благодаря процессу минерализации органического костного матрикса – остеоида. Оставшаяся часть кальция фильтруется почками в объеме около 6 г/сут, из которых 98% реабсорбируется в ток крови [3, 4].
В регуляции костного и минерального обменов принимают участие: 4 гормона (кальцемические) – паратиреоидный гормон (ПТГ), кальцитонин, фактор роста фибробластов-23 (ФРФ-23) и активные формы витамина D; 3 органа-мишени – кости, почки и ЖКТ; 3 костных минерала – кальций, магний, фосфор [4]. Понимание причин и следствий нарушений работы вышеуказанных элементов является ключевым для адекватного лечения минерального и костного дисбаланса.
В целом кальциемические гормоны определяют содержание минералов в биологических жидкостях организма (моча и кровь) и их действие на уровне органов-мишеней изучено довольно подробно. Однако на клеточном и внутриклеточном уровнях обмен кальция остается малоизученным. Кальций (как фосфор и магний) попадает в центральный кровоток из КТ, почек, ЖКТ, и наоборот. Эти транспортные пути могут проходить через клетки (трансклеточно) или в обход клеток (параклеточно, периклеточно) [5–7]. Параклеточный транспорт, как правило, происходит пассивно – путем диффузии по направлению минерального градиента (downhill diffusion), и не подвержен гормональной регуляции. Диффузия также может происходить через специальные клеточные каналы, которые в определенное время открываются или закрываются [8, 9].
Трансклеточный транспорт осуществляется против минерального градиента (uphill diffusion) и является активным. Для данного процесса требуется дополнительная энергия, получаемая при гидролизе АТФ и создающая электромеханический градиент на поверхности специализированных мембранных структур, именуемых портами, обменниками или помпами. Существует три подтипа портов: «унипорты» (транспортируют одно вещество), «симпорты» (транспортируют два вещества в одном направлении) и «антипорты» (транспортируют более одного вещества в двух направлениях). В указанном процессе также принимают участие высокоспециализированные кальций-связывающие белки. Наряду с описанными механизмами существуют котранспорт и обменный транспорт с вовлечением других ионов, включая калий, натрий, хлориды, водород и бикарбонаты, что иногда также требует дополнительной энергии. Сходные процессы наблюдаются внутри клеток, где происходит перераспределение кальция между митохондриями и цитозолем [8, 9]. Предполагается, что изменения содержания минералов во внеклеточной среде во многом нивелируются их внутриклеточным перераспределением.
Обратный процесс заключается в переходе кальция (и других минералов) из клеток во внеклеточный «отсек». Таковым для эритроцитов является окружающая плазма крови, а для клеток почечного эпителия – моча. Для костных клеток внеклеточным отсеком служат костный мозг и капиллярная кровь. Трансклеточный транспорт кальция зависит от работы ряда белков, включая кальмодулин, кальбиндин, интегральный мембранный белок, а также от активности щелочной фосфатазы. Экспрессия последних трех веществ опосредуется метаболитами витамина D. По-видимому, выход кальция из клеток осуществляется теми же структурами, что и его вход. В отличие от кальция для фосфора специализированных связывающих белков не описано [6, 7].
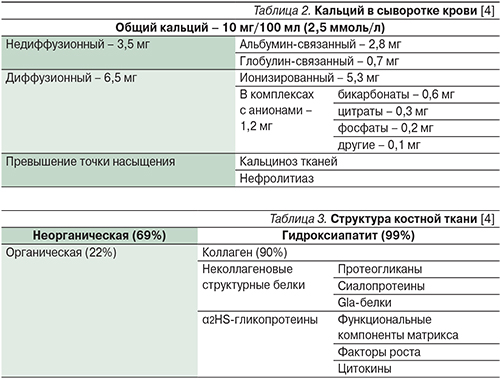
Предполагается, что на молекулярном уровне кальциемические гормоны осуществляют свое действие через описанные мембранные структуры и связывающие белки. Например, витамин D усиливает всасывание кальция через потенцирование синтеза кальбиндина в энтероцитах. В почечных канальцах ПТГ и ФРФ-23 регулируют транспорт кальция и фосфатов, а витамин D поддерживает их концентрацию в крови, регулируя всасывание в кишечнике и (возможно) выделение с мочой [10–12]. Распределение кальция в организме человека представлено в табл. 1.
Метаболизм кальция
Содержание кальция в сыворотке крови и во внеклеточной жидкости у млекопитающих жестко регулируется в узком диапазоне, обеспечивая оптимальную жизнедеятельность клеток. Физиологическую роль в организме человека играет исключительно ионизированный кальций. Его концентрация находится в крови на пределе «насыщения» и тесно взаимосвязана с концентрацией фосфатов. Внутриклеточный кальций, являющийся вторичным «мессенджером» для большинства физиологических процессов, также подвержен жесткой регуляции. Однако его концентрация на порядок ниже внеклеточной [1–3].
Биологическими функциями, в которых активно участвует кальций, являются [4]:
Основное депо кальция находится в КТ, а его внекостная часть составляет около 10%. В среднем с пищей должно поступать около 1 г кальция в сутки, из которых 500 мг всасываются, а оставшаяся часть выводится с калом. Ежесуточно приблизительно 10 г кальция фильтруется почечными клубочками, и подавляющая его часть реабсорбируется канальцами, лишь 200–300 мг выводятся с мочой. Костный скелет потребляет около 250 мг кальция в сутки. Для данного процесса типична высокая вариабельность.
Костный метаболизм кальция зависит от доли «лабильного» (обменного) кальция, находящегося у поверхности костных клеток. Однако точной анатомической локализации «отсеков» лабильного и нелабильного кальция в настоящее время не существует. Участниками костного метаболизма являются остеобласты и остеокласты. В случае патологии костный обмен может быть ускоренным (гиперпаратиреоз) или замедленным (гипопаратиреоз) с соответствующими изменениями концентраций кальция в сыворотке крови и моче. Регуляторами костного обмена выступают витамин D и ПТГ, точками приложения действия которых являются КТ, почки и ЖКТ, обеспечивая изменения содержания кальция в сыворотке крови. Кальцитонин предположительно угнетает костную резорбцию и в меньшей степени участвует в обмене кальция как такового [5].
Около 50% кальция сыворотки крови находится в ионизированном состоянии, остальная часть – в связанном с белками плазмы виде или в комплексах с различными анионами (табл. 2).
Концентрация ионизированного кальция у здорового человека составляет 1,25±0,07 ммоль/л. Регулирование содержания кальция крови осуществляют кальциемические гормоны и, вероятно, половые стероиды [1–3].
Костный обмен
Кость состоит из минерального и органического компонентов (табл. 3). Минеральная часть в основном представлена гидроксиапатитом, а органическая – коллагеном 1-го типа, входящего в структуру костного матрикса. Органическая часть является продуктом жизнедеятельности остеобластов. Минералы находятся в кости в двух формах: кристаллы гидроксиапатита типичны для зрелой ткани, аморфные массы фосфата кальция – для созревающей. Равновесие двух компонентов обеспечивает кости ее целостность и функциональную состоятельность. Витамин D является ключевым гормоном для начала минерализации, но в дальнейшем его роль уменьшается за счет включения локальных механизмов (концентрация минералов, наличие нуклеаторов, отсутствие ингибиторов минерализации) [1, 13].
По структуре КТ подразделяется на кортикальную и трабекулярную. Кортикальная кость составляет 80% скелета человека, трабекулярная – оставшиеся 20%. При этом за счет особенностей строения площадь поверхности трабекулярной кости в 4–5 раз больше кортикальной. Соответственно, метаболическая активность трабекулярной КТ выше. Процент ежегодного ремоделирования трабекулярной КТ составляет 20–30%, кортикальной – не более 10%. У взрослого человека КТ претерпевает полное ремоделирование каждые 3 года. До 20–25 лет происходит быстрое накопление костной массы до пикового значения, в последующем наблюдается фаза плато, а с 40 лет начинается ее возрастная потеря [4]. В целом женщины обладают меньшей костной массой за счет ее меньшего (на 30%) пикового значения и ускоренной потери после менопаузы. В настоящее время активно изучаются генетические и эпигенетические механизмы, ответственные за соотношение процессов остеосинтеза и остеорезорбции [14].
Клеточный пул костного скелета представлен остеобластами, остео-цитами (замурованными в зрелой кости остеобластами), выстилающими клетками и остеокластами. Два основных представителя клеточных линий имеют различное происхождение. Остеокласты происходят из гематопоетических стволовых клеток, способных дифференцироваться в макрофаги, гранулоциты, эритроциты, мегакариоциты, тучные клетки, В- и Т-лимфоциты. Остеобласты имеют в качестве предшественника мезенхимальную стволовую клетку, которая дает начало хондро-, мио-, адипоцитам и фибробластам. В настоящее время возможность фенотипической модуляции отдельных клеточных представителей в пределах одной линии считается доказанной. На этапе формирования зрелой кости остеокласты подвержены слиянию и последующему апоптозу, а остеобласты – трансформации в остеоциты и клетки выстилки. Лишь малая часть остеобластов подвергается апоптозу. Этим объясняется разная скорость остеосинтеза (медленная) и остеорезорбции (быстрая), что клинически определяет диагностическую ценность маркеров костного ремоделирования [3, 4].
Лишь недавно была расшифрована роль остеоцитов в костном метаболизме. Доказано, что после формирования КТ остеоциты остаются в костных лакунах и в последующем образуют микроскопические канальцы, соединяющие их с другими остеоцитами, остеобластами и мелкими сосудами. Тем самым в кости формируется своеобразный «клеточный синцитий», способствующий передвижению минералов в зоны активного синтеза и их взаимодействию с костным матриксом. Другой функцией остеоцитов является передача механических стимулов (аналог нейронов в нервной ткани), в конечном счете определяющая скорость ремоделирования в различных зонах КТ. Также установлено, что остеоциты являются биологически активными клетками. Среди продуктов их синтеза в настоящее время изучается склеростин (фактор, ингибирующий образование кости), который рассматривается в качестве экспериментальной «мишени» антиостеопоротической терапии в будущем [15].
Гиперкальциемия при различных патологических состояниях
В клинической практике снижение уровня кальция в сыворотке крови встречается довольно редко, преимущественно у детей, манифестируя тетанией. У взрослых гипокальциемия, как правило, служит следствием дефицита витамина D и кальция в пищевом рационе, проявлением отдельных заболеваний эндокринной системы (первичный гипопаратиреоз, синдром Кона) или симптомом хронической почечной недостаточности. Лечение этих состояний подробно описано в соответствующих руководствах [1–3].
Гораздо чаще практикующий врач сталкивается с гиперкальциемией, прогноз которой гораздо серьезнее. Гиперкальциемия играет роль в танатогенезе в случае развития кардиальных (злокачественные нарушения ритма) или неврологических (гиперкальциемическая кома) осложнений. Впервые гиперкальциемия была описана при онкологических заболеваниях [16]. Оказалось, что ее могут вызывать как костные метастазы, так и некоторые вещества, продуцируемые опухолевыми клетками. Нередко два указанных процесса сосуществуют, поскольку опухолевые клетки не в состоянии резорбировать кость непосредственно, а активируют соответствующие остекласты путем межклеточного взаимодействия или посредством высвобождения определенных субстанций. Наиболее вероятным кандидатом на роль такого агента в настоящее время считается ПТГ-связанный пептид (ПТГ-СП) [17]. В случае солидных опухолей повышение экспрессии ПТГ-СП наблюдается в 80% случаев. Было установлено, что ПТГ-СП может продуцироваться как нормальными, так и злокачественными клетками.
О его роли в генезе гиперкальциемии косвенно говорит тот факт, что эктопическая продукция нативного ПТГ встречается крайне редко. Исходно гиперэкспрессия ПТГ-СП была отмечена при опухолях из железистого эпителия. Повышение уровня ПТГ-СП наблюдается в половине случаев рака молочной железы или простаты. При наличии сопутствующей гиперкальциемии экспрессия ПТГ-СП возрастает в разы. Доказано, что для опухолей, сопровождающихся на начальном этапе развития повышением образования ПТГ-СП, характерно облигатное костное метастазирование в будущем. В последующем сходные результаты были получены при злокачественных опухолях других локализаций, включая рак легких.
Интересно, что повышение уровня ПТГ-СП может наблюдаться и при неонкологических заболеваниях, сопровождающихся гиперкальциемией. В частности, его продукция макрофагами определяет течение заболевания и выраженность гиперкальциемии при саркоидозе. В последнее время появились данные, связывающие гиперкальциемию с повышением концентрации метаболитов витамина D, что нередко наблюдается при лимфомах и других гемобластозах. За счет усиления остеорезорбции гиперкальциемию могут также вызывать отдельные цитокины (в частности, интерлейкин-1), а также фактор роста опухолей β. В то же время гиперпродукция простагландинов при ряде опухолей в настоящее время не считается причиной гиперкальциемии [18].
Кальций и остеопороз
Роль нарушений кальциевого гомеостаза в развитии остеопороза прослежена в наблюдательных исследованиях [19]. Большинство населения земного шара в настоящее время не потребляет достаточного количества кальция (800–1000 мг/сут) по причине неправильного пищевого рациона, нарушения всасывания кальция в кишечнике или непереносимости молочных продуктов [20]. Сходная ситуация существует с витамином D, являющимся кофактором всасывания кальция в кишечнике. Дополнительными причинами дефицита витамина D являются недостаточная инсоляция и генетические мутации [21]. Большинство постменопаузальных женщин страдают D-дефицитом и имеют низкую минеральную плотность КТ [22–24].
В то же время препараты кальция не способствовали в клинических исследованиях предотвращению развития остеопороза или снижению темпа его прогрессирования. Следует отметить, что в большинстве работ использовался цитрат кальция, потребление которого приводило к резкому повышению уровня кальция в сыворотке крови, и способствовало развитию т.н. синдрома кальциевых добавок, проявляющегося быстрым формированием нефролитов и прогрессированием сердечно-сосудистых заболеваний. При этом положительного влияния на формирование КТ отмечено не было [25, 26]. В связи с этим препараты кальция были исключены из большинства алгоритмов терапии остеопороза ведущих медицинских ассоциаций [20, 27, 28].
В то же время нельзя не отметить некоторые особенности результатов упомянутых работ [28, 29]:
Последующие работы показали, что дефицит пищевого кальция не всегда коррелирует с выраженностью возрастной потери КТ. Частично это объясняется индивидуальной вариабельностью последней. Как правило, снижение уровня кальция в крови в первую очередь компенсируется активацией физиологических механизмов его всасывания из кишечника, увеличением реабсорбции в почках и вымывания из костного скелета. Также имеет место различная этническая предрасположенность к остеопорозу [30].
Тем не менее увеличение потребления пищевых продуктов, богатых кальцием (включая искусственно обогащенные), наряду с достаточным потреблением витамина D и остеогенными физическими нагрузками является ключевым элементом программ по предотвращению остеопороза, а также компонентом схемы его лечения [31, 32].
Заключение
Клиническое значение нарушений костного и кальциевого метаболизма определяется их выраженностью и коморбидным фоном.
В большинстве случаев при наличии гипокальциемии следует предполагать заболевание почек, первичный гипопаратиреоз, мальабсорбцию или дефицит витамина D. При выявлении гиперкальциемии очень высокой становится вероятность обнаружения онкологического заболевания или первичного гиперпаратиреоза. Оценка индивидуального риска возникновения патологических переломов при нарушениях костного и кальциевого метаболизма проводится по общепринятым правилам [33]. Последующее проведение денситометрии для определения минеральной плотности костной ткани позволяет устанавливать правильный диагноз и определять индивидуальную тактику ведения пациента. Перед назначением комбинированных с витамином D препаратов кальция следует оценивать характер привычного питания и определять риск сердечно-сосудистых осложнений. Суточная доза кальция должна находиться в пределах 1000–1500 мг/сут.
Литература
1. Deftos L.J. Clinical Essentials of Calcium and Skeletal Metabolism. Professional Communication Inc. 1st Edition, 1998. Р. 1–208.
2. Gupta A., March L. Treating osteoporosis. Aust. Prescr. 2016;39(2):40–6.
3. Brown E.M. Physiology of Calcium Homeostasis. In: The Parathyroid. 2nd Edition, 2001. Р. 167–82.
4. Shaker J.L., Deftos L. Calcium and Phosphate Homeostasis. Endotext
5. Drezner M.K. Phosphorus Homeostasis and Related Disorders. In: Principles of Bone Biology. 2nd Edition, 2002. Р. 321–38.
6. Yanagawa N., Lee D.B. Renal Handling of Calcium and Phosphorus. In: Disorders of Bone and Mineral Metabolism. 1992. Р. 3–40.
7. Favus M.J. Intestinal Absorption of Calcium, Magnesium, and Phosphorus. In: Disorder of Bone and Mineral Metabolism. 1992. Р. 57–82.
8. Reuss L. Basic Mechanisms of Ion Transport. In: The Kidney. 3rd Edition, 2000. Р. 85–106.
9. Berger U.V., Peng J.B., Hedier M.A. The membrane transporter families in mammals. In: The Kidney. 3rd Edition, 2000. Р. 107–38.
10. Watts N.B. Estrogens, Estrogen agonists/antagonists, and calcitonin. In: Primer on the Metabolic Bone Diseases and Disorders of Mineral Metabolism. 8th Edition, 2013. Р. 408–11.
11. White K.E., Econs M.J. Fibrobalst growth factor-23 (FGF23). In: Primer on the Metabolic Bone Diseases and Disorders of Mineral Metabolism. 8th Edition, 2013. Р. 188–94.
12. Bhattacharyya N., Chong W.H., Gafni R.A., Collins M.T. Fibrobalst growth factor 23: state of the field and future directions. Trends Endocrinol. Metab. 2012;23:610–18.
13. Kruger M.C., Wolber F.M. Osteoporosis: Modern Paradigms for Last Century’s Bones. Nutrients. 2016;8(6):pii: E376.
14. Riancho J.A. Epigenetics of Osteoporosis: Critical Analysis of Epigenetic Epidemiology Studies. Curr. Genomics. 2015;16(6):405–10.
15. McClung MR, Grauer A., Boonen S. Romosozumab in Postmenopausal Women with Low Bone Mineral Density. N. Engl. J. Med 2014;370:412–20.
16. Deftos L.J. Hypercalcemia in malignant and inflammatory diseases. Endocrinol. Metab. Clin. North Am. 2002;31:1–18.
17. Nissenson R.A. Juppner H. Parathyroid Hormone. In: Primer on the Metabolic Bone Diseases and Disorders of Mineral Metabolism. 8th Edition, 2013. P. 208–14.
18. Deftos, L.J. Immunoassays for PTH and PTHrP. In: The Parathyroids. Second Edition, 2001. P. 143–65.
19. Beto J.A. The role of calcium in human aging. Clin. Nutr. Res. 2015;4:1–8.
20. Kim K.M., Choi H.S., Choi M.J., Chung H.Y. Calcium and vitamin D supplementations: 2015 position statement of the Korean Society for Bone and Mineral Research. J. Bone Metab. 2015;22:143–49.
21. Carmeliet G., Dermauw V., Bouillon R. Vitamin D signalling in calcium and bone homeostasis: A delicate balance. Best Pract. Res. Clin. Endocrinol. Metab. 2015;29:621–31.
22. Godala M., Materek-Kusmierkiewicz I., Moczulski D., Gaszynska E., Szatko F., Tokarski S., Kowalski J. Assessment of 25(OH)D vitamin concentration in plasma of residents of Lodz with metabolic syndrome in pre- and postmenopausal period. Prz. Meopauzalny. 2014;13:293–97.
23. Gonzalez G. Vitamin D status among healthy postmenopausal women in South America. Dermatoendocrinol. 2013;5:117–20.
24. Stolarczyk A., Horvath A., Szczechura M., Kaminska M., Dziechciarz P. High prevalence of vitamin D insufficiency in community-dwelling postmenopausal Polish women. Prz. Menopauzalny. 2014;13:289–92.
25. Machado M.C., Bruce-Mensah A., Whitmire M., Rizvi A.A. Hypercalcemia associated with calcium supplement use: Prevalence and characteristics in hospitalised patients. J. Clin. Med. 2015;4:414–24.
26. Manson J.E., Bassuk S.S. Calcium supplements: Do they help or harm? Menopause. 2014;2:106–8.
27. Golden N.H., Abrams S.A. Committee on Nutrition. Optimising bone health in children and adolescents. Pediatrics. 2014;134:e1229–43.
28. Reid I.R., Bistow S.M., Bolland M.J. Calcium supplements: Benefits and risks. J. Intern. Med. 2015;278:354–68.
29. Cesareo R., Iozzino M., D’onofrio L., Terrinoni I., Maddaloni E., Casini A., Campagna G., Santonati A., Palermo A. Effectiveness and safety of calcium and vitamin D treatment for postmenopausal osteoporosis. Minerva Endocrinol. 2015;40:231–37.