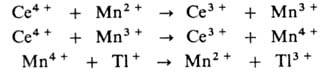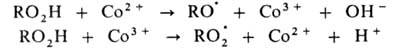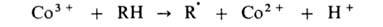гомогенный катализ что такое
ГОМОГЕННЫЙ КАТАЛИЗ
ускорение хим. р-ции в присутствии катализатора, к-рый находится в одной фазе с исходными реагентами (субстратами) в газовой фазе или р-ре. При Г. к., как и при гетерогенном катализе, катализатор в р-ции не расходуется, однако является ее необходимым участником; без катализатора р-ция протекает гораздо медленнее или не идет вовсе.
затруднено из-за высокого окислит.-восстановит. потенциала пары Т1 2+ /Т1 + (для пары Т1 3+ /Т1 2+ этот потенциал значительно ниже). В присут. ионов Мп р-ция протекает по многостадийному механизму:
В радикально-цепных процессах в присут. нек-рых в-в может ускоряться образование радикалов в р-циях зарождения или разветвления цепи. Так, при окислении орг. в-ва RH в присут. ионов Со в небольшой концентрации ускоряется разветвление цепи, а при высокой концентрации этих же ионов-также и развитие цепи. Каталитич. механизм распада гидропероксида включает следующие стадии:
Развитие цепи каталитически ускоряется по схеме:
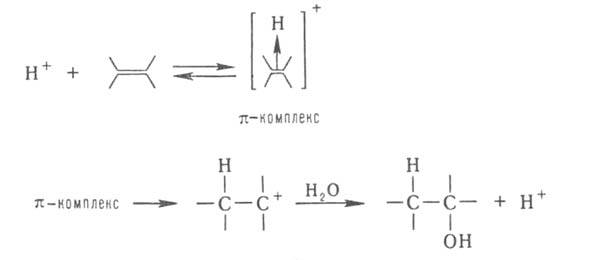
При гетеролитич. присоединении по кратным связям молекулы AD (А-акцепторная, D-донорная часть молекулы) катализатором м. б. более сильный, чем AD, акцептор (электрофил) А или донор (нуклеофил) D. Напр., при гидратировании олефинов к-та Н + служит катализатором, т. к. облегчает последующее взаимод. с водой:
В металлокомплексном Г. к. р-ции ускоряются в присут. комплексных соед. Ti, Fe, Cu, Pt и др. переходных металлов, к-рые способны к образованию комплексов с молекулами субстратов. Каталитич. активность м. б. обусловлена след. факторами: 1) пространств. близостью молекул субстратов, входящих как лиганды в координац. сферу металла, 2) ослаблением хим. связей в молекулах субстратов и снижением энергии активации при их разрыве; 3) усилением вследствие электронных эффектов донорных или акцепторных св-в молекул субстратов, входящих в металлокомплекс; 4) снятием запретов по симметрии молекулярных орбиталей благодаря участию d-орбиталей металлов; 5) возможностью многоэлектронных р-ций с использованием d-электронов переходных металлов в некомплементарных окислит.-восстановит. р-циях с субстратами, для к-рых последовательное одноэлектронное окисление или восстановление термодинамически затруднено. Комплексы переходных металлов, кроме того, иногда облегчают образование своб. радикалов, что обеспечивает возможность катализа радикальных и радикально-цепных р-ций. Металлокомплексные соед. катализируют гидрирование, окисление, полимеризацию, карбонилирование олефинов и ацетиленов, фиксацию азота, диспропорционирование олефинов, активацию и разл. р-ции алканов и др. Типичный механизм металлокомплексного Г. к. рассмотрен на примере каталитич. гидрирования олефинов. Он включает стадии окислит. присоединения Н 2 (1), образование комплекса с олефином (2), внедрение молекулы олефина по связи МЧН (3), восстановит. отщепление алкана (4):
Т. обр., во всех типах Г. к. катализатор, как правило, обеспечивает новый хим. механизм процесса. Каталитич. р-ции происходят в неск. стадий, в одной из к-рых частица катализатора входит в каталитич. цикл, а в другой выделяется в своб. состоянии, чтобы вновь участвовать в р-ции. В этом смысле гомогенно-каталитич. р-ции подобны цепным; их принципиальное отличие заключается в том, что в цепных р-циях скорость образования продукта больше скорости образования активного центра (скорости инициирования цепи) в v раз (v- длина цепи), тогда как в каталитич. процессах скорость образования активного центра катализатора больше скорости образования продукта или этот активный центр присутствует в системе заранее.
Кинетика гомогенно-каталитич. р-ций определяется их механизмом (см. Каталитических реакций кинетика).
Лит.: Гам мет Л., Основы физической органической химии, пер. с англ., М., 1972, с. 407-45; Джен к с В., Катализ в химии и энзимологии, пер. с англ., М., 1972; Литвиненко Л. М., Олейник Н. М., Органические катализаторы и гомогенный катализ, К., 1981; Parshall G. W., Homogeneous catalysis, N.Y., 1980. А. Е. Шилов.
КАТАЛИЗ. ГОМОГЕННЫЙ КАТАЛИЗ
Актуальность темы обусловлена распространенностью каталитических процессов в природе и широким использованием катализаторов в технологических процессах. Также роль катализа неоспоримо велика в биологических системах, поскольку все процессы, проходящие в живых организмах, являются каталитическими.
Цель работы: изучить влияния катализаторов на скорость химических реакций, рассмотреть механизм каталитических процессов в гомогенных системах.
В соответствии с целью работы были поставлены следующие задачи:
— рассмотреть основные понятия химической кинетики;
— изучить факторы, влияющие на скорость протекания химических процессов;
— рассмотреть механизм протекания гомогенных каталитических процессов;
— изучить виды гомогенного катализа;
— изучить кинетику каталитического разложения пероксида водорода.
Теоретическаячасть
Скоростью реакции называется число элементарных актов реакции, происходящих в единицу времени в единице объема (для гомогенных реакций) или на единице поверхности раздела фаз (для гетерогенных реакций).
Скорость реакции обычно характеризуют изменением концентрации какого-либо из исходных или конечных продуктов реакции в единицу времени. Если в момент времени τ1 и τ2 концентрация одного из веществ равны с1 и с2, то среднюю скорость ῡ в интервале времени τ1 и τ2 можно выразить так:
Факторы, влияющие на скорость химической реакции:
— давление для реакций с участием газов;
— площадь поверхности соприкосновения для реакций с участием твердых веществ;
Катализаторы – это вещества, изменяющие скорость реакции за счет участия в промежуточном химическом взаимодействии с компонентами реакции.
Если катализаторы и реагенты находятся в разных фазах и имеют границу раздела, то катализ называется гетерогенным.
Катализаторы, которые находятся в системе в том же фазовом состоянии, что и реагенты, называют гомогенными.
Механизм протекания гомогенных каталитических процессов
Увеличение скорости катализируемой реакции связано с меньшей энергией активации нового пути реакции.
Вторая стадия для данной реакции является лимитирующей.
Распишем константy равновесия для первой стадии:
Так как вторая стадия является лимитирующей, то
Подставляя уравнение (2) в уравнение (3), получаем
kэфф зависит от природы кислоты и от pH раствора.
В общем основном катализе роль катализатора исполняет молекула основания.
Рассмотрим процесс превращения некоторого субстрата в продукт реакции с участием основания в роли катализатора.
Вторая стадия для данной реакции является лимитирующей.
Распишем константу равновесия для первой стадии:
Так как вторая стадия является лимитирующей, то
Подставляя уравнение (5) в уравнение (6), получаем
kэфф зависит от природы основания и от pH раствора.
Например, специфический кислотный катализ
SH + + H2O →P + H3O + (лимитирующая стадия)
Напишем константу равновесия первой стадии
Так как вторая стадия является лимитирующей, то
Подставляя уравнение (8) в уравнение (9), получаем:
kэфф зависит только от pH раствора.
И специфический основный катализ:
Напишем константу равновесия первой стадии
Так как вторая стадия является лимитирующей, то
Подставляя уравнение (11) в уравнение (12), получаем:
kэфф зависит только от pH раствора.
Многие процессы, идущие в организме человека, катализируются ферментами, например, превращение крахмала в глюкозу, гидролиз эфиров, расщепление белков, разложение пероксида водорода, дегидратация СО2 из крови и др.
Ферменты являются полимерами (белками) или комплексами полимеров с низкомолекулярными соединениями. Размеры их значительно превышают размеры ионов и молекул в растворах, поэтому ферменты иногда называют микрогетерогенными катализаторами.
Механизм их действия имеет свою специфику, например, включает образование комплекса активный центр фермента – реагент по типу «замок – ключ».
Рассмотрим, например, ферментативный гидролиз белков. Широко используют частичный гидролиз под действием пептидаз. Среди пептидаз имеются ферменты, избирательно гидролизующие пептидные связи либо внутри белковой молекулы – эндопептидазы, либо на конце цепи – экзопептидазы, отщепляющие аминокислоту с N- или С-конца. Отдельные пептидазы расщепляют пептидные связи между определенными аминокислотными остатками. Так, трипсин гидролизует пептидные связи, образованные лизином (или аргинином) с другими аминокислотами, пепсин – пептидную связь между двумя аминокислотами с неполярными (гидрофобными) радикалами, например, между валеином и лейцином. Для осуществления полного гидролиза применяют набор ферментов.
В организме белки пищи расщепляются полностью, поскольку для жизнедеятельности используются только свободные α-аминокислоты.
Гомогенный катализ в газовой фазе
Гомогенно-каталитические реакции в газовой фазе протекают обычно по механизму цепных реакций. Примером может служить гомогенный катализ цепной реакции окисления монооксида углерода в диоксид углерода в присутствии следов водяного пара. Реакция начинается с образования атома кислорода (активного центра):
При отсутствии паров воды цепная реакция не развивается, так как активный центр Ȯ не регенерируется:
где М – инертная частица (например, стенка сосуда или примесь в газе), которой передается избыточная энергия. Могут быть и другие реакции с участием активного центра Ȯ, приводящие к обрыву цепи.
В присутствии следов водяного пара в газовой смеси активный центр О вступает в реакцию с молекулой Н2О, в связи с чем протекает разветвленная цепная реакция с регенерацией активных центров ȮН, Ḣ и Ȯ:
H + OH + M → H2O + M (и)
Практическая часть
Изучение кинетики каталитического разложения пероксида водорода
Задача экспериментальной части: определить порядок реакции разложения пероксида водорода и константу скорости реакции.
Для изучения кинетики процесса разложения пероксида водорода в настоящей работе применяется газометрический способ. Количество разложившегося к данному моменту пероксида водорода определяют по объему выделившегося кислорода.
Оборудование и посуда: установка для изучения кинетики (состоит из реакционного сосуда, бюкса, бюретки, уравнительной склянки, термостата, штатива); пипетка, вместимостью 1 мл; пипетка, вместимостью 2 мл; секундомер.
Реактивы: 3% раствор пероксида водорода (аптечный), 1 М раствор иодида калия (катализатор).
Порядок выполнения работы
В бюкс помещается 1 мл раствора иодида калия.
В реакционный сосуд помещается 2 мл раствора пероксида водорода.
Бокс помещается в реакционный сосуд и закрывается пробкой с газоотводной трубкой.
Перемещением уравнительного сосуда вдоль штатива устанавливается одинаковые уровни воды в бюретке и уравнительном сосуде.
Включается секундомер и через каждые 0,5-1,0 мин измеряется объем выделившегося кислорода; перед каждым измерением устанавливается одинаковый уровень воды в бюретке и уравнительном сосуде.
Экспериментальные данные заносятся в таблицу 1.
Ʈ, мин
V выделившегося кислорода, мл
V выделившегося кислорода (с учетом влажности воздуха), мл
Гомогенный и гетерогенный катализ
Катализаторы и каталитические системы. Сущность каталитического действия. Гомогенный катализ. Гетерогенный катализ. Методы повышения эффективности технологических процессов за счет использования катализаторов
При гомогенном катализе катализатор и реагирующие вещества образуют одну фазу (газовая смесь или раствор). При гетерогенном катализе катализатор и реагирующие вещества находятся в разных фазах.
Адсорбционная теория гетерогенного катализа (ГК)
Описывает каталитические процессы, которые происходят на поверхности раздела твердой фазы (катализатор) и газовой фазы (реагирующие вещества). Центральную роль в процессе (ГК) играют физическая и химическая адсорбция.
Адсорбция – накопление молекул на поверхности раздела фаз. Физическая адсорбция происходит под действием сил Ван-дер-Ваальса. Химическая адсорбция (хемосорбция) происходит вследствие образования химических связей между адсорбируемыми молекулами и поверхностью.
Стадии гетерогенного катализа на примере каталитического гидрирования этилена
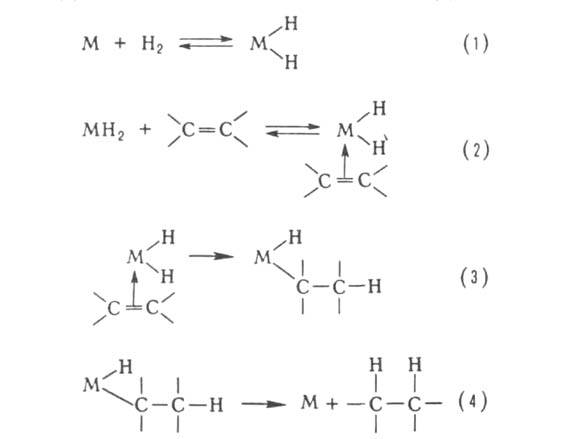
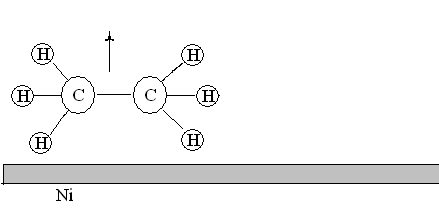
1. Диффузия. Реагирующие молекулы диффундируют к поверхности твердого вещества (см. рис. ).
Рис.19. Диффузия молекул этилена и водорода из газовой фазы к поверхности никелевого катализатора
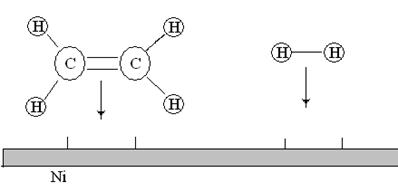
2. Адсорбция. Реагирующие молекулы сначала адсорбируются физически, затем вступают в химические реакции с активными центрами поверхности (хемосорбируются) (см. рис. ).
Активные центры – свободные участки поверхности, где могут адсорбироваться молекулы реагирующих веществ. Другая часть поверхности катализатора занята адсорбированными молекулами примесей. Число активных центров на единицу поверхности зависит от природы и способа приготовления катализатора.
Рис.20. Адсорбция молекул этилена и водорода на поверхности никелевого катализатора
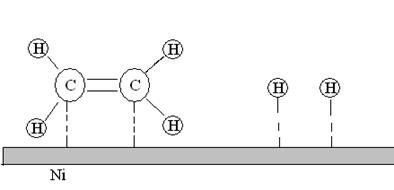
3. Химическая реакция. Адсорбированные атомы и молекулы вступают в химическую реакцию с образованием продуктов.
Рис. 21. Химическое взаимодействие молекул этилена и водорода на поверхности никелевого катализатора
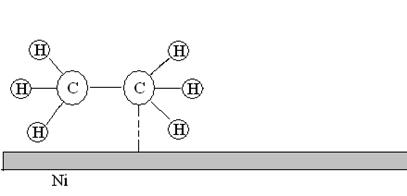
4. Десорбция. Молекулы продуктов реакции переходят из состояния хемосорбированности в состояние физической адсорбированности и затем десорбируются с поверхности.
Рис. 22. Десорбция молекул этана с поверхности никелевого катализатора
5. Диффузия. Молекулы продуктов реакции диффундируют с поверхности.
Рис. 23. Диффузия молекул этана с поверхности никелевого катализатора в газовую фазу
ГОМОГЕННЫЙ КАТАЛИЗ
Цель курсовой работы: рассмотреть сущность каталитического процесса и изучить механизм действия катализатора (частный случай – гомогенный катализ).
В соответствии с целью работы были поставлены следующие задачи:
— изучить основные понятия химической кинетики;
— изучить факторы, влияющие на скорость химической реакции;
— изучить механизм действия катализатора, свойства катализаторов, виды катализа и особенности гомогенного катализа;
— исследовать кинетику реакции окисления йодоводородной кислоты пероксидом водорода.
Теоретическая часть.
Скорость гомогенной реакции – это количество вещества, вступающего в реакцию или образующегося в результате реакции за единицу времени в единице объема системы:
гдеV – объем газа или раствора [л],
∆с – изменение концентрации [моль/ л],
∆n – изменение количества вещества [моль],
∆t – интервал времени [с].
Факторы, влияющие на скорость химической реакции:
— давление для реакций с участием газов;
— площадь поверхности соприкосновения для реакций с участием твердых веществ;
Катализатор – вещество, изменяющее скорость химической реакции участием в образовании активированного комплекса одной или нескольких стадий химического превращения и не входящее в состав конечных продуктов.
Скорость реакции непосредственно зависит от значения энергии активации: если оно мало, то за определенное время протекания реакции энергетический барьер преодолеет большое число частиц и скорость реакции будет высокой, но если энергия активации велика, то реакция идет медленно.
Гомогенный катализ – процесс, проходящий с участием катализатора, находящегося в одной фазе (жидкой или газообразной) с реагирующими веществами. Рассмотрим некоторую реакцию
В присутствии катализатора осуществляются две быстро протекающие стадии, в результате которых образуются частицы промежуточного соединения АК и затем (через активированный комплекс АВК # ) конечный продукт реакции с регенерацией катализатора:
Примером такого процесса может служить реакция разложения ацетальдегида, энергия активации которой EA = 190 кДж/моль:
В присутствии паров йода этот процесс протекает в две стадии:
Экспериментально установлено, что уменьшение энергии активации этой реакции в присутствии катализатора составляет 54 кДж/моль; константа скорости реакции при этом увеличивается приблизительно в 105 раз.
Процессы гомогенного катализа классифицируются:
2. по фазовому состоянию гомогенные каталитические процессы делят на жидкофазные (в растворах) и газофазные.
Примером кислотно-основного катализа в растворе может служить гидратация олефинов в спирты, катализируемая кислотами (НА). В общем виде:
К реакциям гомогенного катализа относятся реакции омыления жиров и сложных эфиров, инверсия сахара, гидролитическое расщепление ацеталей, амидов, которые ускоряются действием водородных ионов, точнее – ионов гидроксония, ферментативный катализ, протекающий в организме человека и животных.
Ферментативный катализ
Ферментативный катализ – каталитические реакции, протекающие с участием ферментов – биологических катализаторов белковой природы. Ферментативный катализ имеет две характерные особенности:
2. Высокая специфичность. Например, амилаза катализирует процесс расщепления крахмала, представляющего собой цепь одинаковых глюкозных звеньев, но не катализирует гидролиз сахарозы, молекула которой составлена из глюкозного и фруктозного фрагментов.
Согласно общепринятым представлениям о механизме ферментатив-ного катализа, субстрат S и фермент F находятся в равновесии с очень быстро образующимся фермент-субстратным комплексом FS, который сравнительно медленно распадается на продукт реакции P с выделением свободного фермента; т.о., стадия распада фермент-субстратного комплекса на продукты реакции является определяющей скорость (лимитирующей).
Исследование зависимости скорости ферментативной реакции от концентрации субстрата при неизменной концентрации фермента показали, что с увеличением концентрации субстрата скорость реакции сначала увеличивается, а затем перестает изменяться (рис. 2.3.) и зависимость скорости реакции от концентрации субстрата описывается следующим уравнением:
Здесь Кm – константа Михаэлиса, численно равная концентрации субстрата при. Константа Михаэлиса служит мерой сродства между субстратом и ферментом: чем меньше Кm, тем больше их способность к образованию фермент-субстратного комплекса.
Рис. 2.3. Зависимость скорости ферментативной реакции от концентрации субстрата.
Характерной особенностью действия ферментов является также высокая чувствительность активности ферментов к внешним условиям – рН среды и температуре. Ферменты активны лишь в достаточно узком интервале рН и температуры, причем для ферментов характерно наличие в этом интервале максимума активности при некотором оптимальном значении рН или температуры; по обе стороны от этого значения активность ферментов быстро снижается.
Экспериментальное изучение кинетики окисления
йодоводородной кислоты пероксидом водорода
Задача практической части работы: определить константы скорости реакции окисления йодоводородной кислоты пероксидом водорода.
Реакция окисления йодоводородной кислоты является примером гомогенного катализа. Она ускоряется в присутствии нескольких капель раствора молибдата аммония. Йодоводородная кислота образуется при взаимодействии йодида натрия с серной кислотой:
В результате окисления йодоводородной кислоты пероксидом водорода выделяется йод:
Расход пероксида водорода определяют по количеству выделившегося йода, который титруют раствором тиосульфата натрия в присутствии крахмала:
Реакции (1) и (3) протекает практически мгновенно, поэтому скорость суммарного процесса определяется скоростью более медленной реакции (2).
Поскольку йодид натрия в процессе титрования йода тиосульфата натрия регенерируется, концентрации NaJ и HJ практически постоянны и, следовательно, скорость реакции (2) определяется только концентрацией H2O2.
Процесс окисления HJ пероксидом водорода идет по кинетическому уравнению первого порядка:
гдес 0 и с – концентрация H2O2 в начальный момент времени и через время t от начала реакции.
Реактивы: 0,03 М раствор йодида натрия; 2 М раствор серной кислоты; 0,025 М раствор пероксида водорода; 0,025 М раствор тиосульфата натрия; катализатор 1 М раствора молибдата аммония; 0,5 % раствор крахмала.
Порядок выполнения работы
Опыт проводится при комнатной температуре (25 0 С).
Бюретку заполняют стандартным раствором Na2S2O3.В колбу
В реакционную смесь вносят 5 капель раствора молибдата аммония для быстрого доведения реакции до конца. Выделившийся йод оттитровывают тиосульфатом из той же бюретки до обесцвечивания раствора. Общий объем израсходованного раствора тиосульфата натрия (V 0 Na2S2O3) эквивалентен исходному объему раствора пероксида водорода. Точнуюконцентрацию исходного раствора пероксида водорода с 0 H2O2 рассчитывают по уравнению:
Обработка экспериментальных данных
Для каждого момента времени (t) вычисляют константу скорости реакции. Для этого последовательно рассчитывают:
— число моль неизрасходованного пероксида водорода (nH2O2)
— концентрацию неизрасходованного пероксида водорода (с H2O2)
— константу скорости реакции
Проведение расчетов:
Результаты эксперимента и расчетов представлены в таблице.
Экспериментальные и расчетные данные (при температуре 25 0 C)
Катализ и катализаторы
Катализ – это процесс изменения скорости химической реакции при помощи катализаторов – веществ, принимающих участие в химической реакции, но в состав конечных продуктов не входящих и в результате реакции не расходующихся.
Одни катализаторы ускоряют реакцию (положительный катализ), другие – замедляют (отрицательный катализ). Отрицательный катализ называют ингибированием, а катализаторы, понижающие скорость химической реакции – ингибиторами.
Различают гомогенный и гетерогенный катализ.
Гомогенный катализ.
При гомогенном (однородном) катализе реагирующие вещества и катализатор находятся в одинаковом агрегатном состоянии и между ними отсутствует поверхность раздела. Пример гомогенного катализа – реакция окисления SO2 и SO3 в присутствии катализатора NO (реагирующие вещества и катализатор являются газами).
Гетерогенный катализ.
В случае гетерогенного (неоднородного) катализа реагирующие вещества и катализатор находятся в различных агрегатных состояниях и между ними существует поверхность (граница) раздела. Обычно катализатор – твердое вещество, а реагирующие вещества – жидкости или газы. Пример гетерогенного катализа – окисление NN3 до NO в присутствии Pt (катализатор – твердое вещество).
Механизм действия катализаторов
Действие положительных катализаторов сводится к понижению энергии активации реакции Еа(исх), действие ингибиторов – противоположное.
Так, для реакции 2HI = H2+I2 Еа(исх)=184 кДж/моль. Когда же эта реакция протекает в присутствии катализатора Au или Pt, то Еа(исх)=104 кДж/моль, соответственно.
Механизм действия катализатора при гомогенном катализе объясняется образованием промежуточных соединений между катализатором и одним из реагирующих веществ. Далее промежуточное соединение реагирует со вторым исходным веществом, в результате чего образуется продукт реакции и катализатор в первоначальном виде. Так как скорость обоих промежуточных процессов значительно больше скорости прямого процесса, то реакция с участием катализатора протекает значительно быстрее, чем без него.
SO2 +1/2 O2 = SO3 протекает очень медленно, а если использовать катализатор NO
то реакции NO +1/2О2 = NO2 и NO2 +SO2 = SO3 +NO протекают быстро.
Механизм действия катализатора при гетерогенном катализе иной. В этом случае реакция протекает вследствие адсорбции молекул реагирующих веществ поверхностью катализатора (поверхность катализатора неоднородна: на ней имеются так называемые активные центры, на которых и адсорбируются частицы реагирующих веществ.). Увеличение скорости химической реакции достигается, в основном, за счет понижения энергии активации адсорбированных молекул, а также, отчасти, за счет увеличения концентрации реагирующих веществ в местах, где произошла адсорбция.
Каталитические яды и промоторы.
Некоторые вещества снижают или полностью уничтожают активность катализатора, такие вещества называют каталитическими ядами. Например, небольшие примеси серы (0,1%) полностью прекращает каталитическое действие металлического катализатора (губчатого железа), использующегося при синтезе аммиака. Вещества, повышающие активность катализатора, называют промоторами. Например, каталитическая активность губчатого железа значительно возрастает при добавлении примерно 2% метаалюмината калия KAlO2.
Применение катализаторов
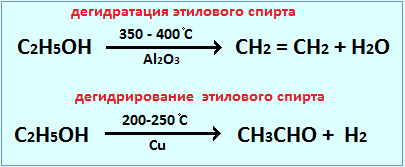
Действие катализатора избирательно и специфично. Это означает, что, применяя различные катализаторы, из одних и тех же веществ можно получить различные продукты. Это особенно характерно для реакций органических веществ. Например, в присутствии катализатора AlO3 происходит дегидратация этилового спирта, в присутствии Cu – дегидрирование:
Биологические катализаторы, принимающие участие в сложных химических превращениях, протекающих в организме, называются ферментами.
Катализаторы широко используются в производстве серной кислоты, аммиака, каучука, пластмасс и др. веществ.