гипопаратиреоза что это такое
Что такое гипопаратиреоз? Причины возникновения, диагностику и методы лечения разберем в статье доктора Ананьева А. Ш., эндокринолога со стажем в 4 года.
Определение болезни. Причины заболевания
Гипопаратиреоз — это заболевание, возникающее из-за недостаточной секреции паращитовидными железами паратиреоидного гормона или нечувствительностью тканей организма к его действию. Патология сопровождается снижением содержания кальция в крови, что проявляется судорогами, болями в костях, мышцах и нарушениями сердечного ритма.
Гипокальциемия — стойкое снижение содержания общего кальция в крови ниже 2,2 ммоль/л, ионизированного кальция ниже 1,1 ммоль/л.
Наиболее частые причины гипопаратиреоза:
Симптомы гипопаратиреоза
К основным симптомам гипопаратиреоза относятся:
Кроме того, при заболевании отмечаются боли в костях, головные боли, снижение зрения и двоение в глазах.
Патогенез гипопаратиреоза
Концентрация внеклеточного кальция регулируется в узких пределах основными факторами:
Паращитовидные железы в зависимости от концентрации ионизированного кальция крови выделяют определённое количество паратиреоидного гормона. При низкой концентрации ионов кальция в крови секреция паратиреоидного гормона увеличивается. И наоборот, высокая концентрация кальция подавляет секрецию паратгормона. При первичном поражении паращитовидных желёз (операция, травма), в результате их недоразвития, при нарушении действия паратгормона или чувствительности к нему паратиреоидный гормон перестаёт регулировать фосфорно-кальциевый обмен. В результате возникает синдром гипокальциемии.
Классификация и стадии развития гипопаратиреоза
В зависимости от причин заболевания выделяют следующие виды гипопаратиреоза:
1. Повреждение паращитовидных желёз:
2. Снижение функции паращитовидных желёз:
3. Недоразвитие паращитовидных желёз (врождённый гипопаратиреоз):
Также существует ряд заболеваний, которые клинически имитируют гипопаратиреоз, но на самом деле представляют собой вторичный гиперпаратиреоз (гипокальциемия и высокий уровень ПТГ):
По течению выделяют:
Осложнения гипопаратиреоза
Диагностика гипопаратиреоза
Для постановки диагноза в первую очередь собирают анамнез болезни (историю заболевания) и осматривают пациента.
Врачу важно знать:
При осмотре пациента врач обращает внимание на следующие симптомы [3] :
Для подтверждения гипокальциемии проводят следующие исследования (не менее двух раз) [3] :
Для уточнения причин гипокальциемии:
Инструментальные методы для подтверждения гипокальциемии не требуются, их проводят для исключения других заболеваний и уточнения осложнений гипопаратиреоза [3] :
По результатам дополнительных методов исследования могут быть рекомендованы консультации других специалистов:
Лечение гипопаратиреоза
Немедикаментозное лечение:
Медикаментозное лечение — при хронической гипокальциемии основной задачей медикаментозного лечения является восстановление фосфорно-кальциевого баланса в организме. С этой целью назначают [3] [6] [10] :
Лечение гипокальциемии, вызванной дефицитом магния или сопровождающееся им, требует применения препаратов магния в сочетании с витамином Д и солями кальция.
Для лечения острой гипокальциемии необходимо уменьшить концентрацию кальция в крови ниже 1,9 ммоль/л:
Прогноз. Профилактика
Прогноз для жизни благоприятный. Чаще всего лечение осуществляется амбулаторно. Контроль и эффективность лечения оценивается по отсутствию клинических проявлений гипокальциемии (боли в костях, судорог, возбудимости), нормализации показателей фосфора и кальция.
При первичном назначении терапии, смене лекарственных препаратов или подборе доз необходим контроль кальция и фосфора. Для этого пациенту следует посещать эндокринолога один раз в 7-10 дней.
При налаженной стабильной терапии консультация эндокринолога необходима один раз в 3-6 месяцев. Наблюдение офтальмолога для контрольного осмотра проводят один раз в 6-12 месяцев.
Для компенсации заболевания требуется поддерживать уровень электролитов:
Профилактика гипопаратиреоза должна быть комплексной, она включает предупреждение:
Гипопаратиреоз
Общая информация
Краткое описание
Автоматизация клиники: быстро и недорого!
— Подключено 300 клиник из 4 стран
Автоматизация клиники: быстро и недорого!
Мне интересно! Свяжитесь со мной
Классификация
2. Послеоперационный гипопаратиреоз – развивается в результате хирургического вмешательства на щитовидной железе или других органах шеи с повреждением паращитовидных желез, обычно возникает после полного удаления щитовидной железы (тиреоидэктомия);
3. Посттравматический гипопаратиреоз развивается в результате:
4. Аутоиммунный гипопаратиреоз встречается при полигландулярной аутоиммунной болезни.
По течению:
острая стадия – состояние трудно компенсируется, часто возникают тяжелые приступы судорог;
хроническая стадия – нечастые приступы провоцируются инфекциями, физической нагрузкой, нервным перенапряжением, менструацией, психологической травмой. Обострения гипопаратиреоза обычно возникают весной и осенью. Адекватное лечение позволяет добиться длительной ремиссии.
латентная (скрытая) стадия – внешние проявления отсутствуют, обнаруживаются нарушения на биохимическом уровне и при проведении специального обследования.
Диагностика
II. МЕТОДЫ, ПОДХОДЫ И ПРОЦЕДУРЫ ДИАГНОСТИКИ И ЛЕЧЕНИЯ
Перечень основных и дополнительных диагностических мероприятий
Основные (обязательные) диагностические обследования, проводимые на амбулаторном уровне:
Диагностические критерии
Жалобы и анамнез [3].
• при аутоиммунном гипопаратиреозе – кандидоз, признаки надпочечниковой недостаточности.
При легкой форме заболевания судороги возникают 1-2 раза в неделю, могут длиться минуты;
При тяжелой форме возникают неоднократно за сутки и продолжаются несколько часов. Спазм мускулатуры может сопровождаться бледностью кожи, перепадами давления, сердцебиением, расстройством пищеварения (рвотой, поносом). В тяжелых случаях гипопаратиреоза пациенты могут терять сознание (Таблица 1).
Таблица 1. Клинические симптомы гипопаратиреоза
При гипопаратиреозе происходят изменения со стороны зубочелюстной системы: у детей – нарушения формирования зубов, дефекты эмали; у больных всех возрастных групп – кариес, дефекты эмали зубов. У детей также происходит задержка роста [5]. 12.3
Лабораторные исследования
Лабораторная диагностика гипопаратиреоза подразумевает исследование Ca, P и ПТГ в сыворотке крови и исследование Ca и P в моче (Таблица 2,3).
Таблица 2. Референсные значения Са, Р и паратгормона в крови:
Таблица 3. Референсные значения Са, Р в моче:
• МРТ выявляет кальцинаты во внутренних органах, подкожной клетчатке, ганглиях головного мозга.
Гипопаратиреоз
В организме человека, по разным причинам, может возникнуть недостаток паратгормона, из-за которого и развивается гипопаратиреоз. Согласно статистике, патологией страдает 0,3-0,4 процента населения планеты. Причем возникнуть она может вне зависимости от возраста, пола человека. Заболевание требует серьезного и адекватного подхода, так как возможны опасные последствия, вплоть до летального исхода. Для этого предусмотрена детальная и дифференцированная диагностика гипопаратиреоза, применение новейших методов лечения и меры профилактики, благодаря которым можно избежать опасной симптоматики или снизить ее интенсивность.
Что такое гипопаратиреоз
Паращитовидная железа вырабатывает секрецию парагормона, и ввиду различных патологических фактов, возможен недостаток вещества. У больного возникает сбой в обменных процессах, касаемых важных для организма фосфора и кальция. Также провоцировать состояние может нарушение чувствительности тканей, рецепторов к паратгормону. На этом фоне происходит понижение показателей активности паращитовидки, ведущей к тем же обменным нарушениям.
Существуют разные виды гипопаратиреоза – идиоптический, врожденный, посттравматический, послеоперационный и аутоиммунный. В крови человека меняется уровень содержания паратгормонов Р и Са, а на денситометрии, при рентгене отражается стадия остеосклероза.
Современные представители специализации эндокринология выделяют несколько форм проявления гипопаратиреоза, обуславливая характером течения, симптоматикой заболевания.
Острая
У больного часто возникают сильные приступы судорог, прерывистое дыхание, учащенный пульс, мощная слабость, быстрая утомляемость. Состояние сложно компенсируется.
Хроническая
Приступы возникают не часто, их провокаторами являются инфекционные процессы, нагрузки физического плана, стрессы, перенапряжение, критические дни, усталость. Переохлаждение, длительное нахождение на жаре, открытом солнце. Состояние может обостряться в весенний, осенний сезоны. При адекватном отношении к проблеме и соответствующем лечении формируется стойкая ремиссия на длительное время.
Скрытая (латентная)
Наружные признаки практически отсутствуют, но болезнь кроется внутри организма и может потихоньку развиваться. Для выявления требуется детальное исследование организма.
Причины гипопаратиреоза
Симптомы и последствия
Главная клиническая деталь заболевания – пациент страдает судорогами. В его организме усиливается мышечная, нервная возбудимость из-за дефицита паратгормона. На этом фоне наблюдаются мощные мышечные сокращения, при которых пациент ощущает сильные боли. Данный признак именуется в медицине «тетанический».
Перед судорогами у больного могут наблюдаться скованность мышечной ткани, онемение, ощущение «мурашек» в зоне верхней губы, пальцев рук и нижних конечностей, похолодание и покалывание. Затем возникают сами судороги, и, как правило, они имеют симметричный характер, то есть с обеих сторон. Сначала рефлексируют мышцы рук, далее ножные. В редких случаях спазмируют лицевые мышцы внутренних органов и тела.
Спазм мышечной структуры нередко сопровождается бледностью кожных покровов, учащенным сердцебиением, резкими скачками давления, расстройствами в ЖКТ – рвота, понос. В тяжелых случаях больной может потерять сознание.
Нарушения в вегетатике – наблюдается:
Нарушается сердечная деятельность, повышается чувствительность к резким звукам, громким разговорам, музыке. Из вкусовых – человек слишком восприимчив к кислым, сладким и острым блюдам. Сбивается терморегуляция – больному или слишком, жарко или возникает озноб.
Последствия
Если в организме присутствует дефицит кальция на протяжении длительного времени, то возникают проблемы с психикой человека, его памятью. Развивается бессонница, раздражительность, неврозы, эмоциональные срывы, депрессия, тоска, снижаются интеллектуальные способности.
При хроническом течении болезни формируются и трофические патологии:
У детей при гипопаратиреозе неправильно формируются зубы, наблюдается гипоплазия зубной эмали, развитие кариеса и отставание в росте.
Длительное течение заболевания приводит к формированию катаракты, при котором происходит помутнение глазного хрусталика, снижение остроты зрения и развитие слепоты. Латентное (скрытое) течение выявляется спазмами мышечной структуры, частыми вирусными, грибковыми и бактериальными инфекциями, авитаминозом и интоксикациями.
Лечение
Диета
В рацион необходимо включать продукты, богатые кальцием, но при этом содержащие малое количество фосфора. Сюда относятся фрукты, овощи, кисломолочная продукция.
В моменты обострения болезни следует отказаться от мясной пищи.
В рационе должен присутствовать витамин D2- ергокальциферол, поэтому в меню нужно включить яйца, печень, рыбий жир.
Профилактика
Чтобы при оперативном вмешательстве не возникло опасных последствий, применяется щадящая техника, не задевающая паращитовидный орган.
При рецидивирующем типе токсического зоба, чтобы избежать развития гипопаратиреоза, применяется лучевая терапия с йодом радиоактивным вместо хирургического вмешательства.
Большое значение имеет профилактика осложнений после операций – работа со спайками, инфильтратами. Данные патологии могут вызвать сбой кровоснабжения в зону околощитовидных желез. Важно вовремя после операции обнаружить признаки нервно-мышечной возбудимости.
Прогнозы
При гипопаратиреозе прогноз благоприятен, главное – применить адекватное лечение. Правильная компенсация и контроль врача-эндокринолога хотя бы 1 раз в полгода позволяет не только не развиваться гипопаратиреозу, но и опасным последствиям патологии. Еще лучше, если проводить корректирующие курсы лечения 1 раз в 3 месяца и соблюдать все рекомендации профильного специалиста.
Гипопаратиреоз
Гипопаратиреоз – заболевание, развивающееся вследствие недостатка паратгормона, секретируемого паращитовидными железами, или нарушения рецепторной тканевой чувствительности к нему. Снижение функциональной активности паращитовидных желез различного генеза наблюдается у 0,3—0,4% населения и может возникнуть в любом возрасте, приводя к нарушению обмена кальция и фосфора. Различают врожденный, послеоперационный, посттравматический, аутоиммунный и идиопатический гипопаратиреоз. В ходе диагностики гипопаратиреоза важное значение имеет определение содержания паратгормона, Са и Р в крови, выявление остеосклероза при рентгенологическом исследовании и денситометрии.
МКБ-10
Общие сведения
– заболевание, развивающееся вследствие недостатка паратгормона, секретируемого паращитовидными железами, или нарушения рецепторной тканевой чувствительности к нему. Снижение функциональной активности паращитовидных желез различного генеза наблюдается у 0,3—0,4% населения и может возникнуть в любом возрасте, приводя к нарушению обмена кальция и фосфора.
Причины гипопаратиреоза
Паратгормон совместно с гормоном щитовидной железы кальцитонином и витамином D отвечает за регуляцию в организме фосфорно-кальциевого обмена. Его недостаток вызывает снижение в крови уровня кальция и повышенное содержание фосфатов. В результате нарушается минеральный баланс (равновесие между ионами К, Na, Mg), проницаемость клеточных мембран, что проявляется усилением нервно-мышечной возбудимости и судорогами. Гипокальциемия и гиперфосфатемия способствуют отложению солей кальция во внутренних органах и на стенках кровеносных сосудов.
Развитие гипопаратиреоза нередко бывает связано с заболеваниями щитовидной железы, что объясняется их близким анатомическим расположением и тесной функциональной взаимосвязью. Гипопаратиреоз может развиваться в результате:
Классификация гипопаратиреоза
Современная эндокринология выделяет следующие формы гипопаратиреоза, обусловленные характером течения заболевания:
С учетом причины выделяют гипопаратиреоз:
Симптомы гипопаратиреоза
В зависимости от сведенных судорогой мышц развиваются характерные проявления со стороны соответствующих органов.
Судорожный синдром при гипопаратиреозе проявляется спазмом мышц:
При гипопаратиреозе судороги отличаются болезненностью, при легкой форме заболевания возникают 1-2 раза в неделю, могут длиться минуты; при тяжелой форме возникают неоднократно за сутки и продолжаются несколько часов. Могут появляться спонтанно, а могут провоцироваться какими либо внешними раздражителями (механическими, болевыми, термическими, электрическими). Спазм мускулатуры может сопровождаться бледностью кожи, перепадами давления, сердцебиением, расстройством пищеварения (рвотой, поносом). В тяжелых случаях гипопаратиреоза пациенты могут терять сознание.
При длительном низком уровне Ca в крови у пациентов с гипопаратиреозом отмечаются изменения психики: снижение интеллекта, памяти, неврозы, эмоциональная лабильность (депрессия, тоска), расстройство сна.
При длительном гипопаратиреозе возможно развитие катаракты (помутнения хрусталика со снижением остроты зрения и развитием слепоты). При латентном течении заболевания спазмы мышц могут возникать при острых инфекциях, интоксикации, беременности, недостаточности витаминов.
Осложнения
При спазме мускулатуры рук усиливается тонус сгибательных мышц, (рука принимает позицию «руки акушера»). При мышечных судорогах в ногах сильнее напряжены разгибательные мышцы (сгибание подошвы – «конская стопа»). Отмечается болезненность судорог во время приступов тетании, но пациент находится в сознании. Спазм гладкой мускулатуры может проявиться печеночной или почечной коликой.
Диагностика
Диагностика явных клинических форм гипопаратиреоза основана на результатах внешнего осмотра больного, присутствия типичного анамнеза (перенесенные операции на щитовидной или паращитовидных железах, лучевая терапия радиоактивным йодом), симптомов повышенной нервно-мышечной возбудимости (судорожная готовность или приступы тонических судорог).
Лабораторная диагностика гипопаратиреоза подразумевает исследование уровня кальция и фосфора, паратгормона в крови и моче. При гипопаратиреозе отмечается гиперфосфатемия, гипокальциемия, снижение концентрации паратгормона в сыворотке крови, гипокальциурия, гипофосфатурия.
Лечение гипопаратиреоза
Терапия гипопаратиреоза и предупреждение судорожных приступов проводится под постоянным контролем эндокринолога. Назначается диета, богатая кальцием, магнием и бедная фосфором (молочная продукция, овощи, фрукты). Резкое ограничение или отказ от мясных продуктов необходим в период обострения гипопаратиреоза. Важен прием с пищей витамина D2 (эргокальциферола), который содержится в желтке яиц, печени, рыбьем жире.
При гипопаратиреозе назначаются препараты кальция (кальций карбонат, глюконат кальция). Для повышения всасывания в кишечнике кальция обязателен его одновременный прием с хлоридом аммония, желудочным соком или разведенной хлористоводородной кислотой. Компенсация состояния при гипопаратиреозе монотерапией кальция не позволяет полностью нормализовать его уровень в крови, поэтому дополнительно применяют препараты витамина D (эргокальциферол, альфакальцидол, колекальциферол). Для активации выработки витамина D в собственном организме пациентам с хроническим гипопаратиреозом рекомендовано умеренное физиотерапевтическое ультрафиолетовое облучение или принятие солнечных ванн.
Для профилактики судорожного синдрома назначают противосудорожные и успокаивающие препараты (люминал, бромиды); в случае гипокальциемического криза внутривенно вводят раствор глюконата кальция.
Прогноз при гипопаратиреозе
Прогностические данные при гипопаратиреозе – благоприятные. Лечение гипопаратиреоза и предупреждение судорожных приступов требуют постоянного контроля врача-эндокринолога. Контроль осуществляют с целью оценки компенсации заболевания и коррекции курса лечения 1 раз в 3 месяца, один раз в полгода необходим осмотр врача – окулиста по поводу возможного развития катаракты.
Профилактика гипопаратиреоза
С целью предупреждения гипопаратиреоза при проведении хирургического вмешательства на щитовидной железе применяются щадящие оперативные техники по отношению к паращитовидным железам. Пациентам с рецидивирующим токсическим зобом во избежание развития гипопаратиреоза рекомендуется проводить лучевую терапию радиоактивным йодом вместо хирургической операции. Важное значение имеет профилактика послеоперационных осложнений (спаек, инфильтратов), которые могут нарушить кровоснабжение околощитовидных желез, а также раннее обнаружение у пациентов после хирургического вмешательства на щитовидной железе симптомов повышенной нервно-мышечной возбудимости и своевременное принятие мер.
Для предупреждения судорожного синдрома и развития острого гипокальциемического криза при гипопаратиреозе необходимо исключение провоцирующих факторов, профилактика интоксикаций и инфекций. Пациентам с гипопаратиреозом необходимо придерживаться диеты: она должна быть обогащена кальцием и ограничена фосфором, обязательно необходимо полностью отказаться от мясных продуктов, так как они вызывают развитие тетании. При гипопаратиреозе осуществляется диспансерный контроль за содержанием Ca и P в крови.
Гипопаратиреоз в детском и подростковом возрасте
В статье рассмотрены современные данные о этиологии, патогенезе, клинике, генетической диагностике гипопаратиреоза у детей-подростков. Описаны синдромы, протекающие с клиникой этого заболевания. Представлены методы обследования и современные рекомендации
The article considers modern data on etiology, pathogenesis, clinical picture, genetic diagnostics of hypoparathyroidism in adolescents and children. The syndromes flowing with the clinical picture of this disease are described. The methods of examination and modern recommendations for treatment are presented.
Гипопаратиреоз (гипоПТ) — это эндокринное заболевание, характеризующееся недостаточным синтезом, секрецией или периферическим действием паратиреоидного гормона (ПТГ). Следствием гипоПТ является нарушение фосфорно-кальциевого обмена. Гипокальциемия — основной признак этого заболевания, однако причины ее могут быть разные.
Кальций (Са) играет важную роль в функционировании любой клетки и в обменных процессах организма в целом. Он участвует в мышечном сокращении, является посредником при передаче сигналов между клетками, изменяет проницаемость мембран клеток.
Основным депо Са в организме считается костная ткань (около 99%). Приблизительно 1% его находится в виде лабильных фосфатных солей, которые могут легко растворяться и изменять концентрацию Сa в плазме крови.
Биологически активной (примерно 50%) является фракция свободного (ионизированного) кальция (Са 2+ ), остальной Са связан с белками плазмы крови, цитратами, фосфатами, которые влияют на плотность кости. Щелочная среда увеличивает связь Са с альбумином, уменьшая пул ионизирующей фракции.
Фосфор в организме человека содержится в кристалличеcкой форме в костной ткани (85%), в межклеточной жидкости в форме неорганического фосфата и в мягких тканях в виде сложных фосфорных эфиров.
Вместе с кальцием фосфор составляет основу костной ткани. Фосфаты участвуют в переносе энергии в виде макроэргических связей (ТФ, АДФ, креатинфосфат и т. д.), входят в состав буферных систем плазмы и тканевой жидкости. Фосфорная кислота влияет на процессы гликолиза, глюконеогенеза, обмена жиров.
Кроме ионов Са для сопряженных процессов возбуждения и сокращения необходим и циклический нуклеотид-аденозин 3–5 монофосфат (цАМФ). Он является вторичным мессенджером в процессе сокращения. Са и цАМФ связаны друг с другом. Са регулирует скорость синтеза и распад цАМФ, в то же время последний контролирует вход в клетку ионов Са и таким образом является регулятором цикла сокращения и расслабления мышцы [1].
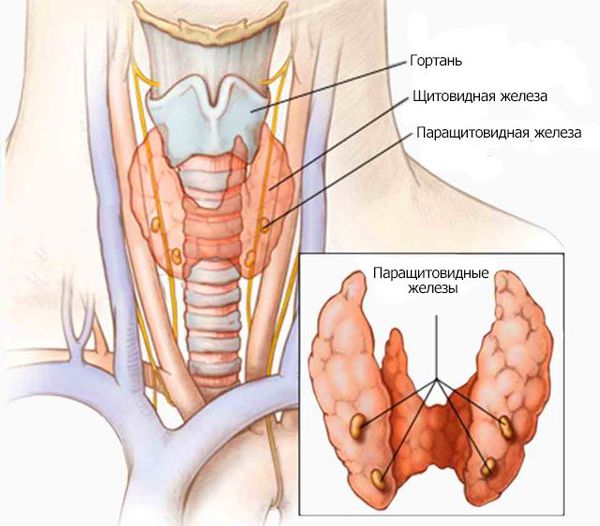
Анатомия и физиология паращитовидных желез
Паращитовидные железы (ПЩЖ) закладываются у зародыша на 5-й неделе внутриутробного развития из 3–4 пар жаберных карманов глоточной кишки. В дальнейшем эти выступы отшнуровываются с образованием 4 отдельных околощитовидных желез. Дополнительные ПЩЖ встречаются в ткани щитовидной и вилочковой желез, в переднем и заднем средостении, в перикарде, позади пищевода, в области бифуркации общей сонной артерии.
Каждая ПЩЖ окружена соединительнотканной капсулой. Паренхима железы представлена трабекулами и скоплениями между ними эндокринных клеток — паратироцитов.
ПТГ синтезируется в главных ацидофильных клетках. Ген, кодирующий синтез ПТГ, локализуется на 11-й хромосоме (11р15). В регуляции экспрессии гена ПТГ принимает участие витамин D (1,25(ОН)2D3), который, как и кальций, может действовать независимо друг от друга.
Сначала синтезируется препрогормон, насчитывающий 115 аминокислотных остатков. Далее от него отщепляется сигнальный петид, содержащий 25 аминокислотных остатков, и образуется прогормон, который перемещается в аппарат Гольджи. В нем происходит превращение его в зрелый гормон, складирующийся в секреторных гранулах.
В крови ПТГ циркулирует в трех основных формах: интактный паратгормон с молекулярной массой 9500, биологически активный карбоксильный фрагмент с молекулярной массой 7000–7500, биологически активный фрагмент с молекулярной массой 4000. Образование фрагментов происходит в печени и почках. Интактный гормон в дальнейшем распадается на короткие звенья, которые связываются с рецепторами на клетках-мишенях [1].
При рождении ПЩЖ хорошо развиты, функционально активны, но при достаточном транспланцетарном транспорте кальция секреция ПТГ понижена. Увеличение концентраций ПТГ в сыворотке крови новорожденного в ранний адаптационный период происходит одновременно со снижением концентрации Са. Нормальный или повышенный уровень ПТГ у здоровых новорожденных устанавливается через 2–3 дня [3].
Органами-мишенями для ПТГ являются кости и почки. В них располагаются кальций-чувствительные рецепторы, воздействуя на которые ПТГ активирует аденилатциклазу. Она влияет на АТФ, превращая его в циклический аденозинмонофосфат (цАМФ), который в свою очередь мобилизует ионы кальция из внутриклеточных запасов.
Магний участвует, в частности, в активации митохондриальной АТР-синтетазы, регулирует активность некоторых ионных каналов и, обладая свойством образовывать устойчивые трехкомпонентные комплексы с нуклеотидами, участвует в процессах синтеза нуклеиновых кислот, транскрипции и трансляции [4].
Введение в организм больших количеств магния значительно снижает секрецию ПТГ, что используется в клинике при гиперпаратиреозе.
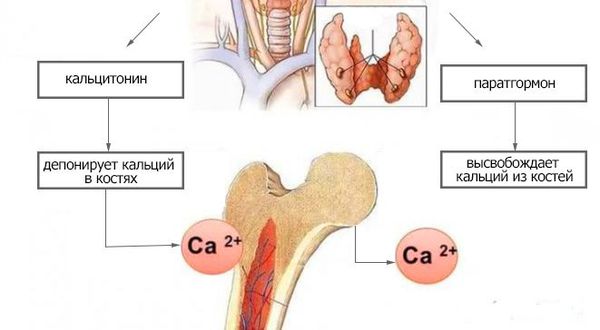
Основная функция ПТГ заключается в поддержании постоянного уровня ионизированного Са в крови, которую он выполняет, влияя на костную ткань, почки и опосредованно через витамин D на кишечник.
В костях ПТГ активирует резорбтивные процессы. В костной ткани содержится три вида клеток: остеоциты, остеобласты (молодые клетки, создающие костную ткань) и остеокласты (разрушают костную ткань). В костной ткани рецепторы к ПТГ располагаются только на остеоцитах и остеобластах. При связывании ПТГ с остеобластами они начинают усиленно синтезировать инсулиноподобный фактор роста 1 (ИФР1) и различные цитокины. Эти вещества влияют на остеокласты, стимулируя их метаболическую активность.
Остеокласты синтезируют протеиназы, такие как щелочная фосфатаза и коллагеназа, которые влияют на распад костного матрикса. В результате мобилизуются Са и фосфаты во внеклеточную жидкость. С этим его действием связано повышение содержания кальция в крови. Воздействие ПТГ на костную ткань происходит только в присутствии витамина D3 (холекальциферола).
В почках ПТГ, как и витамин D, усиливает реабсорбцию Са в дистальных отделах канальцев, тем самым снижая его выведение с мочой и повышая его уровень в крови. Механизм действия ПТГ на фосфаты в почечных канальцах прямо противоположен влиянию витамина D. Первый подавляет реабсорбцию фосфата в нефронах, напротив, витамин D усиливает его реабсорбцию [3]. Фосфатурический эффект паратгормона препятствует отложению фосфата кальция в мягких тканях.
Витамин D действует в кишечнике, увеличивая выработку кальцийсвязывающего белка, необходимого для транспорта экзогенного Са через клеточную мембрану слизистой оболочки кишечника.
Синтез активной формы витамина D3 (1α,25(ОН)2D3 — D-гормона — кальцитриола) происходит при участии фермента 1a-гидроксилазы в проксимальных отделах почечных канальцев под контролем ПТГ. В синтезе этого ключевого фермента необходимы также половые, тиреоидные, соматотропный гормоны, пролактин, кальцитонин.
Основная физиологическая функция витамина D (его активных метаболитов) в организме — регуляция и поддержание на необходимом уровне фосфорно-кальциевого гомеостаза, обеспечение минерализации костей. В костях 1α,25(ОН)2D3 связывается с рецепторами на остеобластах, повышая экспрессию активатора ядерного фактора RANKL. Это ускоряет созревание преостеокластов и их превращение в зрелые остеокласты [5].
В костной ткани кальциферол мобилизует кальций и использует его для процессов минерализации вновь образовавшейся кости. Наряду с этим он влияет на синтез коллагена, участвующего в образовании матрикса костной ткани. Механизм всасывания кальция в кишечнике связан с синтезом энтероцитами кальцийсвязывающего белка (СаСБ), одна молекула которого транспортирует 4 атома кальция. В норме человек потребляет около 1 грамма Са в сутки. От 25% до 50% кальция всасывается при участии кальциферола.
Итак, в плазму крови кальций поступает из кишечника, всасываясь из воды, пищи или путем резорбции костной ткани. Уровень кальция в сыворотке имеет большое значение для большого количества физиологических процессов, поскольку даже небольшие отклонения влияют на различные клеточные функции. Уровень кальция в сыворотке обычно поддерживается в очень узком диапазоне.
Патогенез
Абсолютный или относительный недостаток ПТГ ведет к падению активности остеокластов, снижению резорбции костной ткани и, соответственно, поступлению кальция из кости в кровь. В почках из-за недостатка ПТГ уменьшается синтез активного витамина D, нарастает реабсорбция фосфатов, сокращается всасывание Са, в результате чего развивается гиперфосфатемия и гипокальциемия.
Отрицательный кальциевый и положительный фосфорный баланс нарушают электролитное равновесие, изменяются соотношения кальций/фосфор и натрий/калий. Это ведет к универсальному нарушению проницаемости клеточных мембран, в частности, в нервных клетках, к изменению процессов поляризации в области синапсов.
Возникающее в результате этого повышение нервно-мышечной возбудимости и общей вегетативной реактивности приводит к повышению судорожной готовности и тетаническим кризам. В генезе тетании значительная роль принадлежит также нарушению метаболизма магния и развитию гипомагнезиемии, снижающих синтез ПТГ. Это облегчает проникновение ионов натрия в клетку и выход из клетки ионов калия, что тоже способствует повышению нервно-мышечной возбудимости. Такое же действие оказывает и возникающий при этом сдвиг кислотно-основного состояния в сторону алкалоза [6].
Нозологические формы
Тетания новорожденных
Тетания новорожденных встречается относительно часто. Сопровождается гипокальциемией и нередко гипофосфатемией. Возможно, что этиологическим фактором в патогенезе неонатальной гипокальциемии является резистентность органов-мишеней к паратгормону и транзиторный гипоПТ. В крови здоровых новорожденных концентрация паратгормона или очень низка или не определяется совсем, и только на 4-е сутки после рождения начинается параллельное увеличение в крови содержания ПТГ, связанного и ионизированного кальция. В период новорожденности резервы ПЩЖ у детей снижены. Однако уменьшение концентрации кальция в крови не всегда сопровождается повышением функции ПЩЖ, что свидетельствует об участии дополнительных неизвестных факторов в генезе неонатальной гипокальциемии.
У новорожденных гипокальциемия может проявляться плохим набором веса и обильными срыгиваниями, генерализованными судорогами, острой сердечно-сосудистой недостаточностью [7].
Семейный изолированный гипопаратиреоз
Врожденный изолированный гипопаратиреоз чаще всего обусловлен наследственными нарушениями синтеза паратиреоидного гормона. Выделяют два типа заболевания: гипопаратиреоз инфантильный Х-сцепленный (ген картирован на Xq26-q27) и семейный гипопаратиреоз с аутосомно-доминантным типом наследования (ген картирован на коротком плече 11-й хромосомы) [8]. Зависимые от пола формы заболевания имеют благоприятный прогноз. У детей этой группы обнаруживают гипоплазию или эктопию ПЩЖ, гипоплазию или отсутствие вилочковой железы.
У детей с врожденной недостаточностью ПЩЖ содержание кальция в крови снижено, нарушен рост костей, зубов и волос, наблюдаются длительные сокращения мышечных групп (предплечья, грудной клетки, глотки и др.).
Семейная гиперкальциурическая гипокальциемия
Семейная гиперкальциурическая гипокальциемия — эта аутосомно-доминантная гипокальциемия вызвана активирующей мутацией гена 3q13.3-q21, кодирующей кальцийчувствительный рецептор. Из-за активирующей мутации чувствительность CaSR высокая, что по типу обратной связи приводит к подавлению секреции ПТГ и состоянию гипокальциемии. Однако ПЩЖ у этих пациентов функционируют нормально, хотя заболевание протекает с клиникой гипоПТ.
Особое внимание следует уделять пациентам с этой формой заболевания, поскольку они имеют аномально высокую почечную экскрецию кальция в ответ на лечение добавками кальция, что приводит к высокому риску развития почечной кальцификации и почечной недостаточности [9].
Идиопатический, или аутоиммунный, гипоПТ
Идиопатический, или аутоиммунный, гипоПТ может быть как изолированный, так и быть частью множественной аутоиммунной эндокринопатии.
При изолированном аутоантитела направлены к рецепторам кальция на мембранах клеток ПЩЖ, а именно к связанному с ними цензору, белку G120 кДа, который улавливает самое минимальное снижение уровня кальция в сыворотке крови. Так как антитела связаны с белком G120 Кда, последний не стимулирует в нужной степени секрецию ПТГ, уровень его в сыворотке крови низкий, вследствие чего развивается гипокальциемия [10]. Синдром идиопатического аутоиммунного гипоПТ относится к числу редких форм эндокринопатий, однако случаи его развития в детском возрасте могут встретится.
Аутоиммунный полигландулярный синдром 1-го типа
Аутоиммунный полигландулярный синдром 1-го типа (АПС-1) — моногенное заболевание с аутосомно-рецессивным типом наследования, реже встречаются спорадические случаи. В основе синдрома лежит мутация структуры гена аутоиммунного регулятора (AIRE).
Ген расположен на хромосоме 21q22.3, состоит из 14 экзонов и преимущественно экспрессируется в тимусе. В настоящее время установлено более 50 мутаций данного гена. Самыми распространенными являются R257X, 109del13, R139X. Эти мутации затрагивают области гена, которые ответственны за формирование ДНК-связывающих доменов [11].
Ассоциация АПС-1 с галотипами HLA отсутствует. Пик манифестации приходится на 12 лет. Характерными признаками АПС-1 являются слизисто-кожный кандидоз, первичная хроническая надпочечниковая недостаточность и гипоПТ.
Комбинация симптомов, сроки проявления и степень их выраженности при АПС-1 у детей значительно варьируют. В большинстве случаев дебют заболевания сопровождается развитием кожно-слизистого кандидоза в первые 10 лет жизни, чаще сразу после рождения ребенка. При этом отмечается поражение слизистых ротовой полости, гениталий, кожи, ногтей. Реже в процесс вовлекается желудочно-кишечный тракт, дыхательные и мочевыводящие пути [8].
На фоне кандидоза у 84% пациентов диагностируют гипоПТ, который обычно развивается в первую декаду жизни ребенка. Клинические проявления гипоПТ разнообразны: от характерных парестезий и мышечных судорог до развития приступов, сходных с эпилепсией. Первичный гипокортицизм длительное время протекает в латентной форме и манифестирует у большинства пациентов в течение второго десятилетия жизни острой надпочечниковой недостаточностью.
Клинические фенотипы при данном синдроме гетерогенны и не исчерпываются этими симптомами. Классической триаде заболевания могут сопутствовать первичный гипогонадизм, первичный гипотиреоз на фоне аутоиммунного тироидита, сахарный диабет 1 типа [12].
Среди неэндокринных заболеваний при АПС-1 выявляются алопеция, витилиго, пернициозная анемия, синдром мальабсорбции, аутоиммунный гепатит, аномалия зубной эмали, эктодермальная дисплазия, изолированный дефицит IgA, бронхиальная астма, гломерулонефрит. Появление вышеуказанных клинических компонентов этого синдрома может растягиваться на многие годы, что затрудняет диагностику. Ранняя постановка АПС-1 возможна в случаях длительного кандидоза и моноэндокринной паталогии при исследовании гена AIRE [10].
Яртрогенный гипопаратиреоз
Яртрогенный гипоПТ является наиболее частой причиной постхирургического гипоПТ (2–10%), который развивается в связи с повреждением ПЩЖ при операциях на шее в первые сутки. Согласно данным Garrhyetal, гипоПТ в 38% случаях были связаны с тотальной тиреоидэктомией, в 9% — с частичной тиреоидэктомией, в 21% — с паратиреоидэктомией и в 5% — с другими операциями на шее. Риск развития гипоПТ после операции на шее во многом зависит от опыта хирурга [13]. У большинства пациентов развивался транзиторный гипоПТ. Функция ПЩЖ у них полностью восстанавливалась через 6 месяцев. У 15–25% развивался хронический гипоПТ [14].
Инфильтративно-дистрофический гипоПТ
Инфильтративно-дистрофический гипоПТ связан с отложением в тканях железы различных веществ при системных заболеваниях.
Гемохроматоз — наследственное заболевание, характеризующееся нарушением обмена железа в организме, нарушенной регуляцией всасывания железа в кишечнике, повышенным его содержанием в сыворотке крови и накоплением в тканях и органах.
Талассемия — это гетерогенная группа нарушений, являющихся результатом снижения или отсутствия продукции нормальных цепей глобина. В результате происходит усиленный распад гемоглобина и избыточное образование пигмента гемосидерина и отложение его в тканях железы.
Болезнь Вильсона–Коновалова — наследственное заболевание, передающееся по аутосомно-рецессивному типу. Возникает в условиях мутаций в гене АТР7В, кодирующем белок медьтраснпортирующей АТФазы печени. Характерный признак болезни Вильсона — накопление меди в различных органах и тканях, в большей степени в печени и базальных ганглиях.
Радиационный гипопаратиреоз
Радиационный гипопаратиреоз возникает вследствие лучевого повреждения ПЩЖ при дистанционном облучении органов головы и шеи, а также эндогенном облучении при лечении диффузного токсического зоба или рака щитовидной железы радиоактивным йодом.
Синдром Ди Джорджи
Синдром Ди Джорджи — генетическое заболевание, обусловленное нарушением эмбрионального развития третьего и четвертого фарингеальных мешков.
Встречаемость синдрома Ди Джорджи составляет 1:3000–20 000. Такое значительное расхождение данных обусловлено тем, что достоверная и четкая граница между этим заболеванием и велокардиофациальным синдромом до сих пор не установлена. Отличием болезни Ди Джорджи являются грубые иммунологические нарушения, которые слабо выражены при велокардиофациальном синдроме.
Генетическая природа синдрома Ди Джорджи заключается в повреждении центральной части длинного плеча 22-й хромосомы (22q22.3), где предположительно располагаются гены, кодирующие процессы эмбриогенеза. Одним из этих генов является TBX1, который производит белок T-box. Доказательством взаимосвязи синдрома Ди Джорджи и TBX1 является тот факт, что незначительный процент больных не имеет выраженных повреждений 22-й хромосомы, а присутствуют только мутации в этом гене [15].
Многие проявления синдрома Ди Джорджи определяются сразу после рождения ребенка. Чаще всего первыми обнаруживаются аномалии развития лица — расщепление мягкого и твердого неба, иногда в сочетании с «заячьей губой», прогнатия нижней челюсти. Дети с синдромом Ди Джорджи чаще низкорослые, имеют короткий нос с широкой переносицей, деформированные или недоразвитые хрящи ушных раковин, гипертелоризм. При относительно легком течении заболевания все вышеперечисленные симптомы могут быть выражены довольно слабо, даже расщепление твердого неба может возникать только в задней его части и выявляться лишь при тщательном осмотре оториноларинголога.
Результатом гипоплазии ПЩЖ является дефицит ПТГ и персистирующая гипокальциемия, вследствие чего развивается судорожный синдром, который может проявиться уже в первые часы жизни (неонатальная тетания). Эта патология сочетается с самыми разнообразными дефектами сердечно-сосудистой системы — тетрада Фалло, дефект межжелудочковой перегородки, незаращение артериального протока и другие.
Синдром характеризуется полным или частичным недоразвитием вилочковой железы, где формируется клеточный иммунитет. В крови определяется лимфоцитопения. Дефицит Т-лимфоцитов проявляется склонностью к вирусным, грибковым и бактериальным инфекциям, которые нередко принимают затяжное и тяжелое течение.
Синдром Бараката
Синдром Бараката, или синдром HDR (hypoparathyroidism, deafness, renaldisease).
Это редкое генетическое заболевание, связанное с дефектом гена GATA3 (10p15). Ген кодирует белок, отвечающий за развитие ПЩЖ, внутреннего уха, почек [16]. Гипокальциемические афебрильные судороги и тетания могут проявиться после рождения или в любом возрасте. ПЩЖ представляют собой небольшие эндокринные образования, содержание ПТГ резко снижено или не определяется. У пациентов определяется гипокальциемия, непроизвольное сокращение мышц (тетания) или судороги в грудном возрасте. Двусторонняя нейросенсорная тугоухость может варьировать от легкой до глубокой. Среди почечных аномалий встречаются дисплазия, гипоплазия, аплазия, глюкокортикоид-резистентный нефротический синдром (почечная недостаточность, приводящая к потере большого количества белка в моче).
Синдром Кенни–Каффи
Синдром Кенни–Каффи относится к орфанным заболеваниям, известным как «акроцефалополисиндактилии» (ACPS). Наследуется по аутосомно-доминантному типу. В основе синдрома лежат мутации гена TBCE (1q43–44), вызывающие изменения структуры клеток. Пациенты рождаются с внутриутробной задержкой развития. Врожденные аномалия затрагивают несколько систем организма. Клинически это проявляется пропорциональной карликовостью, маленьким лицом и выпуклым лбом, акроцефалией (высокий конический череп вследствие преждевременного заращения черепных швов), синдактилиями или полидактилиями.
Другие симптомы включат в себя аномалии органа зрения, приступы тетании, связанные с гипоПТ. Костные полости и каналы всех костей сужены (медуллярный стеноз) при нормальном или утолщенном корковом веществе. В анализе крови выявляют гипокальциемию и гиперфосфатемию [17].
Синдром Кенни–Каффи типа 2
Синдром Кенни–Каффи типа 2 (KCS2) является чрезвычайно редкой патологией скелета, вызванной мутацией в гене FAM111A, с аутосомно-доминантным типом наследования.
Дети рождаются малорослые и с низкой массой тела. Голова гидроцефальной формы, лоб выпуклый, микрофтальмия. Характерным является утолщение трубчатых костей и остеосклероз.
Гипокальцимические судороги могут выявляться уже в периоде новорожденности, которые связаны с гипоПТ [18].
Синдром Саньяда–Сакати
Синдром Саньяда–Сакати (синдром HRD, hypoparathyroidism/retardation/dysmorphism) известен также как акроцефалополисиндактилия III типа. Этот синдром вызван дефектом гена 1q.42-q.43. Хотя синдром Саньяда–Сакати имеет один и тот же локус с аутосомно-рецессивной формой синдрома Кенни–Каффи, пациенты при последнем отличаются нормальным интеллектом и скелетными особенностями.
Синдром характеризуется внутриутробной задержкой роста, микроцефалией. Лицо вытянутое, узкое, глаза глубоко посажены, нос клювовидный, уши большие и висящие, губы тонкие, переносица плоская, микрогнатия, длинный фильтр. Задержка умственного развития легкая или умеренно выражена.
Кроме того, при синдроме Саньяда–Сакати нарушается развитие костной системы: деформации рук и ног, короткие пальцы (брахидактилия), полидактилия, слаборазвитость костей голени и аномалии бедренных костей. Дети рождаются с врожденными пороками сердца и глаз. У некоторых выявляли дефекты формирования сосудов (извилистость сосудов сетчатки, верхней брыжеечной артерии), помутнение роговицы.
Врожденный гипоПТ проявляется рано тетанией или повышенной судорожной готовностью. Пациенты значительно отстают в росте [19].
Окончание статьи читайте в следующем номере
ФГБОУ ВО РНИМУ им. Н. И. Пирогова МЗ РФ, Москва
Гипопаратиреоз в детском и подростковом возрасте (часть 1) В. В. Смирнов, П. Н. Владимирова
Для цитирования: Лечащий врач № 6/2018; Номера страниц в выпуске: 49-53
Теги: щитовидная железа, эндокринные заболевания, органы-мишени, кальций