гиподенсный участок что это такое
Опухоль надпочечника
Вести-Кузбасс: видеорепортаж о мастер-классе: «Эндоскопические операции в хирургии, урологии и гинекологии»
Инциденталома надпочечника ( случайно найденная опухоль) – опухоль выявленная при ультразвуковом, Ямрт или Кт обследовании, которое проводилось в отсутствии жалоб и клинической картины со стороны надпочечников. Эти опухоли обнаруживаются приблизительно у 4% людей, из них двухстороннее поражение составляет около 15%. Выявленное образование может оказаться как гормонально-неактивным, так и активно производящим различные гормоны, может исходить из различных зон надпочечника или иметь неспецифичную органную принадлежность, может быть как злокачественной, так и доброкачественной.
Диагностика опухоли надпочечника
Для хирургов наиболее интересным вопросом является статистическая вероятность различных нозологических форм (кортизол- и альдостерон-продуцирующие аденомы, феохромоцитома, адренокортикальный рак, метастаз в надпочечник рака) в рамках инциденталом ( выявленных опухолей надпочечников). Оценка вероятности важна с точки зрения наиболее актуальных проблем: злокачественного потенциала и гормональной активности опухолей.
Пр размере опухоли более 4 см частота злокачественной природы опухоли составляет более 25%. Если при динамическом наблюдении отмечается рост опухоли на 1 см в год или 0,5 см за 6 месяцев, необходимо безотлагательное выполнение оперативного вмешательства, так как для доброкачественных аденом характерен рост всего 2-3 мм в год.
При обнаружении опухоли необходимо провести КТ-семиотику опухоли. При исследовании КТ-плотности на разных фазах выведения контраста (wash-out), аденомы коры надпочечника быстро снижают показатели плотности, в то время как другие образования надпочечников имеют тенденцию к задержке контрастного вещества. Снижение КТ-плотности через 10 мин. после введения контраста более чем на 50% от разности значений плотности в доконтрастную и контрастную фазу свидетельствует о доброкачественной аденоме коры надпочечника. Измерение этого показателя имеет близкую к абсолютным значениям чувствительность при дифференциальном диагнозе аденом от феохромоцитомы, адренокортикального рака и метастатической карциномы.
Повторное КТ обычно рекомендуется через 6, 12, и 24 месяца после первичного выявления. При подозрительных данных КТ (высокая плотность и накопление контраста) и небольшом размере опухоли (до 3 см) оптимальным считают интервал первичного наблюдения 3 месяца. При больших размерах, также показано оперативное вмешательство, без дальнейшего наблюдения.
Лечебная тактика при опухоли надпочечника
При выявлении опухоли надпочечника размером более 1 см в первую очередь необходимо исключить или подтвердить гормональную активность образования, которая может проявляться гиперкатехоламинемией, АКТГ-независимым гиперкортицизмом, первичным гиперальдостеронизмом.
На втором этапе для диагностики злокачественного потенциала опухоли рекомендована оценка количественных денситометрических показателей при трехфазной мультиспиральной КТ:
При получении высокоплотных КТ-значений в нативную фазу, задержки контраста в отсроченной фазе – злокачественный потенциал опухоли должен оцениваться, как высокий.
В дифференциальном диагнозе опухолей надпочечника пункционная биопсия не имеет доказанных преимуществ, ассоциируется с низкой чувствительностью, специфичностью и высокой вероятностью осложнений. Тоже самое кажется и такого метода диагностики, как ПЭТ КТ, выявлено что не все нейроэндокринные злокачественные опухоли надпочечника накапливают контрастное вещество, таким образом данный метод не являются специфическим и достоверным, и может дать ложно –отрицательный результат.
Показания к оперативному хирургическому лечению опухоли надпочечника
Абсолютным показанием к операции при наличии образований надпочечников являются:
Посмотреть видео операций при опухолях надпочечника в исполнении профессора Вы можете на сайте «Видео операций лучших хирургов мира».
Образования надпочечников: тактика ведения
Частота выявления новообразований надпочечников постоянно возрастает, их распространенность составляет 1-10%. Хотя в каждом случае необходимо выявить гормональную активность и злокачественный потенциал, большая часть из них представлена гормонально неакти
Abstract. Detection of adrenal neoplasms frequency is increasing constantly, their estimated at 1 to10%. Although in each case it is necessary to identify hormonal activity and malignant potential, most of them are represented by hormone inactive and benign adenomas. Approximately a fifth of the adrenal formations after further verification are hormone-active or carcinomas that require surgical treatment. The main goal of imaging studies in adrenal incidentalomas is the timely detection of malignant tumors; to determine the characteristics of neoplasms, computed tomography, magnetic resonance imaging and, if necessary, a number of radioisotope studies are used. The size of the lesion detected on computed tomograms exceeding 4-6 cm, its uneven edge or heterogeneity of the structure, an attenuation coefficient of 10 Hounsfield units or higher with a non-contrast study, washout of the contrast agent after 10 or 15 minutes by less than 40%, calcification and invasion in the surrounding tissues suggest the malignancy of the adrenal gland lesion, the likelihood of this increases with a combination of these signs. The developed visualization methods and laboratory evaluation allow to assess their morphological structure and functionality with high confidence. The principles of monitoring the growth and hormonal activity of adrenal formations had been currently developed, but the aspects of the long-term dynamic monitoring remain poorly understood. For citation: Morgunov L. Yu. Аdrenal tumors: management tactics // Lechaschy Vrach. 2020; 12 (23): 18-23. DOI: 10.26295/OS.2020.98.90.004
Резюме. Частота выявления новообразований надпочечников постоянно возрастает, их распространенность составляет 1-10%. Хотя в каждом случае необходимо выявить гормональную активность и злокачественный потенциал, большая часть из них представлена гормонально неактивными и доброкачественными аденомами. Примерно пятая часть образований надпочечников после дальнейшей верификации представляет собой гормонально активные или карциномы, требующие оперативного лечения. Основная цель визуализирующих исследований при инциденталомах состоит в своевременном выявлении злокачественных опухолей; для определения характеристик новообразований используют компьютерную томографию, магнитно-резонансную томографию и при необходимости ряд радиоизотопных исследований. Размер выявленного на компьютерных томограммах образования, превышающий 4-6 см, его неровный край или неоднородность структуры, коэффициент ослабления 10 единиц Хаунсфилда или выше при неконтрастном исследовании, вымывание контрастного вещества через 10 или 15 минут менее чем на 40%, кальцификация и инвазия в окружающие ткани предполагают злокачественность поражения надпочечников, вероятность этого повышается при сочетании данных признаков. Разработанные методы визуализации и лабораторная оценка с большой достоверностью позволяют судить об их морфологической структуре и функциональности.
В настоящее время разработаны принципы наблюдения за ростом и гормональной активностью образований надпочечников, однако вопросы длительного динамического наблюдения за ними остаются малоизученными.
Образования надпочечников, случайно обнаруженные при визуальном исследовании, выполненном по причинам, не связанным с их патологией, носят название инциденталом (ИН). Как правило, образования менее 1 см не именуются ИН, и дополнительные диагностические тесты рекомендуются лишь для объемных процессов, превышающих данный размер, при отсутствии клинических симптомов гормональной активности. Быстрое развитие технологий визуализации в последние годы существенно повысило шансы на их обнаружение.
Распространенность ИН составляет от 1% до 8,7% [1] и увеличивается с возрастом, гендерные различия отсутствуют. Например, в стационары Италии ежегодно госпитализируются около 1 450 000 пациентов, у 58 000 из них выявляются ИН [2]. N. Unger (2019) полагает, что распространенность ИН несколько выше – около 3% и увеличивается до 10% у пожилых людей; у 15% пациентов с ИН выявляются признаки их гормональной активности [3]. Хотя данная патология встречается достаточно редко, ее клиническое и экономическое бремя представляется весомым, а вопросы длительного динамического наблюдения пока остаются без ответа.
11-20% выявляемых образований надпочечника являются гормонально активными; с самым высоким риском смертности ассоциированы феохромоцитомы, поэтому их наличие требуется исключить в первую очередь. В 80% случаев в надпочечниках выявляются гормонально неактивные и доброкачественные образования, в то время как распространенность феохромоцитомы составляет от 3,0% до 6,0% адренокортикальной карциномы – от 2,0% до 5,0%. Надпочечник – место метастазирования различных видов рака, встречающихся в 1-2% случаев [4, 5].
Если у пациента ранее выявлялись злокачественные опухоли иной локализации, вероятность того, что ИН окажется метастазом рака, составляет почти 50%. По данным J. T. Lenert с соавт. (2001), адренокортикальная карцинома встречается в 4-5% случаев, но прогноз неблагоприятен из-за частого ее выявления в далеко зашедшей стадии, а ее рецидив является достаточно распространенным явлением. В надпочечник часто метастазирует рак легких, почек, толстой кишки, молочной железы, пищевода, поджелудочной железы, печени или желудка, а сами метастазы нередко бывают двусторонними [6]. Метастатические поражения, как правило, неоднородны по структуре, имеют края неправильной формы и являются двусторонними в 10-15% случаев [7].
Национальное многоцентровое исследование, проведенное по инициативе министерства здравоохранения, труда и социального обеспечения Японии в период с 1999 по 2004 г., включало 3672 случая ИН у 1874 мужчин и 1738 женщин; средний возраст 58,1 ± 13,0 лет. Средний размер ИН составил 3,0 ± 2,0 см; диаметр образований оказался значимо большим у пациентов с верифицированными адренокортикальными карциномами, феохромоцитомами, развернутым синдромом Кушинга, миелолипомами, метастазами рака, кистами и ганглионевромами (p 10 ЕХ) (69%) выполнялась повторная визуализация. 105 врачам первичного звена, чьи пациенты включались в исследование, была разослана стандартизированная анкета, состоящая из 16 вопросов. Большинство специалистов первичного звена полагали, что подавляющей части пациентов с ИН и отсутствием клинической симптоматики не требуется гормональная оценка (71%) или последующее наблюдение (72%). Проведенное исследование демонстрирует необходимость междисциплинарного подхода к наблюдению пациентов с ИН путем взаимодействия между эндокринологами, хирургами и врачами общей практики [38].
Европейское общество эндокринологии (ESE) опубликовало рекомендации по ведению пациентов с ИН (2017), которые полагают возможным воздержаться от повторного гормонального исследования у пациентов с ИН с нормальным уровнем гормонов при первоначальной верификации образования. Рекомендации ESE также полагают нецелесообразным выполнять повторную визуализацию при размерах образования менее 4 см и явных признаках доброкачественности. Однако на сегодняшний день не существует достаточных доказательств, подтверждающих нецелесообразность динамического биохимического и морфологического наблюдения у пациентов с ИН даже при изначально выявленных доброкачественных и гормонально неактивных образованиях надпочечников, поэтому желательно оценивать структурные признаки и уровень гормонов по крайней мере в течение 5 лет [39].
Обобщая рекомендации, предложенные Американской ассоциацией клинических эндокринологов, Американской ассоциацией эндокринных хирургов, Национальным институтом здоровья США, J. M. Lee с соавт. (2017) свидетельствуют о том, что при наличии образования менее 4 см требуется КТ-визуализация через 6 месяцев, не превышающая в дальнейшем 2 лет, а также проведение гормональных тестов – ежегодно в течение 4-5 лет [40].
Клинические рекомендации Российской ассоциации эндокринологов ориентируют на нецелесообразность динамического наблюдения при низкоплотных гормонально неактивных опухолях по данным первичной КТ, в этих случаях также не показан мониторинг гормональной активности. Исключение составляют новые клинические проявления (появление или клиническое прогрессирование артериальной гипертензии, сахарного диабета, ожирения, остеопороза), о чем необходимо предупредить пациента. При неопределенном злокачественном потенциале образования требуется контроль размеров через 3-6 мес, а при увеличении максимального размера опухоли за короткий период на 5 мм или росте объема опухоли на 20% необходимо рассмотреть вопрос об оперативном лечении. При наличии ССК показан ежегодный контроль уровня кортизола и мониторинг коморбидных состояний (артериальной гипертензии, сахарного диабета, ожирения, остеопороза) [41].
Тем не менее круг заболеваний, могущих являться потенциальными предикторами появления гормональной активности ИН, настолько широк, что сводит на нет ограничения к проведению дополнительных визуализирующих и лабораторных исследований в динамике. Так, распространенность артериальной гипертензии среди населения РФ достигает 39,7% [42]. Реальная численность пациентов с СД в РФ составляет не менее 9 млн человек и во всем мире возросла более чем в 2 раза за последние 10 лет [43]. Распространенность ожирения среди россиян с возрастом линейно возрастает у мужчин с 14,3% до 36,3%, а у женщин – с 10,7% до 52,3% [44]. Остеопорозом в России страдают не менее 14 млн человек (10% населения страны), еще у 20 млн граждан России имеет место остеопения [45].
Таким образом, тактика в отношении диагностики, наблюдения и ведения пациентов с новообразованиями надпочечников у разных исследователей практически одинакова. Вопросы лечения пациентов со злокачественными и гормонально активными образованиями решены, но результаты длительного наблюдения за больными с доброкачественными ГНОН пока отсутствуют. Темой для дискуссий остается специальность врача, обеспечивающего дальнейшее наблюдение за пациентом (эндокринолог, врач общей практики, онколог, хирург). Вероятно, создание единого регистра больных с образованиями надпочечников даже в пределах крупного мегаполиса позволит определиться с периодом их наблюдения и тактикой дальнейшего ведения.
Литература/References
Л. Ю. Моргунов, доктор медицинских наук, профессор
ФГАОУ ВО РУДН, Москва, Россия
Образования надпочечников: тактика ведения/ Л. Ю. Моргунов
Для цитирования: Моргунов Л. Ю. Образования надпочечников: тактика ведения // Лечащий Врач. 2020; 12 (23): 18-23. DOI: 10.26295/OS.2020.98.90.004
Теги: новообразования, аденома, карцинома, злокачественная опухоль
Вторичные (метастатические) опухоли печени
Общее число больных с метастазами в печень составляет приблизительно одну треть от общего количества больных злокачественными опухолями.
В России ежегодно выявляют около 450 тысяч новых больных раком.
У значительной части из них уже имеются метастазы в печени, у других пациентов метастазы в печень могут быть выявлены в разные сроки после установления диагноза рака.
Количество всех больных с метастазами в печени в России составляет более 100 тысяч, что в десятки раз превосходит количество всех больных первичными опухолями печени и внутрипеченочных желчных протоков.
Метастазы в печень наиболее часто наблюдаются у больных с первичной опухолью толстой кишки, легких, желудка, поджелудочной железы, молочной железы. Рак желчевыводящих путей, пищевода, яичников, предстательной железы, почек, а также меланома реже поражают печень.
Чаще всего метастазы в печени повторяют строение первичных опухолей. Однако в ряде случаев метастазы отличаются от первичных опухолей по степени дифференцировки (созревания) опухолевых клеток, что затрудняет установление принадлежности первичной опухоли.
Как правило, метастатическое опухоли печени редко наблюдаются у больных циррозом печени. Это можно объяснить плохими условиями для фиксации и размножения опухолевых клеток в рубцовоизмененном органе.
Метастатический рак печени обычно характеризуется быстрым прогрессированием и отсутствием специфических лабораторных и клинических признаков.
Всех больных с метастазами в печени делят на две группы независимо от источников метастазирования:
(Более трех метастазов считаются множественными).
У больных с единичными метастазами симптомы заболевания напоминают проявления первичного рака печени (увеличение печени и тупые боли в правом подреберье при незначительных размерах опухоли).
У пациентов с множественными метастазами местные и общие симптомы более выражены и характеризуются нарастающей печеночной недостаточностью и осложнениями в виде механической желтухи.
У некоторых больных возникает отек нижних конечностей и расширение вен передней брюшной стенки в результате сдавления нижней полой вены. У 30% больных уже в момент установления диагноза имеется асцит (скопление жидкости в животе) за счет поражения брюшины.
Диагностика
Регулярное наблюдение и обследование больных, перенесших лечение по поводу злокачественной опухоли, позволяет относительно рано выявить метастазы в печени и провести соответствующее лечение. Прогноз (исход) заболевания лучше в случае обнаружения метастазов в печени после окончания лечения первичного рака различных локализаций по сравнению с больными, у которых метастазы выявлены в момент диагностики первичной опухоли.
Ультразвуковое исследование (УЗИ) позволяет решить большинство диагностических задач: размеры метастазов, связь их с крупными сосудами и протоками печени. Использование УЗИ во время операции дает возможность выявить дополнительные очаги опухоли внутри печени и помогает использовать методы местного воздействия на метастазы.
Рентгеновская компьютерная томография (РКТ) и магнитно-резонансная томография (МРТ) обычно не более эффективны, чем УЗИ, однако могут дать дополнительную полезную информацию, особенно при решении вопроса о хирургическом лечении метастазов в печени.
Пункционная биопсия (взятие кусочка ткани) печени показана в тех случаях, когда природа очагов в печени вызывает сомнения.
Ангиография (контрастное исследование сосудов) печени целесообразна при хорошо кровоснабжающихся метастазах и может помочь в уточнении локализации опухолевых очагов и их происхождении.
Всестороннее обследование позволяет решить комплекс вопросов, связанных с первичной опухолью, и определить план лечения по поводу метастатического поражения печени.
Лечение и прогноз (исход)
Лечение больных с метастазами в печень имеет особенности, отличные от лечения больных с первичными злокачественными опухолями печени и внутрипеченочных желчных протоков.
Ввиду биологических особенностей рака толстой кишки и его метастазирования, больные этой группы с метастазами в печень выделены в отдельную группу.
При хирургическом лечении метастазов рака толстой кишки большое значение придается прогностическим факторам, позволяющим судить об исходе заболевания.
К таким факторам относятся:
5-летняя выживаемость больных с метастазами рака толстой кишки в печень, перенесших частичное удаление печени, составляет 25-35%. При первично неоперабельных (неудалимых) метастазах рака толстой кишки в печени возможно проведение системной (внутривенной) и регионарной (через сосуды печени) химиотерапии. При этом после такого лечения у 15% больных удается выполнить операцию.
В первые два года у 40-60% оперированных больных может развиться рецидив (возврат) заболевания в печени. К концу третьего года без рецидива остаются около 30% оперированных больных.
К локальным методам лечения метастазов рака толстой кишки в печени относятся: радиочастотная термодеструкцая (разрушение опухоли высокой температурой), криодеструкция (уничтожение метастазов низкими температурами), введение в опухолевые узлы этанола и др.
Для системной химиотерапии больных с метастазами рака толстой кишки используют различные противоопухолевые препараты и их комбинации: фторурацил, тегафур, капецитабин, иринотекан, оскалиплатин, ралтитрексед. Эффект от химиотерапии наблюдается у 14-50% больных.
Комбинированное (сочетанное) лечение больных с метастазами рака толстой кишки в печень дает наилучшие отдаленные результаты.
Лечение метастазов других опухолей в печень
Выживаемость больных при хирургическом лечении не зависит от сроков обнаружения метастазов после удаления первичной опухоли, объема оперативных вмешательств, размеров и количества метастазов. Показатели отдаленной выживаемости лучше после резекции печени, чем при химиотерапии. Непременным условием резекции печени по поводу метастазов является полное удаление первичной опухоли. Криодеструкция, микроволновая гипертермическая коагуляция, внутриопухолевое введение этанола, уксусной кислоты, ультразвуковая фокусная, лазерная, радиочастотная термодеструкция метастазов в печени в сочетании с местной или системной химиотерапией и резекцией печени носят паллиативный характер и направлены на увеличение продолжительности жизни. Все указанные методы лечения характеризуются удовлетворительной переносимостью больными.
Комбинированное лечение
У больных с химиочувствительными метастазами в печени (рак молочной железы, рак яичка, рак яичников) оптимальным является применение операции с предварительной химиотерапией и возможной химиотерапией после операции по поводу изолированного поражения печени.
Другим вариантом лечения может быть операция в комбинации с местным воздействием (радиочастотная термодеструкция, криодеструкция, введение в опухоль этанола и др.)
Мероприятия 2022 года
Архив мероприятий
Противораковое общество РОССИИ создано по инициативе ученых-онкологов и главных врачей онкологических диспансеров, представляющих более 50 регионов России, с целью претворения в жизнь программы профилактики рака в России
КТ в диагностике очаговых образований печени
ОЧАГОВОЕ ОБРАЗОВАНИЕ ПЕЧЕНИ — ЧТО ЭТО?
Очаговыми образованиями (или очагами) печени называют единичные или множественные участки изменения ее структуры, которые бывают самого разного происхождения – как доброкачественного, так и злокачественного.
Чаще всего очаги выявляются при УЗИ, но иногда являются случайной находкой при компьютерной томографии или МРТ, когда исследование выполнялось по какой-то иной причине. При этом КТ используется для уточнения размеров, количества, расположения и структуры очагов. При этом по результатам КТ врач, как правило, должен ответить на вопросы о характере изменений: имеем ли мы дело с доброкачественным процессом (например, кистой или гемангиомой), либо злокачественным процессом (рак, метастазы, и т.п.). В ряде случаев после выполнения КТ диагноз остается сомнительным. В таких случаях рекомендуется получить второе медицинское мнение по результатам исследования.
Иногда патологическое образование печени выявляется при сцинтиграфии или ПЭТ (очаг гиперфиксации РФП).
Сделать КТ печени в Санкт-Петербурге
ХАРАКТЕРИСТИКИ ПЕЧЕНОЧНЫХ ОЧАГОВ НА КТ
Все объемные образования печени, выявленные при компьютерной томографии, можно разделить в зависимости от следующих параметров:
1) Плотность – характеристика любой ткани организма, которая измеряется на компьютерных томограммах в т.н. единицах Хаунсфилда. В зависимости от рентгеновской плотности очаги бывают гипо-, гипер- и изоденсными по отношению к окружающей нормальной паренхиме. По плотности можно предположить, что находится в структуре очага: кровь, другая жидкость, мягкотканный компонент. Более достоверно выявляются участки обызвествления – кальцинаты.
2) Структура. Кистозные образования подразделяются на одно- и многокамерные; они могут иметь хорошо видимую стенку или не иметь таковой; содержать включения кальция, геморрагическую – гиперденсную – жидкость, гиподенсную жидкость, например, желчь. Внутри можно обнаружить инородное тело или паразита, кистозный или мягкотканный компонент. Также структура может быть однородная или неоднородная, последняя часто объясняется участками некроза. Выявление извести и кальцинатов свидетельствует о длительности процесса.
3) Форма может быть приближенной к шару, вытянутая, неправильная (иррегулярная) и т. д.
4) Контуры. Ровные или неровные, четкие или нечеткие, видимые на всем протяжении или на ограниченном участке.
5) Размеры. Измеряются линейные размеры очага (длинник и поперечник) на аксиальном срезе либо все три размера (когда это возможно, указывается также объем). Если планируется контрольное исследование через определенное время, выбирается т. н. «маркерный» очаг, изменение размеров которого будет оцениваться во времени.
6) Расположение необходимо указывать в описании КТ-исследования: локализуется ли патологический участок непосредственно в глубине органа, под капсулой, рядом с крупными сосудами, с желчными протоками, с желчным пузырем и т. д. Это может быть навести на мысли о его природе: например, билиарные кисты локализованы чаще всего вблизи желчных протоков, вблизи желчного пузыря.
7) Количество. Солитарный очаг в печени означает одиночный. Число патологических участков (например, метастазов при раке желудка или других органов системы пищеварения) может варьировать. Выявление одного метастаза уже позволяет выставить стадию M1 по системе TNM. Однако следует учитывать, что множественные очаговые образования в печени – это не всегда метастазы, и врач-рентгенолог обязан провести их дифференциальную диагностику, сопоставив многочисленные КТ-признаки.
8) Особенности накопления контраста. Чем меньше накопление контраста в очаге, тем меньше он кровоснабжается. Наоборот, чем быстрее накапливается контраст, тем более развита сосудистая сеть. Чем быстрее снижается плотность после окончания введения контраста, тем интенсивнее кровоток в очаге.
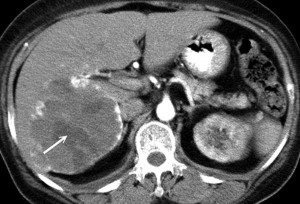
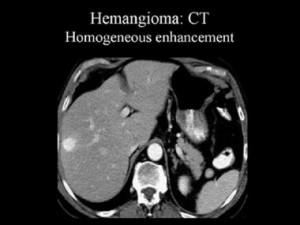
Так, гемангиома печени на КТ без контраста выглядит как гиподенсный участок, природу которого установить затруднительно. В артериальную фазу контрастирования наблюдается значительное увеличение плотностных характеристик гемангиомы (из-за накопления контрастированной крови в сосудистых лакунах), но затем ее плотность снижается и постепенно приходит к прежним значениям, что позволяет отличить гемангиому печени от рака, так как злокачественные новообразования, например, рак кишечника с метастазами в печень при КТ с контрастированием проявляется иначе: для метастазов наиболее характерно усиление плотности в виде «кольца» («ободка»), которое отображает активную (васкуляризованную) часть опухоли.
Гемангиома печени или рак? КТ брюшной полости с контрастным усилением: типичное накопление контраста в виде лакун помогает дифференцировать гемангиому от рака и установить правильный диагноз: кавернозная гемангиома.
ГИПОДЕНСНЫЙ ОЧАГ ПЕЧЕНИ
Гиподенсные образования имеют плотность ниже нормальной паренхимы (в норме ее плотность составляет +50…+70 единиц Хаунсфилда – без контрастирования) и представляют собой следующие морфологические варианты:
2) Гиподенсный очаг плотностью 0…+20 единиц Хаунсфилда чаще всего содержит жидкость. Это может быть простая или паразитарная киста, билома – скопление желчи после операций на желчном пузыре и протоках, а также кистозные метастазы.
3) Гиподенсный очаг плотностью +20…+40 единиц Хаунсфилда бывает обусловлен как жидкостным содержимым, так и мягкотканным. Здесь гораздо больше вариантов, при составлении дифференциального ряда нужно учитывать размеры, форму, характер накопления контрастного вещества.
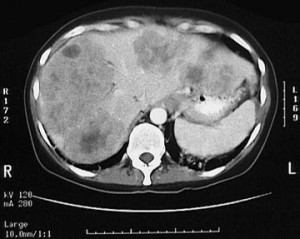
Капиллярная гемангиома правой доли печени: КТ с контрастным усилением в артериальную фазу выявляет гиперденсный участок.
ГИПЕРДЕНСНЫЙ ОЧАГ В ПЕЧЕНИ
Гиперденсные очаги имеют рентгеновскую плотнтость выше нормальной паренхимы (>70 единиц Хаунсфилда) и могут быть обусловлены кистами, содержащими плотную жидкость (с примесями белка или крови), либо их субстратом является опухоль или кальцинат.
1) Очаг плотностью +200…+400 единиц Хаунсфилда обусловлен наличием кальция в структуре. Это может быть обызвествленная киста, фиброма, фиброаденома (либо другая опухоль), обызвествленная гематома.
2) Локальный участок повышения плотности паренхимы зачастую бывает обусловлен отложениями металлов – солей алюминия, железа и т.д.
3) Опухоли бывают как гиперденсными, так и гиподенсными.
КИСТОЗНЫЕ ИЗМЕНЕНИЯ ПЕЧЕНИ
Кистозный характер при КТ имеют следующие образования:
1) Простая киста печени — что это? Простая киста возникает в результате эмбриогенеза и представляет собой ограниченное капуслой скопление жидкости. На КТ она имеют ровные края, четкие контуры, обычно правильную форму; плотностные характеристики жидкости +5…+20 единиц Хаунсфилда, не содержит каких-либо включений (кровь, кальций и т. д.), в их структуре нет перегородок, стенка ровная, без локальных утолщений. Контраст такие кисты не накапливают. Часто возникает вопрос, может ли киста печени перерасти в рак. Если киста имеет типичные КТ-характеристики, тревоги она вызывать не должна, озлокачествления кисты не бывает. Но важно отличить простую кисту от эхинококковой, от кистозной формы метастаза или кистозного рака.
2) Кистозные метастазы в печень при раке молочной железы, желудка, других органов обычно множественные, имеют неправильную форму, неоднородную структуру, размеры от 0,5 см до нескольких десятков см. Характеризуются накоплением контраста в виде «кольца». Обладают инфильтративным ростом. Подозрение на mts в печени возникает при КТ нередко, в таких случаях может помочь второе мнение по снимкам. В наше время множественные метастазы нередко успешно лечатся в крупных онкологических клиниках, где применяются различные методики (хирургическое удаление, химиоэмболизация, радиочастотная абляция и т.п.).
3) Кистозная форма гепатоцеллюлярного рака: форма неправильная, может выявляться солидный компонент (при кистозной форме он выражен минимально), опухоль единичная, оказывает объемное воздействие на рядом расположенные сосуды и желчные протоки.
4) Паразитарные кисты. Чаще всего эти кисты представлены эхинококком, реже – альвеококком. Бывают множественными или единичными, имеют хорошо видимую стенку, усиливающуюся при контрастировании. Бывают однокамерные и многокамерные паразитарные кисты. Внутри таких кист можно обнаружить паразита.
5) Гемангиома правой доли печени, либо левой доли. Гемангиома печени на КТ выглядит как типичный гиподенсный очаг, при контрастировании в артериальную фазу резко усиливается, в результате чего становятся видимыми сосудистые лакуны, а затем медленно теряет контраст. Атипичные гемангиомы на КТ имеют несколько другие характеристики, и отличить их от злокачественного поражения помогает взгляд опытного рентгенолога, имеющего опыт в диагностике заболеваний брюшной полости.
Вторичные (секундарные) изменения в печени на КТ. Рак кишечника с метастазами. Прогноз неблагоприятный, учитывая размеры и количество метастазов.
СОЛИДНЫЕ ОБРАЗОВАНИЯ ПЕЧЕНИ
«Солидный» означает мягкотканный, состоящий из живой ткани. Какие бывают солидные образрования?
1) Объемное образование с включениями жира: липома, липофиброма, ангиолипома, липосаркома и др. Имеют характерную структуру и плотностные характеристики, соответствующие жировой ткани.
2) Фокальная нодулярная гиперплазия (ФНГ) имеет неправильную форму (в виде узла), при нативном исследовании – гиперденсный (незначительно выше нормальной плотности), при контрастировании неравномерно усиливается.
3) Регенераторный узел, локальный участок фиброза либо жировой инфильтрации – признак перерождения печеночной ткани под влиянием различного характера интоксикацией или травм, признак цирроза. Выглядит как локальный гипо- (жировая инфильтрация) или гиперденсный (фиброз) участок.
4) Гепатоцеллюлярный рак (ГЦР). Выглядит как объемное образование неправильной формы, различных размеров (иногда несколько десятков сантиметров в поперечнике), структура его неоднородна – при КТ могут быть выявлены участки некроза, полости (не усиливающиеся при контрастировании). Ткань опухоли за счет хорошего кровоснабжения повышает плотность при контрастировании.
Сделать КТ печени в Санкт-Петербурге
ВТОРОЕ МНЕНИЕ ВРАЧА
Не все специалисты способны достоверно определить изменения в печени, выявленные при компьютерной томографии. Это во многом зависит от опыта рентгенолога, от качества выполнения исследования. К сожалению, при выполнении компьютерной томографии и других лучевых исследований (особенно в отдаленных периферийных клиниках) изменения иногда бывают пропущены, либо неверно истолкованы. Можно ли перепутать метастазы в печени? Увы, нередко обычные доброкачественные гемангиомы трактуются как метастазы, либо наоборот. В ряде случаев кистозные метастазы в печень трактуются как простые кисты, если к тому же не использовать контрастирование. В целом нужно отметить, что диагноз «mts печени» достаточно сложный в плане дифференцировки с другими множественными очаговыми изменениями.
Второе консультативное мнение врача, обладающего опытом в анализе КТ-исследований брюшной полости, всегда полезно – заключение по исследованию даст специалист, имеющий высшую врачебную категорию или научное звание, после подробного ознакомления с историей заболевания, с результатами лабораторных тестов и т. д. В результате точность диагностики становится выше, что позволяет определиться с дальнейшим направлением лечения (либо назначить дополнительные инструментальные и иные диагностические исследования).
Чтобы получить Второе мнение по результатам КТ или МРТ, можно обратиться в Национальную телерадиологическую сеть. Сделать это можно удаленно, не выходя из дома. Достаточно иметь результаты исследования на диске. В течение 24 часов с момента отправки снимков вы получите квалифицированный пересмотр КТ или МРТ с подробным описанием в виде заключения с подписью высококвалифицированного диагноста.