гиперметаболическое образование что это такое
Гиперметаболическое образование что это такое
Австрийское общество клинического питания (АКЕ Recommendations) предлагает следующую классификацию степени выраженности синдрома гиперметаболизма-гиперкатаболизма, основанную на определении потерь азота:
— легкая катаболическая реакция: потери азота не более 6 г /сутки;
— катаболизм средней степени: потери азота 6—12 г/сут;
— тяжелая катаболическая реакция характеризуется потерями более 12 г/сут азота (что соответствует потерям 75 г белка).
Уровень метаболизма можно также определить, ориентируясь на ТМТ (тощую массу тела), в т.ч. рассчитанную (при невозможности уточнения другими способами) по данным экскреции креатинина: ТМТ = 0,29 х ФЭК +7,39, где ФЭК — фактическая экскреция креатинина.
Уменьшение ТМТ свидетельствует о преобладании катаболизма (т.е. является признаком синдрома гиперметаболизма).
Полученные сведения позволяют предварительно сориентироваться в объеме субстратно-энергетического обеспечения, срочно необходимого пациенту.
После определения структуры потребностей для выбора алгоритма нутритивного лечения необходимо определить возможности организма по усвоению нутриентов с использованием различных путей их введения (функциональные возможности органов, лимитирующих гидролиз, всасывание, транспорт по сосудистому руслу и межуточный обмен вводимых компонентов — печени, почек, сердечно-сосудистой системы, кишечника).
Иными словами, для определения объема и структуры нутритивной коррекции (парентеральной, энтеральной, чрезжелудочной, сипинговой или смешанной) оценивают не только метаболические нарушения, степень белково-энергетической недостаточности, дизэлектролитемии, волемических нарушений и сдвигов КОС, выраженность нарушений витаминного обмена, но и состояние лимитирующих органов (синтетическую функцию печени, дезинтоксикационные возможности печени и почек, возможности сосудистого русла и, несомненно, пищеварительно-транспортного аппарата по перевариванию и всасыванию вводимых нутриентов, его двигательную активность). Используемые для этого методы могут быть достаточно стандартными и имеются в любом стационаре.
Полученные данные позволяют с той или иной степенью достоверности определить собственно степень недостаточности питания с ее балльной оценкой. Предложены и другие ориентированные на практику (с различной степенью уточненности) схемы определения недостаточности питания.
Обобщая полученные при уточнении критериев алиментационно-волемического диагноза данные, удается охарактеризовать не только статические, но и функциональные параметры, в том числе трофологической недостаточности, а также уточнить возможности их коррекции с учетом степени сохранности обеспечивающих метаболизм органов и тканей.
У больных с заболеваниями органов пищеварения определение функции лимитирующих органов наиболее важно, так как практически всегда приходится работать в условиях несостоятельности какого-нибудь из них.
Таким образом, для четкого определения тактики проведения нутриционной коррекции необходимы и методы функциональной системной метаболической оценки организма и органов, лимитирующих усвоение нутриентов.
Выставляя алиментационно-волемический диагноз, помимо волемических и электролитных проявлений, оценивают также функции лимитирующих органов (печени, почек, сердца и особенно при данной патологии — функцию кишечника), ориентируясь как на клинико-биохимические тесты, в т.ч. характеризующие переваривание и всасывание (в частности, по параметрам биоэлектрической активности, копрограмме, КЦЖК в копрофильтрате и др.). При этом важна и оценка функциональной способности резервуара (при его наличии).
Весьма интересен в этом смысле коэффициент резервуарной функции — численное отношение суммарного времени пассажа бария по желудку и тонкой кишке ко времени транзита от момента заполнения резервуарной конструкции до дефекации контрастной взвесью, описанное в кн. Г.К. Жерлова, С.Р. Баширова, А.И. Рыжова (2004). По данным этих авторов, в ранние сроки соотношение участия в замедлении пассажа вышележащих отделов кишечника и резервуара приближается к 1, через 1 год соответствует 1:6.
По нашим данным, при соотношении уже 1:5—1:6 можно обеспечивать практически полностью белково-энергетические потребности организма без дополнительной парентеральной коррекции.
Однако периодически (2—3 раза в год) необходим контроль за активностью микробиоты кишечника. Это позволяет обеспечить исследование КЦЖК в копрофильтрате, т.к. при формировании «низкого» илеоректального анастомоза, при удалении ректосигмоидного перехода возникает угроза транслокации (во время акта дефекации каловые массы поднимаются вверх, что приводит не только к дискомфорту, но и к эндотоксикации).
Поэтому Визнер А.Ф. рекомендует хирургам при восстановлении непрерывности желудочно-кишечного тракта при удалении сигморектального сфинктера имитировать его искусственное подобие.
При проведении алиментации исследование активности микробиоты важно с точки зрения своевременного введения фармаконутриентов: при избыточной активности, избыточном обсеменении — использование нифуроксазида, при нормальной активности в период адаптации целесообразно применение пищевых составов, максимально всасывающихся в верхних отделах кишечника (химусоподобные смеси: нутрихим и аналоги).
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Что такое метаболический синдром? Причины возникновения, диагностику и методы лечения разберем в статье доктора Чернышев А. В., кардиолога со стажем в 26 лет.
Определение болезни. Причины заболевания
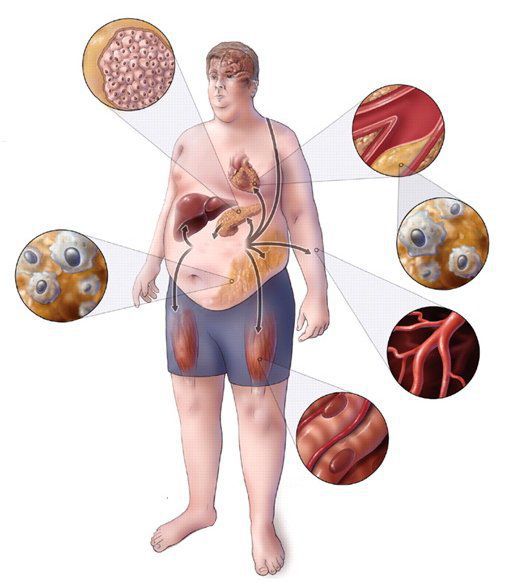
Метаболический синдром (синдром Reaven) представляет собой симптомокомплекс, сочетающий в себе абдоминальное ожирение, инсулинорезистентность, гипергликемию (повышенное содержание глюкозы в крови), дислипидемию и артериальную гипертензию. Все эти нарушения связаны в одну патогенетическую цепь. Кроме того, такой синдром часто сочетается с гиперурикемией (избытком мочевой кислоты в крови), нарушением гемостаза (свёртываемости крови), субклиническим воспалением, синдромом обструктивного апноэ-гипопноэ сна (остановкой дыхания во сне). [4]
Метаболический синдром – хроническое, распространённое (до 35% в российской популяции), полиэтиологическое заболевание (возникающее по многим причинам), в котором главная роль принадлежит поведенческим факторам (гиподинамия, нерациональное питание, стресс). Имеет значение также наследственная предрасположенность к артериальной гипертензии, атеросклероззависимым заболеваниям и сахарному диабету второго типа. [5]
Практикующим врачам важно выделять группу риска метаболического синдрома. К данной группе относятся пациенты с начальными признаками заболевания и его осложнениями: артериальная гипертензия, углеводные изменения, ожирение и повышенное питание, ишемическая болезнь сердца, атеросклеротические заболевания периферических и мозговых артерий, нарушение пуринового обмена, жировая болезнь печени; синдром поликистозных яичников; постменопаузальный период у женщин и эректильная дисфункция у мужчин; гиподинамия, злоупотребление алкоголем, табакокурение, наследственная отягощенность по сердечно-сосудистым и обменным заболеваниям. [3] [7]
Симптомы метаболического синдрома
Клинические проявления метаболического синдрома соответствуют симптомам его составляющих:
Если изменения составляющих синдрома Reaven носят субклинический характер (что встречается довольно часто), то и течение заболевания носит асимптомный характер.
Патогенез метаболического синдрома
Инсулинорезистентность — первопричина развития метаболического синдрома. Представляет собой нарушение утилизации глюкозы в органах-мишенях (поперечнополосатой мускулатуре, липоцитах и печени), связанное с дисфункцией инсулина. Инсулинорезистентность уменьшает усвоение и поступление в клетки скелетной мускулатуры глюкозы; стимулирует липолиз и гликогенолиз, что приводит к липидным и углеводным патологическим изменениям. Кроме того, инсулинорезистентность усиливает секрецию инсулина, в результате чего возникает компенсаторная гиперинсулинемия и активация эндокринных систем (симпатоадреналовой, ренин-ангиотензин-альдостероновой) с формированием артериальной гипертензии, дальнейшим нарушением метаболических процессов, гиперкоагуляции, субклинического воспаления, дисфункции эндотелия и атерогенеза. Эти изменения, в свою очередь, способствуют усилению инсулинорезистентности, стимулируя патогенетический «порочный круг».
Классификация и стадии развития метаболического синдрома
Чёткой классификации и стадийности метаболического синдрома не существует. Его деление некоторыми авторами на полный, включающий все составляющие синдрома, и неполный представляется необоснованным. Несмотря на это, выраженность симптомов, количество компонентов синдрома Reaven и наличие осложнений оказывают влияние на стратификацию риска и выбор тактики лечения у конкретного пациента. Для этого следует учитывать:
В зависимости от индекса массы тела (ИМТ), который рассчитывается делением веса (кг) на рост (м 2 ), классифицируются следующие типы массы тела (МТ):
Второй тип ожирения является более патогенным в плане риска возникновения сердечно-сосудистых заболеваний и сахарного диабета. Это связано с ожирением внутренних органов, в том числе печени (висцеральное ожирение, неалкогольная жировая болезнь печени), снижением сатурации крови кислородом из-за перехода дыхания на грудной, поверхностный тип и эндокринной активностью висцеральной жировой ткани с патологическим изменением выработки адипокинов (лептин, грелин, адипонектин). Выявлена чёткая корреляция между увеличением абдоминальной жировой ткани и индекса массы тела с риском сопутствующих заболеваний. Считается, что риски начинают нарастать при увеличении окружности талии (ОТ) >80 см у женщин и 94 см у мужчин, а при ОТ >88 см и 102 см соответственно риск возрастает значительно.
Центральным патологическим звеном метаболического синдрома является изменение углеводного обмена. Концентрацию глюкозы оценивают в капиллярной крови (норма 1
жен. >1,2
Осложнения метаболического синдрома
Диагностика метаболического синдрома
Для диагностики метаболического синдрома необходимо выявить у пациента основной признак — абдоминальное ожирение по измерению ОТ (>80 см у женщин и >94 см у мужчин) и хотя бы два дополнительных критерия, которые включают в себя:
В клинических условиях нужно дифференцировать метаболический синдром от механического сочетания факторов риска, например артериальной гипертензии, избыточной массы тела без признаков абдоминального ожирения и повышения уровня ОХ крови, что встречается довольно часто (до 30%). В сомнительных случаях рекомендовано дополнительное определение инсулинорезистентности по следующим методикам:
Лечение метаболического синдрома
Лечение метаболического синдрома следует разделить на немедикаментозное и медикаментозное.
Медикаментозное лечение метаболического синдрома, в зависимости от наличия тех или иных его компонентов, может включать гиполипидемические, антигипертензивные препараты, медикаменты для снижения инсулинорезистентности, постпрандиальной гипергликемии и веса.
Основными препаратами, которые используют при лечении артериальной гипертензии у больных синдромом Reaven и сахарным диабетом, являются ингибиторы ангиотензинпревращающего фермента, сартаны и агонисты имидазолиновых рецепторов. Однако для достижения целевого уровня артериального давления часто необходимо сочетание различных классов медикаментов, таких как пролонгированных блокаторов медленных кальциевых каналов, высокоселективных бета-адреноблокаторов и тиазидоподобных диуретиков (индапамид) в сочетании с медикаментами первой линии. [10]
При неэффективности монотерапии статинами целесообразно присоединение эзетрола в дозе 10 мг/сут, который препятствует всасыванию ОХ в кишечнике и может усиливать снижение ХС-ЛПНП на 15-20%.
Фибраты — ещё один класс липидснижающих препаратов. Они расщепляют богатые триглицеридами жировые частицы, снижают синтез свободных жирных кислот и повышают ХС-ЛПВП путём увеличения распада ЛНП. Это приводит к значительному уменьшению триглицеридов (до 50%), ХС-ЛПНП (до 20%) и увеличению ХС-ЛПВП (до 30%). Фибраты также имеют плейотропные эффекты: снижают концентрацию мочевой кислоты, фибриногена и улучшают инсулиночувствительность, однако их положительное влияние на прогноз пациентов не доказано. Наиболее эффективный и безопасный препарат этой группы — фенофибрат 145 мг/сут.
Для снижения инсулинорезистентности препаратом выбора является метформин, который обладает доказанным положительным эффектом на тканевую инсулинорезистентность через усиление поглощения глюкозы тканями-мишенями. Метформин уменьшает скорость всасывания углеводов в тонкой кишке, оказывает периферическое анорексигенное действие, уменьшает продукцию глюкозы печенью, улучшает транспорт глюкозы внутри клеток. Положительное воздействие метформина (1500-3000 мг/сутки) на конечные точки обусловлено снижением инсулинорезистентности, системными метаболическими эффектами (снижение веса, липидных нарушений, факторов свёртываемости крови и т.д.). [9]
При наличии у пациента с синдромом Reaven сахарного диабета второго типа могут применяться современные классы сахароснижающих препаратов, такие как аналог глюкагоноподобного пептида-1, ингибитор дипептидилпептидазы-4 и ингибитор натрийзависимого переносчика глюкозы второго типа. Представитель последнего класса эмпаглифлозин (Джардинс) в исследовании EMPA-REG OUTCOME (2016 год) снизил сердечно-сосудистую смертность у больных сахарным диабетом второго типа на 36%.
Медикаментозная коррекция морбидного ожирения показана, если немедикаментозное лечение не приводит к снижению массы тела более чем на 5% от исходного. Препараты для лечения ожирения делятся на аноретики центрального действия (сибутрамин), и средства, воздействующие на желудочно-кишечный тракт, например орлистат (Ксеникал).
Препарат для снижения аппетита сибутрамин в меньшей степени воздействует на дофаминовые и холинергические процессы, но уменьшает потребление жиров и углеводов, что приводит к похудению и улучшает жировой и углеводный метаболизм. Артериальное давление и частота сердечных сокращений при этом повышается только на 5%.
Орлистат является ингибитором желудочной и панкреатической липаз, вследствие чего треть пищевых триглицеридов не всасывается и снижается их концентрация в крови, что приводит к уменьшению калоража пищи и веса. Кроме того, снижается артериальное давление, уровень глюкозы и инсулинорезистентности.
В медицинской практике лечение метаболического синдрома зависит от наличия и выраженности его компонентов. В таблице ниже показана тактика подбора терапии при вариантах синдрома Reaven, которые встречаются наиболее часто.
Диагностика рака легких методом ПЭТ-КТ
Содержание1 Гиперметаболизм1.1 Причины гиперметаболизма, предрасполагающие факторы1.2 Классификация1.3 Осложнения1.4 Симптомы, диагностика1.5 Лечение гиперметаболизма1.6 Первая помощь1.7 Профилактика2…
Вопрос №1. Что такое исследование «всего тела»?
Исследование «всего тела» заключается в сканировании пациента от уха до верхней трети бедра. Т.е. в область исследования будут включены голова (частично, от козелка уха, без захвата головного мозга), шея, органы грудной полости, брюшной полости, малого таза и костная система (без верхних и нижних конечностей).
Сканирование нижних конечностей проводится за дополнительную плату.
Гиперметаболизм
Гиперметаболизм нередко сопровождает тяжелые патологии, усугубляя их течение. Состояние требует полноценного лечения, поскольку грозит серьезными осложнениями, в отдельных случаях – летальным исходом.
Гиперметаболизм не выделяют в отдельную патологию, он является синдромом и следствием различных заболеваний. Второе название – гиперкатаболизм. Эти состояния объединяются под названием синдром гиперметаболизма-гиперкатаболизма.
В организме происходит усиленный распад питательных веществ вследствие увеличивающейся потребности в энергии. Гиперметаболизм является ответом на патологический процесс, который происходит в теле пациента.
Чаще это характерно для распространенной воспалительной реакции, но любое тяжело протекающее соматическое заболевание способно привести к усиленному обмену веществ.
Причины гиперметаболизма, предрасполагающие факторы
Считается, что гиперметаболизм является одним из симптомов полиорганной недостаточности. Данное состояние может быть следствием большого количества патологий:
Усиленный обмен веществ характерен для злокачественных опухолей, поскольку раковые клетки являются ловушкой для глюкозы. Синдром гиперметаболизма-гиперкатаболизма также встречается при тяжелых травмах и политравмах, синдроме длительного сдавления.
Классификация
Гиперкатаболизм классифицируется согласно уровню потери азота организмом. По этому критерию выделяют:
Осложнения
Одно из осложнений – белково-энергетическая недостаточность. Она проявляется гипотрофией мышечной и жировой ткани, ухудшением качества кожи, сухостью слизистых оболочек, отечностью, апатией. Симптомы недостаточности различных органов только усугубляются. При неоказании помощи в полном объеме пациентам грозит летальный исход.
Усиленный метаболизм приводит к анемии, гиповитаминозам, снижению активности системы иммунитета. Последнее состояние уменьшает резистентность организма к патогенам, что способствует повторному инфицированию. Возможна даже такая патология, как суперинфекция, которая тяжело поддается терапии.
Симптомы, диагностика
Как указывалось, гиперметаболизм является следствием основной патологии. У пациентов с усиленным обменом веществ отмечается снижение массы тела с гипотрофией мышечной и жировой ткани.
Отмечается дефицит всех питательных вещества в организме – белков, жиров и углеводов. У пациентов отмечается выпадение волос, сухость кожи и слизистых, миалгии, раздражительность, нарушения работы сердца и сосудов.
Больные испытывают повышенное чувство голода и жажды, тремор верхних конечностей, скачки температуры и повышенное потоотделение, головные боли и головокружения. Также у пациентов бывают запоры и снижение диуреза.
Симптоматика зависит от основной патологии. У пациентов могут иметь место нарушения сердечного ритма и проводимости, акта дыхания. Также ускоренный катаболизм негативно сказывается на когнитивных функциях человека, нередко развивается токсическая энцефалопатия, признаки которой проходят по мере выздоровления больного.
Для диагностики значение имеет анамнез, общий осмотр пациента. Проводится развернутый общий анализ крови и мочи, биохимия крови с обязательным определением уровня мочевины и креатинина.
В случае системной воспалительной реакции пациентам может назначаться посев крови для выявления патогенов, реакции ПЦР. Последний метод позволяет выявить генетический материал возбудителей заболеваний и является наиболее точным.
Лечение гиперметаболизма
Терапия направлена на лечение основного заболевания, чаще всего проводится в стационарах.
Для компенсации дефицита питательных веществ назначают оральную регидратацию (Гидровит, Регидрон), прием ферментных лекарственных средств (в тяжелых случаях вводят макронутриенты), витаминных комплексов.
В качестве дополнительных препаратов используются НПВС (Ибуклин, Нимесулид, Кеторолак), железосодержащие средства, антидепрессанты (Стимулотон, Алевал, Грандаксин), нейропротекторы (Мексидол, Нейрокс). Для улучшения работы сердечно-сосудистой системы применяется Предуктал.
Первая помощь
Синдром гиперметаболизма представляет угрозу для жизни пациента, но, несмотря на это, экстренная помощь не требуется. Критические состояния развиваются постепенно, спонтанных катастроф в таких случаях не бывает. Все, что необходимо, – раннее обращение к врачу и лечение в полном объеме.
Профилактика
Специфических методов профилактики гиперметаболизма не существует. При развитии признаков заболевания важно посетить врача, который проведет диагностику, выставит верный диагноз и определит эффективную тактику лечения.
Гасанова Сабина Павловна
Что такое метаболизм?
Метаболизм – это группа сложных процессов в организме, превращающих калории из пищи в полезную для жизнедеятельности человека энергию. Он зависит от:
На скорость усвоения пищи действуют разные факторы. Например, находясь в стрессовом состоянии, организм начинает вырабатывать кортизол, замедляющий пищеварительные процессы, и стимулирует запасание жировых отложений.
Внимание! Под метаболизмом подразумевают разные процессы – от переваривания сытного завтрака до дыхания во время сна, когда тело без участия мозга транспортирует кислород в органы.
Следует понимать, что у метаболизма нет скорости, а значит его классификации на медленный, нормальный и быстрый также не существует. Это обуславливается тем, что его скорость невозможно измерить. Но даже если бы это и было возможным, нет никаких эквивалентных единиц измерения, которыми можно было бы эту скорость описать.
Стадии рака легкого
В первичном обследовании пациента, страдающего раком легкого, должны принимать участие несколько специалистов: опытный рентгенолог, специалист по ядерной медицине (радионуклидным методам — сцинтиграфии и ПЭТ), рентгенохирург (специалист в области интервенционной радиологии), пульмонолог, торакальный хирург; необходимо также использовать точные и экономически эффективные методы диагностики. Существующие на данный момент руководства содержат рекомендации, что методы нужно выполнять любому пациенту, у которого имеется высокий риск рака, предпочтительно с выполнением гистологического исследования и взятием образцов ткани. Это позволяет не только установить точный гистологический вариант опухоли, но и правильно стадировать заболевание. Во многих случаях предпочтительнее выполнить биопсию подозрительных лимфоузлов средостения, а не первичной опухоли, что позволяет лучше оценить стадию (например, при биопсии лимофузла с выполнением ПЭТ ставится стадия T2N2, в то время как без ее использования – T2Nx). Кроме того, для опухолей, осложненных обструктивной пневмонией, и образований с выраженными некротическими изменениями, данные играют важную роль для определения области биопсии.
Опухоль левого легкого с частичным некрозом и деструкцией ребер. Визуализируются два метастаза в подключичных лимфоузлах и в мышцах (стрелки), которые на КТ не видны. Необходимо выполнить трансторакальную биопсию той части опухоли, которая расположена в периферических отделах, чтобы получить образец жизнеспособных тканей.
Классификация
Гиперкатаболизм классифицируется согласно уровню потери азота организмом. По этому критерию выделяют:
Патофизиология
Осложнения
Одно из осложнений – белково-энергетическая недостаточность. Она проявляется гипотрофией мышечной и жировой ткани, ухудшением качества кожи, сухостью слизистых оболочек, отечностью, апатией. Симптомы недостаточности различных органов только усугубляются. При неоказании помощи в полном объеме пациентам грозит летальный исход.
Усиленный метаболизм приводит к анемии, гиповитаминозам, снижению активности системы иммунитета. Последнее состояние уменьшает резистентность организма к патогенам, что способствует повторному инфицированию. Возможна даже такая патология, как суперинфекция, которая тяжело поддается терапии.
Часто задаваемые вопросы — Отделение позитронной эмиссионной томографии (ПЭТ)
Исследование «всего тела» заключается в сканировании пациента от уха до верхней трети бедра. Т.е. в область исследования будут включены голова (частично, от козелка уха, без захвата головного мозга), шея, органы грудной полости, брюшной полости, малого таза и костная система (без верхних и нижних конечностей).
Сканирование нижних конечностей проводится за дополнительную плату.
Вопрос №2. Что такое радиофармпрепарат?
Радиофармпрепарат (РФП) – это соединение, состоящее из специального вещества и радионуклида (изотопа, радионуклидной метки). Специальное вещество отвечает за то, в каком органе накопится РФП, а радионуклидная метка позволяет врачу-диагносту увидеть это накопление на изображении.
В настоящее время для производства РФП используется очень широкий спектр как специальных веществ, так и радионуклидных меток. Во всем мире самым часто используемым у онкологических больных соединением специального вещества и радионуклидной метки является 18F-фтордезоксиглюкоза (18F-ФДГ). В данном соединении 18F выполняет функцию радионуклидной метки, ФДГ – специального вещества.
Вопрос №3. Что такое физиологическое накопление РФП?
Физиологическое накопление (гиперфиксация) РФП – это повышенное накопление РФП, определяющееся в различных органах и системах в норме.
Физиологическое накопление наблюдается при исследованиях со всеми РФП: 18F-ФДГ, 11С-холином, 11С-метионином, 68Ga-ПСМА и т.д. В зависимости от типа РФП меняется лишь местоположение физиологической гиперфиксации.
Например, при ПЭТ и ПЭТ/КТ с самой часто используемой 18F-ФДГ физиологическое накопление РФП определяется в коре головного мозга, ротоглотке, носоглотке, мышцах гортаноглотки, миокарде левого желудочка, чашечно-лоханочных системах почек, фрагментарно по ходу петель толстой кишки, мочевом пузыре.
| Физиологическое накопление 18F-ФДГ в коре головного мозга. |
| Физиологическое накопление 18F-ФДГ в ротоглотке. |
| Физиологическое накопление 18F-ФДГ в мышцах гортаноглотки. |
| Физиологическое накопление 18F-ФДГ в миокарде левого желудочка. |
| Физиологическое накопление 18F-ФДГ в чашечно-лоханочных системах почек. |
| Физиологическое накопление 18F-ФДГ по ходу петель толстой кишки. |
| Физиологическое накопление 18F-ФДГ в мочевом пузыре. |
Вопрос №4. Что такое патологическое накопление РФП?
Патологическое накопление РФП – это повышенное накопление РФП в органах и тканях, регистрирующееся при заболеваниях, чаще всего в злокачественных опухолях.
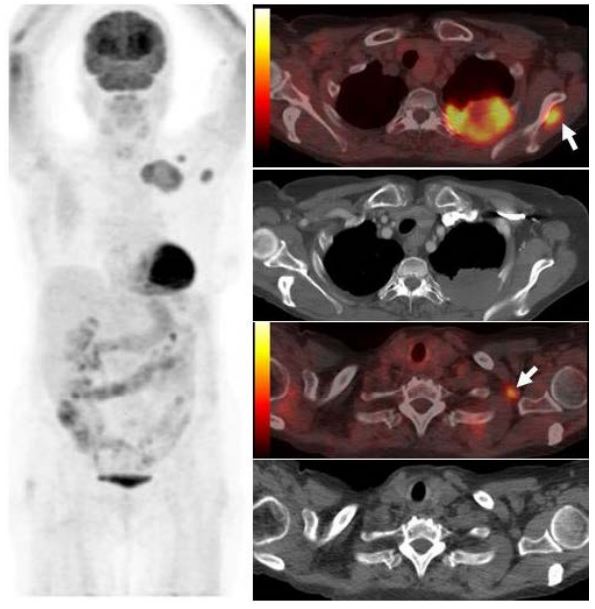
| Данные ПЭТ/КТ с 68Ga-DOTA-TATE у пациента с нейроэндокринной опухолью тощей кишки. В проекции злокачественной опухоли, расположенной в тощей кишке, определяется очаг патологической гиперфиксации РФП. |
| Данные ПЭТ/КТ с 11С-холином у пациента с раком предстательной железы. Состояние после простатэктомии. В костях скелета визуализируются множественные очаги патологического накопления РФП (метастазы). |
| Данные ПЭТ/КТ с 68Ga-ПСМА у пациента с местным рецидивом рака предстательной железы. Состояние после лучевой терапии. В левых отделах предстательной железы определяется очаг патологического накопления РФП. |
Вопрос №5. Что такое метаболически активное и метаболически неактивное образование?
Метаболически неактивное образование – это образование, которое не накопило РФП. Чаще всего отсутствие повышенного накопления РФП в опухоли свидетельствует о ее доброкачественной природе.
| Данные ПЭТ/КТ с 18F-ФДГ у пациента с метаболически неактивным образованием правого легкого (доброкачественная опухоль – гамартома). |
Метаболически активное образование – это образование, в котором накопился РФП в повышенном количестве. Повышенное накопление РФП в опухоли чаще всего свидетельствует о ее злокачественном характере.
| Данные ПЭТ/КТ с 11С-метионином у больного с метаболически активным образованием корня левого легкого (типичный карциноид). |
Вопрос №6. Что такое SUV?
SUV (Standardized Uptake Value, стандартизированный уровень захвата) – это величина, отражающая интенсивность накопления РФП в зоне интереса, например, в опухоли.
Показатель SUV рассчитывается программным комплексом автоматически и измеряется в различных единицах. В нашем Центре, как и в большинстве отечественных и зарубежных медицинских учреждений, где проводится позитронная эмиссионная томография, в качестве единиц измерения показателя SUV принято использовать г/мл (g/ml).
| Данные ПЭТ/КТ с 18F-ФДГ. Оконтуривание метаболически активной злокачественной опухоли левого легкого для измерения показателя SUV. В данном случае величина SUV в опухоли определяется на уровне 13,52 g/ml. |
Вопрос №7. Для чего используется величина SUV?
Величина SUV в основном используется для оценки ответа злокачественной опухоли на проведенное лечение. Важно подчеркнуть, что в ряде клинических ситуаций показатель SUV в опухоли является единственным критерием, позволяющим оперативно получить информацию о чувствительности образования к только что начатой терапии.
Если опухоль чувствительна к лечению, то уровень SUV в ней при повторном ПЭТ-исследовании будет снижаться, если нечувствительна или малочувствительна (резистентна, устойчива) – значение SUV останется без изменений или увеличится. Следует помнить, что своевременная диагностика устойчивости опухоли к лечению позволит скорректировать план лечения, а в некоторых случаях и радикально его изменить.
Как уже было сказано выше, для оценки эффективности терапии врач-радиолог оценивает динамику показателя SUV до и после лечения.
Существует четыре варианта метаболического ответа опухоли на проведенное лечение:
Результаты ПЭТ с 18F-ФДГ у пациента с диффузной В-клеточной крупноклеточной лимфомой до лечения (а), после 2 курса ПХТ (б) и через 13 месяцев после окончания терапии (в).
а – до лечения в средостении визуализируется массивное метаболически активное образование с уровнем SUV=12,6; б – после 4 курса ПХТ отмечается значительное уменьшение метаболического объема опухоли и снижение показателя SUV до 3,4 (достигнут частичный метаболический ответ, т.е. опухоль чувствительна к выбранной ПХТ);
в – через 13 месяцев после окончания ПХТ очагов патологической гиперфиксации РФП в проекции органов средостения не обнаружено (достигнут полный метаболический ответ).
Как это работает и почему происходит накопление ФДГ?
В двух словах:Глюкоза – это энергия! Всем клеткам нужна энергия, а клеткам опухоли энергия нужна особенно, ведь они быстро делятся, а для этого клеткам опухоли нужно много энергии. Поэтому опухолевые клетки накапливаю значительно большее количество глюкозы, а следственно и ФДГ. Поэтому при ПЭТ исследовании мы можем видеть где находятся опухолевые клетки.Необходимо отметить, что к сожалению данный препарат способен определить не все опухоли. Это зависит от характеристик опухоли. Например ФДГ великолепно работает при большинстве лимфом, многих опухолях легких, опухолях кишечника, молочной железы, меланжем и многих других, но диагностическая ценность ФДГ при раке предстательной железы крайне незначительна. Аналогичная ситуация с низкой диагностической значимостью ФДГ наблюдается при большинстве нейроэндокринных опухолей.Для диагностики ФДГ-негативных процессов применяют другие РФП, например Холин, меченый как фтором так и углеродом.Так же возможности аппарата ограничены и мы не можем выявить одну или несколько клеток. Разрешающая способность аппарата ограничена и ПЭТ исследование может визуализировать опухоли начиная от 4-6 миллиметров.
Диагностика
Количественное определение методом непрямой калориметрии, в отличие от уравнения Харриса-Бенедикта, необходимо для точного измерения РЗЭ у онкологических больных.
Электронный научный журнал Современные проблемы науки и образования ISSN 2070-7428

1 Конурбаев Т.Р. 1 1 АО «Республиканский диагностический центр» На базе Республиканского диагностического центра г. Астана, Челябинского областного клинического онкологического диспансера проведено клиническое, обсервационное, описательное исследование по типу сообщения о случае на примере 56 больных с диагнозом рак верхних отделов желудочно-кишечного тракта.
Локализация патологического процесса в пищеводе отмечена у 16 больных (28,5 %), локализация в желудке – у 40 больных (71,5 %). Целью работы явился анализ уровня коэффициента максимального накопления радиофармпрепарата18F-ФДГ при позитронно-эмиссионной томографии в зависимости от глубины инвазии опухолевого процесса, гистологической структуры и дифференцировки опухоли.
При анализе степени поглощения радиофармпрепарата (коэффициент SUVmax) в зависимости от протяженности поражения органа выявлено, что по мере увеличения размеров опухоли отмечается увеличение поглощения радиомодифицированной глюкозы, что свидетельствует о большей активности опухоли. Нами выявлено, что коэффициент SUVmax не зависел от гистологической структуры опухоли.
Так, наиболее низкое поглощение радиомодифицированной глюкозы отмечено при аденокарциноме, наибольшее при плоскоклеточном раке. При этом разница средних величин была статистически не значимой (р>0,05). Повышение уровня поглощения глюкозы по мере снижения степени дифференцировки опухоли связано с повышением активности онкологического процесса при низкой степени дифференцировки опухоли.
На основании полученных результатов сделан вывод, что коэффициент максимального поглощения радиофармпрепарата18F-ФДГ не зависит от глубины инвазии опухолевого процесса и гистологической структуры опухоли; а зависит от протяженности поражения органа и степени дифференцировки злокачественной опухоли. радиофарм препарат18F-ФДГ.позитронно эмиссионная томография 1. Гранов А.М.
ПЭТ в онкологической клинике / А.М. Гранов, Л.А. Тютин, Костеников // Материалы Х Российского онкологического конгресса. – 2006. – С.46-49.
2. Рязанов В.В., Шевкунов Л.Н. Возможности совмещенной позитронно-эмиссионной и компьютерной томографии в дифференциальной диагностике и стадировании первично выявленных образований пищевода и желудка / В.В.Рязанов, Л.Н.
Шевкунов // Материалы Х Российского онкологического конгресса. – 2006. – С.212.
3. Труфанов Г.Е. Совмещенная позитронно-эмиссионная и компьютерная томография (ПЭТ-КТ) в онкологии / Г.Е. Труфанов, В.В. Рязанов, Н.М. Дергунова и др. – М.: ЭЛБИ-СПб, 2005. – С. 126.
4. Тюляндин С.А. Рациональная тактика лечения операбельного рака пищевода / С.А.
Тюляндин // Материалы Х Российского онкологического конгресса. – 2006. – С.85-87.
5. Хамзабаев Ж.Х. Лучевая диагностика в онкологии: Современное состояние и перспективы развития / Ж.Х. Хамзабаев // Астана медициналық журналы. – 2012. – № 3(71). – С.22-25.
6. Шаназаров Н.А. Мультидисциплинарный подход к лечению больных с местнораспространенным раком желудка / Н.А. Шаназаров: Автореф. дис.
… д-ра мед. наук. – 2010. – 48 с. 7. Brucher B.L. Neoadjuvant therapy of esophageal squamous cell carcinoma: response evaluation by positron emission tomography/ B.L. Brucher, W. Weber, M. Bauer // Ann Surg. – 2001. – № 233. – Р. 300-309.
8. Lordick F.
PET to assess early metabolic response and to guide treatment of adenocarcinoma of the oesophagogastric junction: the MUNICON phase II trial / F. Lordick, K. Ott, B.J. Krause // Lancet Oncol. – 2007. – № 8. – Р.797-805.
9. Ott K. Fluorodeoxyglucose-positron emission tomography in adenocarcinomas of the distal esophagus and cardia / K. Ott, W.A. Weber, U. Fink // World J Surg. – 2003.
– № 27. – Р.1035-1039.
10. Ott K. Metabolic imaging predicts response, survival, and recurrence in adenocarcinomas of the esophagogastric junction / K. Ott, W.A. Weber, F. Lordick // J ClinOncol. – 2006. – № 24. – Р.4692-4698.
11. Wieder H.A. Time course of tumor metabolic activity during chemoradiotherapy of esophageal squamous cell carcinoma and response to treatment / H.A. Wieder, B.L.
Brucher, F. Zimmermann // J ClinOncol. – 2004. – № 22. – Р.900-908.
Актуальность проблемы. В настоящее время большинство онкобольных нуждаются в комбинированном лечении [4,6]. Наблюдаемые у ряда больных неудачи побудили в последнее время шире прибегать к выбору тактики лечения в зависимости от оценки распространенности процесса [3].
Происходит постоянная оптимизация методов для оценки распространения заболевания у пациентов с опухолями пищевода и желудка. Компьютерная томография (КT) представляет стандарт в определении инвазии опухоли. КТ является неинвазивным и наименее дорогостоящим из доступных методов, но имеет серьезные ограничения в плане точной постановки диагноза [5].
Позитронно-эмиссионная томография (ПЭТ) также является неинвазивным, но предоставляет качественно иную информацию по сравнению с КТ, благодаря своей функции участия в метаболическом процессе опухоли, а не только определяя размер опухоли [1].
Многие исследователи показали, что снижение метаболической активности, измеренной значением стандартизированного накопления (SUV) на ПЭТ/КТ, в результате терапии является прогностически значимым критерием [7,9,10]. Следует отметить, что ПЭТ/КТ изображения были изучены у ограниченного количества больных и, согласно другим исследованиям, прогностическая ценность является сомнительной [8,11]. Тем не менее данные ПЭТ/КТ при злокачественных опухолях верхних отделов желудочно-кишечного тракта не были подтверждены [2] и требуют дальнейшего изучения.
Цель работы: выявить зависимость коэффициента максимального поглощения радиофармпрепарата18F-ФДГ от следующих характеристик опухолевого процесса – глубины инвазии опухолевого процесса, гистологической структуры опухоли и степени дифференцировки злокачественной опухоли.
Материалы и методы исследования. В исследование были включены 56 больных с установленным диагнозом или подозрением на злокачественную опухоль верхних отделов желудочно-кишечного тракта, в возрасте от 29 до 89 лет, проходивших обследование на базе отделения радиоизотопной диагностики АО «Республиканского диагностического центра» г.
Астана в период с 2010 по 2012 г. Основными критериями включения в исследование явились: наличие или подозрение на злокачественную опухоль желудка или пищевода; проведение позитронно-эмиссионной томографии, совмещенной с компьютерной томографией.
Локализация патологического процесса в пищеводе отмечена у 16 больных (28,5%), локализация в желудке – у 40 больных (71,5%). Всем больным проведено ПЭТ/КТ исследование на базе Республиканского Диагностического Центра г. Астана.
Позитронно-эмиссионный томограф, совмещенный с 16-срезовым компьютерным томографом GeminiGXL 16 фирмы Philips производства 2008 года.
Для проведения ПЭТ/КТ исследования на базе РДЦ создан производственный комплекс, включающий циклотрон «Cyclone 18/9» для производства короткоживущих изотопов, радиохимическая лаборатория для производства радиофармпрепаратов.
При проведении ПЭТ/КТ использовался радиофармацевтический препарат «Фтордезоксиглюкоза, 18F, раствор для внутривенного введения». Вводимая доза препарата зависела от площади поверхности тела исследуемого человека. Поверхность тела рассчитывалась по номограмме, исходя из веса и роста больного. Диагностическая доза препарата составляла 220 МБк на 1 м2 поверхности тела пациента; как правило, использовали 300–550 МБк на одно исследование. Препарат вводился внутривенно медленно в объеме 5,0–10,0 мл.
Результаты и их обсуждение. Нами проведен анализ показателя SUVmax в первичной опухоли и определена зависимость коэффициента SUVmax в зависимости от основных характеристик онкологического процесса, таких как глубина инвазии опухолевого процесса, гистологическая структура и дифференцировка опухоли.
Накопление фармпрепарата в первичной опухоли у больных со злокачественными новообразованиями верхних отделов желудочно-кишечного тракта варьировало от 2,1 до 13, в среднем составило 6,25±2,26.
Зависимость максимального накопления радиоизотопа глюкозы от глубины инвазии опухолевого процесса в стенку органа представлена на рисунке 1.
Рисунок 1. Коэффициент SUVmax в зависимости от глубины инвазии опухолевого процесса
Как видно из представленной диаграммы, максимальное накопление радиофармпрепарата не зависело от глубины инвазии стенки органа опухолевым процессом.
Наибольшие показатели накопления радиофармпрепарата в первичной опухоли отмечены при прорастании мышечного (Т2, n=27) и серозного (Т3, n=21) слоев.
Наиболее низкие показатели отмечены при поражении только слизистого слоя (Т1, n=3) и при прорастании в соседние органы (Т4, n=5). Полученные данные не имели статистически значимых различий (p=0,41).
Проведен анализ содержания радиофармпрепарата ФДГ 18F в зависимости от протяженности поражения органа. Полученные данные представлены в таблице 1.
Таблица 1. Коэффициент SUVmax в зависимости от протяженности поражения органа