гиперфенилаланинемия что это такое
СОДЕРЖАНИЕ
Симптомы и признаки
Причина
ФКУ или гиперфенилаланинемия также может возникать у людей без генотипа ФКУ. Если мать имеет генотип PKU, но лечилась бессимптомно, высокие уровни [phe] в кровотоке матери могут повлиять на плод без PKU во время беременности. Матерям, успешно пролеченным от фенилкетонурии, рекомендуется вернуться к диете с ограничением [phe] во время беременности.
У небольшой группы пациентов с гиперфенилаланинемией наблюдается соответствующее снижение уровней фенилаланина в плазме при ограничении этой аминокислоты в диете; однако у этих пациентов все еще развиваются прогрессирующие неврологические симптомы и судороги, и они обычно умирают в течение первых 2 лет жизни («злокачественная» гиперфенилаланинемия). Эти младенцы проявляют нормальную ферментативную активность фенилаланингидроксилазы (PAH), но имеют дефицит дигидроптеридинредуктазы (DHPR), фермента, необходимого для регенерации тетрагидробиоптерина (THB или BH 4 ), кофактора PAH.
Поддерживайте уровни фенилаланина в плазме в терапевтическом диапазоне от 120 до 360 мМ, используя диету, ограничивающую фенилаланин, но в остальном полноценную с точки зрения питания. Рекомендуется пожизненное лечение для снижения риска долгосрочных психоневрологических проблем и снижения риска материнского синдрома фенилкетонурии.
Исход
С лечением результат отличный. Большинство младенцев с классической фенилкетонурией, которых лечат в течение первых 10 дней жизни, достигают нормального интеллекта. Однако проблемы с обучением встречаются чаще, чем у здоровых сверстников.
Гиперфенилаланинемия что это такое
Гиперфенилаланинемия (ГФА) представляет собой повышение уровня фенилаланина в крови натощак по сравнению с показателями, выявляемыми у здоровых пациентов идентичного возраста. Гиперфенилаланинемия (ГФА) является группой заболеваний, среди которых наиболее частым является дефицит фенилаланингидроксилазы (ФАГ). Небольшое количество случаев связано с дефектом системы кофактора биоптерина (Burgard et al, 2000).
а) Биохимические и генетические изменения при фенилкетонурии и гиперфенилаланинемии:
1. Дисфункция метаболизма. Для гидроксилирования фенилаланина до образования тирозина необходимо три фермента: ФАГ, карбиноламиндегидротаза (КАД) и дигидропротеинредуктаза (ДПР), и два кофактора: тетрагидробиоптерин (ТГБ) и редуцированный НАД. На основании уровня фенилаланина в плазме и остаточной активности ФАГ в печени выделено три наследственных фенотипа ГФА в связи с дефицитом ФАГ: классическая фенилкетонурия, атипичная фенилкетонурия и нефенилкетонурическая ГФА. Дефекты синтеза и метаболизма 5,6,7,8-тетрагидробиоптерина (ТГБ) являются причиной ГФА и нарушений обмена нейротрансмиттеров.
2. Генетические изменения. ГФА является преобладающим нарушением метаболизма аминокислот среди представителей белой расы, частота заболевания составляет приблизительно 1 на 10000 живых новорожденных. Данное аутосомно-рецессивное заболевание вызвано более чем 500 мутациями локуса ФАГ. Различные группы мутаций преобладают в определенной этнической популяции, что позволяет проводить пренатальную диагностику, выявлять носителей и прогнозировать фенотип фенилкетонурии, связанный с определенным гаплотипом.
Некоторые мутации ФАГ приводят к дефициту ФАГ с остаточной ферментной активностью, которая усиливается под действием ТГБ. В таких случаях фармакологические дозы ТГБ приводят к минимум 30% снижению уровня фенилаланина в крови (Fiori et al., 2005).
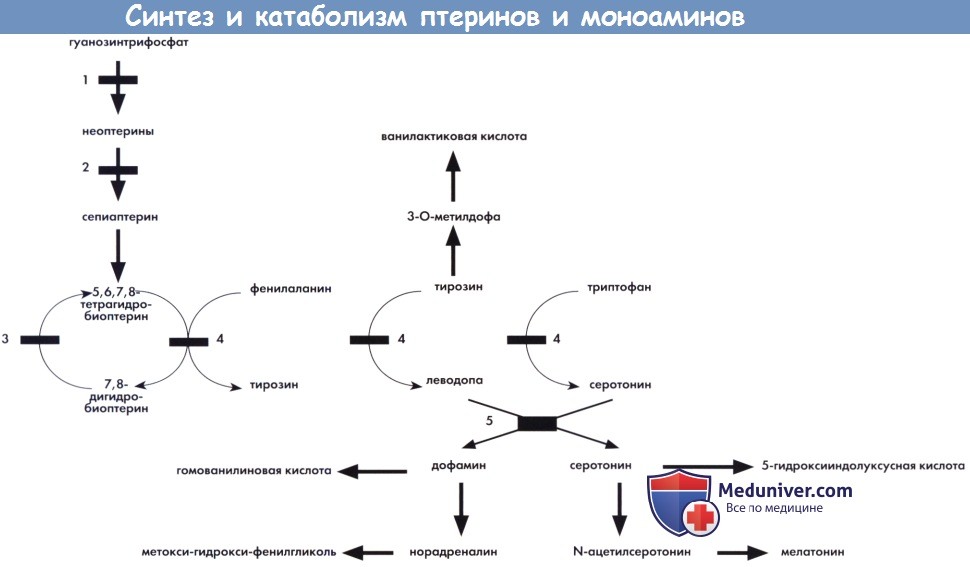
1 — гуанозинтрифосфатциклогидролаза. 2 — биоптеринсинтаза. 3 — дигидроптеридинредуктаза.
4 —фенилаланин-, тирозин-, триптофангидроксилазы.
5 — ароматическая L-декарбоксилаза аминокислот (зависимая от пиридоксальфосфата).
3. Патогенез. Считается, что клинические проявления гиперфенилаланинемии (ГФА) являются результатом накопления фенилаланина и его вторичного воздействия на химические процессы в головном мозге. Фактически, фенилкетонурия чаще всего сопровождается задержкой умственного развития, в то время как при нефенилкетонурической гиперфенилаланинемии умственное развитие не меняется, что предполагает наличие порогового уровня фенилаланина во внеклеточных жидкостях, при превышении которого персистирующая постнатальная (или фетальная) гиперфенилаланинемия приводит к необратимому повреждению головного мозга. В случае если пороговая величина достигается позже, после прекращения соблюдения диеты пациентами, которым ранее проводилось лечение фенилкетонурии, развиваются обратимые химические изменения, способные оказывать воздействие на нейрофизиологические функции.
У пациентов с фенилкетонурией при высоком уровне фенилаланина в плазме отмечается снижение синтеза нейротрансмиттеров. Дефект синтеза нейротрансмиттеров может быть связан с конкурентным ингибированием транспорта крупных аминокислот (тирозина, триптофана и разветвленных цепей аминокислот) в головной мозг через гематоэнцефалический барьер и из спинномозговой жидкости обратно в кровь, что приводит к низкой концентрации тирозина и триптофана в головном мозге пациентов, несмотря на высокое содержание данных веществ в спинномозговой жидкости, а также, возможно, с конкурентным ингибированием гидроксилирования тирозина высоким уровнем фенилаланина.
В головном мозге пациентов старшего возраста, которым не проводилось лечения фенилкетонурии, отмечается аномальная миелинизация, уменьшение массы мозга и снижение содержания миелина. Данное пагубное влияние подтвердилось в ходе исследования на мышах (модель НРН-5). Результаты настоящих или ранее проведенных наблюдений стали основой для гипотезы о снижении количества миелина вследствие ингибирования специфичной для олигодендритных клеток АТФ-сульфурилазы, приводящего к низкому содержанию сульфатидов в миелине, который в свою очередь подвергается протеолитическому распаду. В дальнейшем отмечается потеря нейронов и уменьшение количества межнейронных связей, что было продемонстрировано путем количественной оценки плотности рецепторов нейротрансмиттеров. Если перенести на человека результаты, полученные в ходе исследований на животных, особое поражение гиппокампа и затылочного пространства могут объяснить некоторые нейрофизиологические нарушения у пациентов с фенилкетонурией, которым не проводилось лечения или лечение было недостаточным.
Аномальный синтез белков головного мозга вследствие дезагрегации полисом и снижении скорости удлинения полипептидной цепи могут приводить к снижению массы головного мозга. Дезагрегация полисом отмечается также в сердце и головном мозге плодов крыс, подвергающихся воздействию ГФА беременной самки; данное обстоятельство имеет отношение к фетопатии, связанной с ГФА беременной женщины.
Снижение содержания ДНК и синтеза в нейронах, подвергающихся воздействию фенилаланина в высоких концентрациях, также может объяснять снижение пролиферации нейронов, потерю нейронов и нарушение роста головного мозга.
б) Клинические проявления. Фенилкетонурия при отсутствии лечения Клинические проявления фенилкетонурии, по поводу которой не проводилось лечения, включают задержку умственного развития, неврологические аномалии и вненеврологические симптомы (хотя сроки их возникновения варьируют у различных пациентов). Задержка умственного развития часто сочетается с микроцефалией. Аномалии ЭЭГ встречаются часто (78-95% случаев), но только у 25% пациентов отмечаются припадки, чаще всего генерализованные. Нередко встречается психотическое поведение с гиперактивностью, деструктивным и самодеструктивным поведением, импульсивностью и неконтролируемым поведением с эпизодами эмоционального возбуждения.
У большинства пациентов слабопигментированная кожа с экзематозными проявлениями. Общее физическое развитие обычно хорошее.
Клинический фенотип представляет преимущественно исторический интерес, так как в настоящее время симптомы предотвращаются за счет ранней диагностики и лечения. Тем не менее, до сих пор отмечаются случаи пропущенной ГФА у новорожденных в случае, если тесты не проводились или были получены ложноотрицательные результаты.
в) Фенилкетонурия, по поводу которой проведено раннее лечение. У детей с фенилкетонурией, выявленной при рутинном скрининге новорожденных, по поводу которой вскоре после рождения была начата диетотерапия с ограничением фенилаланина, отмечается нормальный уровень умственного развития (Hanley, 2004). Тем не менее, результаты ретроспективных исследований свидетельствуют о том, что даже при максимально благоприятных условиях лечения у детей отмечается тенденция к более низкому коэффициенту IQ, чем у родственников первой линии, и худшей способности к обучению, чем у сибсов и детей контрольной группы. Часто встречаются субклинические нейрофизиологические (изменения вызванных потенциалов и проводимости нерва) и нейропсихологические нарушения, особенно у пациентов, не строго соблюдающих диету.
Частота аномалий на ЭЭГ увеличивается с возрастом вне зависимости от раннего и строгого соблюдения диеты, а результаты МРТ свидетельствуют о том, что дисмиелинизация является практически универсальным проявлением среди пациентов с классической и атипичными формами фенилкетонурии. Изменения на МРТ затрагивают затылочно-теменные области и в наиболее тяжелых случаях распространяются на лобные и височные доли. Описанные изменения не имеют явной взаимосвязи ни с клиническими или нейропсихологическими проявлениями, ни с контролем потребления фенилаланина в раннем детском возрасте, но коррелируют с уровнем фенилаланина в крови на момент проведения нейровизуализации и частично обратимы при снижении концентрации фенилаланина в крови.
г) Лечение фенилкетонурии и гиперфенилаланинемии (ГФА). У пациентов с классической и атипичной фенилкетонурией для предотвращения необратимых повреждений головного мозга диета с исключением фенилаланина должна быть начата вскоре после рождения. Ежедневное пероральное применение тетрадигидробиопентина может быть альтернативой диете у пациентов с чувствительной к тетрадигидробиопентину формой атипичной фенилкетонурии (Muntau et al., 2002). Для предотвращения интеллектуальной, неврологической и нейрофизиологической деградации после расширения диеты универсальной тактикой является пожизненное лечение. У пациентов с нефенилкетонурической ГФА (уровень фенилаланина в сыворотке
Редактор: Искандер Милевски. Дата публикации: 12.12.2018
Фенилкетонурия у детей и ее лечение
Фенилкетонурия (ФКУ) — генетическое заболевание, характеризующееся нарушениями обмена фенилаланина. Встречается с частотой 1 на 8000–15 000 новорожденных. Выделяют четыре формы ФКУ; существует свыше 400 различных мутаций и несколько метаболических фенотип
.jpg)
Определение, патогенез, классификация
Фенилкетонурия — наследственная аминоацидопатия, связанная с нарушением метаболизма фенилаланина, в результате мутационной блокады ферментов приводящая к стойкой хронической интоксикации и поражению ЦНС c выраженным снижением интеллекта и неврологическим дефицитом [1, 2].
Основное значение в патогенезе классической ФКУ имеет неспособность фенилаланингидроксилазы перерабатывать фенилаланин до тирозина. В результате в организме накапливается фенилаланин и продукты его аномального обмена (фенилпировиноградная, фенилуксусная, фенилмолочная кислоты) [1–3].
В числе других патогенетических факторов рассматриваются нарушения аминокислотного транспорта через гематоэнцефалический барьер, нарушения церебрального пула аминокислот с последующим нарушением синтеза протеолипидных белков, нарушения миелинизации, низкие уровни нейротрансмиттеров (серотонин и др.) [1–4].
Фенилкетонурия I (классическая или тяжелая) — аутосомно-рецессивное заболевание, вызванное мутацией гена фенилаланингидроксилазы (длинное плечо хромосомы 12); выявлены 12 различных гаплотипов, из которых около 90% ФКУ ассоциировано с четырьмя гаплотипами. Наиболее частые мутации в гене фенилаланингидроксилазы: R408W, R261Q, IVS10 nt 546, Y414C. В основе болезни — дефицит фенилаланин-4-гидроксилазы, обеспечивающей конверсию фенилаланина в тирозин, что приводит к накоплению в тканях и физиологических жидкостях фенилаланина и его метаболитов [1–4].
Особую группу составляют атипичные варианты ФКУ, при которых клиническая картина напоминает классическую форму болезни, но по показателям развития, несмотря на проведение диетотерапии, не отмечается положительной динамики. Эти варианты ФКУ связаны с дефицитом тетрагидроптерина, дегидроптеринредуктазы, 6-пирувоилтетрагидроптеринсинтазы, гуанозин-5-трифосфатциклогидролазы и т. д. [1–4].
Фенилкетонурия II (атипичная) — аутосомно-рецессивное заболевание, при котором генный дефект локализуется в коротком плече хромосомы 4 (участок 4р15.3), характеризующееся недостаточностью дегидроптеринредуктазы, приводящей к нарушению восстановления активной формы тетрагидробиоптерина (кофактор в гидроксилировании фенилаланина, тирозина и триптофана) в сочетании со снижением в сыворотке крови и спинномозговой жидкости фолатов. Результатом являются метаболические блоки в механизмах превращения фенилаланина в тирозин, а также предшественников нейромедиаторов катехоламинового и серотонинового рядов (L-дофа, 5-окситриптофан). Болезнь описана в 1974 г. [1–4].
Фенилкетонурия III (атипичная) — аутосомно-рецессивное заболевание, связанное с недостаточностью 6-пирувоилтетрагидроптеринсинтазы, участвующей в процессе синтеза тетрагидробиоптерина из дигидронеоптеринтрифосфата (описано в 1978 г.). Дефицит тетрагидробиоптерина приводит к расстройствам, сходным с нарушениями при ФКУ II [1–4].
Примаптеринурия — атипичная ФКУ у детей с легкой гиперфенилаланинемией, у которых в моче в больших количествах присутствует примаптерин и некоторые его производные при наличии нормальной концентрации в спинномозговой жидкости нейромедиаторных метаболитов (гомованилиновой и 5-оксииндолуксусной кислот). Энзиматический дефект пока не выявлен [1–4].
Материнская ФКУ — заболевание, сопровождающееся снижением уровня интеллекта (до умственной отсталости) среди потомства женщин, страдающих ФКУ и не получающих специализированную диету в совершеннолетнем возрасте. Патогенез материнской ФКУ детально не изучен, но предполагается ведущая роль хронической интоксикации плода фенилаланином и продуктами его аномального метаболизма [1–4].
R. Koch и соавт. (2008) при аутопсии головного мозга младенца, у матери которого отмечалась ФКУ (без адекватного контроля за уровнем фенилаланина в крови), обнаружили ряд патологических изменений: низкий вес мозга, вентикуломегалию, гипоплазию белого вещества и задержку миелинизации (без признаков астроцитоза); хронических изменений в сером веществе головного мозга не было обнаружено. Предполагается, что нарушения в развитии белого вещества мозга ответственны за формирование неврологического дефицита при материнской ФКУ [5].
В практических целях в медико-генетических центрах РФ используется условная классификация ФКУ, основанная на уровнях содержания фенилаланина в сыворотке крови: классическая (тяжелая или типичная) — уровень фенилаланина выше 20 мг% (1200 мкмоль/л); средняя — 10,1–20 мг% (600–1200 мкмоль/л), а также уровень фенилаланина 8,1–10 мг%, если он устойчив на фоне физиологической нормы потребления белка в рационе питания; легкая (гиперфенилаланинемия, не требующая лечения) — уровень фенилаланина до 8 мг% (480 мкмоль/л) [2].
Клинические проявления и диагностика
При рождении дети с ФКУ I выглядят здоровыми, хотя чаще имеется специфический хабитус (светлые волосы, голубые глаза, суховатая кожа). При отсутствии своевременного выявления и лечения болезни в течение первых двух месяцев жизни у них появляется частая и интенсивная рвота и повышенная раздражительность. Между 4 и 9 месяцами становится очевидным выраженное отставание в психомоторном развитии [1–4].
Пациентов отличает специфический («мышиный») запах кожных покровов. Выраженные неврологические нарушения у них редки, но характерны черты гиперактивности и расстройств аутистического спектра. При отсутствии своевременного лечения уровень IQ составляет
В. М. Студеникин, доктор медицинских наук, профессор
Т. Э. Боровик, доктор медицинских наук, профессор
Т. В. Бушуева, кандидат медицинских наук
НЦЗД РАМН, Москва
Гиперфенилаланинемия с дефицитом тетрагидробиоптерина
OMIM 261640
Наша команда профессионалов ответит на ваши вопросы
Гиперфенилаланинемия (ГФА) – группа гетерогенных заболеваний, обусловленных нарушением обмена незаменимой аминокислоты фенилаланина, вызванных нарушением синтеза или регенерации тетрагидробиоптерина (BH4), кофактора в реакции гидроксилирования фенилаланина, тирозина и триптофана.
Нарушение метаболизма фенилаланина также встречается при дефиците фермента фенилаланингидроксилазы (ФАГ), принимающего участие в процессе превращения фенилаланина в тирозин. Мутации в гене PAH, кодирующий фенилаланингидроксилазу, приводят к наиболее частому врожденному нарушению метаболизма аминокислот среди европейцев –фенилкетонурии.
ВН4-дефицитная ГФА типа А
ВН4-дефицитная ГФА типа В
ГТФ циклогидролаза I
ВН4-дефицитная ГФА типа С
ВН4-дефицитная ГФА типа D
ГФА без дефицита ВН4
Гиперфенилаланинемия с дефицитом тетрагидробиоптерина А типа
OMIM 261640
Молекулярно-генетической причиной HPABH4A являются мутации в гене PTS, расположенном на длинном плече хромосомы 11 в районе q22.3-23.3.
Гиперфенилаланинемия с дефицитом тетрагидробиоптерина B типа
OMIM 233910
Гиперфенилаланинемия с дефицитом тетрогидробиоптерина типа В (HPABH4В) – наследственное аутосомно-рецессивное заболевание. Дефицит тетрагидробиоптерина, вызванный недостатком ГТФ циклогидролазы I – очень редкое аутосомно-рецессивное заболевание (на сегодняшний день в мировой литературе описано около 20 случаев), связано с недостаточностью фермента ГТФ циклогидролазы I, участвующего в превращении ГТФ в тетрогидробиоптерин. Клинические проявления заболевания начинаются уже в неонатальном периоде проблемами вскармливания. Заболевание характеризуется тяжелыми нарушениями психомоторного развития, тяжелой мышечной гипотонией мышц тела и гипертонией мышц конечностей, затруднением вращения глаз, конвульсиями, частыми эпизодами гипертермии. Лечение дофамином снимает неврологическую симптоматику, но не предотвращает развитие энцефалопатии.
Молекулярно-генетической причиной заболевания являются изменения в гене GCH1, расположенном на длинном плече 14 хромосомы в регионе q22.2.
Гиперфенилаланинемия с дефицитом тетрагидробиоптерина C типа
OMIM 261630
Тип наследования HPABH4C – аутосомно-рецессивный. Заболевание связано с мутацией в гене QDPR. Ген локализован на хромосоме 4p15.3.
Гиперфенилаланинемия с дефицитом тетрагидробиоптерина D типа
OMIM 264070
Гиперфенилаланинемия с дефицитом тетрогидробиоптерина типа D (HPABH4D) – наследственное аутосомно-рецессивное заболевание, связанное с дефицитом фермента птерин-4-альфа-карбиноламиндегидратазы. Данное заболевание характеризуется незначительным проходящим повышением ФА в крови, выявляемом на скрининге. В большинстве случаев заболевание протекает бессимптомно, у пациентов отмечается нормальное психомоторное развитие. В некоторых случаях может наблюдаться проходящий неврологических дефицит в младенчестве. Также, во время полового созревания может отмечаться развитие неаутоимунного сахарного диабета и гипомагниемии. Основным отличием данного заболевания от других ВН4-дефицитных форм ГФА является примаптеринурия, характеризующаяся выделением 7-биоптерина (примаптерина) с мочой.
Молекулярно-генетической причиной заболевания являются изменения в гене PCBD1, расположенном на коротком плече 2 хромосомы в регионе q22.1.
ДОФА-зависимая дистония
OMIM 612716
ДОФА-зависимая дистония – наследственное аутосомно-рецессивное заболевание. Возникает из-за нарушения синтеза ВН4, вызванного дефицитом сепиаптерин редуктазы. При этом возникает дефицит допамина и серотонина в центральной нервной системе. Клинически, у больных людей наблюдается L-DOPA-зависимое суточные колебания двигательных расстройств, обычно связанное с задержкой когнитивных функций и тяжелой неврологической дисфункцией. Неврологические проявления при ДОФА-зависимой дистонии схожи с таковыми при других ВН4-дефицитных ГФА. Единственное отличие заключается в отсутствии гиперфенилаланинемии.
Молекулярно-генетической причиной заболевания являются изменения в гене SPR, расположенном на длинном плече 10 хромосомы в регионе р13.2.
Гиперфенилаланинемия без дефицита ВН4
OMIM 617384
Молекулярно-генетической причиной заболевания являются изменения в гене DNAJC12, расположенном на длинном плече 10 хромосомы в регионе р21.3. Данный ген кодирует белок семейства шаперонов HSP40 – DNAJC12, который участвует в восстановлении молекулы ФАГ в процессе гидролиза АТФ.
В Центре Молекулярной Генетики проводится прямая диагностика всех известных типов гиперфенилаланинемии, которая основана на поиске мутаций в генах PAH, PTS, GCH1, QDPR, PCBD1, SPR, DNAJC12 методом секвенирования всей кодирующей последовательности и областей экзон-интронных соединений данных генов
Другие виды гиперфенилаланинемии
Рубрика МКБ-10: E70.1
Содержание
Определение и общие сведения [ править ]
Фенилкетонурия 2 типа
Синонимы: дефицит дигидроптеридинредуктазы, ФКУ II типа
Дефицит дигидроптеридинредуктазы крайне редок, но составляет около трети всех форм дефицита тетрагидробиоптерина. Фенилкетонурия 2 типа чаще встречается в странах Средиземноморья. наследование аутосомно-рецессивное.
Фенилкетонурия 2 типа была впервые описана Smith в 1974 г.
Этиология и патогенез [ править ]
Дефицит дигидроптеридинредуктазы вызван мутациями в гене QDPR, который кодирует хиноид дигидроптеридинредуктазы, участвующей во второй стадии регенерации тетрагидробиоптерина. Дефицит тетрагидробиоптерина (BH4) приводит к развитию гиперфенилаланинемии из-за вторичного дефекта фенилаланингидроксилазы и истощению дофамина и серотонина из-за дефицита кофактор-зависимых ферментов тетрагидробиоптерина, участвующих в синтезе нейротрансмиттеров. Две специфические мутации (p.G151S и p.F212C) приводят к развитию легкой форме дефицита дигидроптеридинредуктазы, влияя только на метаболизм серотонина.
Клинические проявления [ править ]
В отсутствии лечения фенилкетонурия 2 типа обычно проявляется в возрасте 4-5 месяцев задержкой психомоторного развития, нарушением тонуса, судорогами, окулогирическими кризами, сонливостью (с суточным колебанием бодроствования), раздражительностью, гипертермией, гиперсаливацией, трудностями при глотании и аномальными движениями. Микроцефалия наблюдается у одной трети пациентов. В тяжелых случаях наблюдается повышенный риск недоношенности и низкого веса при рождении, а клинические симптомы, такие как гипотония, плохой сосательный рефлекс и снижение спонтанных движений, очевидны с момента рождения.
Другие виды гиперфенилаланинемии: Диагностика [ править ]
Фенилкетонурия 2 типа обычно подозревается при скрининге новорожденных, демонстрируя повышенные уровни фенилаланина. Фенилкетонурия 2 типа диагностируется путем обнаружения снижения активности дигидроптеридинредуктазы в клетках крови и снижения уровней метаболитов серотонина, допамина и фолата в цереброспинальной жидкости. Визуализация мозга может выяаить прогрессирующие кальцификации в базальных ганглиях, белом или сером веществе. В 50% случаев ЭЭГ демонстрирует пароксизмальную активность. Диагноз подтверждается генетическим тестированием.
Дифференциальный диагноз [ править ]
Дифференциальный диагноз включает классическую фенилкетонурию, другие причины дефицита тетрагидробиоптерина (BH4), например, дефицит 6-пирувоил-тетрагидробиоптерин синтетазы, дефицит ГТФ цитрогидролазы I, а также пренатальные инфекции, синдром Айкарди-Гутьереса, инфантильный паркинсонизм (например, дефицит транспортера дофамина или тирозингидроксилазы) и расстройства, влияющие на белое вещество головного мозга (например, нейрональный цероидный липофусциноз, ганглиозидозы, болезнь Александера).
Другие виды гиперфенилаланинемии: Лечение [ править ]
Целью терапии является снижение уровня фенилаланина в крови путем коррекции тетрагидробиоптерина, как правило, в сочетании с диетой с ограничением поступления фенилаланина и восстановлением уровней нейротрансмиттеров в головном мозге путем назначения предшественников нейротрансмиттеров (леводопа в сочетании с карбидопой и 5-окситриптофан). Агонисты дофамина длительного действия (прамипексол, ропинирол) могут использоваться для стабилизации клинической и биохимической картины. Ингибиторы моноаминооксидазы (селегилин) также полезны для продления действия предшественников нейротрансмиттеров. Прием метилфолата или фолиевой кислоты может восстанавливать уровни фолата в мозге.
Профилактика [ править ]
Прочее [ править ]
Дефицит 6-пирувоил-тетрагидробиоптерин синтетазы
Определение и общие сведения
Заболевание впервые было описано Kaufman в 1978 г.
В отсутствие лечения дефицит 6-пирувоил-тетрагидробиоптерин синтетазы вызывает неврологические симптомы в возрасте 4 или 5 месяцев, хотя часто они становятся очевидными с момента рождения. Основные симптомы включают в себя задержку психомоторного развития, нарушения тонуса, судороги, сонливость, раздражительность, аномальные движения, гипертермию, гиперсаливацию и затруднение при глотании.
Синонимы: гиперфенилаланинемическая эмбриопатия, материнская ФКУ, материнская гиперфенилаланинемия, фенилкетонурическая эмбриопатия
Определение и общие сведения
Материнская фенилкетонурия является редким врожденным нарушением метаболизма фенилаланина, характеризующееся развитием микроцефалии, задержкой роста, врожденными порокоми сердца, лицевым дисморфизмом и умственной неполноценностью у младенцев без фенилкетонурии от матерей с повышенными концентрациями фенилаланина в крови.
По оценкам, распространенность материнской фенилкетонурии в Европе составляет 1/10 000. Увеличение выживаемости при фенилкетонурии благодаря неонатальному скринингу, увеличило число потенциальных беременностей с риском развития материнской фенилкетонурии.
Этиология и патогенез
Аномально высокие концентрации фениланина у матери лежит в основе клинических проявлений, обнаруживаемых у детей. Фенилкетонурия и гиперфенилаланинемия вызваны мутациями в гене PAH (12q22-q24.2).
Следует строго поддерживаться оптимальных концентраций фениланина у матери на протяжении всей беременности, чтобы уменьшить риск развития данных аномалий.
