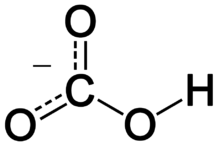
гидрокарбонат в воде что это такое
Гидрокарбонаты
Гидрокарбонаты щелочных металлов в воде растворимы. Также в воде хорошо растворимы гидрокарбонаты щелочноземельных металлов, в отличие от карбонатов.
Содержание
Получение
Гидрокарбонат натрия плохо растворим в холодной воде, поэтому его можно отделить от хлорида аммония фильтрованием.
Химические свойства
В итоге раствор гидрокарбонатов имеет щелочную реакцию.
Применение
Гидрокарбонат натрия (сода) используется в производстве искусственных минеральных вод и заправки огнетушителей, в кондитерском деле и хлебопечении, в быту, в медицине.
Физиологическое действие
Литература
Примечания
См. также
Полезное
Смотреть что такое «Гидрокарбонаты» в других словарях:
ГИДРОКАРБОНАТЫ — (бикарбонаты) кислые соли угольной кислоты Н2СО3, напр., питьевая сода NаНСО3 … Большой Энциклопедический словарь
гидрокарбонаты — – кислые соли угольной кислоты. Словарь по аналитической химии [3] … Химические термины
гидрокарбонаты — (бикарбонаты), кислые соли угольной кислоты Н2СО3, например питьевая сода NaHCO3. * * * ГИДРОКАРБОНАТЫ ГИДРОКАРБОНАТЫ (бикарбонаты), кислые соли угольной кислоты Н2СО3, напр., питьевая сода NаНСО3 … Энциклопедический словарь
Гидрокарбонаты — бикарбонаты, двууглекислые соли, кислые соли угольной кислоты (См. Угольная кислота) H2CO3, например NaHCO3 (Гидрокарбонат натрия). Г. получают действием CO2 на карбонаты или гидроокиси в присутствии воды. При нагревании они превращаются… … Большая советская энциклопедия
ГИДРОКАРБОНАТЫ — (от гидро. и карбонаты) кислые соли угольной к ты H2CO3; Г. натрия NaHCO3 питьевая сода … Большой энциклопедический политехнический словарь
ГИДРОКАРБОНАТЫ — (бикарбонаты), кислые соли угольной кислоты Н2СО3, напр. питьевая сода NaHCO3 … Естествознание. Энциклопедический словарь
гидрокарбонаты — гидрокарбон аты, ов, ед. ч. н ат, а … Русский орфографический словарь
гидрокарбонаты — мн., Р. гидрокарбона/тов; ед. гидрокарбона/т (2 м) … Орфографический словарь русского языка
Минеральная вода — Минеральные воды воды, содержащие в своем составе растворённые соли, микроэлементы, а также некоторые биологически активные компоненты. Среди минеральных вод выделяют минеральные природные питьевые воды, минеральные воды для наружного… … Википедия
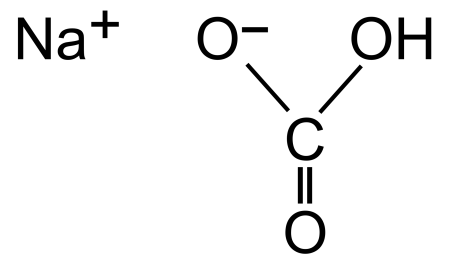
Гидрокарбонат натрия
| Гидрокарбонат натрия | |
|---|---|
 | |
 | |
| Систематическое наименование | гидрокарбонат натрия |
| Традиционные названия | пищевая (питьевая) сода, сода двууглекислая, двууглекислый натрий, бикарбонат натрия, кислый углекислый натрий |
| Хим. формула | CHNaO₃ |
| Рац. формула | NaHCO3 |
| Состояние | твёрдое |
| Молярная масса | 84,0066 г/моль |
| Плотность | 2,159 г/см³ |
| Т. разл. | 60—200 °C |
| Растворимость в воде | 9,59 г/100 мл |
| ГОСТ | ГОСТ 2156-76 ГОСТ 4201-79 ГОСТ 32802-2014 |
| Рег. номер CAS | 144-55-8 |
| PubChem | 516892 |
| Рег. номер EINECS | 205-633-8 |
| SMILES | |
| Рег. номер EC | 205-633-8 |
| Кодекс Алиментариус | E500(ii) |
| RTECS | VZ0950000 |
| ChEBI | 32139 |
| ChemSpider | 8609 |
| ЛД50 | 4220 мг/кг |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. | |
Гидрокарбонат натрия (лат. Natrii hydrocarbonas ), другие названия: бикарбонат натрия, чайная сада, питьевая или пищевая сода, двууглекислый натрий — неорганическое соединение, натриевая кислая соль угольной кислоты с химической формулой NaHCO3.
В обычном виде — мелкокристаллический порошок белого цвета.
Используется в промышленности, пищевой промышленности, в кулинарии, в медицине как нейтрализатор химических ожогов кожи и слизистых оболочек концентрированными кислотами и для снижения кислотности желудочного сока. Также применяется в буферных растворах.
Содержание
Химические свойства
Гидрокарбонат натрия — кислая натриевая соль угольной кислоты. Проявляет все свойства соли сильного основания и слабой кислоты. В водных растворах имеет слабощелочную реакцию. В широком диапазоне концентраций в водном растворе pH раствора изменяется незначительно, на этом основано применение раствора вещества в качестве буферного раствора.
Реакция с кислотами
Гидрокарбонат натрия реагирует с кислотами с образованием соответствующей кислоте соли, например, хлорида натрия, сульфата натрия и угольной кислоты, которая в процессе реакции распадается на углекислый газ и воду, при этом углекислый газ выделяется из раствора в виде пузырьков:
В быту обычно применяется реакция «гашения соды» уксусной кислотой, с образованием ацетата натрия или гашение лимонной кислотой с образование цитрата натрия, реакция с уксусной кислотой:
Термическое разложение
При температуре выше 60 °C гидрокарбонат натрия начинает распадаться на карбонат натрия, углекислый газ и воду (процесс разложения наиболее эффективен при 200 °C, при более высоких температурах карбонат натрия начинает распадаться на оксид натрия и углекислый газ):
При этом процессе выделения воды в виде водяного пара и углекислого газa масса исходного продукта уменьшается примерно на 37 %.
Получение
В промышленности гидрокарбонат натрия получают аммиачно-хлоридным способом. В концентрированный раствор хлорида натрия, насыщенный аммиаком, под давлением пропускают углекислый газ. В процессе синтеза происходят две реакции:
В холодной воде гидрокарбонат натрия мало растворим, и его отделяют от охлаждённого раствора фильтрованием, а из полученного после фильтрования раствора хлорида аммония снова получают аммиак, возвращаемый в производство вновь:
Применение
Двууглекислый натрий (бикарбонат) применяется в химической, пищевой, лёгкой, медицинской, фармацевтической промышленности, цветной металлургии, в быту. Зарегистрирован в качестве пищевой добавки E500 (ii), входит в состав пищевой добавки E500.
В химической промышленности
Применяется для производства красителей, пенопластов и других органических продуктов, фторорганических соединений, продуктов бытовой химии, наполнителей в огнетушителях, Реагент для отделения диоксида углерода, сероводорода из газовых смесей, например, отходящих газов топливосжигающих установок. В этом процессе углекислый газ поглощается раствором гидрокарбоната натрия при повышенном давлении и пониженной температуре, далее поглощённый углекислый газ выделяется из раствора при подогреве и снижении давления;
В лёгкой промышленности — в производстве резины для подошв обуви и в производстве искусственных кож, кожевенном производстве при дублении и нейтрализации кожи после кислого дубления, текстильной промышленности при отделке шёлковых и хлопчатобумажных тканей;
В пищевой промышленности — в хлебопечении, производстве кондитерских изделий, приготовлении газированных напитков.
В кулинарии
Основное применение пищевой соды в пищевой промышленности и в быту — кулинария, где применяется, преимущественно, в качестве основного или дополнительного разрыхлителя в составе кислого и пресного теста. При добавлении питьевой соды в кислое тесто происходит реакция с молочной кислотой, продуцированной при заквашивании дрожжевыми микроорганизмами, при этой реакции выделяется углекислый газ, вспучивающий тесто.
При добавлении в пресное тесто углекислый газ выделяется при выпечке из-за термического разложения.
При применении соды в чистом виде важно соблюсти правильную дозировку, так как она оставляет в продукте карбонат натрия, дающий определённый привкус. Порядок замешивания для теста: соду — в муку, кислые компоненты (уксус, кефир и пр.) — в жидкость.
В медицине
Традиционно раствор питьевой соды используется для дезинфекции зубов и дёсен при зубных болях и полости рта и горла, при сильном кашле, ангине, фарингите, а также как общепринятое средство от изжоги и болей в желудке.
Применяется при заболеваниях, сопровождающиеся выраженным ацидозом (при диабете, инфекциях и др), для борьбы с ацидозом при хирургических вмешательствах (назначается 3-5 г. внутрь).
Применяется в качестве антиаритмического средства.
Как антацидное средство (как и все другие щелочи) применяется при язвенной болезни желудка, и двенадцатиперстной кишки, при повышенной кислотности желудочного сока.
Имеются так же данные о применении препарата (в виде капельных и внутривенных вливаний) при гипертонической болезни, симптоматической почечной гипертонии, и хронической почечной недостаточности. Эффект связан с увеличением выделения ионов натрия и хлора и возрастанием осмотического диуреза.
В виде свечей применяется против укачивания при морской и воздушной болезнях
Применяется в качестве отхаркивающего средства, т.к. повышая щелочные резервы крови, сдвигает в щелочную сторону реакцию бронхиальной слизи, делая мокроту менее вязкой.
Применяется внутривенно с целью быстрого устранения метаболического ацидоза во время реанимационных мероприятий, заболеваниях почек.
Нужно иметь ввиду, что в результате применения может возникнуть т.н. кислотный рикошет (при реакции содой с соляной кислотой происходит выделение CO2, который оказывает раздражающее действие на стенку желудка, усиливая выделение гастрина).
В альтернативной медицине питьевая сода иногда заявляется как «лекарство» от рака, однако, никакой экспериментально подтверждённой эффективности применения такого «лечения» не существует.
Противопоказания к применению в медицинских целях
Является источником натрия, тем самым увеличивая объём циркулирующей крови, усугубляя отёки и повышая артериальное давление. Применение при сниженной скорости клубочковой фильтрации может привести к метаболическому алкалозу.
Пожаротушение
Гидрокарбонат натрия вместе с карбонатом аммония используется в качестве наполнителя в огнетушителях с сухим наполнением и в стационарных системах сухого пожаротушения. Это применение обусловлено тем, что от воздействия высокой температуры в очаге горения вещество выделяет углекислый газ, атмосфера которого затрудняет доступ кислорода воздуха в очаг горения.
В быту
Применяется как безопасное для здоровья средство для чистки поверхностей столовой и кухонной посуды, поверхностей кухонных столов, иных поверхностей, соприкасающихся с пищей, путем протирки их с помощью влажной тряпки с сухим порошком питьевой соды.
В транспорте
Применяется для нейтрализации следов электролита — серной кислоты на поверхности пластмассовых корпусов свинцовых аккумуляторов насыщенным водным раствором питьевой соды.
Производство
В Российской Федерации двууглекислый натрий выпускается в соответствии с требованиями и техническими условиями, выпускается на предприятиях АО «Башкирская содовая компания» в г. Стерлитамак, Республика Башкортостан, а также на Крымском содовом заводе в г. Красноперекопск, Крымский полуостров.
Хранение
Гидрокарбонат натрия хранят в закрытых упаковках, в сухом месте вдали от источников огня. Гарантийный срок хранения натрия двууглекислого — 12 месяцев со дня изготовления. Срок годности не ограничен.
Безопасность
Вещество нетоксично, пожаро- и взрывобезопасно.
Гидрокарбонат в воде что это такое
Методы определения щелочности и массовой концентрации карбонатов и гидрокарбонатов
Water. Methods for determination of alkalinity and mass concentration of carbonates and hydrocarbonates
Дата введения 2014-01-01
Предисловие
Цели, основные принципы и общие правила проведения работ по межгосударственной стандартизации установлены ГОСТ 1.0 «Межгосударственная система стандартизации. Основные положения» и ГОСТ 1.2 «Межгосударственная система стандартизации. Стандарты межгосударственные, правила и рекомендации по межгосударственной стандартизации. Правила разработки, принятия, обновления и отмены»
Сведения о стандарте
1 ПОДГОТОВЛЕН Обществом с ограниченной ответственностью «Протектор» совместно с Закрытым акционерным обществом «Роса» на основе собственного перевода на русский язык англоязычной версии стандартов, указанных в пункте 5
2 ВНЕСЕН Федеральным агентством по техническому регулированию и метрологии
3 ПРИНЯТ Межгосударственным советом по стандартизации, метрологии и сертификации (протокол от 3 декабря 2012 г. N 54)
За принятие проголосовали:
Краткое наименование страны по МК (ИСО 3166) 004-97
Код страны по МК (ИСО 3166) 004-97
Сокращенное наименование национального органа по стандартизации
Госстандарт Республики Казахстан
4 Приказом Федерального агентства по техническому регулированию и метрологии от 12 декабря 2012 г. межгосударственный стандарт ГОСТ 31957-2012 введен в действие в качестве национального стандарта Российской Федерации с 1 января 2014 г.
— исключения отдельных пунктов указанных международных стандартов, тексты которых с обоснованиями исключения приведены в приложении ДД;
— внесения дополнительных положений, фраз и слов, что обусловлено учетом потребностей национальной экономики и особенностей межгосударственной стандартизации, выделенных в тексте настоящего стандарта курсивом.
Наименование настоящего стандарта изменено относительно наименования указанных международных стандартов для приведения в соответствие с ГОСТ 1.5-2001 (подраздел 3.6).
Сведения о соответствии ссылочных межгосударственных стандартов международным стандартам, использованным в качестве ссылочных в примененных международных стандартах, приведены в дополнительном приложении ДГ.
Сопоставление структуры настоящего стандарта со структурой примененных в нем международных стандартов приведено в дополнительном приложении ДД
7 ПЕРЕИЗДАНИЕ. Ноябрь 2019 г.
8 Настоящий стандарт подготовлен на основе применения ГОСТ Р 52963-2008 (ИСО 9963-1:1994, ИСО 9963-2:1994)
Информация о введении в действие (прекращении действия) настоящего стандарта и изменений к нему на территории указанных выше государств публикуется в указателях национальных стандартов, издаваемых в этих государствах, а также в сети Интернет на сайтах соответствующих национальных органов по стандартизации.
В случае пересмотра, изменения или отмены настоящего стандарта соответствующая информация будет опубликована на официальном интернет-сайте Межгосударственного совета по стандартизации, метрологии и сертификации в каталоге «Межгосударственные стандарты»
1 Область применения
Настоящий стандарт распространяется на питьевую и природную (поверхностную и подземную) воду, в том числе воду источников питьевого водоснабжения, а также на сточную воду, и устанавливает следующие титриметрические методы определения щелочности, карбонатов и гидрокарбонатов с визуальным или потенциометрическим фиксированием конечной точки титрования:
Методы позволяют определять молярные концентрации щелочности от 0,1 до 100 ммоль/дм . Метод А позволяет определять массовые концентрации карбонатов от 6 до 6000 мг/дм и гидрокарбонатов в диапазоне от 6,1 до 6100 мг/дм .
Пробы воды со значениями щелочности более 10 ммоль/дм перед анализом разбавляют.
При визуальном титровании определению щелочности мешают:
— интенсивная окраска воды, которую перед титрованием устраняют путем добавления гидроксида алюминия (или активированного угля) с последующим фильтрованием через бумажный фильтр «синяя лента» или стеклянный фильтр;
— наличие суспензированных карбонатов, которые перед титрованием устраняют фильтрованием через бумажный фильтр «синяя лента» или стеклянный фильтр;
— свободный хлор в концентрациях свыше 0,5 мг/дм , затрудняющий фиксирование перехода окраски индикатора. Свободный хлор перед титрованием устраняют путем добавления раствора тиосульфата натрия молярной концентрации 0,1 моль/дм из расчета 0,1 см на 200 см пробы воды, что позволяет удалить до 1,8 мг/дм хлора в указанном объеме пробы воды.
В случае если окраску или мутность пробы нельзя устранить вышеуказанными способами, пробу воды рекомендуется анализировать потенциометрическим титрованием.
На потенциометрическое титрование не оказывают влияние окислители, хотя определению конечной точки титрования могут мешать присутствующие в пробе воды органические соединения. Поверхностно-активные вещества, жиры и т.п. могут покрывать пленкой поверхность электродов и замедлять проведение измерений. Поэтому необходимо дополнительное время между добавлением титранта, чтобы привести электроды в равновесие. Электроды следует регулярно очищать растворителями, указанными в инструкции по эксплуатации электродов или, в случае отсутствия указаний, этиловым спиртом.
При определении щелочности рекомендуется избегать контакта пробы воды с атмосферой.
Коэффициенты пересчета значений щелочности, выраженных в других единицах, приведены в таблице А.1 (приложение А).
2 Нормативные ссылки
В настоящем стандарте использованы нормативные ссылки на следующие межгосударственные стандарты:
ГОСТ 17.1.5.05 Охрана природы. Гидросфера. Общие требования к отбору проб поверхностных и морских вод, льда и атмосферных осадков
ГОСТ 83 Реактивы. Натрий углекислый. Технические условия
ГОСТ 1770 (ИСO 1042-83, ИСO 4788-80) Посуда мерная лабораторная стеклянная. Цилиндры, мензурки, колбы, пробирки. Общие технические условия
ГОСТ 3118 Реактивы. Кислота соляная. Технические условия
ГОСТ 4199 Реактивы. Натрий тетраборнокислый 10-водный. Технические условия
ГОСТ 4328 Реактивы. Натрия гидроокись. Технические условия
ГОСТ 4919.2 Реактивы и особо чистые вещества. Методы приготовления буферных растворов
ГОСТ 6709 Вода дистиллированная. Технические условия
ГОСТ 6755 Поглотитель химический известковый ХП-И. Технические условия
ГОСТ 14919 Электроплиты, электроплитки и жарочные электрошкафы бытовые. Общие технические условия
ГОСТ ISO/IEC 17025 Общие требования к компетентности испытательных и калибровочных лабораторий
ГОСТ 17792 Электрод сравнения хлорсеребряный насыщенный образцовый 2-го разряда
ГОСТ 18300 Спирт этиловый ректификованный технический. Технические условия
В Российской Федерации действует ГОСТ Р 55878-2013 «Спирт этиловый технический гидролизный ректификованный. Технические условия».
ГОСТ 24104 Весы лабораторные. Общие технические требования
В Российской Федерации действует ГОСТ Р 53228-2008 «Весы неавтоматического действия. Часть 1. Метрологические и технические требования. Испытания».
ГОСТ 25336 Посуда и оборудование лабораторные стеклянные. Типы, основные параметры и размеры
ГОСТ 27068 Реактивы. Натрий серноватисто-кислый (натрия тиосульфат) 5-водный. Технические условия
ГОСТ 29169 (ИСО 648-77) Посуда лабораторная стеклянная. Пипетки с одной отметкой
ГОСТ 29227 (ИСО 835-1-81) Посуда лабораторная стеклянная. Пипетки градуированные. Часть 1. Общие требования
ГОСТ 29251 (ИСО 385-1-84) Посуда лабораторная стеклянная. Бюретки. Часть 1. Общие требования
ГОСТ 30813 Вода и водоподготовка. Термины и определения
ГОСТ 31861 Вода. Общие требования к отбору проб
В Российской Федерации действует ГОСТ Р 56237-2014 (ИСО 5667-5:2006) «Вода питьевая. Отбор проб на станциях водоподготовки и в трубопроводах».
Расшифровка анализа воды: термины, показатели, инструкция
Подобрать правильный комплект картриджей для очистки воды можно только после проведения комплексного анализа водопроводной воды или воды из скважины. Сегодня мы обсудим этот важный аспект более подробно, научимся читать анализ воды и узнаем, на что нужно обращать внимание в первую очередь.
Что такое чистая вода?
Начнём мы с того, какая же вода считается чистой и пригодной для питья и в каких нормативных документах это закреплено. СанПИН 2.1.4.1074-01 – определяет требования к качеству воды из водопровода, а ГОСТ 2874-82 описывает требования к питьевой воде и контролю её качества.
Из этих документов мы видим, что качество питьевой воды характеризуется не только содержанием или, скорее, отсутствием в ней тех или иных веществ и микроорганизмов, но и органолептическими показателями – мутностью, цветом, привкусом и запахом. Так же, у каждого компонента содержащегося в воде есть свой класс опасности, установленный Всемирной Организацией здравоохранения (ВОЗ): 1 К – чрезвычайно опасные элементы (ртуть, бериллий); 2 К – высоко опасные составляющие (свинец, нитриты, серебро); 3 К – опасные компоненты (железо, хлор, нитраты, метанол); 4 К – вещества умеренной опасности(фенол, сероводород).
Чем больше в анализе показателей, тем он более комплексный и, соответственно, дорогой. Так как водопроводная вода уже была подвержена предварительной обработке, можно сократить t` анализ до базового уровня. Большинство лабораторий сейчас предлагают анализ на 7 – 25 показателей. В это число входят как базовые (общая жёсткость, водородный показатель pH и т.д.), так и более узконаправленные показатели (содержание, кальция, меди, аммиака и других веществ).
Общий анализ воды
Возьмём продвинутый анализ на 14 показателей и детально разберём его. Обычно он представляет собой таблицу с четырьмя колонками:
Название показателя – с этим всё понятно. Обычно здесь же указаны единицы измерения.
Значение показателя – то значение, которое было получено в результате анализа воды.
Метод испытаний – в этом разделе обычно содержится ссылка на ГОСТ или другой нормативный документ, в рамках которого проводился анализ искомого показателя.
Рис. Анализ воды в лаборатории.
Термины в анализах воды и показатели, отражённые в них:
Железо общее (мг\л или мг\дм3) – так как железо в воде может быть как двухвалентным, так и трёхвалентным и находится в виде различных соединений, при анализе воды выводят общий показатель его содержания. Помимо очевидных побочных эффектов (таких как образование ржавого налёта на сантехнике) повышенное содержание железа оказывает токсическое влияние на органы пищеварения и головной мозг и ускоряет течение воспалительных процессов в организме человека.
Согласно СанПИН предельное допустимое содержание железа – 0,3 мг/л, в странах ЕС и того меньше – 0,2 мг/л.
Жёсткость общая (показатели могут различаться – это и ммоль/дм3 и градусы жёсткости (английский, французский, немецкий) читая анализ воды лучше свериться с открытыми источниками) – повышенная жёсткость воды это основная причина появления накипи на нагревательных элементах бытовой техники, что приводит к уменьшению её срока службы. Хотя ВОЗ не регламентирует величину жёсткости воды по показаниям влияния на здоровье человека, однозначно, жёсткая вода имеет горьковатый привкус, вредит бытовой технике и даже ухудшает моющие свойства мыла и стиральных порошков. Жёсткой считается вода с концентрацией ионов кальция или ионов магния более 8 ммоль/л.
Рис. Жёсткая вода / Мягкая вода.
Запах – как и привкус воды, характеризуется по 6ти бальной шкале, где 0 это полное отсутствие, а 5 это очень сильный запах. Предельно допустимое значение для анализа воды – 2 бала – слабый запах – не привлекающий внимания потребителя, но становящийся заметным, если указать на него.
Рис. Это не таблица английского окулиста, а специальный шрифт Снеллена.
Цветность (градус платино-кобальтовой шкалы) – определяется путём сравнения испытуемой воды с эталонами. Показатель наиболее актуален при анализе природных вод и позволяет выявить присутствие соединений трёхвалентного железа и гумусовых веществ (органические вещества из почвы). Предельно допустимая концентрация – 20 градусов.
Водородный показатель (pH) – очень важный показатель, который в том числе влияет на образование коррозии и накипи, изменяет степень токсичности загрязняющих веществ. Так же, от величины pH зависит то, насколько положительно наша кожа и слизистые воспринимают воду. Нормальным считается pH в пределах 6-9 единиц.
Перманганатная окисляемость (мг/л или мг/дм3) – довольно сложный и важный показатель. Если в двух словах это содержание в воде веществ способных удержать железо от преобразования из двухвалентного в трёхвалентное. Чем выше этот показатель, тем сложнее аэрационной колонне окислить железо и удалить его. Предельно допустимая концентрация – 5 мг/л.
Щёлочность ( ммоль/л или ммоль/дм3) – На организм человека негативно влияет как повышенное так и пониженное содержание щелочей. Однако, оптимальный кислотно-щелочной баланс в потребляемой воде благотворно влияет на работу желудочно-кишечного тракта. Для этого щёлочность воды должна находиться в пределах 0,5 – 6,5 ммоль/л.
Общая минерализация (мг/л или мг/дм3) – суммарное содержание всех минеральных веществ в воде. Показатели будут сильно различаться в зависимости от места забора воды. Исходя из гигиенических требований, общая минерализация должна находиться в пределах от 280 до 1000 мг/л. Из за большого содержания минеральных веществ в употребляемой воде могут развиться болезни пищеварения, повыситься сухость кожи и начаться проблемы с обменом веществ.
Рис. Чтобы вернуть в воду нормальное количество минералов на систему обратного осмоса ставят минерализатор.
Сульфиды (сероводород) (мг/дм3 или мг/л) – в основном, содержаться в глубинных водах, если сульфиды находят в поверхностных водах, то это свидетельствует о протекании неподалёку гнилостных процессов. Вода приобретает гнилостный запах и у неё увеличиваются окислительные свойства. Содержание в воде сульфидов не должно превышать 0,003 м/л.
Свободный хлор (мг/л или мг/дм3) – Как известно, свободный хлор способствует уничтожению всех бактериальных угроз в воде, однако, его избыток опасен для человека. Содержание свободного хлора не должно превышать 0,5 мг/л.
Безусловно, в воде может содержаться ещё куча всего, например различные тяжёлые металлы или нефтепродукты. Всё зависит от исходного источника и множества различных факторов среды.
Инструкция по забору воды:
Как подобрать фильтр для очистки воды?
Теперь, когда мы имеем на руках анализ воды, вопрос подбора фильтра становится для нас гораздо более ясным. Если большинство основных показателей находятся в пределах нормы – мы можем ограничиться стандартным магистральным фильтром серии АКВАБРАЙТ АБФ-10 с установленным в нём верёвочным или спеченным полипропиленовым картриджем. Если же у нас есть небольшие отклонения от норм – актуально приобрести трёхступенчатую систему АКВАБРАЙТ АБФ-ТРИА с наиболее подходящим по ситуации набором картриджей (СТАНДАРТ, УМЯГЧЕНИЕ, АНТИЖЕЛЕЗО). Если же выявлены значительные отклонения от норм, то не обойтись без системы обратного осмоса АКВАБРАЙТ АБФ-ОСМО.