генерализованная инфекция что это такое простыми словами
Цитомегаловирус: что за инфекция и чем опасна?
Цитомегаловирус — вирус герпеса 5 типа.
Цитомегаловирусная (ЦМВ) инфекция, или цитомегалия — хроническое герпесвирусное заболевание человека с возможностью поражения практически всех органов и систем: ЖКТ, бронхо-легочной и мочеполовой систем.
До 80% всех людей на свете инфицированы ЦМВ, но у большинства с ним нет хлопот. Если только речь не идет об иммунодефицитах, беременности и внутриутробном развитии.
Чем же так коварен ЦМВ?
1. ЦМВ отличается высоким тропизмом (любовью) к клеткам слюнных желез и в локализованной форме находится только там.
2. Вирус способен поражать любые клетки практически всех внутренних органов.
3. ЦМВ — хроническая персистирующая инфекция человека. Однажды заразившись, человек инфицирован навсегда, но для здоровых это не опасно.
4. Развитие цитомегалии связано с потерей иммунного контроля над латентным состоянием ЦМВ.
5. Инкубационный период составляет от 20 до 60 дней.
6. Цитомегаловирус передается через близкий физический контакт человека с человеком. Это может происходить через жидкости организма:
Во время беременности заражение происходит через плаценту или непосредственно во время родов.
Инфицирование возможно при поцелуе или при контакте с предметами, на которых есть частички слюны или мочи больного человека.
Основная часть людей заражается в детстве, обычно в яслях или детском саду, т.е. там, где есть много контактов между детьми. Реже инфицирование происходит в возрасте 10-35 лет.
Выделяют следующие формы заболевания:
1. Приобретенная ЦМВ:
3. ЦМВ у ВИЧ-инфицированных и др. лиц с ослабленным иммунитетом.
Что же происходит когда мы инфицируемся ЦМВ?
Первая встреча с вирусом чаще всего протекает бессимптомно. Только в 2% случаев отмечают симптомы, похожие на ОРВИ (повышение температуры, боль в горле, в суставах и мышцах, увеличение лимфатических узлов). У людей с нормальным иммунитетом инфекция обычно не вызывает серьезных осложнений.
Гораздо опаснее врожденная ЦМВ. Чаще всего беременные женщины получают ЦМВ от больных детей младшего возраста. Различные врожденные патологии диагностируют у 10% детей, инфицированных во время внутриутробного развития. Вирус существенно увеличивает риск преждевременных родов, задержки внутриутробного развития, спонтанного прерывания беременности.
ЦМВ относят к группе так называемых TORCH-инфекций, чаще всего связываемых с аномалиями развития плода и патологией беременности. Заражение вирусом может произойти до беременности или непосредственно во время внутриутробного развития ребенка. В первом случае нет клинических проявлений, а в крови выявляются только специфические «поздние» антитела. Такая ситуация не опасна ни для плода, ни для женщины, риск осложнений не превышает 1%.
Первичное инфицирование матери во время беременности связано с большим риском для плода (30–50%).
В результате 10–15% детей могут иметь нарушения слуха или зрения, судороги, замедление внутриутробного развития, микроцефалию (уменьшение размера мозга). После рождения возможны неврологические симптомы, задержка умственного и физического развития, поражение печени, которое чаще всего проявляется желтухой, увеличение селезенки. ⠀ Вот такая вроде как «неопасная» инфекция.
Как же можно заподозрить, что у человек инфицирован ЦМВ?
Симптомы вирусных инфекций, если ты не врач, кажутся одинаковыми.
У здоровых людей заболевание может себя вообще ничем себя не проявлять и человек может даже не узнать, что заразился. Реже болезнь протекает в виде острой ЦМВ, по симптомам напоминающей инфекционный мононуклеоз:
Как правило, выздоровление наступает за 2 недели.
У больных с иммунодефицитом ЦМВ протекает более тяжело, так как вирус быстро распространяется по организму и вызывает:
Заподозрить инфекцию можно по общему анализу крови, где уровень лимфоцитов превышает 50% ( у взрослых) и 72% (у детей до 4,5 лет), и появляются атипичные лимфоциты (мононуклеары).
Точную диагностику ЦМВ проводят с помощью анализа:
ИФА позволяет определить антитела к ЦМВ в сыворотке крови. Оценивают наличие иммуноглобулинов — IgG и IgM.
Высокий уровень IgM в крови больного обычно свидетельствует о первичном инфицировании. При реактивации вируса количество IgM может расти.
Если определяют IgG, то встреча организма с ЦМВ уже не первая; эти антитела остаются на всю жизнь. Их количество может расти при активации вируса.
Расшифровка результатов анализов ведется врачом.
ПЦР определяет наличие специфических для ЦМВ участков ДНК в образцах слюны, грудного молока и т.д.
Как лечить цитомегаловирусную инфекцию?
Вопрос на самом деле сложный. Так как специфического лечения и профилактики ЦМВ-инфекции нет.
В тяжелых случаях применяется посиндромная терапия (в зависимости от вовлечения в инфекционный процесс внутренних органов).
Обоснованием включением в терапевтический комплекс противовирусных средств иммунного действия (интерферонов) является то, что клинические проявления инфекции обычно связаны с иммунодефицитными состояниями различной степени выраженности.
При ЦМВ инфекции всегда наблюдается сниженная выработка собственного интерферона. Учитывая, что ЦМВ является хроническим, персистирующим возбудителем, интерферонотерапия может быть рекомендована и в качестве профилактики обострений.
Но данную терапию назначает врач.
Профилактика ЦМВ
Специфическая профилактика ЦМВ инфекции отсутствует.
Эффективной и безопасной вакцины против ЦМВ пока не существует.
Вирус передается при половых контактах, поцелуях, совместном использовании столовых приборов, игрушек, зубных щеток. Поэтому соблюдение общих правил гигиены, мытье рук с мылом перед приготовлением еды, после похода в туалет или смены подгузника поможет предотвратить заражение. При контакте с биологическими жидкостями (спермой, мочой) необходимо использовать резиновые перчатки.
Уязвимым группам пациентов — например, принимающим иммунодепрессанты после пересадки органов или беременным — нужно более тщательно соблюдать гигиенические правила.
По возможности нужно избегать контакта с маленькими детьми (особенно до 5 лет) и тем более не целовать их, не есть с ними из одной посуды.
Что такое инфекция цитомегаловирусная? Причины возникновения, диагностику и методы лечения разберем в статье доктора Александрова Павла Андреевича, инфекциониста со стажем в 13 лет.
Определение болезни. Причины заболевания
Цитомегаловирусная болезнь (ЦМВИ, цитомегалия, вирусная болезнь слюнных желёз, болезнь с включениями) — это общее системное инфекционное заболевание, вызываемое вирусом семейства герпесов V типа — цитомегаловирусом, который специфически поражает лейкоциты и клетки различных органов (слюнных желёз, почек, лёгких, печени, головного мозга и другие).
Клинически характеризуется многообразием проявлений — от бессимптомного течения до генерализованных (распространённых) форм с поражением внутренних органов и центральной нервной системы, а также пожизненного пребывания в организме.
Этиология
Вид — Cytomegalovirus hominis (открыт в 1956 году)
Является древним человеческим вирусом (предположительно с Кембрийского периода), который в ассоциации с другими герпесвирусами оказал значительное влияние на формирование иммунитета современного человека.
Внутривидовая структура неоднородна. Известно о трёх штаммах вируса: Davis, АД 169, Kerr и Towne. Они могут иметь различия в тропизме к тканям человека, различаться по степени вирулентности и патогенности.
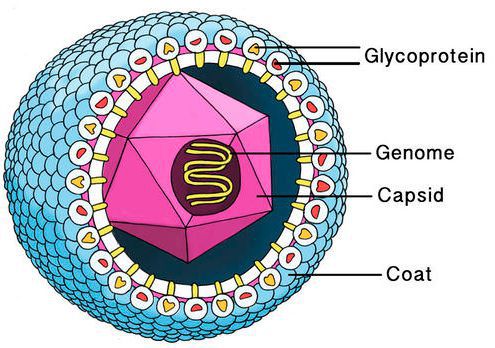
Цитомегаловирус имеет внешнюю гликопротеиновую оболочку, в составе которой есть B и H звенья — к ним формируются антитела. Представляет собой двухцепочечный ДНК-содержащий крупный вирус с диаметром нуклеокпсида до 180 нм.
Вирус способен поражать практически любую ткань человеческого организма, т.е. обладает политропностью. При развитии в ядрах инфицированных клеток образует включения (незрелые вирионы), описываемые как «глаз совы».
Вызывает цитомегалию (увеличение) клеток, не приводя к их гибели. Способен при активном течении значительно снижать иммунитет. Возможна трансплацентарная передача вируса с развитием врождённой инфекции.
Культивируется на культуре фибробластов (клеток соединительной ткани) человека. Изменения хромосомного набора клеток не вызывает. Очень чувствительны к ЦМВ клетки плода и новорождённого.
Малоустойчив в окружающей среде, быстро погибает при повышении температуры до 56°С и действии дезинфицирующих средств, теряет заражающие свойства при замораживании. В условиях комнатной температуры способен сохраняться в течение нескольких дней. [1] [3] [4] [8]
Эпидемиология
Антропоноз. Источник инфекции — только человек (больной различными формами и носитель), причём выделение вируса возможно в течение всей жизни человека и зависит от его индивидуальных иммунологических особенностей. Возможно заражение различными штаммами ЦМВ, роль этого в изменении патологии и клинической картине пока не выяснена.
Как передаётся цитомегаловирус
Механизмы передачи вируса:
Факторами передачи вируса выступают слюна (преимущественно), моча, кровь, вагинальный секрет, слёзы, сперма, фекалии, грудное молоко.
Восприимчивость среди населения высокая, наибольшее количество заражённых выявляется в детском и подростковом возрасте, когда происходит повышение контактных взаимодействий между людьми. Во взрослом состоянии ЦМВ инфицировано до 95% населения планеты, которые являются пожизненными носителями вируса. [1] [2] [3] [8]
Симптомы цитомегаловирусной инфекции
Инкубационный период — от 15 дней до трёх месяцев (при манифестной, т. е. явно выраженной форме).
Врождённая форма цитомегаловирусной инфекции
Цитомегаловирусную инфекцию выявляют примерно у одного из 200 рождённых детей, каждый пятый из них имеет или будет иметь проблемы со здоровьем. Сразу после рождения выявляются низкая масса тела, увеличение печени и селезёнки, желтуха, увеличение всех групп лимфоузлов, высыпания геморрагического характера, различные органные поражения, резкие изменения гемограммы и функциональных тестов. В крови, слюне и моче выявляется вирусная ДНК (в ряде случаев выделение вируса продолжается на протяжении нескольких лет).
Прогноз серьёзен и зависит от тяжести поражения и объёма проводимых лечебных мероприятий. В более поздние сроки инфицирования беременной вероятность тяжёлых проявлений заболевания существенно ниже, и новорождённые, как правило, не имеют симптомов врождённой ЦМВ-инфекции на начальных этапах после родов, однако это не говорит о полном клиническом благополучии в будущем — возможно поражение нервной системы различной степени выраженности и нейросенсорная тугоухость. Поэтому такие дети нуждаются в обследовании и наблюдении профильных специалистов, а при необходимости — в лечении. [1] [2] [3] [5] [8] [10]
Приобретённая форма цитомегаловирусной инфекции
При приобретённых формах заболевание чаще всего протекает в детском или подростковом возрастах. В эти периоды отмечается наибольшая лабильность иммунной системы (имеет значение при группе «детских инфекций»).
Чаще всего первичное инфицирование протекает или бессимптомно, или по типу ОРЗ нетяжёлого течения. Наблюдаются лёгкая слабость, субфебрилитет (температура 37,1-38,0°С), дискомфорт в мышцах, першение в горле, иногда насморк, увеличение лимфатических узлов шеи, увеличение и болезненность слюнных желёз.
Зачастую такие проявления не вызывают настороженности в плане ЦМВ и самостоятельно купируются в течение 1-2 недель — болезнь переходит в стадию латентного течения (носительство).
При инфицировании в более позднем возрасте (взрослые люди), а также у некоторых детей (с нарушением иммунитета) и ослабленных больных заболевание, как правило, протекает с явными морфофункциональными нарушениями и гораздо тяжелее, чем у первой группы лиц. Наблюдается:
Синдром тонзиллита не характерен. Увеличивается печень и селезёнка, значимо изменяются показатели гемограммы и функциональных печёночных проб.
В зависимости от состояния иммунной системы и возможностей её коррекции клинически значимая первичная инфекция у данной группы людей продолжается в течение 1-3 месяцев и, как правило, завершается победой организма над вирусной экспансией с последующим формированием вирусоносительства без каких-либо явных клинических проявлений.
В некоторых случаях (ВИЧ-инфекция, онкологические заболевания, длительный приём цитостатических препаратов, генетические дефекты иммунной системы) может наблюдаться длительное волнообразное течение первичной инфекции или реактивация (обострение) имеющегося носительства вируса (латентной формы). В этом случае отмечается:
Мононуклеозоподобный синдром
При выраженной форме болезни может развиться мононуклеозоподобный синдром — слабость, субфебрильная температура (37,1—38,0 °C), увеличение и чувствительность лимфоузлов, увеличение печени и селезёнки, изменения крови вирусного характера.
Симптомы цитомегаловируса у мужчин и женщин
Цитомегаловирусная инфекция поражает людей всех возрастов и полов. Принципиальных отличий в симптомах у мужчин и женщин нет, за исключением поражения половых органов.
Цитомегаловирусная инфекция у беременных
У беременных первичная инфекция может протекать бессимптомно или с ограниченными клиническими проявлениями (чаще всего). При заражении ребёнка (плода) до родов в зависимости от сроков первичного инфицирования женщины (иногда истинной реактивации ЦМВ при СПИДе) возможно развитие врождённой цитомегаловирусной инфекции.
Риск внутриутробной передачи — до 90% от всех случаев инфицирования на любом сроке беременности.
При заражении в ранние сроки беременности высок риск самопроизвольного выкидыша, мертворождения или рождения детей с явными пороками развития (патологии лёгких, головного мозга, почек, сердца, сосудов, органа слуха, психоневрологическими нарушениями).
Интересной особенностью является влияние возраста беременной, на котором произошло первичное инфицирование, на частоту передачи инфекции: у женщин до 20 лет риск передачи в три раза выше и не зависит от сроков беременности, а после 20 лет риск внутриутробного инфицирования существенно ниже
Симптомы хронической цитомегаловирусной инфекции
Болезнь становится хронической, если вирус долго находится в организме и иммунная система не может ему противостоять. Характерны длительная субфебрильная температура (37,1—38,0 °C) и слабость. Может увеличиться печень, лимфоузлы (чаще нескольких разных групп), иногда селезёнка, возникает поражение глаз и миокардит.
Цитомегаловирусная инфекция у людей с нормальным иммунитетом
Заболевание носит всеобщий характер и чаще всего не сопровождается сколько-нибудь значимыми отклонениями в жизнедеятельности человека, т.е. иммунная система среднестатистического жителя планеты способна самостоятельно найти достойный выход из ситуации.
Цитомегаловирусная инфекция при СПИДе
При СПИДе болезнь протекает крайне тяжело — может развиться генерализованная форма инфекции, т. е. поражаются различные органы:
Прогноз часто неблагоприятен. Генерализованная форма цитомегаловирусной инфекции может также развиваться у пациентов с ослабленным иммунитетом и младенцев.
Патогенез цитомегаловирусной инфекции
Входные ворота — слизистая оболочка различных органов, преимущественно ротоглотки и верхних дыхательных путей (также желудочно-кишечного тракта, мочеполовой системы и других органов).
В месте внедрения никаких структурных и воспалительных изменений не наблюдается. После проникновения вируса в организм он атакует свои главные мишени — лимфо- и моноциты, эпителиальные клетки слюнных желёз, лёгких, почек и других органов.
Поражённые клетки увеличиваются в размерах в 3-4 раза (цитомегалия), в ядре клетки формируются включения (незрелые вирионы), в результате чего клетка приобретает вид «совиного глаза». При активном течении болезни развивается депрессия большинства звеньев иммунитета, в том чичле и белка ИНФ-α.
В дальнейшем в ответ на проникновение ЦМВ развивается защитная реакция в виде образования специфических антител различных классов, активации Т-киллеров и развития реакций гиперчувствительности замедленного типа, проявляющейся в поражённых органах образованием узелковых лимфомоноцитарных инфильтратов.
Однако инфицированные клетки не погибают, а продолжают функционировать и выделяют специальный слизисто-белковый секрет, который, обволакивая вирионы, обеспечивает маскировку вируса от иммунной системы человека. Это выражается в слабом иммунном ответе и переходу острого заболевания в длительный латентный процесс (носительство).
При слабой репликации и равновесных отношениях с иммунитетом вирус может длительно (пожизненно) сохранятся в организме в состоянии относительной стабильности, не вызывать никаких органных поражений и не причинять никаких неудобств человеку. Вирусную ДНК при таком состоянии в крови выявить не удаётся, однако в эпителии слюнных желёз и моче вирус можно обнаружить (обычно в незначительном количестве).
При значительном снижении иммунитета (ВИЧ, онкологические заболевания, пересадка органов, длительный приём цитостатиков) происходит активизация вирусной репликации, вирус попадает в кровь и вновь атакует различные органы. [1] [3] [10]
Классификация и стадии развития цитомегаловирусной инфекции
Общепринятой классификации не существует, она разнится в зависимости от особенностей медицинского подхода к проблематике заболевания.
Классификация по клинической форме:
1. Приобретённая ЦМВ:
○ генерализованная (мононуклеозоподобная, лёгочная, церебральная и почечная, печёночный гепатит, с поражением ЖКТ, комбинированного вида);
Отдельно выделяют цитомегаловирусную болезнь у ВИЧ-инфицированных.
Классификация по МКБ-10:
Классификация по степени тяжести:
Осложнения цитомегаловирусной инфекции
Осложнения при цитомегалии бывают специфическими неспецифическими.
Специфические осложнения:
Неспецифические осложнения обусловлены наслоением вторичной бактериальной флоры. Это гнойные осложнения — повышение температуры тела до 41°С, соответствующие симптомы поражения определенных органов, нейтрофильный лейкоцитоз. [1] [3] [9] [10]
Диагностика цитомегаловирусной инфекции
Лабораторная диагностика:
Также проводится инструментальная диагностика:
Дифференциальная диагностика:
Лечение цитомегаловирусной инфекции
Лечение бессимптомной цитомегаловирусной инфекции
Бессимптомные носители цитомегаловирусной инфекции, как правило, не нуждаются в лечении. Исключением могут быть пациенты, которые получают сильную терапию, выраженно угнетающую иммунную систему. В таком случае может возникнуть опасное обострение инфекции, т. е. лечение проводится для профилактики.
Лечение цитомегаловирусной инфекции лёгкой степени тяжести
Лечения проводится в амбулаторных условиях. Важно отметить, что заболевание носит всеобщий характер и чаще всего не сопровождается сколько-нибудь значимыми отклонениями в жизнедеятельности человека. Это определяет основную лечебно-диагностическую тактику при выявлении активной (острой) ЦМВ-инфекции (при отсутствии тяжёлого течения и осложнений) — это здоровое питание, полноценный отдых и динамическое наблюдение. Лишь в случаях упорного течения и выраженных отклонений клинико-лабораторного характера следует подключать средства медикаментозного лечения.
Лечение средней и тяжёлой формы цитомегаловирусной инфекции
Больные средней тяжести, тяжёлые пациенты и дети неонатального возраста подлежат стационарному обследованию, наблюдению и лечению.
Принципы лечения цитомегаловируса должны отвечать следующим требованиям:
Медикаментозное лечение
С учётом индивидуальных особенностей проводится этиотропная терапия, направленная на ослабление вируса, прекращение его генерализованной циркуляции (персистенции) и патогенного потенциала.
В зависимости от условий могут применяться специфические цитомегаловирусные иммуноглобулины, специфические противовирусные препараты прямого противоцитомегаловирусного действия (в основном в условиях реанимации и интенсивной терапии).
В целях повышения сопротивляемости организма показано назначение средств иммунокоррекции и иммунотерапии, патогенетическое и симптоматическое лекарственное обеспечение.
Диета
Питание больных осуществляется согласно тяжести заболевания, проявлениям и возрастному фону. В общем показана диета №5 по Певзнеру с отказом от жирной, жареной, острой и раздражающей пищи, механически и химически щадящие питание.
Диспансерное наблюдение
После выписки за переболевшими устанавливается диспансерное наблюдение в течении 6-12 месяцев с периодическими осмотрами профильных специалистов и обследованием, объём и кратность которого определяется лечащим врачом. [1] [2] [5] [8] [10]
Прогноз. Профилактика
Прогноз, как правило, благоприятный (переход в неактивное носительство).
Специальной профилактики заражения не существует.
В очаге заболевания противоэпидемические мероприятия не проводятся, карантина нет.
После клинического выздоровления дети допускаются в коллективы без ограничительных мероприятий.
В целях выявления источников повышенной опасности ЦМВ проводятся обследования донорам крови, органов и тканей, а также беременным женщинам. Если беременная не имеет специфических антител IgG к ЦМВ, за ней следует установить более тщательное наблюдение с трёхкратным обследованием на ЦМВ за время беременности. В это время ей следует по возможности минимизировать общение с детьми, не пользоваться чужой посудой и не целоваться с новыми людьми.
Рекомендовано назначение профилактического лечения больным СПИДом и после трансплантации органов препаратами прямого противовирусного действия.
Вакцина для предотвращения врождённого ЦМВ находится в стадии разработки. [1] [2] [9]
Клинические формы хронической Эпштейн-Барр-вирусной инфекции: вопросы диагностики и лечения
Какие заболевания могут вызвать вирус Эпштейна-Барра? Какие симптомы типичны для ВЭБ-инфекции? Существуют ли строго специфичные для ВЭБ изменения лабораторных показателей? Что включает в себя комплексная терапия ВЭБ-инфекции?
Какие заболевания могут вызвать вирус Эпштейна-Барра? Какие симптомы типичны для ВЭБ-инфекции?
Существуют ли строго специфичные для ВЭБ изменения лабораторных показателей?
Что включает в себя комплексная терапия ВЭБ-инфекции?
В последние годы наблюдается рост числа больных, страдающих хроническими рецидивирующими герпес-вирусными инфекциями, которые во многих случаях сопровождаются выраженным нарушением общего самочувствия и целым рядом терапевтических жалоб. Наиболее широко распространены в клинической практике лабиальный герпес (чаще вызывается Herpes Simplex I), опоясывающий лишай (Herpes zoster) и генитальный герпес (чаще вызывается Herpes simplex II); в трансплантологии и гинекологии часто встречаются заболевания и синдромы, вызванные цитомегаловирусом (Cytomegalovirus). Однако о хронической инфекции, вызванной вирусом Эпштейна-Барр (ВЭБ), и ее формах врачи общей практики осведомлены явно недостаточно.
ВЭБ был впервые выделен из клеток лимфомы Беркетта 35 лет назад. Вскоре стало известно, что вирус может вызывать у человека острый мононуклеоз и назофарингеальную карциному. В настоящее время установлено, что ВЭБ ассоциирован с целым рядом онкологических, преимущественно лимфопролиферативных и аутоиммунных заболеваний (классические ревматические болезни, васкулиты, неспецифический язвенный колит и др.). Кроме того, ВЭБ может вызывать хронические манифестные и стертые формы заболевания, протекающие по типу хронического мононуклеоза [1, 3, 6, 9,12]. Вирус Эпштейна—Барр относится к семейству герпес-вирусов, подсемейство гамма-герпес-вирусов и род лимфокриптовирусов, содержит две молекулы ДНК и обладает способностью, как и другие вирусы этой группы, пожизненно персистировать в организме человека [6, 8]. У части больных на фоне иммунной дисфункции и наследственной предрасположенности к той или иной патологии ВЭБ может вызывать различные заболевания, о которых упоминалось выше. ВЭБ инфицирует человека, проникая через интактные эпителиальные слои путем трансцитоза в нижележащую лимфоидную ткань миндалин, в частности В-лимфоциты [7]. Проникновение ВЭБ в В-лимфоциты осуществляется через рецептор этих клеток CD21 — рецептор к С3d-компоненту комплемента. После инфицирования число пораженных клеток увеличивается посредством вирус-зависимой клеточной пролиферации. Инфицированные В-лимфоциты могут значительное время находиться в тонзиллярных криптах, что позволяет вирусу выделяться во внешнюю среду со слюной.
С инфицированными клетками ВЭБ распространяется по другим лимфоидным тканям и периферической крови. Созревание В-лимфоцитов в плазматические клетки (что происходит в норме при их встрече с соответствующим антигеном, инфектом) стимулирует размножение вируса, а последующая гибель (апоптоз) этих клеток приводит к выделению вирусных частиц [7] в крипты и слюну. В инфицированных вирусом клетках возможно два вида размножения: литический, то есть приводящий к гибели, лизису, клетки-хозяина, и латентный, когда число вирусных копий небольшое и клетка не разрушается. ВЭБ может длительно находиться в В-лимфоцитах и эпителиоцитах назофарингеальной области и слюнных желез. Кроме того, он способен инфицировать другие клетки: Т-лимфоциты, NK-клетки, макрофаги, нейтрофилы, эпителиоциты сосудов [1, 6, 8, 9]. В ядре клетки-хозяина ДНК ВЭБ может формировать кольцевую структуру — эписому, либо встраиваться в геном, вызывая хромосомные нарушения [14].
При острой или активной инфекции преобладает литическая репликация вируса.
Активное размножение вируса может происходить в результате ослабления иммунологического контроля, а также стимуляции размножения клеток, инфицированных вирусом под действием целого ряда причин: острой бактериальной или вирусной инфекции, вакцинации, стрессов и др.
По данным большинства исследователей, сегодня примерно 80—90% населения инфицировано ВЭБ. Первичная инфекция чаще возникает в детском или молодом возрасте. Пути передачи вируса различны: воздушно-капельный, контактно-бытовой, трансфузионный, половой, трансплацентарный. После заражения ВЭБ репликация вируса в организме человека и формирование иммунного ответа могут протекать бессимптомно либо проявляться в виде незначительных признаков ОРВИ. Но при попадании большого количества инфекта и/или наличии в данный период значимого ослабления иммунной системы у пациента может развиться картина инфекционного мононуклеоза. Возможно несколько вариантов исхода острого инфекционного процесса:
Ближайший и отдаленный прогноз для больного с острой инфекцией, вызванной ВЭБ, зависит от наличия и степени выраженности иммунной дисфункции, генетической предрасположенности к тем или иным ВЭБ-ассоциированным заболеваниям (см. выше), а также от наличия ряда внешних факторов (стрессы, инфекции, операционные вмешательства, неблагоприятное воздействие окружающей среды), повреждающих иммунную систему. Было обнаружено, что ВЭБ обладает большим набором генов, дающим ему возможность в определенной мере ускользать от иммунной системы человека. В частности, ВЭБ вырабатывает белки — аналоги ряда человеческих интерлейкинов и их рецепторов, изменяющих иммунный ответ [5]. В период активного размножения вирус продуцирует ИЛ-10-подобный белок, который подавляет Т-клеточный иммунитет, функцию цитотоксических лимфоцитов, макрофагов, нарушает все этапы функционирования естественных киллеров (то есть важнейших систем противовирусной защиты). Другой вирусный белок (BI3) также может подавлять Т-клеточный иммунитет и блокировать активность клеток-киллеров (через подавление интерлейкина-12). Еще одно свойство ВЭБ, как и других герпес-вирусов, высокая мутабельность, позволяет ему на определенное время избегать воздействия специфических иммуноглобулинов (которые были наработаны к вирусу до его мутации) и клеток иммунной системы хозяина. Таким образом, размножение ВЭБ в организме человека может явиться причиной усугубления (возникновения) вторичного иммунодефицита.
Клинические формы хронической инфекции, вызванной вирусом Эпштейна—Барр
Хроническая активная ВЭБ-инфекция (ХА ВЭБИ) характеризуется длительным рецидивирующим течением и наличием клинических и лабораторных признаков вирусной активности [9]. Пациентов беспокоят слабость, потливость, нередко — боли в мышцах и суставах, наличие кожных высыпаний, кашель, затрудненное носовое дыхание, дискомфорт в горле, боли, тяжесть в правом подреберье, прежде нехарактерные для данного больного головные боли, головокружение, эмоциональная лабильность, депрессивные расстройства, нарушение сна, снижение памяти, внимания, интеллекта. Часто наблюдаются субфебрильная температура, увеличение лимфоузлов, гепатоспленомегалия различной степени выраженности. Нередко эта симптоматика имеет волнообразный характер. Иногда больные описывают свое состояние как хронический грипп.
У значительной части больных с ХА ВЭБИ наблюдается присоединение других герпетических, бактериальных и грибковых инфекций (герпес-лабиалис, генитальный герпес, молочница, воспалительные заболевания верхних дыхательных путей и желудочно-кишечного тракта).
ХА ВЭБИ характеризуется лабораторными (косвенными) признаками вирусной активности, а именно относительным и абсолютным лимфомоноцитозом, наличием атипичных мононуклеаров, реже моноцитозом и лимфопенией, в ряде случаев анемией и тромбоцитозом. При исследовании иммунного статуса у больных ХА ВЭБИ наблюдаются изменение содержания и функции специфических цитотоксических лимфоцитов, естественных киллеров, нарушение специфического гуморального ответа (дисиммуноглобулинемия, длительное отсутствие наработки иммуноглобулина G (IgG) или так называемое отсутствие сероконверсии к позднему нуклеарному антигену вируса — EBNA, что отражает несостоятельность иммунологического контроля размножения вируса. Кроме того, по нашим данным, более чем у половины больных снижена способность к стимулированной продукции интерферона (ИФН), повышено содержание сывороточного ИФН, имеют место дисиммуноглобулинемия, нарушение авидности антител (их способности прочно связываться с антигеном), уменьшено содержания DR+лимфоцитов, нередко повышены показатели циркулирующих иммунных комплексов и антител к ДНК.
У лиц с выраженной иммунной недостаточностью возможно возникновение генерализованных форм ВЭБ-инфекции с поражением центральной и периферической нервной систем (развитие менингита, энцефалита, мозжечковой атаксии, полирадикулоневритов), а также с поражением других внутренних органов (развитие миокардита, гломерулонефрита, лимфоцитарного интерстициального пневмонита, тяжелых форм гепатита). Генерализованные формы ВЭБ-инфекции нередко заканчиваются летальным исходом [10, 15].
ВЭБ-ассоциированный гемофагоцитарный синдром характеризуется развитием анемии или панцитопении. Часто сочетается с ХА ВЭБИ, инфекционным мононуклеозом и лимфопролиферативными заболеваниями. В клинической картине преобладают интермиттирующая лихорадка, гепатоспленомегалия, лимфоаденопатия, панцитопения или выраженная анемия, печеночная дисфункция, коагулопатия. Гемофагоцитарный синдром, развивающийся на фоне инфекционного мононуклеоза, характеризуется высокой летальностью (до 35%). Вышеописанные изменения объясняют гиперпродукцией провоспалительных цитокинов (ФНО, ИЛ1 и ряда других) Т-клетками, инфицированными вирусом. Эти цитокины активируют систему фагоцитов (размножение, дифференцировку и функциональную активность) в костном мозге, периферической крови, печени, селезенке, лимфоузлах. Активированные моноциты и гистиоциты начинают поглощать клетки крови, что приводит к их разрушению. Более тонкие механизмы этих изменений находятся в стадии изучения.
Стертые варианты хронической ВЭБ-инфекции
По нашим данным, ХА ВЭБИ нередко протекает стерто или под масками других хронических заболеваний.
Можно выделить две наиболее часто встречающиеся формы латентной вялой ВЭБ-инфекции. В первом случае больных беспокоит длительный субфебрилитет неясного генеза, слабость, боли в периферических лимфоузлах, миалгии, артралгии. Характерна также волнообразность симптоматики [11]. У другой категории больных помимо вышеописанных жалоб имеют место маркеры вторичного иммунодефицита в виде ранее нехарактерных для них частых инфекций дыхательных путей, кожи, желудочно-кишечного тракта, гениталий, которые на фоне терапии полностью не проходят или же быстро рецидивируют. Наиболее часто в анамнезе этих пациентов имеют место длительные стрессовые ситуации, чрезмерные психические и физические перегрузки, реже — увлечение голоданием, модными диетами и т. д. Нередко вышеописанное состояние развивалось после перенесенной ангины, ОРЗ, гриппоподобного заболевания. Характерными для этого варианта инфекции также являются устойчивость и длительность симптоматики — от шести месяцев до 10 и более лет. При повторных обследованиях обнаруживают ВЭБ в слюне и/или лимфоцитах периферической крови. Как правило, повторные углубленные обследования, проводимые у большинства этих пациентов, не позволяют обнаружить других причин длительного субфебрилитета и развития вторичного иммунодефицита.
Очень важен для постановки диагноза ХА ВЭБИ является и тот факт, что в случае устойчивого подавления вирусной репликации удается достичь длительной ремиссии у большинства пациентов. Диагностика ХА ВЭБИ затруднена из-за отсутствия специфических клинических маркеров заболевания. Определенный «вклад» в гиподиагностику вносит и недостаточная информированность практических врачей о данной патологии. Тем не менее, учитывая прогрессирующий характер ХА ВЭБИ, а также серьезность прогноза (риск развития лимфопролиферативных и аутоиммунных заболеваний, высокая летальность при развитии гемофагоцитарного синдрома), при подозрении на ХА ВЭБИ необходимо проводить соответствующее обследование. Наиболее характерный клинический симптомокомплекс при ХА ВЭБИ — это длительный субфебрилитет, слабость и снижение работоспособности, боли в горле, лимфаденопатия, гепатоспленомегалия, печеночная дисфункция, психические нарушения. Важным симптомом является отсутствие полного клинического эффекта от проведения общепринятой терапии астенического синдрома, общеукрепляющей терапии, а также от назначения антибактериальных препаратов.
При проведении дифференциальной диагностики ХА ВЭБИ в первую очередь следует исключить следующие заболевания:
Лабораторные исследования в диагностике ВЭБ-инфекции
Как уже упоминалось выше, все перечисленные изменения не являются строго специфичными для ВЭБ-инфекции (их можно обнаружить и при других вирусных инфекциях).
По нашим данным, в иммунном статусе при ВЭБ-инфекции встречаются два вида изменений: повышенная активность отдельных звеньев иммунной системы и/или дисбаланс и недостаточность других. Признаками напряженности противовирусного иммунитета могут быть повышенные уровни ИФН в сыворотке крови, IgА, IgМ, IgЕ, ЦИК, нередко — появление антител к ДНК, повышение содержания естественных киллеров (CD16+), Т-хелперов (CD4+) и/или цитотоксических лимфоцитов (CD8+). Система фагоцитов может быть активирована.
В свою очередь, иммунная дисфункция/недостаточность при этой инфекции проявляется снижением способности к стимулированной продукции ИФН альфа и/или гамма, дисиммуноглобулинемией (снижение содержания IgG, реже IgА, повышение содержания Ig М), снижением авидности антител (их способности прочно связываться с антигеном), снижением содержания DR+лимфоцитов, CD25+ лимфоцитов, то есть активированных Т-клеток, уменьшением числа и функциональной активности естественных киллеров (CD16+), Т-хелперов (CD4+), цитотоксических Т-лимфоцитов (CD8+), снижением функциональной активности фагоцитов и/или изменением (извращением) их реакции на стимулы, в том числе на иммунокорректоры.
Специфические IgM-АТ появляются в острой фазе заболевания или в период обострения и через четыре–шесть недель, как правило, исчезают. IgG-АТ к ЕА (ранние) также появляются в острой фазе, являются маркерами активной репликации вируса и при выздоровлении снижаются за три–шесть месяцев. IgG-АТ к VCA (ранние) определяются в остром периоде с максимумом ко второй–четвертой неделе, затем их количество снижается, и пороговый уровень сохраняется длительное время. IgG-АТ к EBNA выявляются спустя два — четыре месяца после острой фазы, и их выработка сохраняется в течение всей жизни.
По нашим данным, при ХА ВЭБИ более чем у половины больных в крови определяются «ранние» IgG-АТ, в то время как специфические IgM-АТ определяются значительно реже, при этом содержание поздних IgG-АТ к EBNA колеблется в зависимости от стадии обострения и состояния иммунитета.
Надо отметить, что проведение серологического исследования в динамике помогает в оценке состояния гуморального ответа и эффективности противовирусной и иммунокорригирующей терапии.
Использование данного метода в клинической практике для выявления того или иного внутриклеточного агента из-за слишком высокой его чувствительности нередко затруднено, так как нет возможности отличить здоровое носительство (минимальное количество инфекта) от проявлений инфекционного процесса с активным размножением вируса. Поэтому для клинических исследований используют ПЦР-методику с заданной, более низкой чувствительностью. Как показали наши исследования, применение методики с чувствительностью 10 копий в пробе (1000 ГЭ/мл в 1 мл образца) позволяет выявлять здоровых носителей ВЭБ, в то время как снижение чувствительности метода до 100 копий (10000 ГЭ/мл в 1 мл образца) дает возможность диагностировать лиц с клинико-иммунологическими признаками ХА ВЭБИ.
Мы наблюдали больных с наличием клинических и лабораторных данных (в том числе результатов серологических исследований), характерных для вирусной инфекции, у которых при первичном обследовании анализ на ДНК ВЭБ в слюне и клетках крови был отрицательным. Важно отметить, что в этих случаях нельзя исключить репликацию вируса в желудочно-кишечном тракте, костном мозге, коже, лимфоузлах и др. Только повторное обследование в динамике может подтвердить или исключить наличие или отсутствие ХА ВЭБИ.
Таким образом, для постановки диагноза ХА ВЭБИ помимо проведения общеклинического обследования необходимы исследование иммунного статуса (противовирусного иммунитета), ДНК, диагностика инфекции в различных материалах в динамике, серологические исследования (ИФА).
Лечение хронической Эпштейн—Барр-вирусной инфекции
В настоящее время общепринятых схем лечения ХА ВЭБИ не существует. Однако современные представления о влиянии ВЭБ на организм человека и данные об имеющемся риске развития серьезных, нередко фатальных заболеваний показывают необходимость проведения терапии и диспансерного наблюдения у больных, страдающих ХА ВЭБИ.
Данные литературы и опыт нашей работы позволяют дать патогенетически обоснованные рекомендации по терапии ХА ВЭБИ. В комплексном лечении данного заболевания используют следующие препараты:
Другие группы лекарств, как правило, играют вспомогательную роль.
До начала лечения желательно обследовать членов семьи больного на предмет выделения вирусов (со слюной) и возможности повторного инфицирования пациента, при необходимости подавление вирусной репликации проводят и у членов семьи.
Препаратом выбора является интерферон-альфа, в среднетяжелых случаях назначаемый в виде монотерапии [14]. Хорошо зарекомендовал себя (в том, что касается биологической активности и переносимости) отечественный рекомбинантный препарат реаферон, при этом стоимость его существенно ниже, чем у зарубежных аналогов. Используемые дозы ИФН-альфа различаются в зависимости от веса, возраста, переносимости препарата. Минимальные дозы — 2 млн. ЕД в сутки (по 1 млн. ЕД два раза в день внутримышечно), первую неделю ежедневно, затем три раза в неделю в течение трех–шести месяцев. Оптимальные дозы — 4–6 млн. ЕД (по 2—3 млн. ЕД два раза в день).
ИФН-альфа, как провоспалительный цитокин, может вызвать гриппоподобную симптоматику (лихорадка, головные боли, головокружение, миалгии, артралгии, вегетативные расстройства — изменение АД, ЧСС, реже диспептические явления).
Выраженность указанных симптомов зависит от дозы и индивидуальной переносимости препарата. Это преходящие симптомы (исчезают через 2—5 дней от начала лечения), и часть из них контролируется назначением нестероидных противовоспалительных средств. При лечении препаратами ИФН-альфа могут возникать обратимые тромбоцитопения, нейтропения, кожные реакции (зуд, сыпи разнообразного характера), редко — алопеция. Длительное применение ИФН-альфа в больших дозах может привести к иммунной дисфункции, клинически проявляющейся фурункулезом, другими гнойничковыми и вирусными поражениями кожи.
В среднетяжелых и тяжелых случаях, а также при неэффективности препаратов ИФН-альфа к лечению необходимо подключать аномальные нуклеодиты — валацикловир (валтрекс), ганцикловир (цимевен) или фамцикловир (фамвир).
Курс лечения аномальными нуклеотидами должен составлять не менее 14 дней, первые семь дней желательно внутривенное введение препарата.
В случаях тяжелого течения ХА ВЭБИ в комплексную терапию включают также препараты иммуноглобулинов для внутривенного введения в дозе 10—15 г. При необходимости (по результатам иммунологического обследования) — назначают иммунокорректоры с Т-активирующей способностью или замещающие тимические гормоны (тимоген, иммунофан, тактивин, и др.) в течение одного-двух месяцев с постепенной отменой или переходом на поддерживающие дозы (два раза в неделю).
Лечение ВЭБ-инфекции необходимо проводить под контролем клинического анализа крови (один раз в 7—14 дней), биохимического анализа (один раз в месяц, при необходимости чаще), иммунологического исследования — через один-два месяца.
К противовирусной терапии препаратами ИФН-альфа и аномальными нуклеотидами в первую очередь подключают системные кортикостероиды в дозах: парентерально (в пересчете на преднизолон) 120–180 мг в сутки, или 1,5–3 мг/кг, возможно использование пульс-терапии метипредом 500 мг в/в капельно, или внутрь по 60–100 мг в сутки. Внутривенно вводят плазму и/или препараты иммуноглобулинов для внутривенного введения. При выраженной интоксикации показаны введение детоксицирующих растворов, плазмаферез, гемосорбция, назначение антиоксидантов. В тяжелых случаях применяют цитостатики: этопозид, циклоспорин (сандиммун или консупрен).
Лечение назначают при появлении клиники ВЭБ-инфекции или при формировании признаков ВИД.
Проведение комплексной терапии с включением указанных выше препаратов позволяет добиться ремиссии заболевания у части пациентов с генерализованной формой заболевания и при гемофагоцитарном синдроме. У больных со среднетяжелыми проявлениями ХА ВЭБИ и в случаях стертого течения заболевания эффективность терапии выше (70—80%) помимо клинического эффекта часто удается добиться подавления репликации вируса.
После подавления размножения вируса и получения клинического эффекта важно продлить ремиссию. Показано проведение санаторно-курортного лечения.
Больных следует информировать о важности соблюдения режима труда и отдыха, полноценного питания, ограничения/прекращения приема алкоголя; при наличии стрессовых ситуаций необходима помощь психотерапевта. Кроме того, при необходимости проводят поддерживающую иммунокорригирующую терапию.
Таким образом, лечение больных с хронической Эпштейн—Барр-вирусной инфекцией является комплексным, проводится под лабораторным контролем и включает применение препаратов интерферона-альфа, аномальных нуклеотидов, иммунокорректоров, заместительных иммунотропных препаратов, глюкокортикоидных гормонов, симптоматических средств.
Литература
И. К. Малашенкова, кандидат медицинских наук
Н. А. Дидковский, доктор медицинских наук, профессор
Ж. Ш. Сарсания, кандидат медицинских наук
М. А. Жарова, Е. Н. Литвиненко, И. Н. Щепеткова, Л. И. Чистова, О. В. Пичужкина
НИИ физико-химической медицины МЗ РФ
Т. С. Гусева, О. В. Паршина
ГУНИИ эпидемиологии и микробиологии им. Н. Ф. Гамалеи РАМН, Москва
Клиническая иллюстрация случая хронической активной ВЭБ-инфекции с гемофагоцитарным синдромом
Больная И. Л., 33 лет, обратилась в лабораторию клинической иммунологии НИИ ФХМ 20.03.97 с жалобами на длительный субфебрилитет, выраженную слабость, потливость, боли в горле, сухой кашель, головные боли, одышку при движении, учащенное сердцебиение, нарушения сна, эмоциональную лабильность (повышенную раздражительность, обидчивость, плаксивость), забывчивость.
Из анамнеза: осенью 1996 года после тяжелой ангины (сопровождавшейся сильной лихорадкой, интоксикацией, лимфоаденопатией) возникли вышеуказанные жалобы, длительно сохранялись увеличение СОЭ, изменения лейкоцитарной формулы (моноцитоз, лейкоцитоз), была выявлена анемия. Амбулаторное лечение (антибиотикотерапия, сульфаниламиды, препараты железа и др.) оказалось неэффективным. Состояние прогрессивно ухудшалось.
При поступлении: t тела — 37,8°С, кожные покровы повышенной влажности, выраженная бледность кожи и слизистых. Лимфоузлы (подчелюстные, шейные, подмышечные) увеличены до 1-2 см, плотноэластической консистенции, болезненные, не спаяны с окружающими тканями. Зев гиперемирован, отечен, явления фарингита, миндалины увеличены, рыхлые, умеренно гиперемированы, язык обложен бело-серым налетом, гиперемирован. В легких дыхание с жестким оттенком, рассеянные сухие хрипы на вдохе. Границы сердца: левая увеличена на 0,5 см влево от среднеключичной линии, тоны сердца сохранены, короткий систолический шум над верхушкой, ритм неправильный, экстрасистолия (5—7 в мин), ЧСС — 112 в мин, АД — 115/70 мм рт ст. Живот вздут, умеренно болезненный при пальпации в правом подреберье и по ходу толстой кишки. По данным УЗИ органов брюшной полости, незначительное увеличение размеров печени и — в несколько большей степени — селезенки.
Из лабораторных анализов обращали на себя внимание нормохромная анемия со снижением Hb до 80 г/л с анизоцитозом, пойкилоцитозом, полихроматофилией эритроцитов; ретикулоцитоз, нормальное содержание сывороточного железа (18,6 мкм/л), отрицательная реакция Кумбса. Кроме того, наблюдались лейкоцитоз, тромбоцитоз и моноцитоз с большим количеством атипичных мононуклеаров, ускорение СОЭ. В биохимических анализах крови отмечались умеренное повышение трансаминаз, КФК. ЭКГ: ритм синусовый, неправильный, предсердная и желудочковая экстрасистолия, ЧСС до 120 в минуту. Электрическая ось сердца отклонена влево. Нарушение внутрижелудочковой проводимости. Снижение вольтажа в стандартных отведениях, диффузные изменения миокарда, в грудных отведениях наблюдались изменения, характерные для гипоксии миокарда. Также был существенно нарушен иммунный статус — повышено содержание иммуноглобулина М (IgМ) и снижено иммуноглобулинов А и G (IgА и IgG), наблюдалось преобладание продукции низкоавидных, то есть функционально неполноценных антител, дисфункция Т-звена иммунитета, повышение уровня сывороточного ИФН, снижение способности к продукции ИФН в ответ на многие стимулы.
В крови были повышены титры IgG-антител к ранним и поздним вирусным антигенам (VCA, EA EBV). При вирусологическом исследовании (в динамике) методом полимеразной цепной реакции (ПЦР) в лейкоцитах периферической крови была обнаружена ДНК ВЭБ.
В эту и последующие госпитализации проводились углубленное ревматологическое обследование и онкологический поиск, были исключены также другие соматические и инфекционные заболевания.
Больной были поставлены следующие диагнозы: хроническая активная ВЭБ-инфекция, умеренная гепатоспленомегалия, очаговый миокардит, соматогенно обусловленная персистирующая депрессия; вирусассоциированный гемофагоцитарный синдром. Иммунодефицитное состояние; хронический фарингит, бронхит смешанной вирусно-бактериальной этиологии; хронический гастрит, энтерит, дисбиоз кишечной флоры.
Несмотря на проведенную беседу, от введения глюкокортикоидов и препаратов интерферона-альфа больная категорически отказалась. Было проведено лечение, включающее противовирусную терапию (виролекс внутривенно в течение недели, с переходом на зовиракс 800 мг 5 раз в день per os), иммунокорригирующую терапию (тимоген по схеме, циклоферон 500 мг по схеме, иммунофан по схеме), заместительную терапию (октагам по 2,5 г два раза внутривенно капельно), детоксикационные мероприятия (инфузии гемодеза, энтеросорбция), антиоксидантную терапию (токоферрол, аскорбиновая кислота), использовали препараты-метаболики (эссенциале, рибоксин), назначалась витаминотерапия (поливитамины с микроэлементами).
После проведенного лечения у больной нормализовалась температура, уменьшились слабость, потливость, улучшились некоторые показатели иммунного статуса. Однако полностью подавить репликацию вируса не удалось (ВЭБ продолжал определяться в лейкоцитах). Клиническая ремиссия продолжалась недолго — через полтора месяца наступило повторное обострение. При исследовании помимо признаков активации вирусной инфекции, анемии, ускорения СОЭ были выявлены высокие титры антител к сальмонелле. Проводилось амбулаторное лечение основного и сопутствующего заболевания. Тяжелое обострение началось в январе 1998 года после острого бронхита и фарингита. По данным лабораторных исследований, в этот период отмечались утяжеление анемии (до 76 г/л) и нарастание количества атипичных мононуклеаров в крови. Отмечалось нарастание гепатоспленомегалии, в мазке из зева найдены Chlamidia Trachomatis, золотистый стафилококк, стрептококк, в моче — Ureaplasma Urealiticum, в крови обнаружено существенное повышение титров антител к EBV, CMV, вирусу простого герпеса 1-го типа (HSV 1). Таким образом, у больной увеличивалось число сопутствующих инфекций, что также свидетельствовало о нарастании недостаточности иммунитета. Проводилась терапия индукторами интерферона, заместительная терапия Т-активаторами, антиоксидантами, метаболиками, длительная детоксикация. Заметный клинический и лабораторный эффект был достигнут к июню 1998 года, пациентке рекомендовано продолжить метаболическую, антиоксидантную, иммунозаместительную терапию (тимоген и др.). При повторном исследовании осенью 1998 года в слюне и лимфоцитах ВЭБ не определялся, хотя сохранялись умеренная анемия и иммунная дисфункция.
Таким образом, у больной И., 33 лет, острая ВЭБ-инфекция приняла хроническое течение, осложнилась развитием гемофагоцитарного синдрома. Несмотря на то что удалось достигнуть клинической ремиссии, больная нуждается в динамическом наблюдении с целью как контроля репликации ВЭБ, так и своевременной диагностики лимфопролиферативных процессов (учитывая высокий риск их развития).