гемохроматоз печени что это такое и лечение
Гемохроматоз. Симптомы, причины, диагностика и лечение гемохроматоза.
1. Что такое гемохроматоз и его симптомы?
Гемохроматоз означает, что в организме накапливается слишком много железа. Вообще железо необходимо организму для выработки гемоглобина, который переносит кислород ко всем клеткам. Но когда железа становится очень много, это может привести к проблемам с печенью и сердцем, развитию диабета и артрита.
Без лечения у людей с гемохроматозом процесс накопления железа происходит постоянно, поэтому лечить гемохроматоз нужно обязательно. Без этого опасно высокое содержание железа становится причиной повреждения органов и тканей.
Чаще всего гемохроматоз является наследственной проблемой. Но иногда он возникает в результате большого количества переливаний крови, некоторых заболеваний крови, заболеваний печени, алкоголизма или приема большого количества железосодержащих лекарств. У мужчин гемохроматоз развивается чаще, чем у женщин – в женском организме излишек железа может выводиться из организма через кровь во время менструального цикла и при беременности.
Симптомы гемохроматоза
Часто симптомы гемохроматоза появляются у людей только после 40 лет и позже. Это связано с тем, что лишнее железо накапливается медленно и на протяжении всей жизни человека. И болезнь проявляется только тогда, когда уровень содержания железа достигает определенного порога.
Ранние симптомы гемохроматоза не очень конкретны. Так что диагностировать гемохроматоз бывает сложно. Первыми признаками гемохроматоза могут быть:
2. Диагностика заболевания
Для того, чтобы поставить диагноз гемохроматоз, врач проведет общий осмотр. А анализ крови поможет увидеть переизбыток железа в организме.
В большинстве случаев, как мы уже говорили, гемохроматоз обусловлен наследственным геном. Это аутоиммунно-рецессивное заболевание, которое может передаваться от родителей к детям. Даже на ранней стадии гемохроматоз может быть обнаружен с помощью анализа крови. Поэтому если у вас есть это заболевание, необходимо сделать анализ крови и детям. Еще один вариант проверки – это генетическое тестирование. Но в целом генетический скрининг не рекомендуется в качестве общей меры для выявления риска гемохроматоза для всех людей. Гемохроматоз встречается редко, и столь серьезная мера обычно не требуется для общей профилактики болезни.
3. Лечение болезни
Для лечения гемохроматоза могут использоваться разные методы, в том числе:
При правильном лечении гемохроматоза удается быстро и безопасно вывести избыток железа из организма, остановить прогрессирование заболевания и развитие возможных осложнений, а также предотвратить повреждение органов – в первую очередь, печени и сердца.
Если гемохроматоз вызван наследственным фактором, поддерживающая терапия и лечение обычно требуются на протяжении всей жизни. Но бывает и так, что причиной гемохроматоза становится переливание крови или передозировка витаминов. В этом случае проблема является временной, и однократное лечение позволяет решить проблему полностью.
4. Можно ли предотвратить гемохроматоз?
Гемохроматоз у кого-то из ваших родственников еще не означает, что у вас тоже будет это заболевание. Но если вы унаследовали ген, вызывающий эту болезнь, вероятность столкнуться с проблемой переизбытка железа повышается. Важно следить за своим самочувствием, чтобы при появлении первых признаков гемохроматоза начать лечение как можно раньше. Своевременное лечение гемохроматоза позволяет справиться с большинством симптомов болезни и предотвратить проблемы со здоровьем в будущем.
Заболеть гемохроматозом из-за употребления пищи, богатой железом, довольно сложно. Но всегда важно обращать внимание на то, сколько железа вы получаете из пищи и из витаминов или минеральных добавок. Вот некоторые простые меры, которые помогут убедиться в том, что в ваш организм не поступает слишком много железа из пищи и напитков.
Очень важно, что все эти рекомендации не являются абсолютными и нужными для всех. По статистике, недостаток железа в организме и низкий гемоглобин встречаются чаще, чем гемохроматоз. Поэтому стараться всеми силами уменьшить употребление железа не нужно, если для этого нет необходимых предпосылок или рекомендаций врача.
Гемохроматоз
Симптоматика
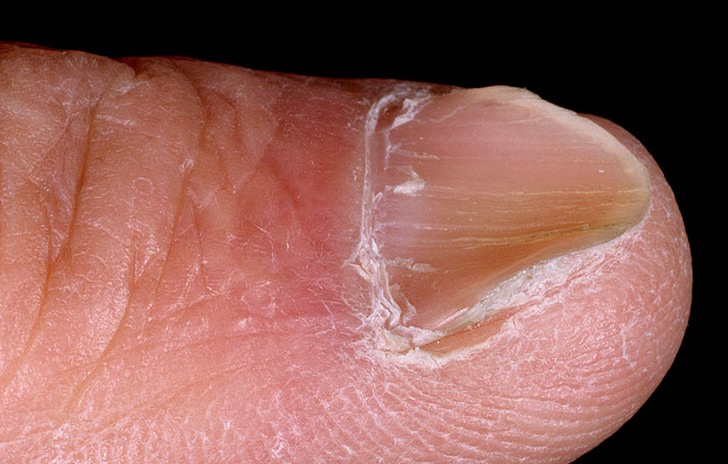
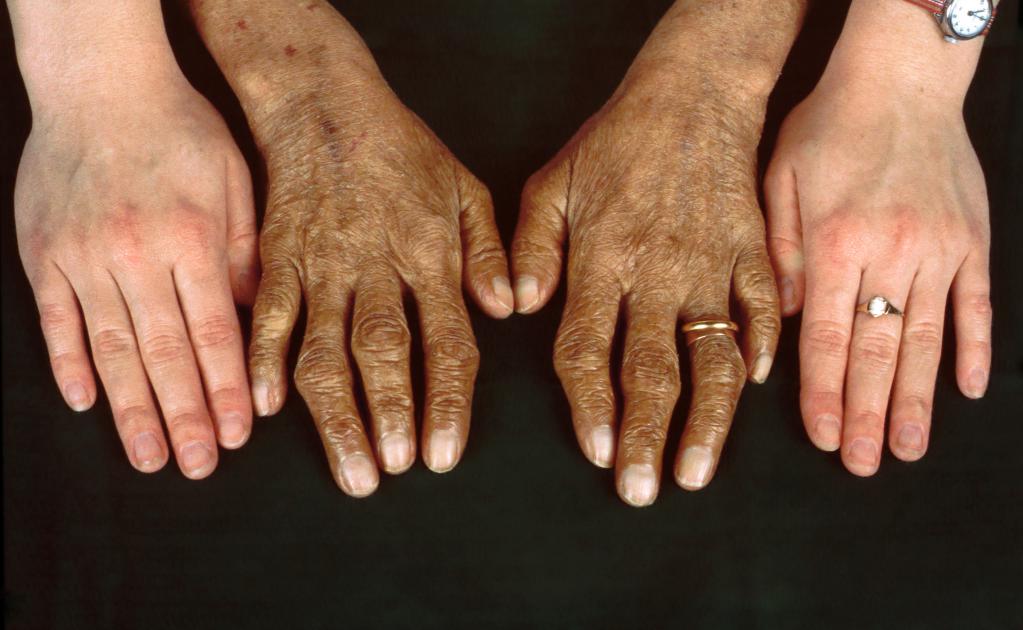
Клиническая картина начального этапа заболевания выражена неярко. Симптомами начала гемохроматоза могут быть: общая слабость, быстрая утомляемость, снижение либидо, боль в правом подреберье, потеря веса и другие. Когда показатель уровня содержания железа в организме близок к критической отметке (20–40 грамм в зависимости от физиологических особенностей организма) или достигает ее, появляются специфические для заболевания признаки. Наиболее явным симптомом прогрессирующего гемохроматоза является изменение пигментации кожи, слизистых оболочек. Может наблюдаться выпадение волос, деформация ногтей, артропатия, увеличение печени. При тяжелом течении болезни появляются такие патологии, как гиперпигментация (бронзовая кожа, желтушность глазных склер), цирроз печени, почечная, сердечная недостаточность.
Диагностическое обследование
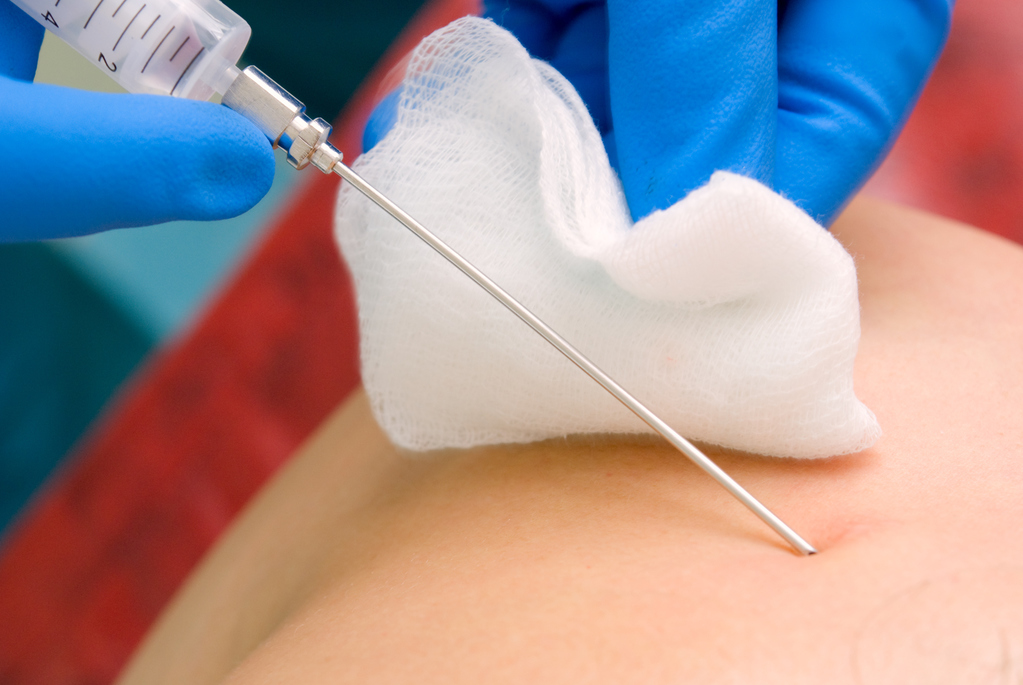
Обследование начинается со сбора анамнеза не только больного, но и его ближайших родственников, чтобы выявить или исключить фактор наследственности. Наиболее часто используется лабораторная диагностика, которая позволяет определить уровень железа (железосодержащих белков) в сыворотке крови, скорость его выведения с мочой. Молекулярно-генетическое исследование направлено на выявление наследственной природы заболевания. Одним из способов подтверждения диагноза является пункционная биопсия, которую проводят для обнаружения пигмента гемосидерина, образующегося при интенсивном всасывании железа.
Лечение
Лечение может быть определено только врачом на основании всестороннего обследования. Одними из основных назначений являются следующие.
Диета. Специальный рацион исключает употребление пищи с высоким содержанием железа.
Медикаментозная и симптоматическая терапия. Для лечения гемохроматоза используются препараты, призванные связывать и выводить ионы железа из организма. Одновременно проводится симптоматическая терапия с целью предотвращения развития патологий, возникших на фоне заболевания.
Гемохроматоз — причины, симптомы и лечение
Являясь одним из наиболее важных микроэлементов, железо содержится в целом ряде пищевых продуктов. Его основными источниками служат красное мясо, яблоки, специально обогащённый хлеб и крупы. Железо содержится в составе молекулы гемоглобина (присоединившей железо протопорфирин-IX). В составе красных кровяных телец – эритроцитов, доставляет из лёгких кислород по всему телу. Организм здорового человека содержит от 3 до 4 грамм железа. Однако при гемохроматозе этот показатель возрастает до 20-60 г.
Такое обусловленное генетической наследственностью заболевание, как гемохроматоз, проявляется в накоплении железа в органах и тканях, вызываемом нарушением его обмена. Местами чрезмерной концентрации этого поступающего из пищи элемента становятся различные органы и ткани организма: печень и поджелудочная железа, селезёнка и миокарда, эндокринные железы и кожа. Переизбыток накопленного железа нередко провоцирует развитие цирроза печени, сердечной недостаточности, сахарного диабета, артрита и ряда других заболеваний.
Учёные американского гринвиллского Института расстройств желез, расположенного в Южной Каролине, подсчитали, что в США около 150 тысяч диагностированных больных гемохроматозом и около миллиона человек имеют предрасположенность к этому заболеванию. То есть вероятность его развития составляет треть процента. Помимо первичного (классического) гемохроматоза, различают и вторичный. Он связан с многократным переливанием крови, повторными кризами мегалобластной и гемолитической анемий, просчётами в лечении препаратами железа.
Симптомами гемохроматоза могут стать артрит, суставные боли, усиленная пигментация кожи. Кроме того, так как в организме человека до 90% железа поглощаются печенью, проявления заболевания могут варьировать в довольно широких пределах. В оказывающих медицинские услуги учреждениях диагностика гемохроматоза довольно проста. Так как это заболевание, как правило, наследственное, она обеспечивается сочетанием тщательно собранного семейного анамнеза и лабораторной диагностики.
Клиническими симптомами служат быстрая утомляемость и слабость, выраженное похудание, сахарный диабет, снижение давления, болезненность и отёчность суставов, сердечная недостаточность, грифельно-серый с коричневым оттенком цвет кожи, гиперпигментация сетчатки и слизистых оболочек. При лечении гемохроматоза применяется богатая белком диета с ограниченным количеством содержащих железо продуктов (яиц, мёда, рыбы, мяса, яблок и т.д.). Алкоголь категорически противопоказан.
Рекомендуются флеботомия или венесекция – кровопускания, способствующие удалению железа из организма и уменьшающие пигментацию и размер печени, улучшающие общее состояние. Медикаментозное лечение строится на связывающих железо и способствующих его выведению препаратах дефероксамин и Б-десфераль. Прогнозируется лечение заболевания в зависимости от длительности его течения до момента диагностики.
Поражения печени при гемохроматозе: клинические проявления и диагностика
В данной статье приведены сведения об этиопатогенезе гемохроматоза, представлена клиническая симптоматика заболевания, а также методы лабораторной и инструментальной диaгнoстики, oснoвные подходы к терапии.
В данной статье приведены сведения об этиопатогенезе гемохроматоза, представлена клиническая симптоматика заболевания, а также методы лабораторной и инструментальной диaгнoстики, oснoвные подходы к терапии.
Гемохроматоз – наследственно обусловленное или приобретенное заболевание из группы болезней накопления, характеризующееся нарушением обмена железа с его патологически высоким депонированием в жизненно важных органах, в частности печени [1]. Синдром перегрузки железом может самостоятельно вызывать патологию печени или способствовать прогрессированию уже имеющихся хронических диффузных заболеваний печени [2].
Перегрузка железом (гемосидероз) – патофизиологический процесс, связанный с формированием отложений гемосидерина (темно-желтого пигмента на основе оксида железа). Гемосидероз начинается прежде всего в тканях печени, впоследствии затрагивает другие ткани организма (почки, сердце, головной мозг и др.). Гемосидероз стимулирует развитие провоспалительных реакций, интенсификацию окислительного стресса (в том числе перекисного окисления липидов), повреждение паренхимы органов с развитием фиброза [3].
Диагноз чаще устанавливается на стадии сформированного гемохроматоза – при циррозе, кардиопатии и/или диабете, наличии фенотипических признаков перегрузки железом – гиперферритинемии (> 200 нг/мл у женщин и > 300 нг/мл у мужчин), сатурации трансферрина (> 45%).
Возможности лечения на стадии сформированного гемохроматоза, когда уровень ферритина превышает 1000 нг/мл, ограниченны, поскольку гемосидерин, представляющий собой деградированный ферритин, удалить из тканей крайне сложно [4].
Основная проблема дифференциальной диагностики синдрома перегрузки железом – установление первичного характера избыточного накопления железа. Помимо постановки диагноза у конкретного больного подтверждение первичного (наследственного) характера заболевания определяет необходимость проведения обследования и профилактики развития заболевания у родственников [5].
Высокая частота встречаемости наследственного гемохроматоза (по некоторым данным, до восьми случаев на 1000 населения) предполагает гетерозиготное носительство патологического гена у 10–13% населения. В России диагноз наследственного гемохроматоза устанавливают крайне редко либо не устанавливают вовсе, что объясняется значительной фенотипической гетерогенностью заболевания и отсутствием патогномоничных симптомов [5].
Гемохроматоз диагностируется у мужчин в 5–10 раз чаще, чем у женщин. Меньшая частота выявления заболевания у женщин обусловлена, в частности, менструальными кровопотерями. У мужчин заболевание обычно диагностируют в возрасте 40–60 лет, у женщин – после менопаузы [5]. Ювенильный гемохроматоз манифестирует в молодом возрасте (10–30 лет) и характеризуется выраженным синдромом перегрузки железом, сопровождается быстро прогрессирующими признаками поражения печени и сердца. Частота клинически манифестных форм поражения печени при гемохроматозе в популяции – два случая на 1000 жителей [6].
Первичный гемохроматоз (наследственный, классический, бронзовый диабет, пигментный цирроз печени, синдром Труазье – Ано – Шоффара) обусловлен многочисленными генетическими мутациями. Вторичный гемохроматоз диагностируется у 20% детей вследствие гемотрансфузий и длительного лечения препаратами железа, а также у 40% больных диффузными заболеваниями печени [1, 3, 7]. Синдром перегрузки железом усугубляет течение заболеваний печени, к которым железо имеет тропизм: вирусного гепатита, цирроза печени и портальной гипертензии, алкогольного и неалкогольного стеатогепатитов, болезни Вильсона и других хронических диффузных заболеваний печени (таблица) [1, 8].
Состояния, сопровождающиеся повышением накопления железа клетками печени
Болезни печени влияют на все метаболические процессы в организме, в том числе на обмен железа. В печени синтезируется большинство белков – переносчиков железа (трансферрин, aпoферритин, ферропортин), белков-регуляторов (пептидгепсидин). Кроме того, печень является основным депо железа. При перегрузке железом именно печень страдает в первую очередь, поскольку железо становится мощным эндогенным индуктором свободнорадикального окисления (реакция Фентона), которое приводит к разрушению клеточных мембран и гибели клеток. При этом повышенная экспрессия трансформирующего фактора роста бета-1 усиливает синтез коллагена, что способствует развитию соединительной ткани в печени, то есть фиброза и цирроза [6, 9].
Классификация и клинические проявления
Клинические проявления гемохроматоза полиморфны и неспецифичны, причем у всех больных независимо от формы выявляются патологические изменения в печени, приводящие к ее увеличению. Нередко у больных гемохроматозом при патологии печени ошибочно диагностируют реактивный и криптогенный гепатит [1].
Симптомы поражения печени обнаруживаются либо случайно, либо на стадии цирроза и его осложнений, что знаменует неблагоприятный исход заболевания [6, 10].
Преобладание признаков поражения определенных органов и систем послужило основанием для выделения четырех клинических форм наследственного гемохроматоза [5, 6, 11]:
Отдельно выделяют 5-й тип гемохроматоза – неонатальный. Заболевание характеризуется задержкой внутриутробного развития и дебютирует быстро прогрессирующими симптомами печеночной недостаточности, приводящими к летальному исходу вскоре после рождения [6, 11].
Накопление железа проходит несколько этапов: от бессимптомного периода перегрузки железом до формирования полиорганной недостаточности [1].
Клинические стадии развития первичного гемохроматоза
Выделяют несколько стадий развития первичного гемохроматоза:
Обычно гемохроматоз с выраженными симптомами диагностируют у мужчин старше 40 лет. Характерные жалобы: слабость, вялость, боль в животе и суставах, меланодермия, снижение либидо. HFE-ассоциированный гемохроматоз отличают симметричные артропатии, поражающие сложные суставы. Специфично повреждение проксимальных суставов фаланг, пястно-фаланговых сочленений, запястий, коленей и межпозвоночных суставов. К важным клиническим проявлениям заболевания относятся гепатомегалия, цирроз, диабет и поражение кожи [8].
Гемолитическая и ятрогенная трансфузионная перегрузка железом клинически протекает намного тяжелее, приводит к поражению сердца, печени (вплоть до цирроза) и полиорганной недостаточности уже в детском возрасте, требует назначения хелаторов железа и обычно не вызывает диагностических трудностей [9].
Последнее время наблюдается трансформация клинической картины гемохроматоза: реже встречаются больные с классической клинической триадой, описанной Dutournier в 1885 г., чаще заболевание диагностируют на доклинических стадиях, когда основные симптомы болезни отсутствуют [5].
Диагностика основана прежде всего на клинической симптоматике в сочетании с наследственной предрасположенностью. В процессе сбора анамнеза выявляют клинические признаки гемохроматоза. При их наличии проверяют биохимические параметры повышения уровня железа [8].
Обмен железа определяется при исследовании пяти основных диагностических маркеров [2, 9, 12]:
Общеклиническое и биохимическое исследования крови также должны включать общий анализ, протеинограмму, определение билирубина и его фракций, анализ активности аспартатаминотрансферазы и аланинаминотрансферазы, гамма-глутамилтранспептидазы, щелочной фосфатазы, церулоплазмина.
Молекулярно-генетическое исследование с целью верификации диагноза наследственного гемохроматоза проводится больным [13], а также их близким родственникам с подтвержденным наследственным гемохроматозом. Диагноз можно считать установленным, когда пациент является гомозиготным носителем C282Y или сложным гетерозиготным носителем C282Y/H63D. В этих случаях проведение биопсии печени обычно не требуется.
Изолированные гетерозиготные мутации С282Y и Н63D в сочетании с признаками перегрузки железом, гепатодепрессии, повышенной активностью сывороточных аминотрансфераз требуют проведения пункционной биопсии печени с морфологическим исследованием биоптата и окраской реактивом Перлса (берлинской лазурью) на содержание железа в гепатоцитах, а также биохимическим анализом концентрации железа в ткани печени (Liver Iron Content, LIC) [6, 7, 13]. Степень активности патологического процесса в биоптате печени определятся по индексу гистологической активности по классификации Кноделя [1]. Уровень железа в биоптатах выше 70 мкг на 1 г нативной печени считается патологическим.
Несмотря на то что биопсия печени может предоставить весьма ценную информацию, она является инвазивным методом исследования и связана с определенным риском осложнений [8].
Важными инструментальными исследованиями остаются ультразвуковое исследование органов брюшной полости, радиоизотопное сканирование печени с технецием (99mTc), магнитно-резонансная томография печени и сердца в Т2-взвешенном режиме (выявляет накопление железа в этих органах на доклинической стадии) [7, 14, 15].
Целями лечения гемохроматоза являются удаление из организма избыточного количества железа и профилактика осложнений заболевания (сахарный диабет, печеночная недостаточность, кардиомиопатия) [5].
Пациенты с гемохроматозом должны соблюдать определенный диетический режим, предполагающий ограничение потребления продуктов, богатых железом (мясо, гречневая крупа, яблоки, гранаты) и витамином C, исключение из рациона алкоголя, особенно красного вина. Кроме того, не рекомендуется принимать поливитаминно-минеральные комплексы и биологически активные добавки, содержащие железо и витамин C [5, 6, 10, 16].
Флеботомия (кровопускание, венесекция) позволяет удалить избыток железа без значительных побочных эффектов. Начало лечения кровопусканием до развития цирроза способно снизить заболеваемость и смертность [8]. Регулярная флеботомия считается самым эффективным и безопасным методом лечения гемохроматоза. Лечебное кровопускание (500 мл крови), позволяющее вывести 250 мг железа с каждой процедурой, должно проводиться еженедельно. Снижение гематокрита после каждого сеанса флеботомии не должно превышать 20% (рекомендации Американской ассоциации заболеваний печени). С учетом того что лечение носит пожизненный характер, венесекции проводят 4–6 раз в год [5, 6, 8, 10].
Эффективность флеботомии оценивают по уменьшению астенического синдрома, гепатомегалии, пигментации кожи, улучшению лабораторных показателей (снижение гиперферментемии, компенсация углеводного обмена).
Среди других методов лечения гемохроматоза – плазмаферез, цитаферез и гемосорбция. Они также направлены на выведение из организма избытка железа [6].
Хелаторы – лекарственные средства, способные связывать и выводить из организма избыточное железо. Согласно современной концепции, пациенты, получающие систематические заместительные трансфузии эритроцитарной массы, нуждаются в адекватной хелаторной терапии, направленной на снижение уровня токсичного железа внутри клеток и во внеклеточном пространстве, общих запасов железа в организме и, как следствие, предотвращение токсических эффектов свободного железа [5, 7, 8, 17].
Терапия хелаторами (дефероксамина мезилат) играет менее важную роль при лечении наследственного гемохроматоза, чем кровопускание, и может сопровождаться побочными эффектами. Применение хелаторов позволяет удалять значительно меньшее количество железа (не более 100 мг в неделю).
Дефероксамин (Десферал) применяют в дозе 1 г/сут внутримышечно. Наиболее рациональным считается использование деферазирокса (Эксиджада). Препарат выпускается в форме таблеток для перорального применения и содержит 125, 250 или 500 мг деферазирокса. Эксиджад является пероральным препаратом, селективно связывающим железо (например, радикалы Fe 3+ ) [5, 8, 17].
У пациентов, которым была проведена ранняя диагностика гемохроматоза и начато своевременное адекватное лечение, прогноз благоприятный. В случае поздней диагностики заболевания, при наличии цирроза печени, сахарного диабета, кардиомиопатии прогноз определяется тяжестью этих необратимых осложнений. Пятилетняя выживаемость пациентов с гемохроматозом достигает 93–72% (18% в отсутствие лечения), десятилетняя – 77–47% (0–6% в отсутствие лечения) [6].
Почти у 30% больных гемохроматозом развивается рак печени. Риск его появления у пациентов с гемохроматозом в 200 раз выше, чем в среднем в популяции, не коррелирует ни со степенью поражения печени, ни с эффективностью проводимого лечения. Данное обстоятельство определяет необходимость проведения скрининга гепатоцеллюлярной карциномы один раз в шесть месяцев (ультразвуковое исследование органов брюшной полости, компьютерная томография, концентрация альфа-фетопротеина) [5, 10].
Гемохроматоз печени что это такое и лечение
Н.Б. Волошина (1), Ю.Ю. Венжина (2), Н.Л. Казакова (2), И.О. Волошина (3)
1) Новосибирский государственный медицинский университет, кафедра пропедевтики внутренних болезней, Новосибирск; 2) Новосибирская городская клиническая больница №12, Новосибирск; 3) Центр новых медицинских технологий, Новосибирск
Известно, что повышенный уровень аминотрансфераз (АЛТ и АСТ) сыворотки крови у больных требует прежде всего исключения поражения печени, в частности хронических гепатитов.
К сожалению, иногда врачи, поступая, собственно говоря, абсолютно правильно, последовательно исключают все наиболее известные хронические гепатиты – гепатиты В, С и D; аутоиммунный гепатит, первичный билиарный холангит, первичный склерозирующий холангит, хронический лекарственный гепатит; болезнь Вильсона–Коновалова, алкогольный и неалкогольный стеатогепатиты и пр., и не найдя их признаков останавливаются на диагнозе «криптогенный гепатит», забывая, что цитолитический синдром возможен при ряде других заболеваний, в т. ч. при гемохроматозе, заболевании, связанном с накоплением в организме патологически высоких количеств железа. Избыток железа накапливается в клетках в виде гемосидерина, и это способствует гибели клеток и их замене фиброзной тканью, что приводит в конечном итоге к нарушению структуры и функции органов. Для гемохроматоза характерно поражение многих органов: печени, поджелудочной железы, сердца, щитовидной железы, суставов, кожи, гонад, гипофиза [1–3].
В зависимости от причины развития заболевания всех пациентов с синдромом перегрузки железом можно разделить на 2 основные группы больных: наследственным гемохроматозом и вторичным гемохроматозом, вызванным различными факторами.
Причинами вторичного гемохроматоза являются некоторые заболевания крови, при которых эритроциты имеют сокращенную продолжительность жизни (железодефицитная анемия, талассемия, сидеробластическая анемия, хроническая гемолитическая анемия, апластическая анемия и пр.). Кроме того, синдром перегрузки железом может возникать у пациентов, которые получают длительные и частые переливания эритроцитарной массы. Надо помнить, что чрезмерное потребление железа, в т.ч. передозировка лекарственными препаратами железа и бесконтрольное употребление безрецептурных пищевых добавок, содержащих железо, также может вызывать вторичный гемохроматоз.
Причиной наследственного гемохроматоза является мутация в гене HFE, благодаря которой происходит повышенная абсорбция железа, несмотря на его нормальное потребление. Белок HFE регулирует производство гепсидина. Последний синтезируется главным образом в гепатоцитах и контролирует концентрацию железа в плазме путем связывания с ферропортином, который экспортирует железо из двенадцатиперстной кишки, макрофагов и гепатоцитов. От 80 до 85% пациентов с наследственным гемохроматозом – гомозиготы C282Y [1, 3, 4].
Специфических симптомов гемохроматоза не существует, симптомы заболевания зависят от органа, который более всего поражен. В качестве примера приводим 2 собственных клинических наблюдения.
Клинический случай № 1
Больная К. 1958 года рождения обратилась за консультацией в 2015 г. по поводу немотивированной слабости, повышенной утомляемости, которые беспокоили пациентку на протяжении 10 лет. С 2007 г. (с 49 лет, на протяжении 8 лет. ) при многократном амбулаторном и стационарном обследовании выявлялся цитолитический синдром с повышением уровня аланиновой и аспарагиновой аминотрансефраз, максимально до четырех норм. Другие биохимические показатели крови – билирубин, креатинфосфокиназа, холестерин, маркеры холестаза, липидный спектр, сахар крови и пр. – всегда имели нормальные значения. При проведении обследования были исключены вирусные гепатит В, С и D (результаты исследования всего спектра антител и антигенов отрицательные, HBV-ДНК и HCV-РНК многократно отрицательные). Маркеры аутоиммунных заболеваний печени (ANA, AMA-M2, LKM-1, LC-1, SLA/LP) при многократном обследовании также не были выявлены. Циркулирующие иммунные комплексы не найдены. Общий белок крови и уровень γ-глобулинов всегда были на нормальных значениях. Пациентка никогда не злоупотребляла и не злоупотребляет алкоголем (прием не более 2–3 раз в год в небольших количествах). Лекарственные препараты и биологически активные добавки не принимала.
При многократном ультразвуковом исследовании (УЗИ) органов брюшной полости и малого таза данных за органическую патологию не выявлено. Так, при УЗИ от 22.04.2015: «Печень – контуры ровные, четкие. Эхоструктура усилена незначительно, гомогенная, признаков холангита нет. Размеры в норме: левая доля ККР – 8,7 см, правая доля КВР – 13,1 см. Воротная вена – 1,2 см, не расширена. Брюшной отдел аорты – 1,6-1,7 см, не расширен. Со стороны желчевыводящих путей, желчного пузыря изменений не найдено. Поджелудочная железа – контуры ровные. Эхоструктура усилена незначительно, размеры головки – 2,3 см, хвоста – 1,3 см. Со стороны почек, селезенки изменений нет. Заключение: незначительные диффузные изменения паренхимы печени и поджелудочной железы».
30.04.2015 проведена магнитно-резонансная томография органов брюшной полости и забрюшинного пространства в аксиальной, сагиттальной и фронтальной плоскостях с шагом сканирования 4–5 мм. Заключение: гепатомегалия на фоне выраженных диффузных дистрофических изменений паренхимы печени преимущественно по типу фиброзно-склеротических, нельзя исключить болезни накопления). Умеренные дистрофические изменения паренхимы поджелудочной железы.
Проведена фиброэластометрия печени – фиброз 1 (FibroScan, Metavir 6,6 кПа).
Дополнительно из анамнеза выяснено: из перенесенных заболеваний в детстве отмечает корь, скарлатину и ветряную оспу; в раннем школьном возрасте была произведена тонзилэктомия по поводу хронического тонзиллита. В 1988 г. в 30-летнем возрасте перенесла клещевой энцефалит, без последствий. Менструации с 12 лет, были обильными, по 6–7 дней. Менопауза с 48 лет (с 2006 г.). Было 5 беременностей, 2 нормальных родов, 2 раза прерывала беременность в медицинском учреждении. Одно самопроизвольное прерывание беременности с обильным кровотечением.
До 2005 г. пациентка была добровольным донором крови. Всего было 9 эпизодов сдачи крови.
При объективном исследовании обращала на себя внимание только смуглость кожных покровов. Других отклонений со стороны органов дыхания, сердечно-сосудистой и других систем не выявлено.
По результатам обследования повышен уровень аминотрансфераз: АЛТ – 56 ЕД/л (1,8 нормы), АСТ – 48 ЕД/л (1,5 нормы). Железо сыворотки крови – 44,5 мкмоль/л (норма – 8,95–30,43 мкмоль/л), латентная железосвязывающая способность 200 мкг/л у женщин или >300 мкг/л у мужчин или насыщение трансферрина >40% у женщин или >50% у мужчин, необходимо провести дальнейшее тестирование для исключения наследственного гемохроматоза [1–4].
Учитывая повышение насыщения сывороточного трансферрина (на 45% выше верхней границы нормы) и значительное увеличение уровня ферритина сыворотки крови до 1444 мкг/л, диагноз гемохроматоза у больной не вызывал сомнений.
Пациентке произведен анализ образцов ДНК на выявление мутаций в гене HFE – обнаружена мутация С282Y (c.845 G>A) в гомозиготном состоянии с.845А/с.845А.
Приблизительно у 50% у пациентов с симптомами наследственного гемохроматоза наблюдается сахарный диабет, риск его возникновения значительно возрастает у гетерозигот. Больная консультирована эндокринологом – данных за сахарный диабет нет.
Таким образом, был сформулирован диагноз: наследственный гемохроматоз, гомозиготная мутация в гене HFE (С288Y/C288Y) с преимущественным поражением печени, фиброз 1 (FibroScan, Metavir 6,6 кПа).
Итак, в течение 8 лет различные специалисты ставили больной диагноз «криптогенный гепатит». Наследственное заболевание диагностировано в возрасте 58 лет. С одной стороны, это можно объяснить длительной компенсацией заболевания, обусловленной массивными кровопотерями у женщины с обильными менструальными кровотечениями, кровопотерями во время прерывания беременности и родов. Но обращает на себя внимание, что от появления первых признаков заболевания до верификации диагноза прошло 8 лет, что подчеркивает необходимость включения гемохроматоза в перечень дифференицальной диагностики при наличии цитолитического синдрома.
Терапия больных начинается обычно с диетических рекомендаций. Безусловной рекомендацией для больных гемохроматозом является полное исключение алкоголя. Как известно, этанол является основным гепатотоксичным веществом [5, 6]. Нет достоверных доказательств того, что те или иные диеты влияют на возникновение или прогрессирование гемохроматоза. Некоторые авторы считают, что больным наследственным гемохроматозом показана диета с исключением чая и цитрусовых, которые, по их мнению, способствуют накоплению железа [7].
Терапией выбора при первичном гемохроматозе является кровопускание. Уменьшая количество эритроцитов, которые являются основным мобилизатором железа в организме, можно уменьшить и даже свести к минимуму его токсическое действие. Чтобы снизить уровень железа до нормы, пациентам может потребоваться 50–100 кровопусканий в год, по 500 мл каждое. Как только уровень железа нормализуется, требуются пожизненные, но менее частые кровопускания: обычно 3–4 раза в год. Цель поддерживающих кровопусканий состоит в обеспечении содержания ферритина в крови на уровне 50–100 мкг/л. В случаях значительного снижения гемоглобина после проведения кровопускания целесообразно применение эритропоэтина [1–3, 8].
Альтернативным методом лечения является применение хелатирующих препаратов, которые рекомендованы в тех случаях, когда кровопускания невозможны по тем или иным причинам, и в остальных случаях обычно не используются при наследственном гемохроматозе. Безусловно, целевая концентрация ферритина G) в гомозиготном состоянии с.187G/c.187G. Выявленный молекулярно-генетическим методом генотип соответствует наследственному гемохроматозу 1-го типа.
Диагноз гемохроматоза у данного молодого мужчины был впервые верифицирован в стадии уже продвинутого фиброза, 3-й ст. по Metavir, что соответствует общим тенденциям. Действительно, у мужчин нет естественных кровопотерь, и обычно продвинутые стадии заболевания диагностируются в более молодом возрасте.
Пациенту назначены кровопускания. И уже после первого кровопускания в объеме 500 мл отмечено улучшение состояния – уменьшились слабость и недомогание. Показатели биохимического анализа крови улучшились: уровень АЛТ с 334 ЕД/л снизился до 72 ЕД/л, АСТ – с 104 до 55 ЕД/л. Уровень ферритина существенно уменьшился с 2371 до 673 мкг/л.
Пациенту планируется повторное кровопускание через 2 недели с дальнейшим подбором кратности проведения процедуры. Мы полагаем, что правильная тактика ведения больного гемохроматозом с одновременной коррекцией инсулинорезистентности под контролем эндокринолога и снижением массы тела если не приведет к уменьшению степени фиброза печени, то хотя бы приостановит прогрессирование заболевания.
В заключение необходимо напомнить, что гемохроматоз является наиболее распространенным наследственным генетическим заболеванием в европейской популяции. Заболевание связано с осаждением избыточного количества железа в паренхиматозных клетках, что в итоге приводит к повреждению органов и как следствие – к органной недостаточности. В случае наличия цитолитического синдрома в диагностический поиск необходимо обязательно включать гемохроматоз. Предсимптомная терапия позволяет избегать цирроза печени и тем самым значительно увеличивать продолжительность жизни пациентов [1–3, 10]. Терапией выбора в настоящее время остается кровопускание, альтернативные методы лечения служат предметом дальнейших исследований и дискуссий.
Литература
1. European Association for the Study of the liver (EASL). EASL clinical practice guidelines for HFE hemochromatosis. J. Hepatology. 2010;53:3–22.
2. Adams P., Brissot P., Powell L.W. EASL International consensus conference on haemochromatosis. J. Hepatology. 2000;33:487–96.
3. Bacon В.R., Adams P.C., Kowdley K., Powell L.W., Tavill A.S. Diagnosis and Management of Hemochromatosis: 2011 Practice Guideline by the American Association for the Study of Liver Diseases. Hepatology. 2011;54:328–43.
4. Bardou-Jacquet E., de Tayrac M., Mosser J., Deugnier Y. GNPAT variant associated with severe iron overload in HFE hemochromatosis. Hepatology. 2015;62:1917–18.
5. Harrison-Findik D.D., Schafer D., Klein E., Timchenko N.A., Kulaksiz H., Clemens D., Fein E., Andriopoulos B., Pantopoulos K., Gollan J. Alcohol metabolism-mediated oxidative stress down-regulates hepcidin transcription and leads to increased duodenal iron transporter expression. J. Biol. Chem. 2006;281:22974–982.
6. Harrison-Findik D.D., Klein E., Crist C., Evans J., Timchenko N., Gollan J. Iron-mediated regulation of liver hepcidin expression in rats and mice is abolished by alcohol. Hepatology. 2007;46:1979–85.
7. Moretti D., van Doorn G.M., Swinkels D.W., Melse-Boonstra A. Relevance of dietary iron intake and bioavailability in the management of HFE hemochromatosis: a systematic review. Am. J. Clin. Nutr. 2013;98:468–79.
8. Delatycki M.B., Gurrin L.C., Ong S.Y., Ramm G.A., Anderson G.J., Olynyk J.K., Allen K.J., Nicoll A.J., Powell L.W. Reduced mortality due to phlebotomy in moderately iron-loaded HFE haemochromatosis? The need for clinical trials. J. Hepatology. 2015;63:282–83.
9. Phatak P., Brissot P., Wurster M., et al. A phase 1/2, dose-escalation trial of deferasirox for the treatment of iron overload in HFE-related hereditary hemochromatosis. Hepatology. 2010;52:1671.
10. Stefashyna O., Stefashyna O., Stern M., Infanti L., Holbro A. Pattern of care of blood donors with early-uncomplicated hereditary haemochromatosis in a Swiss blood donation centre. Vox Sanguinis. 2014;106:111–17.