вирус герпеса 6 типа у ребенка что делать
Герпес 6 типа у детей

Симптомы герпеса 6 типа у ребенка
Каковы главные симптомы детского герпеса 6 типа?
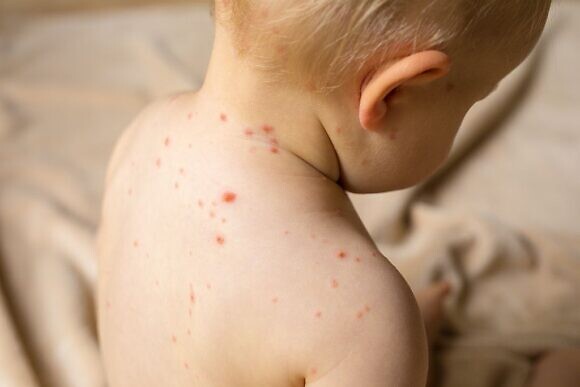
Надо отметить, что в группе риска находятся, прежде всего, малыши от 4 месяцев. В этом возрасте у активного ребенка может внезапно, казалось бы, беспричинно, подняться температура и держаться до пяти дней. Затем по всему телу малыша появляются обильные высыпания. Эта сыпь, хотя и занимает значительную часть кожных покровов ребенка, обычно не сопровождается зудом и не доставляет особого беспокойства маленькому пациенту. Родителей пугает этот вирус больше, чем ребенка. Диагностировать iii причину высыпаний и лихорадки удается не всегда. Порой, герпетическую инфекцию можно принять за корь, энтеровирусную инфекцию или аллергию. Тем более, что при появлении сыпи ребенок становится вялым, капризным, может потерять аппетит. Можно наблюдать у малыша и увеличение лимфоузлов. Сыпь держится от нескольких часов до нескольких дней. Педиатры всегда рекомендуют при температуре у таких маленьких детей незамедлительно обращаться к специалистам. Кстати, часто герпес может протекать вообще без высыпаний. Точный диагноз можно поставить только после проведения ряда анализов.
Осложнения, которые могут быть связаны с герпесом 6 типа
К сожалению, ВГЧ-6В не всегда ограничивается только лихорадкой и сыпью при первичном инфицировании. Возможны и более серьезные последствия:
Особенности терапии вируса герпеса 6 типа у детей
Как и в случае с ВПГ 1 и ВПГ 2, сегодня не существует препаратов, способных полностью избавить человека от вируса герпеса 6 типа. Как правило, переболев герпесом 6 типа, ребенок приобретает иммунитет, способность подавлять активность вируса. Тем не менее, вирус продолжает существовать в организме человека.
В период болезни врач назначает симптоматическое лечение, которые снижает дискомфорт для ребенка, и облегчает течение болезни.
А вот высыпания на коже малыша можно обрабатывать препаратом ВИФЕРОН Гель. Средство наносится три-пять раз в день. Этот препарат также можно применять в самом раннем возрасте.
Профилактика простудных заболеваний
Несмотря на то, что герпес 6 типа у детей очень заразен и легко передается воздушно-капельным путем, а также через слюну, поцелуи и так далее, ребенка все равно можно попытаться защитить, если не от этой инфекции, то от сочетания герпеса и ОРЗ. Ослабленный вирусом герпеса организм очень чувствителен к другим инфекциям, в том числе респираторным, поэтому терапия таких микст-инфекций может усложниться.
Особенно это касается малышей, которые по тем или иным причинам не получают материнское молоко. Такие дети, как считается, более подвержены вирусным заболеваниям. Перенесение же одновременно герпесвирусной и иной инфекции может быть очень большой нагрузкой для организма ребенка.
Поэтому в возрасте от 4 месяцев до трех лет желательно соблюдать некоторые профилактические меры:
К последнему пункту можно отнести и уж упомянутый ВИФЕРОН Гель. Для профилактики его следует наносить на слизистую внутри носика ребенка, два раза в день.
Врач дерматовенеролог, д.м.н., профессор
iv Никольский М.А., Радыш М.В. Роль вирусов герпеса человека 6 и 7-го типов в возникновении фебрильных судорог у детей // Вопросы диагностики в педиатрии. 2012. Т. 4. № 4. С. 46–48.
Педиатр Михаил Никольский: Герпес – лечить или не лечить
Александра Петровская: Добрый день. Это программа для самых больших. С нами в студии врач-педиатр и кандидат медицинских наук Михаил Никольский. Михаил Андреевич, здравствуйте.
Михаил Никольский: Добрый день.
А.П.: Мы сегодня собрались здесь по поводу вашей научной работы, посвященной герпесу 6 и 7 типа. Давайте попытаемся объяснить слушателям, что это такое, а, самое главное, откуда эти типы взялись, и какие еще типы – первый, второй, третий и так далее – идут до 6 и 7.
М.Н.: В общей сложности выделяют 8 или 9 типов герпеса, смотря как считать. Первый и второй типы – это обычный герпес, который вызывает простуду на губах. Третий тип – это вирус герпес зостер, который вызывает ветрянку или опоясывающий лишай у взрослых людей.
А.П.: То есть то, что мы называем ветрянкой, это, на самом деле, тот же самый герпес?
М.Н.: Не тот же самый, это совершенно другой герпес, но тоже герпес.
А.П.: По какому принципу они все объединены под этим названием?
М.Н.: Это сложно. Когда ученые изучали ДНК этих вирусов, выяснилось, что у всех у них имеются похожие родственные черты. Четвертый тип, вирус Эпштейна-Барр, вызывает инфекционный мононуклеоз инфекционный. Пятый тип – это то, что все знают как цитомегаловирус. Это тоже часто инфекции, причем преимущественно детские.
И, наконец, 6 и 7 тип – это то, чем я занимаюсь. Чаще всего они вызывают у детей розеолу – трехдневную лихорадку или внезапную экзантему. Далее идет восьмой тип герпеса, он встречается при саркоме Капоши. Это тяжелое заболевание, которое преимущественно встречается у ВИЧ-инфицированных пациентов.
А.П.: Что, помимо общего названия и некого сходства ДНК, их еще объединяет? Может, есть общие методы терапии или сходные последствия воздействия вируса на организм?
М.Н.: Во-первых, в отличие от многих других вирусов, против герпесов есть лекарство. Это во многом отличает эти вирусы от других, потому что от огромного числа вирусов нет никаких лекарств.
А.П.: А как же все эти модные противовирусные, которые везде рекламируют?
А.П.: Фейки запрещены.
М.Н.: Фейки запрещены, но, видимо, реклама лекарств без доказанной эффективности разрешена.
А.П.: Это тема для отдельной программы.
М.Н.: Это беда нашей страны, потому что у нас фейки влезли даже в клинические рекомендации. И мы лечим людей всеми этими «фуфломицинами». Более того, мы ими обязаны лечить, потому что у нас есть соответствующие клинические рекомендации.
А.П.: Это кто-то лоббирует?
А.П.: В этих словах чувствуется Ваше презрение к гомеопатии.
М.Н.: С точки зрения клинического врача в какой-то степени это да, презрение, это правда.
Вернемся к герпесам. У них есть уникальная особенность. После того, как человек заболел первичной герпесной инфекцией, эти вирусы не уходят из организма человека. Все герпесы, с которыми человек столкнулся в жизни, остаются в нем навсегда.
А.П.: Я встречалась с утверждением, что трудно встретить на Земле человека старше 10 лет, который не имел бы антител к тому или иному виду герпеса.
А.П.: А они начинают лечить?
М.Н.: Да, совершенно верно. Пациент-то не знает, что это норма. Он видит, что у него «страшный» анализ, что нашли такое-то количество этих герпесов, и врач, скорее всего, сам по незнанию, по непониманию этой проблемы начинает лечить нормальное носительство герпесов. А чем он лечит? Теми же фуфломицинами и лечит. И ничего не происходит.
А.П.: Итог – герпес лечить не надо?
М.Н.: Надо, если он вызвал тяжелое заболевание – а все герпесы в определенных случаях могут вызывать тяжелые заболевания. Например, герпес 6-го типа – частая причина тяжелых состояний у пациентов после пересадки костного мозга. Если герпес после пересадки костного мозга обострился на фоне снижения, фактического уничтожения собственного иммунитета, то терапия обязательно требует мощных противовирусных средств.
Да вот взять ветрянку – казалось бы, безобидное заболевание. Но после 11 лет оно тяжело проходит и может иметь последствия. Поэтому считается, что если пациент младше 11 лет, то оно часто проходит само по себе. А если старше 11 лет, то лучше не рисковать, а назначить ацикловир.
А.П.: Это препарат с доказанной эффективностью?
М.Н.: Да, он действует именно на вирус ветрянки.
А.П.: Выходит, что герпес, который всегда находится в организме, в какой-то момент обостряется. Я, например, слышала про герпес 6-го типа, что это характерное заболевание для детей до 2-3 лет. Выходит, что нет.
М.Н.: Дело в том, что герпес 6-го типа – это та самая наиболее частая инфекция, которая вызывает всегда внезапную экзантему или трехдневную лихорадку или розеолу. В принципе, очень понятная инфекция: три дня у ребенка высокая температура, потом появляется типичная пятнисто-папулезная сыпь. В течение двух дней она исчезает сама по себе, и человек выздоравливает.
Само заражение может произойти хоть через обычный поцелуй, как это и происходит со многими герпесами. То есть в организм ребенка вирус может попасть через контакт со слюной матери, бабушки, любого взрослого человека, которые обычно и являются носителем всех герпесов. И вот ребенок переносит эту первичную инфекцию через вирус герпеса человека 6-го типа, и после этого герпес человека 6-го типа остается в этом ребенке навсегда. И никуда он не денется, и никак от него не избавиться.
Но лечить его надо только в одной ситуации – если он вызвал какое-то тяжелое заболевание, что у здоровых людей практически никогда не встречается. Только при тяжелых иммунодефицитах, которые обычно возникают при трансплантации органов и тканей. Вот там бывают ситуации, когда требуется интенсивное лечение герпеса 6-го типа.
А.П.: Еще такой момент. Какие другие заболевания могут быть связаны с вирусами герпеса, которые присутствуют в организме?
М.Н.: Как я уже сказал, герпесы 6-го и 7-го типа «классически» вызывают розеолу у детей. Еще герпес 6-го и иногда, но редко, 7-го типа ассоциированы с фебрильными судорогами у детей. Есть исследования, которые показывают связь определенных видов эпилепсии с вирусом герпеса человека 6-го типа. Так что получается, что герпес 6-го типа фактически вызывает одну из разновидностей эпилепсии.
А.П.: Присутствует этот вирус в организме почти каждого, а эпилепсия при этом далеко не у всех. То есть это говорит о том, что какой-то прямой связи нет, есть и другие факторы, влияющие на появление этого заболевания?
М.Н.: Конечно, тут много факторов. Например, два человека подхватили одну и ту же инфекцию: но у одного насморк, а у второго менингит. А инфекция одна и та же. Конечно, тут задействовано много факторов.
А.П.: В ходе программы мы с вами коротко поговорили обо всех герпесах, обозначили все важные моменты. И, завершая беседу, хочу вернуться к началу. Какие вопросы в этой области сегодня стоят перед наукой?
М.Н.: Кстати, забыл сказать, что особой формой герпеса человека 6-го типа является хромосомная интегрированная форма этого вируса, когда герпес 6-го типа внедряется в хромосому человека и начинает передаваться по наследству всем поколениям.
Сейчас мы в Петербурге получили грант. Мы проводим бесплатные обследования всех желающих по определенным показаниям на наличие хромосомно-интегрированного герпеса человека 6-го типа. Как раз-таки наличие хромосомно-интегрированного герпеса человека 6-го типа, возможно, дает связи с некоторыми болезнями. Оказывается, что чуть ли не 1% населения земного шара имеет встроенный в свой геном хромосомно-интегрированный вирус.
А.П.: Хорошо. Вспоминая мои студенческие годы, какая гипотеза стоит у вас в этом научном исследования? Если что – то что?
М.Н.: Мы пока набираем референсную группу, мы ищем людей, их обследуем. Меня лично сейчас больше всего интересует, есть ли клинические проявления хромосомной интеграции герпеса человека 6-го типа у новорожденных детей. На мой взгляд, это самая интересная концепция, еще никто в мире это направление не разрабатывал. Пока что есть предварительные результаты, но я их еще не готов озвучивать.
А.П.: У нас в гостях был Михаил Никольский, врач-педиатр и кандидат медицинских наук. Спасибо и хорошего всем дня!
Герпесвирусы у детей
Поделиться:
«Приезжайте, — сказала мне по телефону мама ребенка. — Мы не можем вылечить дочку».
Несмотря на то что она сама позвонила в клинику и сказала, что хочет вызвать именно и только меня, мой ответный звонок не вызывал оживления в ее бесцветном голосе. Но я догадывался о возможной причине. Как правило, это свидетельствует о богатом, но неудачном опыте общения с врачами, вера которым уже сильно подорвана.
«Нас просто замучил этот чертов цитомегаловирус», — сообщила мне мама.
История была такова. В 8 месяцев ребенок сильно заболел. Долго держалась температура, сначала ставили диагноз ОРВИ, потом назначили антибиотики, но они не помогали. Тогда врач сказал, что это цитомегаловирус. И действительно, в мазке из зева его обнаружили. Ребенка направили к инфекционисту.
«Прошло уже 1,5 года, но мы так от этого вируса и не избавились, — в голосе мамы звучала безнадежность. — Он выделяется отовсюду. Он и в крови, и в слюне, и в моче. IgG-антитела тоже шалят, сильно превышена норма. Лечим уже 1,5 года. Вставляем свечи с альфа 2-интерфероном. Пьем иммуномодуляторы. Все бесполезно. То вирус вроде не выявляется в моче, мы уже думаем: все, вылечили, как вдруг бац — и снова он тут как тут. Антитела вообще никак из крови не уходят. В итоге прививки нам делать запретили. А пока мы не вакцинируемся, мы не можем пойти в садик. Что теперь делать, уже не знаем».
Пока я осматривал девочку, которая оказалась внешне абсолютно здорова, я осведомился, читала ли мама «Дон Кихота». «Когда-то в детстве», — непонимающе сказала она.
«Так вот. Избавиться от цитомегаловируса невозможно, — сказал я. — Но в этом же состоит хорошая новость — вся эта проблема не стоит и выеденного яйца. Избавляться от цитомегаловируса не нужно. С вашим ребенком все в порядке.
Вы просто боретесь с ветряными мельницами…».
Откуда в организме постоянный вирус герпеса?
Теперь немного теории. Цитомегаловирус (герпес 5-го типа), как и все остальные герпесвирусы, после заражения не исчезает из организма. Поэтому его обнаружение у здорового пациента абсолютно неинформативно — он будет выделяться всегда.
IgG антитела можно обнаружить у любого человека, который когда-либо переболел какой-либо инфекцией. И даже самый высокий уровень (титр) этих антител не свидетельствует ни о текущей активной инфекции, ни о ее обострении.
В каждом человеке в норме находится около 2 кг микробов. Среди них есть и вирусы, и прежде всего — герпесвирусы. Это семейство включает в себя 9 разных видов. Особенностью герпесвирусов является их способность переходить в латентную стадию, которая длится всю жизнь. Это значит, что после перенесенной острой инфекции герпесы никуда не деваются из организма, а остаются в нем навсегда.
Разные обличья одного вируса
Каждый из человеческих герпесвирусов имеет свои особенности.
Читайте также:
Простой герпес
Герпесы 1-го и 2-го типов опаснее всего, когда когда женщина заражается ими во время беременности. В этом случае есть риск возникновения внутриутробной герпетической инфекции, которая может вызвать тяжелые поражения органов и систем ребенка. Но это бывает довольно редко. Чаще заражение этими видами герпеса происходит уже после рождения.
У детей, заразившихся герпесом 1, может возникать герпетический афтозный стоматит, сопровождающийся высокой температурой, воспалением десен и язвочками на слизистой рта. После 1-2 эпизодов афтозного стоматита герпес переходит в состояние спячки, периодически обостряясь в виде простуды на губах. Герпес 2-го типа — это возбудитель генитального герпеса. У детей встречается относительно редко, заражение может произойти через общие полотенца и постельные принадлежности.
К герпесу 3-го типа относят вирус герпес-зостер, вызывающий ветряную оспу. Самые опасные периоды для ветрянки во время беременности — первый и третий триместры. В первом триместре ветрянка может привести к выкидышу или врожденным дефектам плода, а в последнем триместре — к врожденной ветряной оспе. После перенесенной ветрянки герпес-зостер остается в нервных ганглиях пожизненно. В пожилом возрасте или при снижении иммунитета герпес-зостер прорывается наружу, вызывая опоясывающий лишай.
Герпес 4-го типа (вирус Эпштейна – Барр) может вызвать инфекционный мононуклеоз. Однако большинство случаев этой инфекции протекают малосимптомно, в виде обычного респираторного заболевания. После перенесенной инфекции вирус Эпштейна – Барр остается в латентном состоянии в лейкоцитах, в связи с чем его можно регулярно или периодически выявлять в крови и слюне у большинства здоровых людей — это не страшно.Однако при снижении иммунитета этот тип вируса может пойти в наступление и даже (хотя и очень редко) вызвать развитие некоторых онкологических заболеваний.
Что касается беременных, то заражаются в основном женщины с иммунной недостаточностью, но даже при этом в большинстве случаев плод не страдает.
Зато цитомегаловирус опасен в первую очередь внутриутробной инфекцией. Начавшись внутриутробно, он может вызывать тяжелые проблемы со здоровьем ребенка — тугоухость, нарушение развития. Если же заражение произошло после рождения, оно протекает чаще всего бессимптомно, редко в виде респираторного заболевания или мононуклеозоподобного синдрома, которые проходят самостоятельно без лечения. Однако у пациентов с выраженным иммунодефицитом (например, после трансплантации костного мозга) цитомегаловирус может активироваться и вызвать ряд серьезных проблем, которые потребуют сложного лечения.
Вирус герпеса человека 6-го типа В и вирус герпеса 7-го типа не вызывают внутриутробную инфекцию. Но они являются причиной розеолы (псевдокраснухи), очень частого заболевания детей первых лет жизни. После перенесенной инфекции герпес 6 сохраняется в лейкоцитах крови и слюне, где его можно практически всегда обнаружить.
Вирусы герпеса типов 6А и 8 редко встречаются у детей.
Получается, что единственная проблема маленькой пациентки была в том, что ее мама, накрученная медработниками, решила, что наличие цитомегаловируса у здорового ребенка является не обычной ветряной мельницей, мирно крутящей свои крылья в поле, а страшным драконом, которого необходимо непременно уничтожить.
В итоге женщина потратила 1,5 года жизни, кучу денег и нервов для обследования и псевдолечения здоровой дочки, чтобы в итоге узнать, что все это было бесполезно. Честно говоря, мне стыдно за некомпетентность своих коллег, но, к сожалению, такое случается. И поэтому лучше самим быть начеку и иметь хотя бы основное представление о проблеме.
Герпесвирусные инфекции у детей
В каждом человеке, в норме, постоянно проживают огромное количество вирусов, грибов и бактерий. К таким постоянным «жильцам» нашего организма относятся вирусы герпесов.
Первичное инфицирование герпесвирусами происходит в раннем детском возрасте. Иногда заселение вируса в организм происходит бессимптомно, а иногда сопровождается характерной, для данного вируса, клинической картиной. В зависимости от реактивности организма, состояния его иммунитета заболевание может протекать достаточно тяжело.
Так, для первичного острого заболевания, вызванного вирусами герпеса 1 типа, характерно тяжелое поражение слизистой полости рта. У ребенка несколько дней держится высокая температура, он отказывается от еды, выражена интоксикация, во рту появляются болезненные язвочки, увеличиваются и болят подчелюстные и шейные лимфоузлы. Улучшение может наступать только к 5-7 дню, а у некоторых детей выздоровление затягивается до 2-3 недель. В дальнейшем, при неблагоприятных условиях, вирус может вновь поднимать голову (рецидивировать), но проявления его, как правило, бывают уже не такими тяжелыми — чаще всего это пузырьковые высыпания на губах, которые в простонародье называют «простуда».
Вирус ветряной оспы (Varicella zoster), тоже относится к семейству герпесвирусов.
При встрече с ним ребенок заболевает ветряной оспой. После этого к вирусу вырабатывается иммунитет, заболеть ветрянкой второй раз человек уже не должен (крайне редко диагностируют повторные случаи заражения), но вирус из организма до конца не уходит, а остается дремать в нервных ганглиях. При ослаблении иммунитета (чаще уже у пожилых людей), эта вирусная инфекция рецидивирует в виде опоясывающего лишая. Пузырьковые элементы появляются на коже по ходу периферических нервов и в половине случаев по ходу межреберных нервов. Сыпь охватывает туловище наподобие пояса (слово «zoster» по-гречески означает пояс). Это состояние сопровождается сильными болями — невралгией и, иногда, общей интоксикацией.
Вирус герпеса 6 типа при первичном инфицировании может вызывать у ребенка острое инфекционное заболевание, которое называется внезапная экзантема (младенческая розеола, шестая болезнь). Сначала возникает высокая температура, которая держится в среднем 3 дня. Катаральных явлений при этом чаще всего нет, лишь небольшая краснота в горле. Затем, на спаде температуры, появляется красная пятнистая сыпь, которая сохраняется 1,5-2 дня и исчезает. Если ребенок при этом получал антибиотик, эта сыпь может быть ошибочно расценена, как лекарственная. Осложнения редки. Переходя в латентную стадию вирус чаще всего никак себя не проявляет. Но обсуждается его причастность к некоторым заболеваниям (например, к синдрому хронической усталости).
Цитомегаловирус и Вирус Эпштейн Барра. Чаще всего они тихо заселяются в организм, но иногда у детей проявляются таким заболеванием, как Инфекционный мононуклеоз. Протекать оно может тяжело. Отмечается длительная высокая лихорадка, генерализованное увеличение лимфоузлов, и особенно лимфоузлов шеи. Они увеличиваются так, что визуально деформируют шею, при этом почти не болят. Также сильно увеличиваются другие лимфоидные образования – миндалины и аденоиды. Из-за этого ребенок не может дышать носом, храпит ночью. На миндалинах могут появиться налеты, чаще всего пленчатые. Может увеличиваться печень, селезенка, иногда возможно появление сыпи, желтухи.
Не надо лечить анализы! Надо лечить ребенка, если того требует его состояние.
В каждом конкретном случае врач назначит лечение, иногда требуется госпитализация в связи с тяжелым течением инфекции.
Задача родителей обратиться во время к врачу.
А после выздоровления соблюдать определенные правила, чтобы иммунный ответ был адекватный и инфекция больше «не поднимала голову».
После перенесенной инфекции долгое время у ребенка сохраняется снижение иммунной защиты организма и ему необходимо:
Диета против герпеса основана на соотношении двух незаменимых аминокислот — аргинина и лизина.
Лизин подавляет вирусы герпеса, аргинин способствует их размножению. Продукты, богатые лизином: молоко, простокваша, ряженка, сыр, творог, йогурты, содержащие живые бактерии, картофель, рыба, свинина, овощи, белое куриное мясо, соевые бобы, чечевица, пивные дрожжи.
Аргинин: шоколад, сахар, изюм, кунжут, семечки, орехи (особенно в арахисе), крупы, пшеничный хлеб, апельсины и мандарины.
Герпесвирусы 6, 7, 8-го типов
За последние 15 лет выделены три новых антропонозных представителя этого семейства — HHV-6, HHV-7, HHV-8, которые характеризуются многообразием клинических проявлений и бессимптомным носительством. HHV-6 Герпесвирус 6-го типа (HHV-6, ВГЧ-6) относительн
За последние 15 лет выделены три новых антропонозных представителя этого семейства — HHV-6, HHV-7, HHV-8, которые характеризуются многообразием клинических проявлений и бессимптомным носительством.
Герпесвирус 6-го типа (HHV-6, ВГЧ-6) относительно недавно внесен в список известных человеческих патогенов и является серьезным претендентом на роль этиологического агента рассеянного склероза и лихорадки новорожденных с судорожным синдромом, инфекционных мононуклеозов негативных по вирусу Эпстайна–Барр (ВЭБ) и цитомегаловирусу (ЦМВ) и ассоциированного с HHV-6 энцефалита. HHV-6 также является кофактором СПИДа, некоторых форм карцином шейки матки и назофарингеальных карцином.
Впервые HHV-6 был выделен в 1986 г. из лимфоцитов периферической крови пациентов с различными лимфопролиферативными заболеваниями, в том числе инфицированных ВИЧ. Новый вирус был назван В-лимфотропным вирусом человека (HBLV — human B-lymphotropic virus). HBLV инфицировал только свежие В-лимфоциты in vitro. Позднее был описан более широкий спектр клеточного тропизма, преимущественно к Т-клеткам, вследствие чего вирус переименовали в HHV-6.
HHV-6 сходен с остальными герпесвирусами, но отличается от них по биологическим, иммунологическим свойствам, спектру чувствительных клеток, антигенной структуре, составу генома, количеству и молекулярной массе структурных вирусных белков. Диаметр вириона — 160–200 нм, тип симметрии икосаэдрический, содержит 162 капсомера, имеет суперкапсидную липидосодержащую оболочку. Геном представлен двунитчатой ДНК. Рестрикционный анализ ДНК HHV-6 установил вариабельность генома различных изолятов вируса. При сравнении первичной структуры геномов HHV-6 и ЦМВ было обнаружено их определенное сходство. Степень гомологии между HHV-6 и ЦМВ была большей, чем между HHV-6 и другими герпесвирусами, что свидетельствует о тесной связи геномов этих двух вирусов.
Исследования изолятов HHV-6 от людей с различной патологией показали, что они принадлежат к двум вариантам: А или В (HHV-6А и HHV-6В). Варианты различаются между собой по клеточному тропизму in vitro, рестрикционному эндонуклеазному профилю, нуклеотидной последовательности, реактивности с моноклональными антителами, сероэпидемиологии и причастности к различным заболеваниям. Инфекция, индуцированная HHV-6А, наблюдается реже, и роль данного варианта вируса в патологии человека недостаточно ясна, а HHV-6В является основным этиопатогеном внезапной экзантемы (Exantema subitum).
Эпидемиология HHV-6-инфекции. Первые клинико-эпидемиологические исследования, проведенные в 1986 г., выявили наличие этой инфекции в зоне отдыха в штате Невада (США). Клинически заболевание выражалось в гриппоподобной симптоматике с повышением температуры, ночным потом, увеличением лимфатических узлов, рядом психологических симптомов (усталость, депрессия). Заболевание получило название «синдром хронической усталости». При этом у 75% больных выявлялись антитела к HHV-6. Год спустя первый больной с клинически сходным заболеванием и антителами к HHV-6 в крови был зарегистрирован в Германии. В дальнейшем эта инфекция была выявлена в Европе (Англия, Швеция) и Африке. При этом разные исследователи сообщили о выделении HHV-6 из клеток крови не только от лиц с различными лимфопролиферативными и гематологическими заболеваниями, инфицированных HTLV-1, ВИЧ-1 и ВИЧ-2 или больных СПИДом, но и от здоровых взрослых.
По данным российских авторов, у 80% здоровых доноров, у 65% ВИЧ-инфицированных и 73% онкологических больных выявляются антитела к HHV-6. При рождении большинство детей серопозитивны за счет материнских антител, титр которых снижается к 5 мес. Однако к одному году процент серопозитивных малышей оказывается таким же, как среди старших детей и взрослых. Высокая частота выявления антител и ранний возраст инфицирования указывают на присутствие вируса в ближайшем окружении. Выделение HHV-6, определение вирусных белков и ДНК в образцах слюны и мокроты указывают на то, что вирус находится в организме человека в слюнных железах, а эксперименты in vitro показали, что он в латентной фазе сохраняется в моноцитах/макрофагах. В естественных условиях основным путем передачи вируса является воздушно-капельный. Нельзя исключить вертикальный путь заражения; антигены вируса присутствовали в абортивном материале в ряде случаев при спонтанных абортах. Также не исключаются половой путь передачи вируса и перинатальная инфекция. Длительная репродукция при острой инфекции и персистенция HHV-6 в клетках крови внешне здоровых людей, включая доноров, является серьезным фактором риска передачи вируса при переливании крови и ее компонентов, трансплантации органов и тканей. Посттрансплантационная серологическая конверсия к HHV-6 отмечается у 43% реципиентов. При этом повышенный титр антител к HHV-6 в крови реципиентов персистировал в течение 2 лет после трансплантации.
Диагностика. Диагностика HHV-6-инфекции основана на сравнительном анализе результатов выделения вируса на чувствительных культурах клеток от больного, обнаружении вирусных белков (при использовании иммунопероксидазного и иммунофлюоресцентного методов, электронной микроскопии) или его генома (при использовании методов гибридизации и полимеразной цепной реакции (ПЦР)) в материалах от больного и выявлении вирусспецифических антител в крови. Вирусспецифические иммуноглобулины класса М (IgM) синтезируются через 2 нед после острой первичной инфекции, достигая титра 1:1280, по данным непрямой иммунофлюоресценции, а класса G (IgG) — на неделю позже и достигают более высокого титра — 1:10240. Поскольку титр IgM быстро снижается и они исчезают через 4–6 нед, острая первичная HHV-6-инфекция диагностируется по наличию IgG (положительным считается титр выше 1:20). Синтез IgM возможен как при первичной, так и при реактивации латентной HHV-6-инфекции. Периодическая реактивация и активная персистентная HHV-6-инфекция у больных с дефектом иммунного ответа, как и при других герпесвирусных инфекциях, приводит к повышению титра вирусспецифических IgG, зачастую без соответствующего повышения титра IgМ.
Первичная HHV-6-инфекция у иммунокомпетентных лиц диагностируется на основании корреляции наличия и нарастания титров вирусспецифических IgG и IgМ с динамикой развития клинических проявлений заболевания. Серологическое исследование должно дополняться выделением вируса и/или обнаружением генома. При иммунных нарушениях и реактивации HHV-6-инфекции число таких геномнесущих клеток возрастает до 50–70, а обнаружение геномнесущих клеток в пределах 200-7500 свидетельствует о патогенетической связи реактивированной HHV-6-инфекции с заболеванием.
Клиника. Спектр заболеваний, связанных с HHV-6, довольно широк. Полиморфизм патологии зависит как от формы инфекции, так и от штаммовых различий вируса.
К заболеваниям, ассоциированным с первичной острой HHV-6-инфекцией, относятся: синдром хронической усталости (миалгический энцефаломиелит); внезапная экзантема у новорожденных и более старших детей (roseola infantum exantema subitum); инфекционный мононуклеоз у подростков и взрослых, не связанный с ВЭБ-инфекцией; гистиоцитарный некротический лимфаденит (KiKuchi’s lymphadenitis).
Заболевания, ассоциированные с персистентной HHV-6-инфекцией, включают: лимфопролиферативные (иммунодефицит, лимфаденопатия, поликлональная лимфопролиферация); злокачественные лимфомы (неходжкинская лимфома, периферическая Т-клеточная лейкемия, В-клеточная лимфома, дерматопатическая лимфаденопатия, болезнь Ходжкина, синусоидальная В-клеточная лимфома, плеоморфная Т-клеточная лимфома).
HHV-6 связывают с различными лимфопролиферативными и иммуносупрессивными заболеваниями, с внезапной экзантемой новорожденных, злокачественными новообразованиями, аутоиммунной патологией, некоторыми заболеваниями ЦНС и др. Реинфекция HHV-6 наблюдается у больных с нарушенным иммунным статусом, иммуносупрессией (трансплантация органов, СПИД и др.).
Доказана этиологическая роль HHV-6 в развитии внезапной экзантемы — широко распространенного заболевания детей в возрасте от 3 мес до 3 лет. В части случаев причиной молниеносной экзантемы является HHV-7. Инкубационный период заболевания — 5–15 дней. Заболевание характеризуется высокой лихорадкой (38,5–40°С) в течение 3–5 дней, в дальнейшем в течение 1–3 дней наблюдаются эритематозная или макулезная кожная сыпь, которая совпадает со снижением температуры. Около половины всех случаев первой в жизни лихорадки новорожденных связаны с первичным инфицированием HHV-6.
С развитием экзантемы связывают преимущественно вариант HHV-6В. В период лихорадки (и даже перед этим) вирус присутствует в CD4+-клетках; в это время выделить вирус из крови больных удается более чем в 90% случаев.
Антитела к HHV-6 отсутствуют в острой фазе болезни и начинают определяться в большинстве случаев на 6–8-й день от начала заболевания. IgM-антитела выделяются на 5-й день лихорадки и обнаруживаются в течение 2–3 нед. IgG-антитела появляются на 7-й день, достигая максимума через 2–3 нед, и персистируют длительное время. Обычно заболевание заканчивается без осложнений, но описаны клинические случаи манифестной инфекции с различными симптомами: лихорадка выше 40°С, воспаление барабанной перепонки, респираторные и гастроинтестинальные симптомы, неврологические осложнения (энцефалиты, менингоэнцефалиты, асептический менингит, судороги с последующей эпилепсией); имеются сообщения о протекании первичной HHV-6-инфекции с гепатоспленомегалией, фатальным фульминантным гепатитом, фатальной диссеминированной инфекцией.
Потенциальная онкогенность HHV-6 и роль в характеризующемся множеством стадий процессе онкогенеза подтверждается следующими фактами. HHV-6 активирует онкопротеины Е6 и Е7 вируса папилломы человека при цервикальной карциноме. ДНК HHV-6 способна индуцировать неопластическую трансформацию клеток NIH3T3 in vitro и на животных моделях.
При анализе образцов слюны от больных назофарингеальной карциномой, методом ПЦР в ряде случаев выявлена ДНК HHV-6. У этих же больных было отмечено достоверное повышение титров антител к HHV-6 класса IgG и, в отличие от здоровой популяции, найдены антитела класса IgA. Таким образом, можно полагать, что наличие антител класса IgA к HHV-6 может служить признаком назофарингеальной карциномы.
Методом ПЦР, гибридизации in situ, ДНК HHV-6 была идентифицирована в тканях и клетках биопсийных образцов ходжкинских, смешанных В- и Т-клеточных неходжкинских лимфом, при ангиоиммунобластоидной лимфаденопатии, африканской лимфоме Беркитта, Т-клеточной острой лимфобластоидной лейкемии, лимфогранулематозе, инфекционном мононуклеозе, не связанном с ВЭБ, и ряде других лимфопролиферативных заболеваний.
Роль HHV-6 в возникновении синдрома хронической усталости обсуждается различными авторами, однако доказательства, которые приводятся в подтверждение этой гипотезы, неоднозначны.
Позднее вирус с аналогичными характеристиками был выделен другими исследователями.
При электронно-микроскопическом исследовании ультратонких срезов клеток, инфицированных HHV-7, выявлены типичные для герпесвируса вирионы диаметром до 170 нм, ДНК 150Кб. Вирионы содержали электронно-плотное цилиндрическое ядро, капсид, тегумент и внешнюю оболочку и имели значительное морфологическое сходство с HHV-6. Гибридизационный анализ показал, что ДНК HHV-7 отличается от ДНК вируса простого герпеса, ВЭБ, опоясывающего лишая и ЦМВ. В то же время ДНК ЦМВ имеет ограниченную перекрестную гибридизацию с ДНК HHV-7 (гомология находится на уровне 36%). Несколько большее сходство выявлено между ДНК HHV и ДНК HHV-7 (по разным данным, гомология находится на уровне 57,5–58,8%). Однако на основании ряда критериев можно сделать вывод, что речь идет о разных вирусах, а не о различных штаммах одного вируса. К настоящему времени HHV-7 классифицируется как член подсемейства β-герпесвирусов.
Распространенность инфекции и пути ее передачи неизвестны. Имеются данные и о выделении HHV-7 из слюны инфицированных, а также персистенции вируса в Т-лимфоцитах, в связи с чем предполагается возможность наличия воздушно-капельного пути передачи инфекции, особенно у детей раннего возраста, и передачи инфекции при переливании крови и ее компонентов. Для выделения и идентификации HHV-7 используют культуру мононуклеаров периферической крови, метод непрямой иммунофлюоресценции, электронной микроскопии, молекулярной гибридизации и сиквенс-анализа ДНК.
Значение HHV-7 в патологии не изучено. HHV-7 ассоциируется с лимфопролиферативными заболеваниями, синдромами хронической усталости и иммунодефицита.
Как самостоятельное заболевание синдром хронической усталости впервые был выделен в 1988 г. Центром по контролю заболеваний (The Centers for Disease Control–CDC, Атланта, США). Поводом для этого послужило внезапное увеличение в штате Невада в 1984 г. числа больных, жалующихся на постоянную усталость, сопровождающуюся рядом соматических и психологических симптомов — при отсутстви видимой причины заболевания. Подобные вспышки заболевания наблюдались и раньше: в Лос-Анжелесе в 1934 г., в Исландии в 1948 г., в Лондоне в 1955 г., во Флориде в 1956 г. Работы по изучению синдрома хронической усталости в США возглавили P. Cheney и D. Peterson. Вскоре в США были открыты специальные клиники для этих больных и создана Национальная ассоциация. Данное заболевание в настоящее время изучается также в Великобритании, Германии, Австралии, Японии и других странах.
В опубликованном CDC в марте 1988 г. в журнале «Annals of Internal Medicine» докладе были сформулированы диагностические критерии (большие и малые) синдрома хронической усталости. Этот диагностический комплекс подвергался пересмотру в 1991, 1992, 1994 гг. К большим (обязательным) диагностическим критериям относят наблюдающиеся в течение не менее 6 мес у ранее здоровых людей постоянную усталость и снижение работоспособности на 50% и более. Вторым обязательным критерием является отсутствие заболеваний или других причин, которые могут вызвать такое состояние.
Малые критерии можно объединить в несколько групп. Первая из них включает симптомы, отражающие наличие хронического инфекционного процесса: субфебрильная температура, хронический фарингит, увеличение лимфатических узлов (шейных, затылочных, подмышечных), мышечные и суставные боли. Вторая группа — психические и психологические проблемы: нарушение сна (гипо- или гиперсомния), снижение памяти, повышенная раздражительность, снижение интеллекта, невозможность концентрации внимания, депрессия и т. д.). Третью группу составили симптомы вегетативно-эндокринной дисфункции: быстрое изменение массы тела, нарушение функции желудочно-кишечного тракта, снижение аппетита, аритмия, дизурия, быстрая физическая утомляемость с последующей продолжительной (более 24 ч) усталостью и др. Четвертая группа объединяет симптомы аллергии и повышенной чувствительности к лекарственным препаратам, инсоляции, алкоголю и некоторым другим факторам.
Согласно диагностическим критериям 1994 г., диагноз синдрома хронической усталости считается достоверным, если у больного выявлены два обязательных критерия и четыре признака из приведенных ниже восьми дополнительных (которые также наблюдаются не менее 6 мес): нарушение памяти или концентрации внимания; фарингит; болезненные шейные лимфатические узлы; мышечные боли; полиартралгии; необычная, новая для больного головная боль; неосвежающий сон; недомогание после физического напряжения.
Распространенность синдрома хронической усталости, по данным большинства исследователей, в разных странах и социально-демографических группах приблизительно одинакова. Заболеванию подвержены люди любого возраста, однако замечено, что женщины в возрасте 25–49 лет болеют чаще, чем мужчины.
Предполагается, что HHV-7 может быть причиной exanthema subitum, но не прямо, а опосредованно, за счет реактивации HHV-6 из латентного состояния. HHV-7 селективно тропен к CD+-Т-клеткам. Показано что вирус инфицирует CD4+ в 42%, а CD8+ в 4% случаев. При взаимодействии HHV-7 и HIV ВИЧ появляется конкурирующий эффект за очередность инфицирования CD+-лимфоцитов.
HHV-8 — это герпесвирус, ассоциированный с саркомой Капоши (KS). Был недавно открыт и идентифицирован молекулярным клонированием с использованием тканей саркомы Капоши. KS — многоочаговая злокачественная опухоль сосудистого происхождения с преимущественным поражением кожных покровов и вовлечением внутренных огранов и лимфатических узлов. Выделяют четыре различные эпидемиологические формы KS: классическая, африканская, ятрогенная и СПИД-ассоциированная KS. HHV-8 подразделяют на три варианта: А, В и С — на основании различий в нуклеотидных последовательностях субсегментов генома.
Вариант А связывают с классической KS и со СПИД-ассоциированными поражениями кожи и внутренних органов, а В и С — с лимфопролиферативными заболеваниями (лимфомами, генерализованными лимфаденопатиями, болезнью Кастлемана).
Вирусная теория развития KS первые была выдвинута в 1967 г. B. MacKinney, изучавшим ее эпидемиологию у жителей Африки. В дальнейшем эту концепцию поддержали многие другие ученые, предполагавшие причастность к этому заболеванию вирусов группы Herpes: ВЭБ, ЦМВ в ассоциации с вирусом простого герпеса 1-го и 2-го иммунотипа, также вируса Т-клеточной лимфомы человека (HTLV).
Новый этап в понимании роли вирусов в развитии KS наступил в 1994 г., когда Y. Chang и соавторы обнаружили в ПЦР с использованием синтезированного ими праймера KS 330233 присутствие уникальной ДНК-последовательности в геноме опухолевых клеток, выделенных из биоптата очагов поражений кожи больного со СПИД-ассоциированным типом KS.
С учетом высокой частоты обнаружения HHV-8 в клетках очагов поражений KS, данных эпидемиологических исследований (обнаружение HHV-8 в очагах поражений больных различными типами KS как из эндемичных, так и неэндемичных регионов), а также подтверждения трансформирующего потенциала некоторых его генов, этот вирус в настоящее время рассматривается как наиболее вероятный кандидат на роль этиологического фактора данного заболевания. Это подтверждается и биологическими свойствами HHV-8: было установлено, что он кодирует белки, контролирующие рост и пролиферацию клеток, и обладает генетическим сродством по отношению к представителям подсемейства радиновирусов, обладающих трансформирующими свойствами. Этиологическая роль HHV-8 в развитии KS также была подтверждена в России. Причем сывороточные антитела к этому вирусу у здоровых доноров из России обнаруживались в 9,6% случаев.
Данные подтверждают возможность персистенции вируса в группах здоровых лиц и его активации в условиях иммуносупресии.
Высокая частота выявления HHV-8 в эякуляте здоровых доноров жителей Италии, которая также является эндемичным по KS регионом, не исключает возможности полового пути передачи данной инфекции. В связи с этим представляют интерес данные S. Lin и соавторов (1995), показавших, что у 13 из 30 ВИЧ-позитивных пациентов с наличием в эякуляте HHV-8 в течение 5 лет развилась KS, тогда как в эякуляте 30 ВИЧ-негативных пациентов без HHV-8 в те же сроки наблюдения KS не развилась ни в одном случае. Проведенные исследования отечественных авторов и полученные ими данные свидетельствуют о том, что ткани урогенитального тракта в некоторых случаях могут быть местом латенции HHV-8. При этом высокая частота хронических воспалительных поражений мочеполовых органов в группе больных c KS должна рассматриваться в качестве фактора, нарушающего гематотестикулярный барьер и тем самым способствующего проникновению в эякулят клеток воспаления, включая инфицированные HHV-8 В-лимфоциты. Необходимо учитывать роль хронического воспаления в снижении общего иммунитета и местного иммунного контроля в тканях репродуктивной системы.Такое воспаление может приводить к активации персистирующего там HHV-8. Установлено, что до 10% вирусов HHV-8, выявляемых в очагах поражения KS, находятся в литической фазе, в связи с чем этот вирус должен с высокой частотой обнаруживаться в лимфоцитах периферической крови. Однако HHV-8 в лимфоцитах периферической крови выявляется, как правило, только у больных с выраженной иммуносупрессией (СПИД-ассоциированным и иммуносупрессивным типом заболевания), тогда как у пациентов с другими типами KS инфицированные клетки содержатся в очагах поражения в эякуляте, а из крови, по-видимому, достаточно эффективно элиминируются. HHV-8 обнаруживали в эякуляте только при наличии у больных с KS хронического воспалительного процесса мочеполовых органов (хронический уретропростатит). Таким образом, эякулят у больных с KS является естественным резервуаром инфекции HHV-8. Инфицированные вирусом HHV-8 лимфоциты проникают в эякулят и сохраняются в нем в условиях аккумуляции CD8+ Т-лимфоцитов, ингибирующих иммунный ответ не только на сперматозоиды, но и на эти инфицированные клетки.
Вирус широко распространен в популяции: более 25% взрослого населения и 90% ВИЧ-инфицированных имеют антитела к литическим белкам HHV-8. HHV-8, как и ВЭБ или HVS, инфицирует в первую очередь лимфоциты и ассоциирован с клеточной трансформацией и иммортализацией. HHV-8 является возможным этиологическим агентом всех форм KS, связан с развитием некоторых В-клеточных лимфом, ангиоиммунобластоидной лимфаденопатии, болезни Кастлемана и ряда других лимфопролиферативных заболеваний.
Несмотря на большой арсенал антигерпетических препаратов терапия заболеваний, вызванных данными вирусами, представляет значительные трудности. Это обусловлено генотипическими особенностями возбудителя, длительной персистенцией вируса в организме, различной чувствительностью к препаратам. Исследования антивирусного действия некоторых препаратов показали, что HHV-6, 7, 8 малочувствительны к аналогам нуклеозидов. С определенным успехом в лечении были использованы ганцикловир и фоскарнет. Однако препаратов, которые были бы достаточно эффективны в лечении инфекции, вызванной HHV-6, 7, 8, пока не найдено.
Литература
Е. Г. Белова, кандидат медицинских наук, доцент
Т. К. Кускова, кандидат медицинских наук
МГМСУ, Москва



 Читайте также:
Читайте также: 