васкулит цнс что это такое
Церебральные васкулопатии (васкулиты): особенности клиники, диагностика, принципы лечения
4-5 сентября в г. Бердянске состоялась междисциплинарная научно-практическая конференция с международным участием «Мозг и сердце», в работе которой приняли участие ведущие украинские кардиологи и неврологи.О трудностях диагностики и лечения васкулитов центральной нервной системы (ЦНС) рассказала заведующая кафедрой неврологии и нейрохирургии Донецкого национального медицинского университета (г. Лиман), кандидат медицинских наук Софья Вениаминовна Селезнева.
– Васкулит ЦНС характеризуется воспалением стенок сосудов с фибриноидным некрозом и лейкоцитарной инфильтрацией, сужением просвета сосуда, повреждением сосудистой стенки, возникновением аневризм и кровоизлияний, высоким риском тромбоза. В большинстве случаев сосуды головного мозга поражаются при системных заболеваниях, но описаны и изолированные церебральные ангииты. При системных васкулитах мозговые сосуды вовлекаются в патологический процесс в 40% случаев.
Классификация церебральных васкулитов:
1. Первичные васкулиты (встречаются редко):
2. Вторичные васкулиты:
Первичные васкулиты ЦНС встречаются крайне редко. Диагноз изолированного ангиита ЦНС является, прежде всего, диагнозом исключения и требует гистологического подтверждения.
Клинические симптомы церебрального васкулита в большинстве случаев являются отражением мультифокальной церебральной ишемии. Наиболее частые проявления – диффузная головная боль, психические расстройства, нарушения зрения, эпилептические приступы, гемисиндромы и признаки поражения ствола мозга, миалгии при миозитах. У таких пациентов могут наблюдаться также множественные моно- и полинейропатии, связанные с поражением vasa nervorum. При неврологическом осмотре у пациентов с церебральным васкулитом можно выявить сенсомоторный дефицит, психические нарушения в виде когнитивного дефицита, изменений личности, аффективных или психотических расстройств.
Характерная неврологическая симптоматика сочетается также с общими симптомами, такими как лихорадка, ночная потливость, потеря массы тела, адинамия. Помочь в установлении диагноза могут признаки поражения других органов и систем, поскольку васкулопатии зачастую носят системный характер. При поражении кожи наблюдаются пурпура, некрозы и язвы, крапивница, феномен Рейно. Васкулит сосудов дыхательной системы приводит к развитию синусита, кровохарканья, язв слизистой оболочки, астматических симптомов. Васкулит сосудов сердца проявляется болью, схожей со стенокардитической, явлениями перимиокардита, тромбозами, стенозами, аневризмами и эмболическими инфарктами. При поражении сосудов желудочно-кишечного тракта пациенты отмечают боли в животе по типу колик и стул с примесью крови; сосудов мочевой системы – олигурию, полиурию, отеки, гематурию; сосудов, кровоснабжающих опорно-двигательный аппарат, – отеки суставов, миалгии, артралгии.
Диагноз церебрального васкулита устанавливается на основании результатов клинического, лабораторного и нейровизуализационного (магнитно-резонансная томография, ангиография) исследований. Для подтверждения диагноза необходимо проведение биопсии с гистологическим исследованием. Наличие воспалительного процесса в ЦНС и сосудистых очагов указывает на церебральный васкулит.
Васкулит внутричерепных сосудов может осложняться рецидивирующей церебральной ишемией, поражением нескольких участков сосуда и сосудистых бассейнов, окклюзией сосудов.
Вторичные васкулиты, которые наблюдаются в основном при системных заболеваниях, встречаются гораздо чаще. Поражение нервной системы при СКВ, по данным разных авторов, выявляется в 25-75% случаев. СКВ – это системное аутоиммунное ревматическое заболевание, которым преимущественно страдают женщины молодого возраста. Этиология СКВ неизвестна, патогенез характеризуется гиперпродукцией широкого спектра органонеспецифических аутоантител, которые вызывают иммунное воспаление в различных тканях и органах.Вовлечение в патологический процесс ЦНС в период высокой активности СКВ является прогностически неблагоприятным и по частоте смертельных исходов сопоставимо с нарушениями со стороны почек.
Характерная особенность СКВ – многообразие клинических проявлений (полисиндромность) и вариантов течения болезни. Поражение ЦНС при СКВ возникает вследствие различных патологических механизмов – ишемии, кровоизлияний, очагового поражения белого вещества мозга по типу демиелинизации и лейкоэнцефалопатии, нейрональной дисфункции. Одной из главных причин поражения нервной системы при СКВ является васкулопатия с гиалинизацией сосудов, периваскулярным лимфоцитозом и эндотелиальной пролиферацией (отмечается у 65% больных), тромбозами и истинными васкулитами (наблюдаются у 15%), инфарктами и геморрагиями преимущественно в поверхностных слоях коры головного мозга. У 80% больных СКВ обнаруживаются признаки острой или хронической недостаточности мозгового кровообращения. Инсульты у больных СКВ могут возникать вследствие кардиогенной эмболии (эндокардита Либмана-Сакса), образования антифосфолипидных антител, васкулопатии, реже – иммунного васкулита. Эти механизмы приводят к поражению не только центральной, но и периферической нервной системы.
Клинические проявления поражения ЦНС при СКВ могут быть явными (например, психозы, инсульты, эпилепсия) или скрытыми (головная боль, нейрокогнитивная дисфункция). Выраженность симптомов значительно варьирует, они могут быть едва заметными и расцениваться как невротические реакции. Все нейропсихические нарушения, развивающиеся у пациентов с СКВ, можно разделить на диффузные (эпилепсия, психические расстройства) и локальные (инсульт). Диагностика острых проявлений поражения ЦНС на фоне высокой воспалительной активности при СКВ практически не представляет трудности. Диагностика вялого течения церебрального васкулита, когда присутствуют лишь субъективные симптомы, а неврологические знаки выявить крайне трудно, напротив, является достаточно сложной задачей. Специфических инструментальных данных, которые характеризуют поражение ЦНС при СКВ, нет.
Признаки, указывающие на поражение нервной системы при СКВ:
Диагностические критерии (нейро-СКВ), предложенные Американской ревматологической ассоциацией (АРА, 1999).
1. Неврологические проявления:
а) судорожные приступы;
б) очаговые двигательные или чувствительные нарушения (гемипарезы, параличи черепных нервов, нарушения походки, поперечный миелит, нейропатия);
в) генерализованные расстройства (нарушения сознания, энцефалит, органические мозговые синдромы).
2. Психические изменения:
а) психоз (эндогенная депрессия, циклические аффективные нарушения, шизофреноподобное расстройство);
б) психоорганические синдромы.
1. Неврологические признаки:
а) парестезии без объективных нарушений чувствительности;
в) псевдоотек диска зрительного нерва.
2. Психические отклонения:
а) реактивная депрессия;
б) перепады настроения;
в) снижение умственных способностей;
д) нарушения поведения.
При поражении ЦНС больным СКВ должен проводиться тот же диагностический комплекс, что и пациентам без ревматической патологии с подобной симптоматикой. Согласно рекомендациям Европейской лиги против ревматизма (EULAR) по лечению СКВ, при подозрении на воспалительный генез поражения ЦНС у таких больных к терапии глюкокортикоидами должны быть добавлены цитостатики.
Профилактика тромбозов – важнейшая превентивная мера у пациентов с поражением сосудов. Золотым стандартом антитромботической терапии является ацетилсалициловая кислота. Процесс тромбообразования запускается при нарушении целостности эндотелия сосудов. Воспалительное повреждение эндотелия или нарушение целостности атеросклеротической бляшки внутри сосуда также инициирует процесс агрегации тромбоцитов и образования тромба. Международные и национальные кардиологические общества рекомендуют применять ацетилсалициловую кислоту в дозе 75 мг как для первичной профилактики тромбозов и других сердечно-сосудистых событий, так и для вторичной профилактики с целью снижения частоты тромботических осложнений у пациентов с острой и хронической формами ишемической болезни сердца, заболеваниями периферических артерий, нарушениями мозгового кровообращения в анамнезе. Ацетилсалициловая кислота (Магникор ® ), как известно, не влияет на вязкость крови, но снижает агрегацию тромбоцитов, препятствуя образованию тромбов.
Одним из современных направлений антитромботической терапии у пациентов с СКВ является назначение цилостазола (Плестазол ® ), который угнетает агрегацию тромбоцитов, ингибирует пролиферацию гладкомышечных клеток, расширяет сосуды и опосредованно снижает уровень общего холестерина, липопротеинов низкой плотности и триглицеридов. Плестазол ® назначают с целью профилактики повторного инсульта, тромбоза и рестеноза после реконструктивных сосудистых операций, стентирования, а также для лечения перемежающей хромоты и постинсультного синдрома.
В клинических исследованиях цилостазол не уступал в эффективности ацетилсалициловой кислоте; в систематическом обзоре ряда исследований (n=3477) он продемонстрировал высокую результативность во вторичной профилактике инсульта.
Подготовила Мария Маковецкая
СТАТТІ ЗА ТЕМОЮ Неврологія
Запаморочення не є окремою нозологією, а радше симптомом різних синдромів і розладів, які порушують функцію рівноваги. Це відчуття нестійкості та дезорієнтації в просторі, яке може виникати внаслідок патологічних змін нервової системи. Складність етіопатогенезу симптому зумовлює потребу в універсальних терапевтичних заходах на перших етапах лікування.
Значна увага під час заходу була приділена актуальним питанням неврології та новітнім досягненням у цій галузі медицини. Особливо цікавою для учасників конференції виявилася доповідь «Мігрень – фактор ризику інсульту: чи це дійсно так?» завідувача кафедри неврології у лікарні Литовського медичного університету, керівника Каунаського центру інсульту, клінічного невролога, професора Антанаса Вайткуса.
У вересні відбулася онлайн-конференція з міжнародною участю «Актуальні питання діагностики та лікування захворювань нервової системи», в якій взяли участь провідні неврологи України та інших країн.
Васкулит
Для жителей районов Савеловский, Беговой, Аэропорт, Хорошевский
В этом месяце жителям районов Савеловский, Беговой, Аэропорт, Хорошевский» предоставляется скидка 5% на ВСЕ мед.
Скидки для друзей из социальных сетей!
Гуляев Сергей Викторович
Врач-ревматолог, терапевт, нефролог
Кандидат медицинских наук
Васкулит (ангиит, артериит) – общее название для группы заболеваний, связанных с воспалением и разрушением стенок кровеносных сосудов. Воспаление сосудов может произойти в любом органе.
Заболевание васкулитом приводит к тому, что сосуды перестают правильно выполнять свою функцию (снабжение кровью тканей и выведение продуктов обмена), поэтому поражаются примыкающие к ним органы.
Васкулиты имеют разные классификации, могут различаться локализацией, этиологией и тяжестью клинической картины. При одних васкулитах поражается только кожа, при других – жизненно важные органы.
Оставленный без лечения васкулит может обернуться серьезными осложнениями. Кишечные и легочные кровотечения, тромбозы, почечная недостаточность, печеночная недостаточность, инфаркт – далеко не полный список опасных последствий заболевания. Васкулит способен привести больного к инвалидности и даже летальному исходу.
Виды и классификация васкулитов
Васкулит сосудов является одним из серьезнейших заболеваний. Воспалительным процессом могут быть охвачены как мелкие сосуды кровеносной системы (капилляры, артериолы и венулы), так и крупные (аорта и ее крупные ветви). Пораженные кровеносные сосуды могут располагаться неглубоко под кожей, в самих внутренних органах и любых полостях.
В зависимости от причины болезни, выделяют 2 вида системного васкулита:
Согласно общепринятой классификации, первичный васкулит может подразделяться на три группы, в зависимости от размеров воспаленных сосудов:
Выделяют также изолированный «васкулит кожи», который может быть проявлением следующих заболеваний:
Также васкулит может поражать различные органы человека:
васкулит мозга, васкулит легких, васкулит нижних конечностей, васкулит глаз. Глаза при васкулите могут очень сильно пострадать (воспаление артерий сетчатки способно привести к кровоизлияниям и частичной потере зрения).
Обычно люди, впервые столкнувшиеся с этим заболеванием, интересуются, заразен ли васкулит. Первичный васкулит не заразен и не опасен для окружающих, однако вторичный (инфекционный) васкулит, появившийся на фоне инфекционных заболеваний, например менингита, может представлять эпидемическую опасность.
Васкулит при беременности может не только спровоцировать задержку развития плода, но и привести к выкидышу.
Симптомы и признаки васкулита
Симптомы васкулита различны. Они зависят от характера поражения, вида васкулита, локализации воспалительного процесса, а также от степени выраженности основного заболевания.
Несмотря на разнообразие вариантов, у многих больных имеются некоторые одинаковые проявления: лихорадка, геморрагическая сыпь на коже, слабость, истощение, боли в суставах и мышечная слабость, отсутствие аппетита, потеря веса, онемение отдельных частей тела.
Облитерирующий тромбангиит (или болезнь Бюргера) связан, в первую очередь, с поражением кровеносных сосудов конечностей, проявляется болью в ногах и появлением больших язв на коже (кожный васкулит на ногах).
Болезнь Кавасаки поражает главным образом детей в возрасте до пяти лет и имеет типичные признаки васкулита (покраснение кожи, лихорадка, возможно воспаление глаз).
Узелковый периартериит в основном поражает средние кровеносные сосуды в различных частях тела, включая почки, кишечник, сердце, нервную и мышечную систему, кожу. Кожные покровы отличаются бледностью, сыпь при васкулите данного типа имеет пурпурный цвет.
Микроскопический полиангиит затрагивает в основном мелкие сосуды на коже, легких и почках. Это приводит к патологическим изменениям в органах, к нарушениям их функций. Болезнь характеризуется значительными поражениями кожи, лихорадкой и потерей веса у больных, появлением гломерулонефрита (иммунного поражения клубочков почек) и кровохарканья (легочный васкулит)
Церебральный васкулит (или васкулит мозга) – тяжелое заболевание, выражающееся воспалением стенок сосудов головного мозга. Может привести к кровоизлиянию, некрозу тканей. Причины появления этого вида сосудистого васкулита еще выясняются.
Гигантоклеточный артериит (болезнь Хортона). Процесс охватывает преимущественно артерии головы. Характерны приступы головной боли, гиперчувствительность кожи головы, боли в мышцах челюсти при жевании, нарушения зрения вплоть до слепоты.
Причины васкулита
Врачи еще не могут до конца определить причины первичного васкулита. Есть мнение, что это заболевание носит наследственный характер и связано с аутоиммунными нарушениями (аутоиммунный васкулит), плюс играют свою роль негативные внешние факторы и инфицирование золотистым стафилококком.
Причиной развития вторичного (инфекционно-аллергическоговаскулита) у взрослых является перенесенная инфекция.
Среди других причин васкулита можно выделить следующие:
Васкулит цнс что это такое
К.Е. Федоров (1), Т.А. Сергиенко (2), С.С. Голубев (3), Е.В. Атясова (4), Н.А. Назарова (2), С.В. Моисеев (5), П.И. Новиков (1)
(1) Ревматологическое отделение УКБ №3 ГБОУ ВПО Первый МГМУ им. И.М. Сеченова Минздрава РФ, Москва; (2) ФГБУ «Клиническая больница №1» Управления делами Президента РФ (Волынская), Москва; (3) Московская международная лаборатория патоморфологии LABORATOIRES DE GENIE, Москва; (4) Отделение лучевой диагностики МЦ «Петровские ворота», Москва; (5) Кафедра внутренних, профессиональных болезней и пульмонологии МПФ ГБОУ ВПО Первый МГМУ им. И.М. Сеченова Минздрава РФ
Васкулиты центральной нервной системы (ЦНС) – это тяжелые, потенциально инвалидизирующие заболевания, которые, как правило, развиваются в результате ревматических, инфекционных, лекарственных или онкологических заболеваний. К более редким формам церебрального васкулита относят изолированные, или первичные, васкулиты ЦНС [1]. В настоящее время морфологически выделяют гранулематозный (около 50%), лимфоцитарный (около 20%) и некротизирующий (около 20%) типы первичных васкулитов ЦНС. К гранулематозным ангиитам в свою очередь относят β-амилоид-ассоциированный васкулит (ABRA – Amyloid Beta Related Vasculitis), который занимает промежуточное положение между разновидностью церебральной амилоидной ангиопатии (ЦАА) и первичными васкулитами ЦНС. Также к этой промежуточной группе можно отнести ЦАА, ассоциированную с воспалением (CAA-RI – Cerebral Amyloid Angiopathy-Related Inflammation) [2].
Распространенность первичного васкулита ЦНС (PACNS – Primary Angiitis of the Central Nervous System) составляет 1 на 2,4 млн человек, в то время как заболеваемость ABRA – примерно 1 на 5 млн.
К основным проявлениям ABRA относятся рецидивирующие геморрагические и ишемические инсульты, эпилепсия и выраженные когнитивные нарушения. Гистологическая картина чаще всего включает гранулематозный ангиит с поражением сосудов среднего и малого калибров, разрывы стенок сосудов с кровоизлияниями, накопление β-амилоида в стенке сосудов в твердой, мягкой мозговых оболочках и веществе головного мозга [2].
В настоящее время нет единой классификации состояний, при которых происходит отложение β-амилоида в ЦНС. Спорадическая ЦАА характеризуется отложением β-амилоида в медии и адвентиции сосудов коры и мягкой мозговой оболочки [3–7]. Амилоид, который откладывается в сосудах, имеет такой же аминокислотный состав, как и предшественник белка амилоида (39–43 аминокислоты) в амилоидных бляшках при болезни Альцгеймера. Отложение β-амилоида в сосудах может приводить к повышенной ломкости сосудов, что ведет к разрыву сосудов и внутримозговым гематомам [3, 4]. Лобарные внутримозговые гематомы являются наиболее частыми проявлениями ЦАА, которая может сопровождаться воспалением сосудистой стенки. Это проявляется медленным снижением когнитивных функций, судорогами, головными болями и наличием гиперинтенсивных очагов в режиме T2 магнитно-резонансной томографии (МРТ), которые отвечают на лечение иммуносупрессивными препаратами [8–14]. Описано несколько разновидностей ЦАА: вариант с развитием периваскулярного воспаления без деструкции стенки сосуда, т.н. CAA-RI [11, 12], и вариант с трансмуральным, часто гранулематозным, ангиитом (ABRA) [13, 14]. Высказаны предположения, что ABRA является вариантом в большей степени первичного васкулита ЦНС, чем церебральной ангиопатии [13, 14]. В настоящее время также отсутствует единая классификация ABRA, поэтому прогноз заболевания и отдаленные последствия не изучены.
В результате одного из самых крупных ретроспективных исследований пациентов с первичными васкулитами ЦНС C. Salvarani была сделана попытка уточнить различные варианты ЦАА. Пациенты с ABRA по сравнению с больными ЦАА оказались моложе, реже имели снижение интеллекта, реже страдали от инсультов, в т.ч. геморрагических, и реже имели тяжелый неврологический дефицит. При МРТ накопление гадолиния в мягкой мозговой оболочке наблюдалось чаще у пациентов с ABRA, также у них отмечен лучший ответ на лечение и исход заболевания. Нельзя исключить, что такие результаты могут быть связаны с тем, что больных ЦАА лечили гораздо реже, чем больных ABRA. Тем не менее лучший ответ на лечение и исход при ABRA можно связать с наличием васкулита, который определяет проявления заболевания и поддается иммуносупрессивному лечению по сравнению с другими формами ЦАА, при которых отсутствует воспаление и состояние считается неизлечимым [2].
При сравнении ABRA и CAA-RI были обнаружены следующие различия. При ABRA чаще выявлялись изменения мягких мозговых оболочек в присутствии или без инфильтративных очагов в белом веществе, накапливающих контраст при МРТ. В то же время лобарные кровоизлияния и вазогенный отек в сочетании с масс-эффектом чаще обнаруживали при ЦАА. При сравнении ABRA и PACNS пациенты с ABRA были старше в момент установления диагноза, чаще страдали от снижения интеллекта и судорожных припадков при первом осмотре, реже имели гемипарезы и нарушения зрения. Уровень белка в ликворе был значительно выше у пациентов с ABRA. Ишемические инсульты встречались реже, а внутримозговые гематомы и накопление гадолиния в мягкой мозговой оболочке чаще в случае ABRA. Ответ на лечение, длительность лечения и исходы заболеваний были сопоставимыми.
Исследование С. Salvarani подтверждает результаты более ранних работ [13] о том, что ABRA и периваскулярная форма (CAA-RI) служат вариантами в большей степени PACNS, чем ЦАА, и имеют схожие механизмы развития. Необходимо также отметить, что, несмотря на отсутствие воспаления, клинические и радиологические проявления ЦАА у отдельных пациентов во многом схожи с ABRA и CAA-RI [15, 16]. Такое сходство заболеваний может объяснить ошибочную постановку диагноза СAA-RI вместо ABRA в случаях обнаружения лишь сегментарного поражения артерий головного мозга при биопсии.
У одного пациента с ABRA и у одного с CAA-RI описано выявление в ликворе интратекальных аутоантител к различным формам белка амилоида (1–40 и 1–42) [17, 18]. Снижение уровня этих антител было отмечено после трех месяцев стероидной терапии наряду с клиническим и радиологическим улучшением. Данные наблюдения могут свидетельствовать о том, что воспаление, связанное с ABRA и CAA-RI, может возникать в результате иммунного ответа на отложение амилоидного белка в церебральных сосудах. Эксперименты с лечением, направленным на активное или пассивное снижение уровня отложения амилоидного белка при болезни Альцгеймера, показали, что такое лечение приводило к менингоэнцефалиту или вазогенному отеку, вызывая клинические, рентгенологические и морфологические проявления, схожие с ABRA и CAA-RI [19, 20]. В исследовании C. Salvarani вазогенный отек, или масс-эффект, наблюдался у 22 (79%) из 28 пациентов с ABRA или CAA-RI [2]. При введении бапинезумаба (хуманизированное моноклональное антитело против амилоидного белка) также развивался вазогенный отек [20].
Клиническое наблюдение
Весной 2014 г. в клинику обратился мужчина 33 лет, армянин, работал менеджером. Причиной обращения были рецидивирующие геморрагические и ишемические инсульты головного мозга.
Из анамнеза известно, что заболеванию предшествовала закрытая черепно-мозговая травма. В 2010 г. выполнена правосторонняя орхидэктомия по поводу семиномы; химиотерапия и лучевая терапия не проводились в связи с полным удалением опухоли и отсутствием метастазов.
В 2012 г. лечение мерказолилом по поводу тиреотоксикоза.
Семейный анамнез без особенностей. Отмечена аллергия на новокаин в виде артериальной гипотензии.
Дебют настоящего заболевания состоялся осенью 2011 г., когда развился периферический парез лицевого нерва. При МРТ патологии не выявлено. Парез самостоятельно регрессировал в течение последующих трех недель. Дальнейшее ухудшение состояния пациента возникло в том же году после повторной закрытой черепно-мозговой травмы, когда появилась диффузная головная боль, двоение в глазах, нарушение походки. При обследовании обнаружены застойные диски зрительных нервов по данным МРТ головного мозга, множественные мелкие кровоизлияния в области моста, глубоких отделах правой височной доли. По данным компьютерной томографии (КТ) и магнитно-резонансной ангиографии сосудов мозга стенозы не выявлены. Проведено симптоматическое лечение с временным улучшением состояния и самочувствия. С мая 2012 г. вновь ухудшение состояния в виде появления сонливости, головокружения, тошноты, рвоты, субфебрилитета. Выявлено повышение уровня СРБ до 2 норм (рис. 1).
По данным МРТ, прогрессирование поражения головного мозга в виде увеличения количества мелких кровоизлияний.
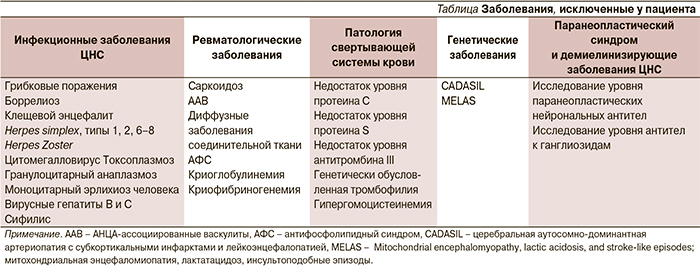
Дифференциальная диагностика проводилась между инфекционными заболеваниями, паранеопластическим синдромом с учетом семиномы в анамнезе, системных заболеваний соединительной ткани (см. таблицу). В анализах ликвора отсутствовали патологические изменения. Обсуждался постгерпетичекий геморрагический энцефалит Штрюмпеля–Ляйхтенштерна.
Лечение интерферонами было прекращено, начато введение дексаметазона с выраженным эффектом, пациент вернулся к повседневной жизни, нормализовались температура тела и уровень С-реактивного белка (СРБ). Через 2 месяца лечение дексаметазоном было прекращено. Следующее ухудшение – после длительного периода злоупотребления алкоголем в конце 2013 г., проявилось общей заторможенностью, нарушениями координации, психическими нарушениями в виде эпизодов неадекватности, агрессии, субфебрилитетом. По данным МРТ отмечено появление новых ишемических и геморрагических очагов в обоих полушариях головного мозга; данных о наличии интракраниальных стенозов не получено (рис. 3).
В марте 2014 г. после горячей ванны у пациента развивается крупное внутримозговое кровоизлияние в правой височной доле с признаками вклинения ствола головного мозга (рис. 4), была проведена хирургическая декомпрессия с эвакуацией гематомы.
Послеоперационный период протекал без осложнений. После кровоизлияния в марте 2014 г. у пациента отсутствовали грубые двигательные и чувствительные нарушения, однако больной был инвалидизирован в связи со стойким психоорганическим синдромом, который не позволял ему вести самостоятельный образ жизни и работать. В мае 2014 г. пациент обратился в Клинику им Е.М. Тареева. При осмотре выявили субфебрилитет, умеренные когнитивные нарушения (MMSE – Mini-Mental State Examination 20 баллов), психоорганический синдром, парциальные судорожные припадки (клонусы нижней челюсти и правой стопы), инвалидизация по модифицированной шкале Рэнкина 2 балла; в соматическом статусе без особенностей. По данным МРТ, отрицательная динамика в виде появления новых ишемических очагов в обоих полушариях головного мозга (рис. 5).
В анализах крови – стойкое повышение уровня СРБ до 2 норм.
Заподозрен первичный васкулит ЦНС. В пользу данного диагноза свидетельствовали множественные геморрагические и ишемические очаги в головном мозге, по данным МРТ, и признаки системного воспаления в виде субфебрилитета и стойкого длительного повышения уровня СРБ.
Дополнительно были исключены наследственная артериопатия (CADASIL) и митохондриальное наследственное заболевание (MELAS). С целью подтверждения диагноза больному выполнена биопсия головного мозга в условиях отделения нейрохирургии ФГБУ «Клиническая больница № 1» Управления делами Президента РФ (Волынская). Под эндотрахеальным наркозом произведен разрез по старому рубцу в правой височно-теменнозатылочной области. Кожный лоскут оттянут, костный лоскут удален. Твердая мозговая оболочка рубцово изменена, умеренно напряжена, слабо пульсирует. В проекции задних отделов нижней височной извилины выделен наиболее интактный участок твердой мозговой оболочки, иссечен на протяжении 5×5 мм, взят для исследования. После дополнительного лоскутного разреза твердой мозговой оболочки выделен интактный участок арахноидальной оболочки в малососудистой зоне, отсечен фрагмент 3×5 мм. Затем в проекции иссеченной арахноидальной оболочки острым путем иссечен фрагмент мозгового вещества 5×5 мм в глубину до 3 мм. Дефект твердой мозговой оболочки замещен фрагментом апоневроза. Костный лоскут уложен на место, фиксирован имевшимися на нем микровинтами. Рана ушита послойно.
При гистологическом исследовании твердой и мягкой мозговых оболочек выявлены признаки гранулематозного деструктивного васкулита в сочетании с массивным диффузным отложением амилоида в паренхиме вещества височной доли большого мозга и в сосудистой стенке (рис. 6).
Таким образом, наличие гранулематозного деструктивного васкулита в сочетании с отложением амилоида позволило диагностировать первичный β-амилоид-ассоциированный васкулит ЦНС.
На 4-е сутки после операции начато лечение. Проведены 3 внутривенные инфузии преднизолона по 1500 мг (из расчета 15 мг/кг массы тела) с последующим переходом на пероральный прием 75 мг/сут преднизолона. Начато лечение циклофосфамидом (ЦФ) в дозе 1400 мг внутривенно капельно 1 раз в 4 недели. В результате лечения через месяц отмечена нормализация уровня СРБ и температуры тела, отсутствие новых повреждений головного мозга.
Обсуждение
Наш клинический случай служит примером длительного течения ABRA, осложнившегося множественными ишемическими и геморрагическими инсультами, когнитивными расстройствами и эпилепсией. ABRA составляет примерно 30% всех PACNS.
К основным характеристикам ABRA по сравнению с другими подтипами PACNS относятся:
Необходимо отметить, что в дебюте заболевание проявлялось поражением периферической нервной системы в виде неврита лицевого нерва. В дальнейшем возникло поражение ЦНС в виде множественных ишемических и геморрагических очагов и отложения амилоида в головном мозге. Данная особенность не противоречит концепции заболевания, а по-видимому, является редким ее проявлением, т.к., с одной стороны, подобное поражение может быть проявлением гранулематозного воспаления, с другой – существуют описания сочетания поражений центральной и периферической нервной системы при PACNS [21].
К факторам риска развития васкулита у данного пациента можно отнести неоднократные травмы головы, лечение мерказолилом и злоупотребление алкоголем. Тщательное обследование пациента с исключением обширного спектра заболеваний позволило сузить круг предполагаемой патологии до PACNS, однако несвоевременно поздно выполненная биопсия не позволила начать адекватное лечение и предотвратить инвалидизацию. Стоит также отметить, что уже на ранних МРТ головного мозга можно было заподозрить отложение амилоида, тем не менее недостаточное качество исследований и неверная трактовка результатов значительно отдалили постановку диагноза. Более того, при хирургической декомпрессии головного мозга в марте 2014 г. по поводу крупного внутримозгового кровоизлияния у молодого больного с длительным анамнезом инсультов удаленный детрит не был исследован гистологически, что потребовало в дальнейшем повторной трепанации черепа для морфологической верификации диагноза.
В последние десятилетия ведутся разработки неинвазивных методов диагностики, таких как определение уровня β-амилоида в ликворе [18], позитронно-эмиссионная томография головного мозга и магнитно-резонансная спектроскопия с использованием высокопольных томографов. Следует отметить, что МРТ с применением специальных режимов остается чувствительным методом диагностики, позволяющим заподозрить PACNS на ранних стадиях; в отсутствие изменений на МРТ диагноз первичного церебрального ангиита маловероятен [21]. При анализе МРТ головного мозга нашего пациента, в особенности последних исследований с использованием режимов FLAIR (Fluid-Attenuated Inversion Recovery – режим с подавлением сигнала свободной воды) и SWI (Susceptibility – Weighted Imaging – изображения, взвешенные по неоднородности магнитного поля), отчетливо видны свежие ишемические очаги (FLAIR), располагающиеся вокруг мелких сосудов (SWI), отложение амилоида и гемосидерина (SWI). Совмещение изображений разных импульсных последовательностей может давать информацию о взаимоотношении очагов ишемии и сосудов головного мозга, состоянии стенок сосудов в очаге ишемии. Несмотря на развитие неинвазивных методик, биопсия остается единственным методом достоверной диагностики ABRA.
В большинстве случаев биопсия головного мозга и его оболочек – это безопасная рутинная операция. Для снижения риска осложнений операции используют стереотаксическую навигацию с учетом расположения сосудов и проводящих путей, а также функционального картирования головного мозга [22]. Существует несколько подходов к биопсии головного мозга. При диффузном поражении головного мозга или отсутствии возможности забора ткани из измененной области следует выполнять биопсию мягкой, твердой оболочек головного мозга, серого и белого вещества височной доли недоминантного полушария. При наличии крупного очага или кровоизлияния предпочтительно взятие материала из пораженной области и оболочки головного мозга, в частности при проведении хирургической декомпрессии по поводу внутримозгового кровоизлияния удаленный детрит должен быть рутинно исследован на наличие амилоида (окраска конго-красным) [21].
В описанном нами случае не использовалась стереотаксическая навигация, т.к. предполагалось поверхностное взятие материала из зоны уже перенесенного крупного кровоизлияния в височной доле недоминантного правого полушария. Обычно для исследования достаточно менее 1 см2 мягкой и твердой мозговых оболочек, объем фрагмента головного мозга определяется индивидуально. Фрагменты помещают в формалин, в перечень гистологических исследований обязательно должна входить окраска на амилоид [2]. При исследовании биоптата нашего пациента наиболее выраженные изменения были выявлены в твердой мозговой оболочке и веществе головного мозга. Именно сочетание таких признаков, как трансмуральный гранулематозный ангиит с разрывом стенок сосудов, кровоизлияния и массивное отложение β-амилоида в первую очередь в стенке сосудов, позволило отнести васкулит к ABRA.
В терапии ABRA используются те же подходы, что и при лечении жизнеугрожающих форм АНЦА-ассоциированных васкулитов: сочетание ГК и ЦФ, использование азатиоприна, препаратов микофеноловой кислоты, ритуксимаба, а также ингибиторов фактора некроза опухоли-α в отсутствие эффекта от стандартной терапии [23, 24]. Для поддержания ремиссии применяют обычно азатиоприн, микофенолат, метотрексат, ритуксимаб. Выраженный лечебный эффект достигается от монотерапии ГК или в сочетании с ЦФ [25, 26]. Уточнение типа PACNS играет важную роль в лечении, т.к. при ABRA не рекомендовано лечение антикоагулянтами и антиагрегантами в связи с очень высоким риском геморрагических инсультов [27].
Несмотря на редкость PACNS в популяции, инсульт в молодом возрасте, особенно сочетание геморрагических и ишемических очагов, эпилепсия, снижение когнитивных функций в сочетании со специфическими изменениями на МРТ всегда требуют проведения дифференциальной диагностики с PACNS. Нередко PACNS эффективно поддаются лечению, особенно на ранних стадиях, поэтому своевременная диагностика и адекватная терапия значительно снижают риск инвалидизации пациента. Решающую роль в диагностике PACNS с поражением артерий среднего и мелкого калибра играет биопсия, которая при правильном планировании и выполнении является безопасной процедурой и должна незамедлительно использоваться при подозрении на PACNS.