вариабельность сердечного ритма резко снижена что это значит как лечить
Вариабельность сердечного ритма резко снижена что это значит как лечить
При инсульте отмечаются преходящие изменения сердечной деятельности, изменения на ЭКГ, которые в ряде случаев являются отражением имеющейся, но скрытой ранее кардиальной патологии [16]. Развитие этих транзиторных кардиальных нарушений напрямую связано с острым церебральным поражением и обозначается понятием «цереброкардиальный синдром» (ЦКС) [5, 7].
В последние годы возрос интерес к изучению вариабельности ритма сердца (ВРС) как показателя, отражающего автономную регуляцию сердца и определяющего риск внезапной сердечной смерти. ВРС представляет собой изменение частоты сердечных сокращений (длительности интервалов RR) вовремени.Снижение ВРС является высокоинформативным независимым предиктором желудочковой тахикардии, фибрилляции желудочков и внезапной смерти у больных инфарктом миокарда [8].
Литературные данные о прогностической значимости ВРС при остром инсульте неоднозначны. У больных с различным течением инсульта встречаются разные варианты изменений вегетативной регуляции и неодинаковая степень их выраженности, что позволяет использовать оценку изменений обоих отделов вегетативной нервной системы для прогнозирования тяжести и исхода заболевания [20]. Есть данные, указывающие и о необходимости переоценки значений ВРС при инсульте [19].
ВРС является одним из механизмов адаптации организма к изменению внешних и внутренних факторов и отражает степень напряжения регуляторных систем на стрессорное воздействие [1, 11]. При ухудшении здоровья пациента или появлении дискомфорта в его состоянии, связанного с началом заболевания, возникновением осложнений в течение заболевания, наличием долговременного стресса ВРС снижается, при улучшении состояния организма (выздоровлении, исчезновении источника стресса) ВРС увеличивается [11].
Острое нарушение мозгового кровообращения приводит не только к повышению уровня катехоламинов плазмы, но и изменениям автономной регуляции сердечно-сосудистой системы, нарушению ВРС, что может негативно влиять на электрическую нестабильность миокарда, провоцировать аритмии, которые могут ухудшать гемодинамику и негативно влиять на репаративные процессы в зоне церебральной ишемии [16, 21]. При развитии ишемического инсульта отмечалась положительная корреляция между частотными показателями ВРС и уровнями систолического и диастолического артериального давления(АД) в дневные и ночные часы, что свидетельствует о едином механизме, участвующем в регуляции работы сердечно-сосудистой системы, и его нарушении у больных в остром периоде ишемического инсульта [2]. При инсульте наблюдалось большее, чем у пациентов с гипертоническим кризом, снижение вегетативного контроля ритма сердца. Так, показатель SDNN был понижен по сравнению с пациентами с гипертоническим кризом на 12,8 % (р
Лечение нарушений ритма сердца
Почему терапия аритмий считается одним из самых сложных разделов кардиологии? Как классифицируются аритмии? Какие группы лекарственных препаратов используются при лечении аритмий? Нарушения ритма сердца (аритмии) представляют собой один из самы
Почему терапия аритмий считается одним из самых сложных разделов кардиологии?
Как классифицируются аритмии?
Какие группы лекарственных препаратов используются при лечении аритмий?
Нарушения ритма сердца (аритмии) представляют собой один из самых сложных разделов клинической кардиологии. Отчасти это объясняется тем, что для диагностики и лечения аритмий необходимо очень хорошее знание электрокардиографии, отчасти — огромным разнообразием аритмий и большим выбором способов лечения. Кроме того, при внезапных аритмиях нередко требуется проведение неотложных лечебных мероприятий.
Одним из основных факторов, повышающих риск возникновения аритмий, является возраст. Так, например, мерцательную аритмию выявляют у 0,4% людей, при этом большую часть пациентов составляют люди старше 60 лет [1, 2, 4]. Увеличение частоты развития нарушений ритма сердца с возрастом объясняется изменениями, возникающими в миокарде и проводящей системе сердца в процессе старения. Происходит замещение миоцитов фиброзной тканью, развиваются так называемые «склеродегенеративные» изменения. Кроме этого, с возрастом повышается частота сердечно-сосудистых и экстракардиальных заболеваний, что также увеличивает вероятность возникновения аритмий [17, 18].
Основные клинические формы нарушений ритма сердца
По характеру клинического течения нарушения ритма сердца могут быть острыми и хроническими, преходящими и постоянными. Для характеристики клинического течения тахиаритмий используют такие определения, как «пароксизмальные», «рецидивирующие», «непрерывно рецидивирующие» [2].
Лечение нарушений ритма сердца
Показаниями для лечения нарушений ритма являются выраженные нарушения гемодинамики или субъективная непереносимость аритмии. Безопасные, бессимптомные или малосимптомные легко переносящиеся аритмии не требуют назначения специального лечения. В этих случаях основным лечебным мероприятием является рациональная психотерапия. Во всех случаях прежде всего проводится лечение основного заболевания.
Антиаритмические препараты
Основным способом терапии аритмий является применение антиаритмических препаратов. Хотя антиаритмические препаты не могут «вылечить» от аритмии, они помогают уменьшить или подавить аритмическую активность и предотвратить рецидивирование аритмий.
Любое воздействие антиаритмическими препаратами может вызывать как антиаритмический, так и аритмогенный эффект (то есть, наоборот, способствовать возникновению или развитию аритмии). Вероятность проявления антиаритмического эффекта для большинства препаратов составляет в среднем 40–60% (и очень редко для некоторых препаратов при отдельных вариантах аритмии достигает 90%). Вероятность развития аритмогенного эффекта составляет в среднем примерно 10%, при этом могут возникать опасные для жизни аритмии. В ходе нескольких крупных клинических исследований было выявлено заметное повышение общей летальности и частоты случаев внезапной смерти (в 2 — 3 раза и более) среди больных с органическим поражением сердца (постинфарктный кардиосклероз, гипертрофия или дилатация сердца) на фоне приема антиаритмических препаратов класса I, несмотря на то что эти средства эффективно устраняли аритмии [7, 8, 9].
Согласно наиболее распространенной на сегодняшний день классификации антиаритмических препаратов Вогана Вильямса, все антиаритмические препараты подразделяются на 4 класса:
I класс — блокаторы натриевых каналов.
II класс — блокаторы бета-адренергических рецепторов.
III класс — препараты, увеличивающие продолжительность потенциала действия и рефрактерность миокарда.
IV класс — блокаторы кальциевых каналов.
Применение комбинаций антиаритмических препаратов в ряде случаев позволяет достичь существенного повышения эффективности антиаритмической терапии. Одновременно отмечается уменьшение частоты и выраженности побочных явлений вследствие того, что препараты при комбинированной терапии назначают в меньших дозах [3, 17].
Следует отметить, что показаний для назначения так называемых метаболических препаратов пациентам с нарушениями ритма не существует. Эффективность курсового лечения такими препаратами, как кокарбоксилаза, АТФ, инозие-Ф, рибоксин, неотон и т. п., и плацебо одинаковы. Исключение составляет милдронат, препарат цитопротективного действия, имеются данные об антиаритмическом эффекте милдроната при желудочковой экстрасистолии [3].
Особенности лечения основных клинических форм нарушений ритма
Экстрасистолия
Клиническое значение экстрасистолии практически целиком определяется характером основного заболевания, степенью органического поражения сердца и функциональным состоянием миокарда. У лиц без признаков поражения миокарда с нормальной сократительной функцией левого желудочка (фракция выброса больше 50%) наличие экстрасистолии не влияет на прогноз и не представляет опасности для жизни. У больных с органическим поражением миокарда, например с постинфарктным кардиосклерозом, экстрасистолия может рассматриваться в качестве дополнительного прогностически неблагоприятного признака. Однако независимое прогностическое значение экстрасистолии не определено. Экстрасистолию (в том числе экстрасистолию «высоких градаций») даже называют «косметической» аритмией, подчеркивая таким образом ее безопасность.
Как было уже отмечено, лечение экстрасистолии с помощью антиаритмических препаратов класса I C значительно увеличивает риск смерти. Поэтому при наличии показаний лечение начинают с назначения β-блокаторов [8, 17, 18]. В дальнейшем оценивают эффективность терапии амиодароном и соталолом. Возможно также применение седативных препаратов. Антиаритмические препараты класса I C используют только при очень частой экстрасистолии, в случае отсутствия эффекта от терапии β-блокаторами, а также амидороном и соталолом (табл. 3)
Тахиаритмии
В зависимости от локализации источника аритмии различают наджелудочковые и желудочковые тахиаритмии. По характеру клинического течения выделяют 2 крайних варианта тахиаритмий (постоянные и пароксизмальные. Промежуточное положение занимают преходящие или рецидивирующие тахиаритмии. Чаще всего наблюдается мерцательная аритмия. Частота выявления мерцательной аритмии резко увеличивается с возрастом больных [1, 17, 18].
Мерцательная аритмия
Пароксизмальная мерцательная аритмия. В течение первых суток у 50% больных с пароксизмальной мерцательной аритмией отмечается спонтанное восстановление синусового ритма. Однако произойдет ли восстановление синусового ритма в первые часы, остается неизвестным. Поэтому при раннем обращении больного, как правило, предпринимаются попытки восстановления синусового ритма с помощью антиаритмических препаратов. В последние годы алгоритм лечения мерцательной аритмии несколько усложнился. Если от начала приступа прошло более 2 суток, восстановление нормального ритма может быть опасным — повышен риск тромбоэмболии (чаще всего в сосуды мозга с развитием инсульта). При неревматической мерцательной аритмии риск тромбоэмболий составляет от 1 до 5% (в среднем около 2%). Поэтому, если мерцательная аритмия продолжается более 2 суток, надо прекратить попытки восстановления ритма и назначить больному непрямые антикоагулянты (варфарин или фенилин) на 3 недели в дозах, поддерживающих показатель международного нормализованного отношения (МНО) в пределах от 2 до 3 (протромбиновый индекс около 60%). Через 3 недели можно предпринять попытку восстановления синусового ритма с помощью медикаментозной или электрической кардиоверсии. После кардиоверсии больной должен продолжить прием антикоагулянтов еще в течение месяца.
Таким образом, попытки восстановления синусового ритма предпринимают в течение первых 2 суток после развития мерцательной аритмии или через 3 недели после начала приема антикоагулянтов. При тахисистолической форме сначала следует уменьшить ЧСС (перевести в нормосистолическую форму) с помощью препаратов, блокирующих проведение в атриовентрикулярном узле: верапамила, β-блокаторов или дигоксина.
Для восстановления синусового ритма наиболее эффективны следующие препараты:
Сегодня с целью восстановления синусового ритма при мерцательной аритмии все чаще назначают однократную дозу амиодарона или пропафенона перорально. Эти препараты отличаются высокой эффективностью, хорошей переносимостью и удобством приема. Среднее время восстановления синусового ритма после приема амиодарона (30 мг/кг) составляет 6 ч, после пропафенона (600 мг) — 2 ч [6, 8, 9].
При трепетании предсердий кроме медикаментозного лечения можно использовать чреспищеводную стимуляцию левого предсердия с частотой, превышающей частоту трепетания, — обычно около 350 импульсов в минуту, продолжительностью 15–30 с. Кроме того, при трепетании предсердий очень эффективным может быть проведение электрической кардиоверсии разрядом мощностью 25–75 Дж после в/в введения реланиума.
Постоянная форма мерцательной аритмии. Мерцание предсердий является наиболее часто встречающейся формой устойчивой аритмии. У 60% больных с постоянной формой мерцательной аритмии основным заболеванием являются артериальная гипертония или ИБС. В ходе специальных исследований было выявлено, что ИБС становится причиной развития мерцательной аритмии примерно у 5% больных. В России существует гипердиагностика ИБС у больных с мерцательной аритмией, особенно среди людей пожилого возраста. Для постановки диагноза ИБС всегда необходимо продемонстрировать наличие клинических проявлений ишемии миокарда: стенокардии, безболевой ишемии миокарда, постинфарктного кардиосклероза.
Мерцательная аритмия обычно сопровождается неприятными ощущениями в грудной клетке, могут отмечаться нарушения гемодинамики и, главное, повышается риск возникновения тромбоэмболий, прежде всего в сосуды мозга. Для снижения степени риска назначают антикоагулянты непрямого действия (варфарин, фенилин). Менее эффективно применение аспирина [1, 17, 18].
Основным показанием для восстановления синусового ритма при постоянной форме мерцательной аритмии является «желание больного и согласие врача».
Для восстановления синусового ритма используют антиаритмические препараты или электроимпульсную терапию.
Антикоагулянты назначают, если мерцательная аритмия наблюдается более 2 суток. Особенно высок риск развития тромбоэмболий при митральном пороке сердца, гипертрофической кардиомиопатии, недостаточности кровообращения и тромбоэмболиях в анамнезе. Антикоагулянты назначают в течение 3 недель до кардиоверсии и в течение 3 — 4 недель после восстановления синусового ритма. Без назначения антиаритмических препаратов после кардиоверсии синусовый ритм сохраняется в течение 1 года у 15 — 50% больных. Применение антиаритмических препаратов повышает вероятность сохранения синусового ритма. Наиболее эффективно назначение амиодарона (кордарона) — даже при рефрактерности к другим антиаритмическим препаратам синусовый ритм сохраняется у 30 — 85% больных [2, 12]. Кордарон нередко эффективен и при выраженном увеличении левого предсердия.
Кроме амиодарона для предупреждения повторного возникновения мерцательной аритмии с успехом используются соталол, пропафенон, этацизин и аллапинин, несколько менее эффективны хинидин и дизопирамид. При сохранении постоянной формы мерцательной аритмии больным с тахисистолией для снижения ЧСС назначают дигоксин, верапамил или β-блокаторы. При редко встречающемся брадисистолическом варианте мерцательной аритмии эффективным может быть назначение эуфиллина (теопек, теотард).
Проведенные исследования показали, что две основные стратегии ведения больных с мерцательной аритмией — попытки сохранения синусового ритма или нормализация ЧСС на фоне мерцательной аритмии в сочетании с приемом непрямых антикоагулянтов — обеспечивают примерно одинаковое качество и продолжительность жизни больных [17].
Пароксизмальные наджелудочковые тахикардии
Пароксизмальные наджелудочковые тахикардии, встречающиеся гораздо реже, чем мерцательная аритмия, не связаны с наличием органического поражения сердца. Частота их выявления с возрастом не увеличивается.
Купирование пароксизмальных наджелудочковых тахикардий начинают с применения вагусных приемов. Наиболее часто используют пробу Вальсальвы (натуживание на вдохе около 10 с) и массаж сонной артерии. Очень эффективным вагусным приемом является «рефлекс ныряния» (погружение лица в холодную воду) — восстановление синусового ритма отмечается у 90% больных. При отсутствии эффекта от вагусных воздействий назначают антиаритмические препараты. Наиболее эффективны в этом случае верапамил, АТФ или аденозин.
У больных с легко переносящимися и сравнительно редко возникающими приступами тахикардии практикуется самостоятельное пероральное купирование приступов. Если в/в введение верапамила оказывается эффективным, можно назначить его внутрь в дозе 160–240 мг однократно, в момент возникновения приступов. Если более эффективным признается в/в введение новокаинамида — показан прием 2 г новокаинамида. Можно иcпользовать 0,5 г хинидина, 600 мг пропафенона или 30 мг/кг амиодарона внутрь.
Желудочковые тахикардии
Желудочковые тахикардии в большинстве случаев возникают у больных с органическим поражением сердца, чаще всего при постинфарктном кардиосклерозе [13, 14].
Лечение желудочковой тахикардии. Для купирования желудочковой тахикардии можно использовать амиодарон, лидокаин, соталол или новокаинамид.
При тяжелых, рефрактерных к медикаментозной и электроимпульсной терапии, угрожающих жизни желудочковых тахиаритмиях применяют прием больших доз амиодарона: внутрь до 4 — 6 г в сутки перорально в течение 3 дней (то есть по 20 — 30 табл.), далее по 2,4 г в сутки в течение 2 дней (по 12 табл.) с последующим снижением дозы [6, 10, 15, 16].
Предупреждение рецидивирования тахиаритмий
При частых приступах тахиаритмий (например, 1 — 2 раза в неделю) последовательно назначают антиаритмические препараты и их комбинации до прекращения приступов. Наиболее эффективным является назначение амиодарона в качестве монотерапии или в комбинации с другими антиаритмическими препаратами, прежде всего с β-блокаторами.
При редко возникающих, но тяжелых приступах тахиаритмий подбор эффективной антиаритмической терапии удобно проводить с помощью чреспищеводной электростимуляции сердца — при наджелудочковых тахиаритмиях — и программированной эндокардиальной стимуляции желудочков (внутрисердечное электрофизиологическое исследование) — при желудочковых тахиаритмиях. С помощью электростимуляции в большинстве случаев удается индуцировать приступ тахикардии, идентичный тем, которые спонтанно возникают у данного больного. Невозможность индукции приступа при повторной электрокардиостимуляции на фоне приема препаратов обычно совпадает с их эффективностью при длительном приеме [17, 18]. Следует отметить, что некоторые проспективные исследования продемонстрировали преимущество «слепого» назначения амиодарона и соталола при желудочковых тахиаритмиях перед тестированием антиаритмических препаратов класса I с помощью программированной электростимуляции желудочков или мониторирования ЭКГ.
При тяжелом течении пароксизмальных тахиаритмий и рефрактерности к медикаментозной терапии применяют хирургические способы лечения аритмий, имплантацию кардиостимулятора и кардиовертера-дефибриллятора.
Подбор антиаритмической терапии у больных с рецидивирующимим аритмиями
С учетом безопасности антиаритмических препаратов оценку эффективности целесообразно начинать с β-блокаторов или амиодарона. При неэффективности монотерапии оценивают действенность назначения амиодарона в комбинации с β-блокаторами [17]. Если нет брадикардии или удлинения интервала РR, с амиодароном можно сочетать любой β-блокатор. У больных с брадикардией к амиодарону добавляют пиндолол (вискен). Показано, что совместный прием амиодарона и β-блокаторов способствует значительно большему снижению смертности пациентов с сердечно-сосудистыми заболеваниями, чем прием каждого из препаратов в отдельности. Некоторые специалисты даже рекомендуют имплантацию двухкамерного стимулятора (в режиме DDDR) для безопасной терапии амиодароном в сочетании с β-блокаторами. Антиаритмические препараты класса I применяют только при отсутствии эффекта от β-блокаторов и/или амиодарона. Препараты класса I C, как правило, назначают на фоне приема бета-блокатора или амиодарона. В настоящее время изучается эффективность и безопасность применения соталола (β-блокатора, обладающего свойствами препаратов класса III).
П. Х. Джанашия, доктор медицинских наук, профессор
Н. М. Шевченко, доктор медицинских наук, профессор
С. М. Сорокoлетов, доктор медицинских наук, профессор
РГМУ, Медицинский центр Банка России, Москва
О чем вам расскажет вариабельность сердечного ритма: гид
Как один параметр, измеренный с помощью смартфона, определяет состояние вашего организма
Многие ученые считают, что будущее за превентивной медициной: наши гаджеты будут собирать достаточное количество информации о показателях здоровья, чтобы можно было начать принимать меры еще до того, как появится реальная проблема. Пока это во многом мечты: точные замеры по-прежнему делаются в лабораториях и клиниках на дорогом и мощном оборудовании.
Тем не менее кое-что уже можно измерять и с помощью смартфона. Например — вариабельность сердечного ритма (heart rate variability, HRV). Мобильные приложения научились «распаковывать» простую метрику в десятки полезных данных об организме, по которой делаются выводы об уровне стресса, работе центральной нервной системы и многом другом.
Как это возможно? Расскажем в нашем гиде.
Космическая технология
Использовать HRV начали еще в 1960-х. Его придумали как неинвазивный способ измерять уровень стресса в организме, оценивать функциональное состояние, риск заболеть и другие параметры. Изначально HRV применяли, чтобы следить за самочувствием астронавтов. Но вариабельность оказалась таким всеобъемлющим показателем, что вскоре изучать ее стали и за пределами NASA.
Что такое вариабельность сердечного ритма
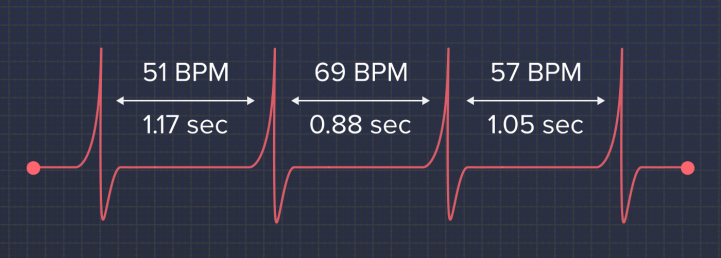
Если очень упрощать — это показатель, отражающий неравномерность вашего сердцебиения.
Сердце бьется с неравными интервалами. Если ваш пульс — 60 ударов в минуту, это не значит, что ваше сердце сокращается ровно раз в секунду. На самом деле, ваше сердцебиение выглядит примерно так:
И это совершенно нормально. Сердце и не должно биться равномерно, оно даже не должно к этому «стремиться». Напротив — чем больше неравномерность, она же вариабельность сердечного ритма, тем лучше ваше функциональное состояние.
Как измерить HRV?
Показатели вариабельности рассчитывают различные приложения. Среди них, к примеру, Welltory — один из топовых сервисов в этой сфере с российскими корнями. Есть еще HRV4Training — это приложение заточено под спортсменов и помогает понять, как тренировки влияют на вариабельность (и наоборот). Приложение платное, им пользуются профессиональные спортсмены вроде членов NBA, NHL и участников Олимпийских игр.
Если вы хотите повысить точность измерений, можно подключать к приложениям гаджеты, которые считывают показатель вариабельности сердечного ритма — например, нагрудный датчик, специальный фитнес-браслет или клипсу. Есть и такие приложения — в частности, CardioMood и Elite HRV, — где вариабельность измеряется не с помощью камеры, а исключительно с помощью кардиомониторов.
Также показатель вариабельности самостоятельно измеряют некоторые гаджеты: например, Apple Watch и Oura Ring (кольцо, чья основная цель — мониторинг сна). Результаты можно увидеть в приложениях Apple Health и Oura соответственно. Но тут есть нюанс: эти гаджеты измеряют всего один показатель вариабельности — и поэтому их нельзя использовать для расширенной аналитики, в том числе подключать к приложениям, разработанным именно для анализа вариабельности.
Обратите внимание, что не каждый гаджет подойдет для измерения вариабельности — например, популярные Fitbit и Mi Band не «отдают» значения интервалов между ударами сердца, поэтому на базе их данных нельзя вычислить параметры, связанные с HRV. Список подходящих устройств можно посмотреть, например, тут.
Какие показатели рассчитываются на базе HRV
Один из главных параметров вариабельности сердечного ритма — это SDNN (Standard Deviation of the Normal-to-Normal). Как можно догадаться из названия, он помогает узнать стандартное (среднеквадратичное) отклонение интервалов между ударами сердца — их еще называют RR-интервалами — от среднего значения. Именно этот параметр отслеживают Apple Watch, и его можно увидеть в приложении Apple Health.
Есть еще один важный параметр вариабельности, сходный с SDNN — RMSSD (Root Mean Square of Successive Differences). Для его расчета используется разница между каждым RR-интервалом и предыдущим интервалом — то есть этот показатель дает представление о динамике. Параметр RMSSD использует в измерении вариабельности кольцо Oura Ring — его вы увидите на графике HRV в приложении Oura.
И SDNN, и RMSSD, и RR-интервалы измеряются в миллисекундах (мс).
На базе полученных параметров — SDNN, RMSSD и RR-интервалов — высчитывают и другие показатели. Один из важнейших — это pNN50: он показывает вероятность того, что каждый случайно выбранный интервал будет отличаться от среднего более чем на 50 мс. Сравнивая здоровых людей с теми, у кого, например, есть проблемы с сердцем, можно увидеть, что у здоровых показатель pNN50 оказывается выше.
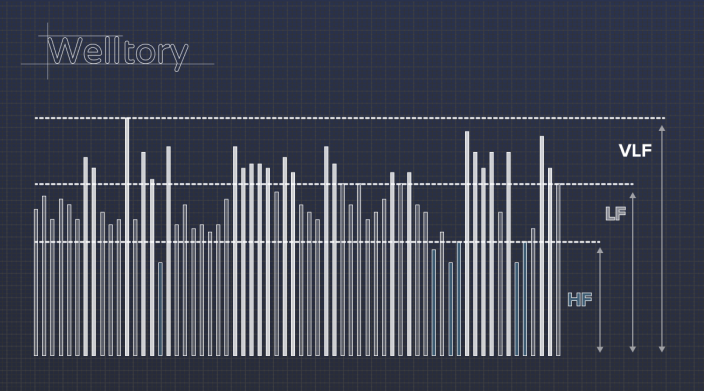
Еще на базе HRV рассчитываются «волны». Не будем углубляться в детали — просто представьте, что все RR-интервалы выстроили в столбики, и стали считать маленькие колебания волнами с высокой частотой (high frequency, HF), а большие — с низкой (low frequency, LF и very low frequency, VLF).
Какое отношение к здоровью имеют эти цифры?
Это главный вопрос. Речь здесь идет не прямом соответствии показателя состоянию организма (сдаешь анализ на кортизол –> понимаешь, какой у тебя уровень стресса), а о корреляции. Но — корреляции, подкрепленной большой статистикой.
Наблюдая, например, за показателем SDNN в течение длительных — суточных — измерений, ученые выяснили, что вариация этого показателя отражает, насколько хорошо в целом организм контролирует работу сердца. Это косвенно говорит о том, эффективна ли вегетативная (автономная) нервная регуляция организма. Обнаружили они это математически — проследив за корреляциями показателя SDNN и параметров, отражающих работу вегетатики.
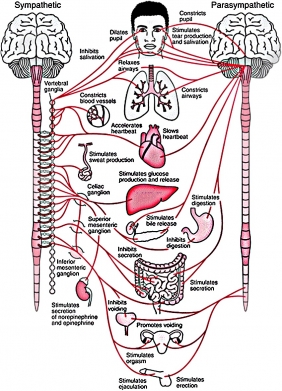
Вегетативная система регулирует работу желез и внутренних органов в автономном режиме — в том смысле, что не зависит от воли человека: мы не можем усилием мысли заставить сердце биться быстрее или сузить зрачки. Состоит из двух дополняющих друг друга частей — симпатической и парасимпатической. Первая, вопреки названию, обычно не сулит ничего хорошего — это система, реагирующая на стресс. Вторая — регулирует работу организма в расслабленном, спокойном состоянии. Проще всего представить работу двух систем на примере травоядного животного — скажем, зебры: пока она мирно пасется, работает парасимпатическая система, при виде хищника включается система симпатическая. Чрезмерная, незатихающая активность симпатической системы у человека — признак хронического стресса.
Что делает с нами симпатическая и парасимпатическая нервная система. Источник: Silvia Bunge, ResearchGate
С RMSSD, который достаточно точен даже при краткосрочных замерах — около 5 минут, другая история. Ученые во время своих экспериментов, тоже математически, выяснили, что в коротких промежутках на разнице между соседними ударами сердца и вариабельности сердечного ритма больше сказывается парасимпатика — та часть автономной нервной системы, что отвечает за расслабление. Именно поэтому параметр RMSSD можно использовать для того, чтобы оценить, насколько хорошо организм сейчас восстанавливается.
В итоге: RMSSD — более точный параметр для краткосрочных замеров, больше реагирует на парасимпатику, позволяет прямо сейчас оценить восстановление; SDNN — менее точный в быстрых замерах, имеет смысл наблюдать за ним в динамике, чтобы оценить, насколько вы в стрессе, сбалансирована ли автономная нервная система и не является ли ваша симпатика чересчур активированной.
Про упомянутые выше «волны» установили такие соответствия: HF—волны отвечают в большей степени за работу парасимпатической системы и за дыхание. Если они в данный момент сильны, значит, вы активно восстанавливаетесь. Мощность HF-волн недостаточна? Возможно, организм работает из последних сил, и нужно сесть и расслабиться, помедитировать и подышать.
А вот LF-волны, напротив, отражают активность симпатической нервной системы — той самой, что отвечает мобилизацией на стресс. Если их мощность достаточна, значит, вы в тонусе. Слишком высокий показатель может говорить о том, что вы перенапряглись, и нужно сбавить обороты. Низкая активность LF волн — показатель того, что вы чересчур расслаблены, и надо собраться и добавить здорового стресса в жизнь.
Еще один важный показатель — это соотношение LF/HF. Оно отражает то, насколько сбалансирована работа вегетативной нервной системы между двумя ее отделами — симпатическим и парасимпатическим. В норме это соотношение должно быть не ниже единицы.
Показатель VLF тоже говорит скорее о состоянии организма в целом. Он помогает определить, справляется ли автономная нервная система с регуляцией вашего состояния — или для борьбы со стрессом уже приходится подключать центральную нервную систему.
Как это работает: пример
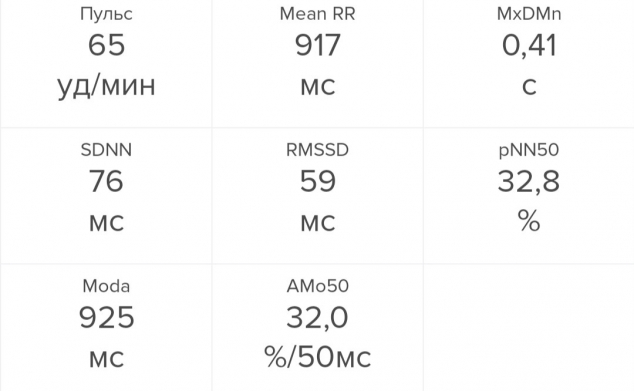
Я измерила вариабельность сердечного ритма во время написания этого текста. Все показатели оказались в порядке: SDNN равен 76 мс (это даже лучше, чем в среднем у женщин моего возраста — 25–35 лет), RMSSD — 59 мс, тоже чуть лучше, чем в среднем. Если же брать нормативные диапазоны, то я буду на верхней границе нормы — отличный результат. И pNN50, который у меня равен 32,8%, находится ровно на уровне среднего здорового молодого человека.
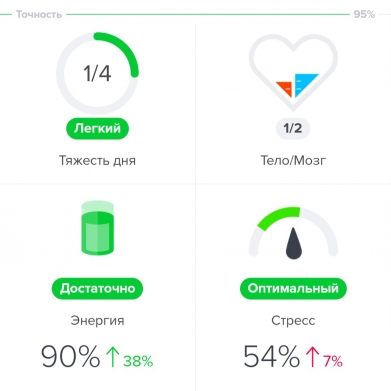
Приложение, которое я использовала — Welltory — выдало мне вердикт: сейчас вы в хорошем состоянии, у вас много энергии, а стресс оптимален. Поэтому, например, я могу сегодня пойти на силовую тренировку или взяться за сложную задачу по работе (чем я, собственно, и занимаюсь).
Но завтра мои параметры могут быть совсем иными — а значит, я получу другие советы и буду корректировать нагрузку в соответствии со своим состоянием.
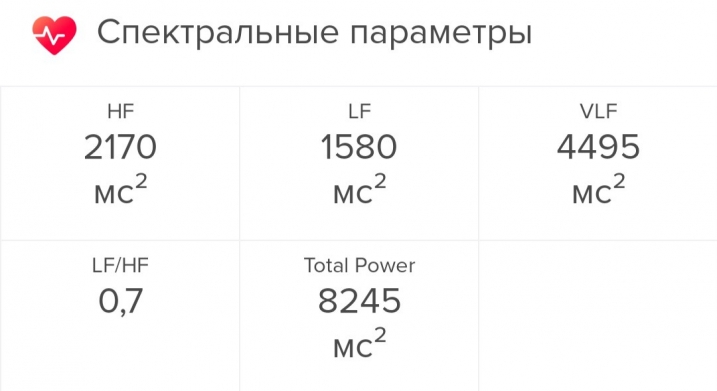
Другой пример. Вчера я сделала измерение HRV перед сном.
Показатель HF-волн был на уровне 2170 мc2, LF — 1580 мc2. Соответственно, соотношение LF/HF было равно 0,7 — вроде бы ниже нормы. Но, как выяснилось, для позднего вечера это в самый раз: это значило лишь, что я хорошо восстанавливаюсь, и организм вошел в режим расслабления перед сном.
Показатель VLF оказался равен 4495 мc2. Приложение сказало мне, что это очень много — я, видимо, слишком вымоталась, и «из-за повышенного физического или эмоционального возбуждения автономная нервная система уже не справляется с управлением ритмом вашего сердца». В этот день я прошла около 12 тысяч шагов — это почти в два раза больше, чем я хожу обычно. Наверно, проблема была в этом.
Можно проще?
Для тех, кому лень разбираться во всем многообразии сложных параметров вариабельности, приложения предлагают простой «вердикт» — для этого показатели HRV переводятся в интуитивно понятные всем факторы. В случае с Welltory, которым пользуюсь я, это стресс, энергия и продуктивность (в вечернее время параметр «продуктивность» меняется на «тяжесть дня»).
Как рассчитываются эти факторы? Все довольно просто.
Есть готовые формулы, которые исследователи вывели математически, изучая разные параметры HRV, объективные и субъективные факторы самочувствия человека. Оказалось, что уровень стресса коррелирует с SDNN и LF — показателями, связанными с симпатикой. Энергия рассчитывается на базе работы парасимпатики, то есть параметров RMSSD и HF: чем хуже работает парасимпатическая нервная система, тем больше усталости копится — и энергии становится меньше. Наконец, показатель продуктивности/тяжести дня скоррелирован с работой префронтальной коры: чем больше она вынуждена вмешиваться в контроль за работой сердца, тем меньше ресурса остается для продуктивной работы. И определить это можно с помощью параметра VLF.
А как все эти готовые формулы применимы к жизни конкретного человека? Вот как: эти формулы «калибруются» под каждого пользователя приложения. Понятно, что мы все разные — и предсказать самочувствие любого случайного человека по одной и той же формуле было бы нереально. Поэтому приложение использует самообучающийся алгоритм — и в качестве исходных данных берет ваши замеры и обратную связь о самочувствии (картинка в правом верхнем углу).
Как применять это на практике?
Вариабельность сердечного ритма — хороший способ быстро и достаточно точно оценить функциональное состояние организма. В отличие от пульса, который в большей степени отражает реакцию организма на физическую активность, HRV учитывает также ментальную и эмоциональную нагрузку. Поэтому, измерив вариабельность сердечного ритма, вы можете в целом оценить, как ваше тело переносит все происходящее в вашей жизни.
Показатели, связанные с HRV, нестабильны. Поэтому интереснее всего наблюдать за ними в динамике. Если уж решите измерять вариабельность сердечного ритма, делайте это регулярно, желательно — в одно и то же время. Хотя бы 4–5 замеров в неделю — и со временем вы сможете увидеть какие-то тренды, заметить корреляцию параметров с образом жизни и, возможно, внести в него какие-то изменения.
Наверное, не стоит относиться к показателям вариабельности слишком серьезно. Замеры не должны заменять здравый смысл и ощущения, но они могут помочь в некоторых ситуациях. Например, так.