валентные электроны как на s так и на d подуровне
Атомы и электроны
Атомно-молекулярное учение
Описываемая модель атома называется «планетарной» и была предложена в 1913 году великими физиками: Нильсом Бором и Эрнестом Резерфордом
Запомните, что в невозбужденном состоянии атом содержит одинаковое число электронов и протонов. Так у кальция (порядковый номер 20) в ядре находится 20 протонов, а вокруг ядра на электронных орбиталях 20 электронов.
Я еще раз подчеркну эту важную деталь. На данном этапе будет отлично, если вы запомните простое правило: порядковый номер элемента = числу электронов. Это наиболее важно для практического применения и изучения следующей темы.
Электронная конфигурация атома
Электроны атома находятся в непрерывном движении вокруг ядра. Энергия электронов отличается друг от друга, в соответствии с этим электроны занимают различные энергетические уровни.
Состоит из s-подуровня: одной «s» ячейки (2s 2 ) и p-подуровня: трех «p» ячеек (2p 6 ), на которых помещается 6 электронов
Состоит из s-подуровня: одной «s» ячейки (3s 2 ), p-подуровня: трех «p» ячеек (3p 6 ) и d-подуровня: пяти «d» ячеек (3d 10 ), в которых помещается 10 электронов
Состоит из s-подуровня: одной «s» ячейки (4s 2 ), p-подуровня: трех «p» ячеек (4p 6 ), d-подуровня: пяти «d» ячеек (4d 10 ) и f-подуровня: семи «f» ячеек (4f 14 ), на которых помещается 14 электронов
Зная теорию об энергетических уровнях и порядковый номер элемента из таблицы Менделеева, вы должны расположить определенное число электронов, начиная от уровня с наименьшей энергией и заканчивая к уровнем с наибольшей. Чуть ниже вы увидите несколько примеров, а также узнаете об исключении, которое только подтверждает данные правила.
Подуровни: «s», «p» и «d», которые мы только что обсудили, имеют в определенную конфигурацию в пространстве. По этим подуровням, или атомным орбиталям, движутся электроны, создавая определенный «рисунок».
Правила заполнения электронных орбиталей и примеры
Должно быть, вы обратили внимание на некоторое несоответствие: после 3p подуровня следует переход к 4s, хотя логично было бы заполнить до конца 4s подуровень. Однако природа распорядилась иначе.
Запомните, что, только заполнив 4s подуровень двумя электронами, можно переходить к 3d подуровню.
Теперь мы располагаем указанное количество электронов на энергетических уровнях, руководствуясь правилами заполнения.
Обращаю ваше особе внимание: на 2p-подуровне углерода мы расположили 2 электрона в разные ячейки, следуя одному из правил. А на 3p-подуровне у серы электронов оказалось много, поэтому сначала мы расположили 3 электрона по отдельным ячейкам, а оставшимся одним электроном дополнили первую ячейку.
Внешний уровень и валентные электроны
Тренировка
Потренируйтесь и сами составьте электронную конфигурацию для магния и скандия. Определите число электронов на внешнем (валентном) уровне и число неспаренных электронов. Ниже будет дано наглядное объяснение этой задаче.
Тест на строение атома и электронные конфигурации.
Четыре электрона на внешнем энергетическом уровне имеют атомы химических элементов:
Ответ: 35
Одинаковое число валентных электронов имеют атомы:
Ответ: 23
Одинаковое число валентных электронов имеют атомы:
Ответ: 24
Одинаковое число валентных электронов имеют атомы:
Ответ: 35
Одинаковую электронную конфигурацию внешнего энергетического уровня имеют атомы:
Ответ: 13
Одинаковое число неспаренных электронов в основном состоянии имеют атомы:
Ответ: 24
Одинаковое число неспаренных электронов в основном состоянии имеют атомы:
Ответ: 15
Три неспаренных электрона в основном состоянии имеют атомы:
Ответ: 24
Одинаковое число неспаренных электронов в основном состоянии содержат атомы:
Ответ: 13
Один неспаренный электрон в основном состоянии имеют атомы:
Ответ: 24
В основном состоянии все валентные электроны расположены только на s-подуровне у атомов:
Ответ: 25
Валентные электроны, расположенные на s- и d-подуровнях, содержат атомы:
Ответ: 24
Все валентные электроны расположены на третьем энергетическом уровне у атомов:
Ответ: 15
К s-элементам относятся:
Ответ: 25
К s-элементам относятся:
Ответ: 15
К p-элементам относятся:
Ответ: 25
К d-элементам относятся:
Ответ: 25
Химические элементы, атомы которых не содержат электронов на d-подуровне:
Ответ: 14
Химические элементы, атомы которых не содержат электронов на d-подуровне:
Ответ: 12
Валентных электронов на d-подуровне не содержат атомы химических элементов:
Ответ: 23
Одинаковое число нейтронов и протонов содержат атомы наиболее распространенных изотопов:
Ответ: 14
Число нейтронов большее, чем число протонов содержат ядра наиболее распространенных изотопов:
Ответ: 13
Не могут переходить в возбужденное состояние атомы:
Ответ: 13
Не могут переходить в возбужденное состояние атомы:
Ответ: 13
Не могут переходить в возбужденное состояние атомы:
Ответ: 24
Не могут переходить в возбужденное состояние атомы:
Ответ: 45
Не могут переходить в возбужденное состояние атомы:
Ответ: 34
Возможен переход в возбужденное состояние для атомов:
Ответ: 23
Один неспаренный электрон в основном состоянии содержат атомы:
Ответ: 24
Из предложенного перечня химических элементов выберите два таких, наиболее устойчивые катионы которых имеют одинаковые электронные конфигурации:
Ответ: 14
Три неспаренных электрона в основном состоянии содержат атомы:
Ответ: 25
В возбужденном состоянии электронную форму внешнего электронного уровня ns 1 np 2 имеют атомы:
Ответ: 12
Электронную формулу внешнего энергетического уровня ns 1 в основном состоянии имеют атомы:
Ответ: 13
Три неспаренных электрона в возбужденном состоянии содержат атомы:
Ответ: 25
Определите элементы, катионы которых имеют электронную формулу внешнего энергетического уровня 4s 2 4p 6
Ответ: 13
Определите элементы, катионы которых имеют электронную формулу внешнего энергетического уровня 2s 2 2p 6
Ответ: 12
Электронную конфигурацию внешнего энергетического уровня в основном состоянии ns 2 np 3 имеют атомы:
Ответ: 23
Схожую электронную конфигурацию внешнего энергетического уровня имеют атомы:
Ответ: 34
Полностью завершенный второй энергетический уровень имеют атомы:
Ответ: 13
Двух электронов до завершения внешнего энергетического уровня не хватает атомам:
Ответ: 34
Одного электрона до завершения внешнего энергетического уровня не хватает атому:
Ответ: 25
В основном состоянии электронную формулу внешнего энергетического уровня ns 2 np 4 имеют атомы:
Ответ: 25
Атомы каких из указанных в ряду элементов в основном состоянии имеют только один неспаренный электрон:
Ответ: 25
Не содержат неспаренных электронов в основном состоянии атомы:
Ответ: 45
Электронную конфигурацию ns 1 имеют атомы:
Ответ: 14
Валентные электроны и на s- и на d-подуровнях содержат атомы:
Ответ: 14
До полного заполнения внешнего энергетического уровня не хватает одного электрона атомам:
Ответ: 34
В основном состоянии во внешнем слое содержат один неспаренный электрон атомы:
Ответ: 13
Одинаковое число валентных электронов содержат атомы:
Ответ: 24
Электронную конфигурацию ns 1 np 3 в возбужденном состоянии имеют атомы:
Ответ: 24
Электронную конфигурацию ns 1 np 2 в возбужденном состоянии имеют атомы:
Ответ: 12
Электронную конфигурацию внешнего энергетического уровня ns 2 в основном состоянии имеют атомы:
Ответ: 34
Из предложенного перечня химических элементов, выберите такие, устойчивые катионы которых имеют электронную конфигурацию, как у атома неона:
Ответ: 13
Из предложенного перечня химических элементов, выберите такие, устойчивые анионы которых имеют электронную конфигурацию, как у атома неона:
Ответ: 24
Из предложенного перечня химических элементов, выберите такие, устойчивые анионы которых имеют электронную конфигурацию, как у атома аргона:
Ответ: 12
Из предложенного перечня химических элементов, выберите такие, устойчивые катионы которых имеют электронную конфигурацию, как у атома аргона:
Ответ: 24
Содержат один неспаренный электрон в основном состоянии атомы:
Ответ: 23
Шесть валентных электронов имеют атомы:
Ответ: 45
Неспаренных электронов не содержат атомы:
Ответ: 45
Как на s-, так и на d-подуровне расположены валентные электроны атомов:
Ответ: 23
Одинаковое число неспаренных электронов на внешнем энергетическом уровне в основном состоянии содержат атомы:
Ответ: 15
До завершения внешнего электронного слоя одного электрона не хватает атомам:
Ответ: 45
В основном состоянии один неспаренный электрон имеют атомы:
Ответ: 15
Электронную формулу внешнего энергетического уровня ns 1 np 2 в возбужденном состоянии имеют атомы:
Ответ: 15
Одинаковое число неспаренных электронов на внешнем энергетическом уровне в основном состоянии содержат атомы:
Ответ: 34
Одинаковое число d-электронов в основном состоянии содержат атомы:
Ответ: 14
Одинаковое число валентных электронов имеют атомы:
Ответ: 24
Одинаковое число энергетических уровней, содержащих электроны, имеют атомы:
Ответ: 12
Определите химические элементы, анионы которых имеют конфигурацию внешнего электронного слоя 2s 2 2p 6 :
Ответ: 45
Одинаковую электронную конфигурацию внешнего энергетического уровня имеют атомы:
Ответ: 14
Из предложенного перечня выберите p-элементы:
Ответ: 45
Одинаковое число неспаренных электронов на внешнем энергетическом уровне в основном состоянии содержат атомы:
Ответ: 45
Из предложенного перечня выберите d-элементы:
Ответ: 35
Одинаковое количество неспаренных электронов в основном состоянии содержат атомы:
Ответ: 24
В наиболее распространенных изотопах атомов каких элементов число нейтронов больше, чем число электронов:
Ответ: 24
На внешнем энергетическом уровне только два электрона содержат атомы:
Ответ: 15
Атомам каких элементов для приобретения электронной конфигурации как у благородного газа не хватает двух электронов:
Ответ: 45
Одного электрона до завершения внешнего электронного слоя не хватает атомам:
Ответ: 34
В возбужденном состоянии электронную конфигурацию внешнего энергетического уровня ns 1 np 3 имеют атомы:
Ответ: 24
Одинаковое число валентных электронов имеют атомы:
Ответ: 24
Одинаковое число спаренных электронов на внешнем энергетическом уровне в основном состоянии содержат атомы:
Ответ: 13
К d-элементам относятся:
Ответ: 45
К p-элементам относятся:
Ответ: 13
d-Электроны содержат атомы:
Ответ: 35
Аналогичную электронную конфигурацию внешнего энергетического уровня в основном состоянии имеют наиболее распространенные изотопы элементов:
Ответ: 12
Один электрон на s-подуровне внешнего энергетического уровня имеют в основном состоянии атомы:
Ответ: 25
Одинаковое число нейтронов содержат наиболее распространенные изотопы элементов:
Ответ: 34
Одинаковое число нейтронов содержат наиболее распространенные изотопы элементов:
Ответ: 34
Одинаковое число нейтронов содержат наиболее распространенные изотопы элементов:
Ответ: 34
Одинаковое число нейтронов содержат наиболее распространенные изотопы элементов:
Ответ: 25
Электронную конфигурацию внешнего энергетического уровня в основном состоянии ns 2 np 2 имеют атомы:
Ответ: 25
Не содержат неспаренных электронов в основном состоянии атомы:
Ответ: 13
Три неспаренных электрона в возбужденном состоянии содержат атомы:
Ответ: 45
Четыре неспаренных электрона в возбужденном состоянии содержат атомы:
Ответ: 15
Одинаковое число валентных электронов содержат атомы:
Ответ: 12
Десять электронов на 3d-подуровне содержат атомы:
Ответ: 15
Пять электронов на 3d-подуровне содержат атомы:
Ответ: 24
Атомы каких химических элементов при потере двух электронов приобретают электронную конфигурацию как у благородного газа:
Ответ: 15
Атомы каких химических элементов при потере одного электрона приобретают электронную конфигурацию как у благородного газа:
Ответ: 25
Наиболее стабильные анионы вида Э 2- образуют химические элементы:
Ответ: 35
Наиболее стабильные катионы вида Э 2+ образуют химические элементы:
Ответ: 35
Почему в 7 задании такой ответ? Объясните, пожалуйста)
Потому что у Na на последнем энергетическом уровне 1s электрон (в норме должно быть 2), соответственно он неспаренный, а у Al на внешнем энергетическом уровне 3 электрона (2s и 1p) соответственно Al тоже содержит один неспаренный электрон
Как можно объяснить 22 и 21 задания с изотопами? Невозможно знать все изотопы у каждого элемента!
Добрый день! Принимаем, что округленная атомная масса для элемента из таблицы Менделеева соответствует атомной массе его наиболее распространенного изотопа. Это справедливо для большинства элементов начала Периодической системы.
На связи с вами! Обращайтесь
Объясните, пожалуйста. почему во 2 и в 4 вопросе такие ответы?
Видеоурок по химии «Валентные возможности атомов. Степень окисления»
Цель урока: повторить и углубить знания учащихся о валентности и степени окисления атомов, познакомить с понятием валентные возможности атомов.
Задачи урока:
Данный материал будет полезен учащимся 11 классов при подготовке к ЕГЭ, при закреплении и повторении изученного материала в предыдущих классах.
Как вы знаете, атомы большинства химических элементов взаимодействуют с другими атомами и образуют множество соединений. Но почему так происходит? Ответ на этот вопрос долгое время оставался неизвестен.
Первой попыткой объяснить химическое взаимодействие была теория Бертолле. Атомы должны притягиваться друг к другу тем сильнее, чем больше их массы. А по электрохимической теории Берцелиуса, каждый атом имеет два противоположно заряженных полюса. Теория делила все элементы на два класса — металлы с преобладанием положительного заряженного полюса и металлоиды с отрицательным заряженным полюсом. Причём считалось, что соединяться друг с другом могли лишь атомы противоположной электрической природы.
Эта теория была отвергнута, когда выяснилось, что элементы одного и того же класса также могут соединяться друг с другом. И только лишь в 20 столетии возникли два направления теории химического взаимодействия на основе электронных представлений, основные положения которых были сформулированы Косселем и Льюисом. С точки зрения Косселя, движущей причиной химического взаимодействия является «стремление» атомов к достижению наиболее устойчивых электронных конфигураций. Основной недостаток теории Косселя в том, что не все соединения могут рассматриваться с ионной точки зрения. Между тем идея Льюиса об образовании электронной пары позволяет охватить самые разнообразные случаи валентной связи и сохраняет свое значение до сих пор.
Впервые понятие «валентности» как соединительной силы ввел Э. Франкланд. Он считал, что взаимодействие разнообразных атомов происходит благодаря валентным силам.
Из всего вышесказанного приходим к выводу, валентность — это мера способности атомов притягиваться друг к другу посредством общих электронных пар. Валентность, как правило, обозначается римской цифрой. Рассмотрим электронные конфигурации атомов, чтобы разобраться, как возникают валентные взаимодействия между атомами.
В основном состоянии на внешних энергетических уровнях, а иногда и на предвнешних уровнях атомов, могут находиться спаренные и неспаренные электроны. Валентность атома определяется числом неспаренных электронов, принимающих участие в образовании химической связи.
У s- и p-элементов валентные электроны расположены на s- и p-подуровнях внешнего энергетического уровня.
Например, литий, у которого заряд ядра +3, 3 электрона, это s-элемент, атом имеет один неспаренный s-электрон, значит валентность лития I.
Рассмотрим другой пример, азот. Заряд его атома +7, у него 7 электронов. Это p-элемент. Соответственно, азот имеет 5 валентных электронов — два спаренных s- электрона и 3 неспаренных p-электрона.
У d-элементов валентные электроны находятся на s-подуровне последнего энергетического уровня и d-подуровне предвнешнего энергического уровня.
Например, у атома титана заряд ядра +22, соответственно столько же электронов — 22. Титан имеет 4 валентных электрона, 2 спаренных s-электронов и два неспаренных d-электронов.
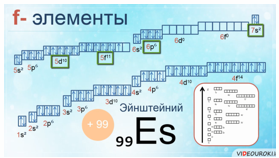
У f-элементов валентные электроны располагаются на s-подуровне последнего энергетического уровня и d-подуровне предпоследнего энергетического уровня и f- подуровня, третьего с края энергетического уровня.
Например, у атома эйнштейния заряд ядра +99, столько же у него и электронов. Эйнштейний имеет 13 валентных электронов, 12 спаренных и 1 неспаренный на 5f-подуровне. Этому элементу было присвоено название эйнштейний в честь выдающегося ученого двадцатого столетия Альберта Эйнштейна, внесшего большой вклад в науку об атоме и атомном ядре.
Следует усвоить, что основные свойства элементов определяются валентными электронами, а уровни, подуровни, на которых располагаются валентные электроны, называются валентными. Самыми первыми вступают в реакцию неспаренные электроны, расположенные на внешнем энергетическом уровне. Количеством этих неспаренных электронов и определяет валентность. Если на спаренные электроны, при имеющейся свободной орбитали в атоме, подействует энергия извне, эти электроны распариваются и атом переходит из основного состояния в возбужденное. Энергия, затраченная на переход электронов, компенсируется при образовании новых связей.
Валентные возможности атомов также определяются числом пустых орбиталей и числом неподеленных электронных пар. Атом-донор предоставляет неподеленную электронную пару атому-акцептору, который имеет свободные орбитали.
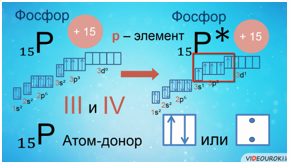
Например, заряд ядра атома фосфора +15, число электронов 15. В основном состоянии атом фосфора, который относится к p-элементам, на внешнем уровне содержит 1 пару спаренных электронов и 3 неспаренных электрона. Поэтому, он проявляет валентность III, так как у него 3 неспаренных p-электрона. Валентность азота IV, так как атом фосфора это атом-донор, который может предоставить пару электронов для образования химической связи.
При имеющихся вакантных орбиталях на 3d-подуровне и паре спаренных электронов на 3s-подуровне атом фосфора может переходить в возбужденное состояние. Это происходит за счёт распаривания и перехода электрона на свободную орбиталь другого подуровня. В атоме появляется 5 неспаренных электронов, что и обеспечивает возможность существования валентности атома фосфора — V.
Поэтому, если у элементов на внешнем энергетическом уровне есть неспаренные электроны, то они являются активными элементами или реакционноспособными. А если на внешнем уровне электроны находятся только в спаренном состоянии, тогда эти элементы относят к малоактивным.
Например, к малоактивным химическим элементам относят VIIIA группу химических элементов Периодической системы. Их так и называют — благородные или инертные (малоактивные) химические элементы — так как на внешнем слое этих элементов все электроны находятся в спаренном состоянии. Нет свободных или неспаренных электронов, которые образовывали связи с электронами других химических элементов.
Следует запомнить, что s-, d-, f-элементы — это металлические элементы, кроме некоторых исключений. Так как на последнем уровне у них электронов меньше, чем 3; у неметаллических элементов, наоборот, на последнем уровне электронов больше, чем 4.
P-элементы могут быть металлические и неметаллические. Рассмотрим Периодическую систему химических элементов. По диагонали от бора к астату все p-элементы выше диагонали — неметаллические, ниже — металлические. По строению элементы, у которых на внешнем энергетическом уровне 3 или 4 электрона, считаются переходными элементами; многие d-элементы — металлические с переходными свойствами.
У элементов в соединении можно определить не только валентность, но и степень окисления. Степень окисления — это условный заряд атома — положительный или отрицательный, в зависимости от смещения электронов от атома или к нему, если считать все связи в веществе ионными. Степень окисления и валентность это не одно и тоже понятие. Например, атом углерода в органических соединениях четырёхвалентен, однако степени окисления имеет различные.
Степень окисления может быть минимальной, промежуточной и максимальной.
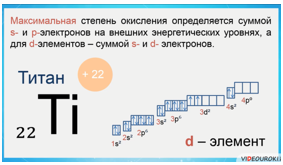
Максимальная степень окисления определяется суммой s- и p-электронов на внешних энергетических уровнях, а для d-элементов — суммой s- и d-электронов.
Например, атом титана — это d-элемент, металлический. На внешнем электронном слое у него находится 4 электрона. Значит, максимальная степень окисления титана +4.
Промежуточными степенями окисления считаются значения между минимальной и максимальной степенями окисления в атомах химических элементов.
В соединениях более сложного состава необходимо расставить известные степени окисления химических элементов, а неизвестную степень окисления обозначить, например, за «x». Далее так же, как и в бинарных соединениях решаем уравнение с одной неизвестной и получаем ответ по абсолютной величине.
В простых веществах с неполярной ковалентной связью степень окисления равна 0. Степень окисления углерода в органических соединениях определяется у каждого в отдельности, учитывая степень окисления элементов, связанных с ним.