валентность вакцины что это значит
Прививки от гриппа: какие делать, можно ли детям, успеваем ли?
Только вакцинация защищает от гриппа?
Отвечает Антон Родионов, кардиолог, кандидат медицинских наук, доцент:
Да. Единственная доказанно работающая специфическая профилактика — это ежегодная вакцинация. Человечество ничего другого работающего пока не придумало. Во всем мире вакцинацию рассматривают как способ, позволяющий, конечно, не на 100% предотвратить, но существенно снизить вероятность заболеваний.
Тут можно возразить, что грипп каждый год мутирует. Это действительно так — раз в год или в два года он меняется. Но вместе с ним меняются и вакцины, а также проводятся исследования, прогнозирующие, какой штамм вируса будет в этом году.
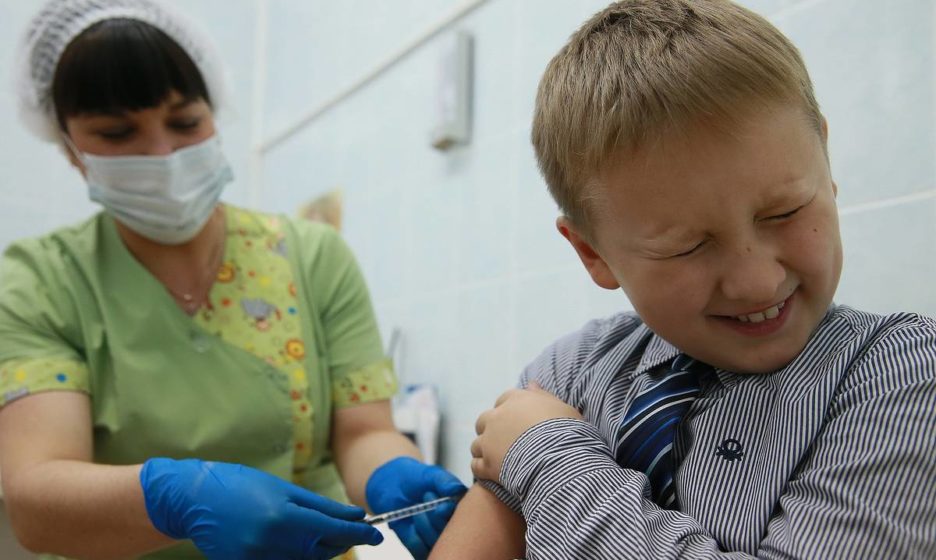
Когда нужно сделать прививку? Сейчас уже поздно?
Отвечает биолог и автор блога «Антонина О. Вакцинах» Антонина Обласова:
Самое время. Оптимальный вариант — завершить вакцинацию до конца сентября-октября, чтобы к началу сезона быть уже защищенным от гриппа.
Если в этот период вакцинацию завершить не удалось, это не значит, что позже ее проводить не нужно. Например, детям делают прививку от гриппа с 6 месяцев. Если ребенок достигнет этого возраста в декабре и еще не болел, то вакцина может защитить его от вируса в оставшуюся часть сезона.
Какие бывают вакцины от гриппа и чем отличаются друг от друга?
Антигены в вакцине могут быть представлены в разном виде.
Большинство вакцин от гриппа, представленных в России — это неживые вакцины следующих типов:
Расщепленные вакцины (сплит) содержат убитый, разобранный на кусочки, вирус. За счет содержания не только поверхностных антигенов, но и «внутренних» белков вируса, приводят к бо́льшей стимуляции иммунного ответа и выработке более аффинных (более «цепких») антител. В России этот вид вакцин представлен вакциной «Флю-М» производства СПбНИИВС, «Ультрикс» и «Ультрикс Квадри» производства компании «Форт». Импортный аналог — вакцина «Ваксигрип» производства компании «Санофи».
Субъединичные вакцины — содержат только поверхностные антигены вируса, они наименее реактогенны. В нашей стране это вакцина «Инфлювак». Отечественных аналогов нет.
Частным случаем субъединичных вакцин являются субъединичные адъювантные вакцины, где действующего вещества (антигена) меньше, но добавлен усиливающий иммунный ответ компонент (адъювант). В России этот вид представлен вакцинами «Совигрипп» («Микроген») и «Гриппол Плюс», «Гриппол Квадривалент («Петровакс Фарм»).
Живые вакцины от гриппа тоже существуют, но применяются редко. Они представляют собой ослабленный вирус, который вводят в нос в виде спрея. За счет этого активируется местный иммунитет во «входных воротах» гриппозной инфекции. Однако такие вакцины имеют больше всего ограничений, поскольку вирус хоть и слабый, но живой. Вакцина предназначена для людей до 2 от 49 лет. Не рекомендуется беременным женщинам, людям с ослабленной иммунной системой и некоторыми хроническими заболеваниями. В России этот вид вакцин представлен вакциной «Ультравак» производства «Микроген», но вы его, скорее всего, не встретите.
Что такое 3- и 4-валентная вакцина?
Валентность вакцины — это количество разновидностей одного патогена, которые она включает. Например, «Превенар 13» — защищает от 13 видов пневмококков, эта вакцина 13-валентная. В состав «Пневмовакс 23» входят антигены 23 разновидностей пневмококков — эта вакцина 23-валентная.
С гриппом точно такая же история. Одновременно циркулирует всего 4 разновидности вируса гриппа — два подтипа вируса гриппа А и две линии гриппа В. Но одна из линий В обычно преобладает.
В состав 3-валентных вакцин включают антигены обоих разновидностей вируса гриппа А и доминирующую по прогнозам линию гриппа В. В состав 4-валентных вакцин — все 4 варианта, поэтому они наиболее эффективны.
Какие вакцины можно сделать ребенку, а какие взрослому?
Большинство вакцин, доступных в РФ, можно делать начиная с возраста 6 месяцев. В том числе взрослым:
Следующие вакцины в сезоне 2019-2020 гг. применяются только начиная с 18 лет:
Какая вакцина от гриппа самая лучшая?
Та, что вам доступна. Любая вакцинация от гриппа лучше, чем вообще никакой.
Лофант тибетский
Агастахис морщинистый, Aga- stachys rugosa, Louphantus tibeticus. Семейство многоколосников. Реликтовое растение. Иммуностимулятор.
По данным биохимических исследований он является мощнейшим иммуностимулятором пролонгического действия, равных которому в растительном мире пока не обнаружено. В отличие от женьшеня его воздействие на организм носит более мягкий и продолжительный характер, его лекарственные свойства нарастают постепенно и продолжаются длительное время. Самое главное его достоинство это то, что он, воздействуя непосредственно на иммунную систему, заставляет ее более активно воздействовать на наши секреторные органы и следовательно поднимать наши внутренние защитные силы.
Вы можете заказать семена лофанта и фитосборы на его основе по почте, через «Контакты» или «Заказ продукции». могу выслать семена, лек. сборы трав с Лофантом, настойки и лечебные бальзамы на его основе + брошюра по выращивания Лофанта тибетского, дабы не выбросить на ветер столь драгоценные семена, т. к. технология выращивания растений из семян требует выполнения определенных мероприятий.
Вакцины и и валентность
Таким образом, вакцинация – это безопасный и рациональный способ вызвать в организме иммунный ответ без необходимости заражать его той или иной болезнью.
Наша иммунная система обладает памятью. Получив одну или несколько доз вакцины, мы, как правило, приобретаем защиту от той или иной болезни на много лет, десятилетий или даже на всю жизнь. Именно это делает вакцины таким эффективным средством. Вакцины не дают нам заболеть, что гораздо лучше необходимости лечить болезнь, когда она уже наступила.
Чем выше валентность вакцины, тем эффективнее её защита от вирусов
Но по отношению к 2-х вирусной комбинации C o vid 2 + Грипп различных модификаций равна нулю. Вот поэтому 2-х валентной вакцине Спутник V практически очень сложно бороться c рекомбинантной разновидности мутаций (C o vid 2 + Грипп). Вся надежда на антитела не из отдельных антигенов SARS-CoV-2, а из цельного инактивированного двойного вируса и создания 4-х валентной инактивированной цельновирионной вакцины.
Двухвекторная вакцина «Спутник V» или «Гам—КОВИД-Вак»
Первая зарегистрированная вакцина от коронавируса «Спутник V» разработана столичным центром им. Гамалеи. Препарат созданной на базе НИЦЭМ им. Н. Ф. Гамалеи уже поступил в гражданский оборот, медики начали прививать население. Директор центра Александр Гинцбург заявлял, что «Спутник V» обеспечит иммунитет минимум на два года.
Эффективность вакцины «Спутник V» на уровне 91,4% подтверждена в результате анализа данных в заключительной контрольной точке клинических исследований. Эффективность вакцины «Спутник V» против тяжелых случаев заболевания коронавирусной инфекцией составляет 100%.
Сомневаться в эффективности вакцины не нужно, подтверждает Александр Гинцбург, директор Центра имени Гамалеи, разработавшего «Спутник V».
Вакцина ГНЦ «Вектора» «ЭпиВакКорона»
В отличие от «Спутник V» вакцина от «Вектора» не является векторной, то есть произведенной на основе аденовируса.
Зарегистрированную вакцину от коронавируса новосибирского центра «Вектор» планируют ввести в гражданский оборот 1 января 2021 года. Это следует из данных Государственного реестра лекарственных препаратов Минздрава России.
Вакцина «ЭпиВакКорона» представляет собой вирусную векторную вакцину на основе аденовируса человека, который содержит в своём геноме вставку, кодирующую фрагмент S-белка SARS-CoV-2, вызывающую иммунный ответ.
У вакцины отсутствуют побочные эффекты, поскольку она синтетическая. Средство создано без использования белка животного происхождения на основе искусственно полученных частиц коронавируса. Такие частицы остаются «абсолютно стабильны и неизменны». Это позволяет избежать неблагоприятных сопутствующих симптомов при вакцинации.
Средство «Вектора», которое получило название «ЭпиВакКорона», является второй разработанной в России вакциной. Заведующий отделом зоонозных инфекций ГНЦ «Вектор» Роспотребнадзора Александр Рыжиков говорил, что прививка этим препаратом обеспечит иммунитет минимум на полгода. Вакцинироваться им можно неоднократно.
«ЭпиВакКорона» от ГНЦ «Вектор» действует против генетически разнородных штаммов коронавируса и на разные антигены, в этом ее преимущество, сообщают в Роспотребнадзоре.
Он добавил, что вакцина не содержит ни вирусных белков, ни вирусного генома. «Действие ее формирует точечный имунный ответ.
Вакцина Центра М.П.Чумакова
Третья российская вакцина от коронавируса, разрабатываемая в Центре им. М.П. Чумакова (ФГБНУ «ФНЦИРИП им. М. П. Чумакова РАН»), ориентировочно будет готова в феврале.
Об этом сообщил главный научный сотрудник центра, академик РАН, профессор Алексей Егоров, передает Ura.ru. «Главное отличие этой вакцины в том, что она сделана не из отдельных антигенов коронавируса, а из цельного инактивированного вируса. Поэтому она дает полный набор всех антигенов этого вируса, а это дает полный набор всех антител», — отметил Егоров.
По его мнению, благодаря этой особенности препарат лучше всего защитит организм от коронавируса. Егоров добавил, что вакцина будет готова ориентировочно в феврале. Центр разработал собственную инактивированную цельновирионную вакцину от коронавирусной инфекции. Препарат уже успешно прошел доклинические исытания, в настоящее время проходит клинические исследования.
Главная особенность российской вакцины от коронавируса, разработанной Институтом имени Чумакова, в том, что она сделана не из отдельных антигенов SARS-CoV-2, а из цельного инактивированного вируса. В цельновирионных вакцинах используются либо искусственно ослабленные вирусы, не способные вызвать заболевание, либо уже убитые вирусы (инактивированные).
Федеральный научный центр исследований и разработки иммунобиологических препаратов им. М.П. Чумакова Российской академии наук ФГБНУ «ФНЦИРИП им. М. П. Чумакова РАН» планирует к началу августа текущего года завершить доклинические испытания собственной вакцины от коронавируса, а в январе 2021 года закончить ее клинические испытания. Об этом сообщил ТАСС генеральный директор центра Чумакова, член-корреспондент РАН Айдар Ишмухаметов.
«Федеральный научный центр исследований и разработки им. М.П. Чумакова РАН»
Вакцина от коронавируса «Урал»
Разрабатываемая ООО «Завод Медсинтез» вакцина против коронавирусной инфекции «Урал» вышла на доклинический этап испытаний. Первые результаты будут опубликованы в феврале, в результате вакцинации формируется иммунный ответ в виде цитотоксических T-лимфоцитов CD8+ и эффекторные Т-клетки памяти с определенным кодом. Режим хранения вакцины — +4 °С. Вакцинация должна проводиться дважды, с интервалом в четырнадцать дней. Срок действия — один год.
Генетическая вакцина «Урал» учитывает эволюционный процесс вируса, из-за чего будет эффективна против любых разновидностей COVID-19, даже тех, которые могут возникнуть в дальнейшем, заявил председатель совета директоров производителя препарата ООО «Завод Медсинтез» Александр Петров. «Наша вакцина разрабатывается таким образом, что она будет эффективна против любых разновидностей COVID, которые даже возможно будут возникать. Она учитывает эволюционный процесс вируса, то есть она сконструирована таким особым образом.
Вакцина от коронавируса Модерна
Среди вакцин который создаются в Moderna, есть и вакцина против MERS, зоонозной инфекции, вызываемой коронавирусом; разработка также ведется совместно с NIAID. Пока ее тестировали только на животных. Вакцина нацелена на белок S (spike), который образует шипики на поверхности капсида. Теоретически можно взять эту вакцину и заменить последовательность на мРНК, кодирующую белок S нового коронавируса. У Барни Грэма с коллегами есть опыт работы с соответствующим белком MERS, известно, например, что он вызывает более сильный иммунный ответ, когда находится в «стабилизированной» конформации, и как получить такую конформацию.
Другая компания, получившая поддержку от CEPI, Inovio, производит вакцины на основе ДНК. Вакцина против MERS от Inovio под названием INO-4700 успешно прошла фазу I КИ, она также нацелена на белок S. И Модерна, и Inovio заявляют, что в течение месяца могут получить достаточно вакцины, чтобы начать тестирование на животных. Генеральный директор Inovio Джордж Ким говорит, что с нетерпением ждет гонки: «Мы начинаем в одно и то же время, и это отличная возможность для нас помериться силами с Moderna». Вот что говорят американские ученые.
Третий грант CEPI будет предоставлен исследователям из Университета Квинсленда. Они разрабатывают вакцину на основе вирусных белков, продуцируемых в клеточных культурах. Молекулярный вирусолог Кит Чаппелл, один из руководителей проекта, говорит, что их цель — подготовить кандидатную вакцину для тестирования на людях через 16 недель: «Это невероятно амбициозно, и мы не можем гарантировать, что сумеем достичь этой цели».
Сначала безопасность и иммуногенность кандидатных вакцин будут проверены на животных. Затем компании должны будут получить одобрение регулирующих органов для запуска первой фазы КИ. Директор NIAID Энтони Фаучи ожидает, что в случае с вакциной Moderna процесс может начаться в течение трех месяцев.
Параллельно с испытаниями на людях проверят способность вакцины защищать животных от вируса. Для этого еще надо будет создать мышиную модель или найти другой вид животных, возможно, приматов, чувствительных к вирусу 2019-nCoV: «Мы строим самолет во время полета», — говорит Ким.
По мнению Грэма, к лету реально начать испытания эффективности на людях. Но даже когда экспериментальные вакцины идеально работают в клинических испытаниях, появляется следующая проблема — масштабирование производства для нужд защиты населения. При наихудшем сценарии возможностей всех трех компаний может оказаться недостаточно. Но если, например, 2019-nCoV окажется сезонным, как многие респираторные вирусы, картина получается более утешительной.
Бансел говорит, что подготовка вакцины в конечном счете является мерой предосторожности: «Мы все надеемся, что эта вакцина нам никогда не понадобится». Есть и другие заявления о готовности создать вакцину в течение года, например, от Johnson & Johnson, Novavax.
Биотехнологическая компания Novavax («Новавакс») из штата Мэриленд (США) получила от Коалиции за инновации в сфере готовности к эпидемиям (CEPI) грант в размере 384 млн долл., сообщает FiercePharma. Грант предназначен для финансирования клинических исследований (КИ) I/II фазы по вакцине-кандидату NVX-COV2373 и начала работ по масштабированию ее производства. В марте Novavax уже получала от CEPI грант в размере 4 млн долл. для финансирования ранних стадий разработки вакцины.
Исследования I фазы начнутся в Австралии в мае. Их результаты ожидаются в июле. КИ II фазы планируется провести в нескольких странах, сообщили в Novavax. Часть полученных средств будет израсходована на расширение производства вакцины NVX-COV2373. Целевой объем производства на конец 2020 года – до 100 млн доз. В 2021 году компания планирует производить свыше 1 млрд доз вакцины.
NVX-COV2373 представляет собой рекомбинантную вакцину на основе наночастиц в комбинации с адъювантом Matrix-M, который также является разработкой Novavax. Данная платформа недавно показала свою эффективность в КИ III фазы квадривалентной противогриппозной вакцины NanoFlu у пациентов в возрасте от 65 лет.
Даже после вакцинации от COVID-19 необходимо соблюдать меры индивидуальной защиты, в том числе ношение масок. Об этом, как передает China Daily, заявил замглавы государственного комитета по вопросам здравоохранения КНР Цзэн Исинь. Цзэн рекомендовал носить маски, соблюдать социальную дистанцию и мыть руки. По его словам, ни одна вакцина не может быть эффективна на 100%. «Прежде чем мы установим коллективный иммунитет, необходимо принять решительные меры по профилактике и контролю эпидемии для безопасности людей», — добавил он.
Китай ведет разработку собственной нереплицированной вакцины от COVID, Ad5-nCoV. Над ней работают компания CanSino Biologics и Институт биоинженерных исследований при Академии военно-медицинских наук. В начале декабря к испытаниям китайском вакцины присоединилась Россия. Российский Минздрав выдал разрешение на участие в испытаниях 8 тыс. добровольцев. Пока результаты не обнадеживающие.
Английская Оксфордская вакцина.
Что мы знаем об Оксфордской вакцине? Вирусологи стараются исправить ее недостатки приводящие к необъяснимому заболеванию. Ибо у одного из испытуемых развился поперечный миелит.
Вакцина Оксфордского университета «обнадеживает» пожилых людей.
Вакцина от коронавируса, разрабатываемая Оксфордским университетом, во время второй фазы испытаний показала обнадеживающие результаты у людей старше 60 и 70 лет, которых относят в группу риска из-за повышенной вероятности развития осложнений после заражения.
Вакцина оксфордских ученых создана на основе ослабленного штамма вируса обычной простуды (относящегося к семейству аденовирусов), взятого у шимпанзе. Работа над вакциной началась в январе и завершилась спустя три месяца, после чего начались клинические испытания.
В сентябре испытания вакцины Оксфордского университета были приостановлены на несколько дней, после того как у одного из волонтеров было обнаружено «потенциально необъяснимое заболевание».
Оксфорд делает так называемую векторную вакцину. Берется некий безопасный, искусственно измененный вирус. И на него буквально пересаживаются спайк-белки коронавируса. Затем этот гибрид вводится в организм человека. Как и SARS-CoV-2, он прикрепляется к клеткам, но ущерба не наносит. А вот иммунная система начинает вырабатывать антитела, которые впредь будут реагировать на все, что обладает этими спайк-белками.
Технология давно отработанная и безопасная. Если делать все правильно. Например, российская вакцина от коронавируса – тоже векторная. Правда она, в отличие от британской, никому не вредит. В чем же между ними разница? Отечественный «Спутник V» создан на основе аденовируса человека. Давно известного и проверенного патогена, на базе которого создан уже не один успешный препарат. Но Оксфорд почему-то решил взять менее изученный аденовирус шимпанзе.
Между тем в ближайшее время ученым предстоит понять, почему заразность нового варианта вируса усилилась, оценить возрастное распределение инфицированных этим штаммом и смертность, установить, не изменятся ли антигены — те участки, на которые вырабатывается иммунный ответ.
Надо отметить: Валентность вакцин, это – это количество болезней, от которых данная вакцина будет защищать. Наиболее эффективны 4-х валентные вакцины. В комбинированных вакцинах снижена концентрация антигенов, что позволяет прививке быть наиболее безопасной.
Чем выше валентность вакцины, тем эффективнее её защита от вирусов
Но по отношению к 2-х вирусной комбинации C o vid 2 + Грипп различных модификаций равна нулю. Вот поэтому 2-х валентной вакцине Спутник V практически очень сложно бороться c рекомбинантной разновидности мутаций (C o vid 2 + Грипп). Вся надежда на антитела не из отдельных антигенов SARS-CoV-2, а из цельного инактивированного двойного вируса и создания 4-х валентной инактивированной цельновирионной вакцины.
Технологические разработки:
Вакцины от COVID-19, над которыми работают ученые во всем мире, разрабатываются на разных технологических платформах, у каждой из которых есть преимущества и недостатки. Заявления о том что вакцина защищает от всевозможных рекомбинантных мутаций, ко-инфекций, голословно.
Нет доказательной базы чтобы так заявлять!
Инактивированные вакцины получают путём выращивания SARS-CoV-2 в культуре клеток, обычно на клетках Vero, с последующей химической инактивацией вируса. Их можно производить относительно легко, однако их выход может быть ограничен продуктивностью вируса в культуре клеток и потребностью в производственных мощностях с высоким уровнем биобезопасности. Эти вакцины обычно вводятся внутримышечно и могут содержать квасцы (гидроксид алюминия) или другие адъюванты. Поскольку весь вирус представлен иммунной системе, иммунный ответ, вероятно, будет нацелен не только на спайковый белок SARS-CoV-2, но также на матрикс, оболочку и нуклеопротеин. Примерами инактивированных вакцин-кандидатов являются CoronaVac от Sinovac Biotech, вакцины Уханьского и Пекинского институтов, QazCovid-in НИИ проблем биобезопасности Казахстана и др.
Живые аттенуированные вакцины получают путём создания генетически ослабленной версии вируса, которая реплицируется в ограниченной степени, не вызывая заболевания, но вызывая иммунный ответ, подобный тому, который вызывается естественной инфекцией. Ослабление может быть достигнуто путём адаптации вируса к неблагоприятным условиям (например, рост при более низкой температуре, рост в нечеловеческих клетках) или путём рациональной модификации вируса (например, деоптимизация кодонов или удаление генов, ответственных за противодействие распознаванию врождённого иммунитета). Важным преимуществом этих вакцин является то, что их можно вводить интраназально, после чего они вызывают иммунную реакцию слизистых оболочек верхних дыхательных путей — главных входных ворот вируса. Кроме того, поскольку вирус реплицируется у вакцинированного индивидуума, иммунный ответ, вероятно, будет воздействовать как на структурные, так и на неструктурные вирусные белки посредством антител и клеточных иммунных ответов. Однако к недостаткам этих вакцин относятся проблемы безопасности и необходимость модификации вируса, что требует много времени, если проводится традиционными методами, и техническая сложность, если используется обратная генетика. Примером живой аттенуированной вакцины служит вакцина-кандидат альянса SpyBiotech Великобритании и Института сыворотки Индии.
Векторные, нереплицирующиеся представляют большую группу вакцин, находящихся в разработке. Такие вакцины обычно основаны на другом вирусе, который был сконструирован для экспрессии белка-шипа и был отключен от репликации in vivo из-за делеции частей его генома. Большинство этих подходов основаны на аденовирусных векторах (AdV), хотя также используются модифицированные вирусы Анкара [de] (MVA), векторы вируса парагриппа человека, вирус гриппа, аденоассоциированный вирус и вирус Сендай. Большинство этих векторов вводятся внутримышечно, проникают в клетки вакцинированного человека и затем экспрессируют спайковый белок, на который реагирует иммунная система хозяина. Эти подходы имеют много преимуществ. Нет необходимости иметь дело с живым SARS-CoV-2 во время производства, существует значительный опыт производства больших количеств некоторых из этих векторов (первичная буст-вакцина на основе Ad26-MVA против вируса Эбола создана много лет назад), и векторы демонстрируют хорошую стимуляцию ответов как В-клеток, так и Т-клеток. Недостатком является то, что некоторые из этих векторов поражаются и частично нейтрализуются уже существующим векторным иммунитетом. Этого можно избежать, используя типы векторов, которые либо редки у людей, либо происходят от вирусов животных, либо используя вирусы, которые сами по себе не вызывают особого иммунитета (например, аденоассоциированные вирусы). Кроме того, иммунитет к векторам может быть проблематичным при использовании схем прайм-буста, хотя этого можно избежать, используя праймирование одним вектором и бустирование другим вектором. Примером нереплицирующейся векторной вакцины является Гам-КОВИД-Вак НИЦЭМ имени Н. Ф. Гамалеи (AdV5/AdV26), CanSino (AdV5), Оксфордская/AstraZeneca ChAdOx1 nCoV-19 (AdV шимпанзе), GRAd-COV2 (AdV гориллы) и др.
Биологические (биотехнологические) векторы – это биологические структуры, способные вносить чужеродный генетический материал в клетку: плазмиды, бактериофаги, вирусы.
Векторные, реплицирующиеся обычно происходят из аттенуированных или вакцинных штаммов вирусов, которые были сконструированы для экспрессии трансгена, в данном случае белка-шипа. В некоторых случаях также используются вирусы животных, которые не размножаются и не вызывают заболеваний у людей. Такой подход может привести к более устойчивой индукции иммунитета, поскольку вектор в некоторой степени распространяется у вакцинированного человека и часто также вызывает сильный врожденный иммунный ответ. Некоторые из этих векторов также можно вводить через поверхности слизистых оболочек, что может вызвать иммунный ответ. Как пример — вектор на основе вируса гриппа, разрабатываемый Пекинским институтом биологических продуктов. В настоящее время находятся в разработке векторы на основе вируса везикулярного стоматита, конской оспы и вируса болезни Ньюкасла.
ДНК-вакцины основаны на плазмидной ДНК, которая может производиться в больших количествах в бактериях. Обычно эти плазмиды содержат промоторы экспрессии у млекопитающих и ген, кодирующий белок-спайк, который экспрессируется у вакцинированного индивидуума при доставке. Большим преимуществом этих технологий является возможность крупномасштабного производства в E. coli, а также высокая стабильность плазмидной ДНК. Однако ДНК-вакцины часто демонстрируют низкую иммуногенность и должны вводиться с помощью устройств доставки, чтобы сделать их эффективными. Это требование к устройствам доставки, таким как электропораторы, ограничивает их использование.
РНК-вакцины появились относительно недавно. Подобно ДНК-вакцинам, генетическая информация об антигене доставляется вместо самого антигена, и затем антиген экспрессируется в клетках вакцинированного человека. Можно использовать либо мРНК (модифицированную), либо самореплицирующуюся РНК. Для мРНК требуются более высокие дозы, чем для самореплицирующейся РНК, которая амплифицируется сама, и РНК обычно доставляется через липидные наночастицы. РНК-вакцины показали большие перспективы в последние годы, и многие из них находятся в стадии разработки, например, против вируса Зика или цитомегаловируса. В качестве потенциальных вакцин против SARS-CoV-2 были опубликованы многообещающие результаты доклинических испытаний. Преимущества этой технологии заключаются в том, что вакцину можно производить полностью in vitro. Однако технология является новой, и неясно, с какими проблемами столкнутся в плане крупномасштабного производства и стабильности при долгосрочном хранении, поскольку требуется ультранизкая температура. Кроме того, эти вакцины вводятся путем инъекции и поэтому вряд ли вызовут сильный иммунитет слизистой оболочки. Примером может служить вакцина-кандидат BNT162b2 немецкого фармконцерна BioNTech, температура хранения которой составляет −70 °C.
Рекомбинантные белковые вакцины можно разделить на рекомбинантные вакцины на основе спайк-белков, рекомбинантные вакцины на основе RBD (англ. Receptor — binding domain ) и вакцины на основе вирусоподобных частиц (англ. VLP , virus — like particle ). Эти рекомбинантные белки могут экспрессироваться в различных системах экспрессии, включая клетки насекомых, клетки млекопитающих, дрожжи и растения; вполне вероятно, что вакцины на основе RBD также могут быть экспрессированы в Escherichia coli. Выходы, а также тип и степень посттрансляционных модификаций варьируются в зависимости от системы экспрессии. В частности, для рекомбинантных вакцин на основе шипованных белков модификации, такие как делеция многоосновного сайта расщепления, включение двух (или более) стабилизирующих мутаций и включение доменов тримеризации, а также способ очистки (растворимый белок против экстракции через мембрану) — может влиять на вызванный иммунный ответ. Преимущество этих вакцин состоит в том, что их можно производить не обращаясь с живым вирусом. Кроме того, некоторые вакцины на основе рекомбинантных белков, такие как вакцина FluBlok от гриппа, были лицензированы, и имеется значительный опыт их производства. Есть и недостатки. Спайковый белок относительно сложно экспрессировать, и это, вероятно, повлияет на продуктивность и на то, сколько доз можно получить. RBD легче выразить; однако это относительно небольшой белок, когда он экспрессируется сам по себе, и, хотя сильные нейтрализующие антитела связываются с RBD, у него отсутствуют другие нейтрализующие эпитопы, которые присутствуют на полноразмерном шипе. Это может сделать вакцины на основе RBD более подверженными влиянию антигенного дрейфа, чем вакцины, содержащие полноразмерный спайковый белок. Подобно инактивированным вакцинам, эти кандидаты обычно вводятся путем инъекции, и не ожидается, что они приведут к устойчивому иммунитету слизистой оболочки. Пример рекомбинантной белковой вакцины-кандидата — NVX‑CoV2373 от Novavax.
И немного о валентности.
Валентность вирусов и вакцин:
Вале́нтность (от лат. valēns «имеющий силу») — способность атомов химических элементов образовывать определённое число химических связей.
Эффективность 3-х и 4-х валентных вакцин против гриппа высока,
Эффективность 3х и 4х валентных вакцин в зависимости от совпадения антигенной структуры выделенных штаммов и линии вакцинного штаммов гриппа на графике.
Чем выше валентность вакцины, тем эффективнее её защита от вирусов.
Но по отношению к 2-х вирусной комбинации C o vid 2 + Грипп различных модификаций равна нулю. Вот поэтому 2-х валентной вакцине Спутник V практически очень сложно бороться c рекомбинантной разновидности мутаций (C o vid 2 + Грипп). Вся надежда на антитела не из отдельных антигенов SARS-CoV-2, а из цельного инактивированного двойного вируса и создания 4-х валентной инактивированной цельновирионной вакцины.
Понятие о валентност и вирусов. Квази-экви валентност ь
Квази-эквивалентность белковых субъединиц в сочетании с их способностью менять свою конформацию лежит в основе многих биологических явлений, чем и объясняется мутации вирусов. Следует отметить, что принцип квази-эквивалентности допускает известные колебания формы, чем, по-видимому, и можно объяснить существование различных форм в общей популяции частиц одного вируса.
Представление о квази-эквивалентности, введенное в вирусологию Каспаром и Клугом [Donald Caspar end Aaron Klug американские ученые вирусологи], допускает образование оболочек из 60 и более строительных блоков концепция эта наилучшим образом объясняет геометрическую укладку капсомеров у большинства изометрических вирусов.
Биологические (биотехнологические) векторы – это биологические структуры, способные вносить чужеродный генетический материал в клетку: плазмиды, бактериофаги, вирусы.
Пациенты, которые победили COVID-19, в течение долгого времени могут страдать от тошноты, диареи, анорексии и болей в животе. Постковидный синдром порождает также депрессию и приступы тревоги.
Люди после выписки нередко обращаются с жалобами на боли, чувство стеснения в груди и нарушение сердцебиения. Сыпь и другие кожные заболевания – довольно редкие симптомы.
Накануне кандидат медицинских наук, врач-иммунолог Николай Крючков рассказал, что каждый пятый пациент, перенесший коронавирус, сталкивается с постковидным синдромом. Медик отметил, что часть его симптомов трудно отличить от естественной слабости после любой тяжелой болезни. Крючков назвал среди симптомов нарушения концентрации внимания, сна и памяти. Перепады настроения и депрессия, а также повод для тревоги.
Ранее исландские ученые обнаружили новый симптом COVID-19. Это миалгия – болевые ощущения в мышцах, сухожилиях, связках, мягких соединительных тканях, а также костях и органах. Помимо прочего, симптомы у пациентов с легкой формой коронавируса также могут отличаться.
Но ни один переболевший почему-то не сообщает о появлении изжоги, повышенной кислотности, перед началом проявления постковидного синдрома, и соответственно лишь малая часть переболевших, врачей и докторов понимают что надо поддерживать КЩР с очень небольшим сдвигом в сторону ощелачивания, т.е повышения ph жидкости в тканях в сторону ощелачивания до 7,45 в критических случаях.