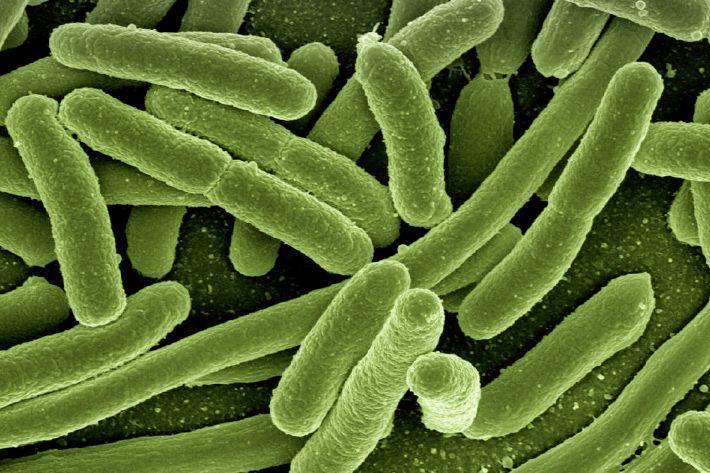
Лактозонегативная кишечная палочка у грудничка повышена что это
Кишечная палочка — Escherichia coli (эшерихия коли). Две стороны одной медали
Кишечная палочка (Escherichia coli, E. coli, эшерихия коли)
Наряду с большим количеством полезных для организма сероваров Escherichia coli существует около полутора сотен патогенных, которые могут вызывать заболевания. Мы говорим, что они «могут вызывать», поскольку их вредное влияние нейтрализуется иммунной системой и микрофлорой, если эти патогенные эшерихии находятся в кишечнике в небольших количествах. Человек может быть носителем патогенных эшерихий и даже не подозревать об этом, «награждая» инфекцией окружающих. Поэтому у нас принято перед приемом на работу и после приема, с определенной периодичностью, проверять работников отдельных коммунальных сфер на патогенные энтеробактерии, в том числе и на кишечную палочку. Делается это в целях профилактики вспышек эшерихиозов.
Патогенные E. coli подразделяют на 4 группы: энтеропатогенные (английское сокращение –EPEC), энетротоксигенные (ETEC), энтероинвазивные (EIEC) и энтерогеморрагические (EHECилиVTEC).
Энтеротоксигенные эшерихии колонизируют тонкий кишечник и вызывают холероподобные заболевания. Носительство после выздоровления не формируется. Чаще всего встречаются в Индии. У нас – в южных регионах. Источники заражения – пища и вода. Пик заболеваемости приходится на детей от года до трех лет. Заражающая доза – 10 8 — 10 9 бактерий, или иначе — колониеобразующих единиц (КОЕ), в 1г кала.

Энтероинвазивные Escherichia coli, такие как О136, О159, О167, О28, О29, О112, О124 : Н30, О124 : Н32, имеют такой же фактор патогенности как у шигелл — бактерий, вызывающих дизентерию. Поэтому симптоматика заболевания напоминает дизентерию. У больного наблюдается непродолжительная водянистая диарея, которая к концу первых суток заканчивается «дизентерийным плевком» — комком слизи. В отличие от предыдущей группы, заболевание, вызванное энтероинвазивными E. coli характеризуется очень высокой температурой и продолжительностью (острый период – до двух недель). Встречаются EIEC повсеместно, заражение происходит также в основном через пищу и воду. Колонизируют толстый кишечник. Чаще всего болеют дети до 2-ух лет. Заражающая доза – 10 5 КОЕ в 1г кала.
Энтеропатогенные эшерихии вызывают инфекции, по симптоматике заболевания сходные с сальмонеллезом. Заражающая концентрация – от 10 5 до 10 10 КОЕ/г. Дети чаще всего получают внутрибольничные штаммы EPEC, либо заражаются контактно-бытовым путем (полотенца, постельное белье). Взрослые приобретают энтеропатогенных эшерихий через продукты. В Соединенных Штатах Америки энтеропатогенные E. Coli стоят на первом месте среди кишечных заболеваний детей. Симптомы: водянистая диарея, тошнота, рвота. Заболевание длительное – до 15 дней. Может формироваться носительство после выздоровления.
Самая опасная, но, к счастью, наиболее редкая группа – энтерогеморрагические или веротоксические эшерихии. К ним относится пока одна серогруппа – О157:Н7. Открыты они были впервые в 80-ых годах и первая вспышка произошла в США (в доме престарелых, через плохо прожаренные гамбургеры). Потом – в Японии. Причем в одном офисном здании заболели практически 1000 человек (ели каракатиц, которые были выловлены в прибрежной зоне). На 30 лет человечество забыло об этом кошмаре, но в 2011 году Европу всколыхнула весть об эпидемии энтерогеморрагической Escherichia coli. Ходят слухи, что происхождение EHEC имеет искусственный характер (бакоружие или неудачные опыты по генной модификации), но это – всего лишь предположение. Фактор патогенности – шигеллоподобный токсин, который превосходит по токсичности шигеллезный в сотни раз. «Ареал обитания» — толстый кишечник. Клиническая картина при заболевании следующая: боли в животе, холероподобная диарея, которая в течение нескольких часов переходит в кровавый понос. Если нет острой почечной недостаточности, в комплексе с низким содержанием тромбоцитов и анемией (все это называется гемолитико-уремическим синдромом, или ГУС), то в течение одной — двух недель больного лечат детоксическими препаратами. Лечение антибиотиками категорически не рекомендуется!
Профилактика всех эшерихиозов: соблюдение гигиенических норм, таких как мытье рук, овощей и фруктов, причем желательно их термически обрабатывать (хотя бы ошпаривать); не есть из одной посуды с несколькими людьми; иметь личные предметы гигиены. Желательно также периодически принимать пробиотики (с предварительной консультацией у врача-гастроэнтеролога) для укрепления защитных сил организма.
Атопический дерматит, нарушения адаптации и дисбактериоз кишечника
Причины возникновения атопического дерматита
Атопический дерматит (АД) — хроническое рецидивирующее воспалительное заболевание кожи, проявляющееся интенсивным зудом, симпатергической реакцией кожи, папулезными высыпаниями и выраженной лихенификацией в сочетании с другими признаками атопии. АД возникает, как правило, в раннем детском возрасте, имеет возрастные особенности локализации, характеризуется гиперчувствительностью как к аллергенам, так и к неспецифическим раздражителям. АД существенно влияет на качество жизни, может быть причиной нарушений сна, снижения активности, невротических состояний и приводить к формированию бронхиальной астмы и, соответственно, инвалидизации [1, 9].
Среди этиологических факторов, приводящих к развитию АД, указывают на сенсибилизацию к пищевым аллергенам, особенно в детском возрасте. Это связано с врожденными и приобретенными нарушениями функций пищеварительного тракта, неправильным вскармливанием, ранним введением в рацион питания высокоаллергенных продуктов, кишечным дисбактериозом, наличием высокого титра условно-патогенной флоры (УПФ), нарушением цитопротективного барьера и т. д., что способствует проникновению антигенов из пищевой кашицы через слизистую оболочку во внутреннюю среду организма и формированию сенсибилизации к пищевым продуктам [6, 7, 10].
Большинство аллергических проблем в той или иной степени связаны с желудочно-кишечным трактом (ЖКТ). Особенно это относится к аллергодерматозам, в том числе к АД. В кишечнике постоянно имеются или транзитом проходят более 90% всех антигенов, с которыми контактирует человек — именно там находятся основные элементы противоаллергической защиты, а кишечная стенка содержит огромное количество иммунокомпетентных клеток, что позволяет некоторым исследователям считать кишечник одним из ключевых органов иммунной системы. Если происходят какие-то нарушения в барьерной функции ЖКТ, в кровь из кишечника начинают поступать различные токсины и антигены, ставшие аллергенами.
Аллергенами могут являться продукты жизнедеятельности условно-патогенной флоры [4] и паразитов, обитающих в просвете кишечника, а также пища, не подвергшаяся достаточному расщеплению. Они сенсибилизируют организм больного, способствуют выработке специфических IgE-антител и последующему выбросу гистамина из тучных клеток, что и определяет клиническую картину пищевой аллергии. Как известно, окружающая среда обильно заселена микроорганизмами. Многие из них не способны к сосуществованию с макроорганизмом, другие являются сапрофитами, третьи — симбионтами, т. е. организмами, способными сосуществовать с другими биологическими видами во взаимосвязанном и обоюдовыгодном взаимодействии. Симбионты необходимы для нормальной жизнедеятельности организма-хозяина.
В нормальных физиологических условиях организм человека содержит сотни различных видов микроорганизмов. Термин «нормальная микрофлора» объединяет микроорганизмы, выделяемые из организма здорового человека: с кожи, слизистых оболочек верхних дыхательных путей, ЖКТ и мочеполовой системы. Нижние отделы тонкой и особенно толстой кишок представляют резервуар бактерий всего организма.
Нормофлорой принято считать совокупность типичных для определенного биологического вида ассоциаций микроорганизмов, естественная жизнедеятельность которых происходит в тех органах и тканях макроорганизма, которые сообщаются с внешней средой. Нормофлора выполняет важнейшие физиологические и иммунологические функции в макроорганизме и составляет с ним единое целое.
Общая численность бактерий кишечника достигает 10 14 клеток, что почти на порядок больше числа клеток всех органов и тканей макроорганизма. Показано, что естественной формой существования в природе любых микроорганизмов является иммобилизованное состояние, т. е. 99,9% бактерий в природе обитает в виде микроколоний, фиксированных к различным поверхностям [12].
Прикрепление микробных клеток к твердым поверхностям происходит в три этапа: на первом — за счет слабых взаимодействий осуществляется обратимая адгезия; второй этап заключается в неспецифической адгезии с помощью фимбрий и пилей, включая возникновение водородных и ионных связей; на третьем этапе происходит образование усиливающего адгезию внеклеточного материала (полисахаридов). Таким образом, формируется биопленка, через которую осуществляется контакт между просветом кишечника и слизистой оболочкой.
Биопленка, покрывающая слизистые оболочки кишечника, кроме полисахаридов микробного происхождения, состоит из колоний микроорганизмов, а также муцина, продуцируемого бокаловидными клетками. Микроорганизмы в составе биопленки в десятки и сотни раз более устойчивы к воздействию неблагоприятных факторов по сравнению с тем, когда они находятся в свободноплавающем состоянии [12]. В отличие от свободноживущих бактерий, представители нормофлоры в животном организме способны фиксироваться лишь к определенным рецепторам кожи и слизистых оболочек. Наиболее многочисленна и разнообразна по составу группа бактерий толстого мукозного слоя, покрывающего внутреннюю поверхность пищеварительного тракта. Нормофлорой ЖКТ для человека являются бифидобактерии, лактобактерии и кишечная палочка с нормальной ферментативной активностью. В составе биопленки эти виды бактерий в норме должны составлять до 99% всей кишечной микрофлоры.
Кроме нормофлоры, в кишечнике человека может присутствовать сапрофитная и условно-патогенная флора. Сапрофитная флора представлена эпидермальным и сапрофитными стафилококками, энтерококками, дрожжами, нейссериями и другими видами бактерий. УПФ кишечника может быть представлена гемолитическими стрептококками, золотистым стафилококком, спорообразующими анаэробами, лактозонегативными энтеробактериями, гемолизирующей кишечной палочкой, грибами рода Candida. В норме количество УПФ не должно превышать 10 3 –10 6 КОЕ в 1 г фекалий, или 10 % общего количества микробов [5].
Нормофлора кишечника участвует во многих жизненно важных процессах макроорганизма, который, в свою очередь, является для нее средой обитания.
Основные функции кишечной микрофлоры можно сформулировать следующим образом:
Нормофлора пищеварительного тракта играет важную роль в защите организма от токсических воздействий экзогенных и эндогенных субстратов и метаболитов. Она защищает макроорганизм от токсичных соединений, не только поступающих в организм с пищей, водой, воздухом, но и образующихся внутри него. Это первое звено в каскаде защитных реакций организма на повреждающие воздействия. Слой: слизь — IgA — нормофлора, занимает все поверхности, образуемые энтероцитами, и защищает слизистую оболочку от дегидратации макромолекул, физической и химической агрессии, а также от атак микроорганизмов, бактериальных токсинов, паразитов [11]. Нормофлора тормозит процессы декарбоксилирования пищевого гистидина, уменьшая тем самым синтез гистамина, а следовательно, снижает аллергический потенциал энтерального питания для детского организма.
Нормофлора, заключенная в высокогидратированный экзополисахаридно-муциновый матрикс (биопленку), как перчатка, покрывает кожу и слизистые оболочки, являясь одновременно и частью окружающей среды, и частью макроорганизма. Фактически микрофлора — буфер, граница между внешней и внутренней средой человека. За счет такого своего уникального положения микрофлора является ключевым, наряду с иммунной системой, элементом обеспечения адаптации человека к окружающей среде, в том числе к питанию.
Адаптация (на средневековой латыни adaptatio — приспособление) в биологии и медицине — приспособление живых организмов к меняющимся условиям существования в результате изменения морфологических и физиологических особенностей и поведения. Адаптацией называется также процесс привыкания. Система адаптации обеспечивает приспособление организма к различным антигенам, т. е. любым веществам, отличающимся по своей структуре от генотипа, в том числе компонентам пищи, микроорганизмам и конечном счете ко всему, что окружает человека.
Другой важный компонент системы адаптации — иммунная система. Любой контакт с антигеном находится под иммунным контролем: сначала иммунная система «знакомится» с антигеном, запоминает его (а при новом контакте распознает чужеродное вещество) и, если оно представляет опасность, уничтожает его (в случае болезнетворных микробов, ядов, токсинов), либо, если опасности для организма нет, проявляет по отношению к нему толерантность — невосприимчивость.
Если все системы адаптации работают слаженно и нормально, антигены не становятся аллергенами — организм адекватно реагирует на окружающую среду, а также на пищу и многочисленные инфекционные агенты внутренней и внешней среды. Сбой в системе адаптации приводит к неадекватному ответу, одним из проявлений которого является АД. Аллергия (в том числе АД) — по сути, неоправданно сильный, извращенный, ответ макроорганизма на какие-то воздействия как извне, так и изнутри, фактически это срыв адаптационных механизмов.
Материалы и методы исследования
В этиологии и патогенезе развития АД имеются не только иммунные нарушения, но и нарушения в микроэкологии ЖКТ (обозначаемые как дисбактериоз кишечника), чему имеется немало подтверждений. При обследовании большого количества детей с различными аллергодерматозами выявлено, что нарушения кишечной микрофлоры отмечались у 92,8% детей, при этом более выраженные отклонения в составе биоценоза соответствовали более тяжелому течению аллергодерматоза — это связано с ускоренным проникновением пищевых и микробных антигенов в кровь и сенсибилизацией организма [8].
Доказана связь неатопических экзем с инфекционными агентами, в частности со стафилококковой, стрептококковой инфекциями, грибами рода Candida, гемолитической E. сoli и другими представителями УПФ. В некоторых исследованиях получены данные о том, что продукты расщепления стафилококкового энтеротоксина и других микроорганизмов высоко гомологичны IgЕ-рецептору. Микробные энтеротоксины фиксируются на В-лимфоцитах, что стимулирует синтез IgЕ, вызывая вторичную гиперсенсибилизацию. Это играет важную роль в поддержании кожного воспаления при атопическом дерматите. Кроме того, продукты жизнедеятельности микроорганизмов — токсины — могут накапливаться в организме человека [7]. У здоровых людей они инактивируются бактериями нормофлоры. В условиях дисбактериоза кишечника эти токсины вызывают реактивное воспаление поджелудочной железы, печени, нарушают функцию этих органов, что вызывает еще более выраженный дисбактериоз кишечника, в результате которого нарушается расщепление и усвоение жизненно важных питательных веществ. Кроме того, крупные молекулы повреждают биопленку, усугубляя дисбактериоз, и, всасываясь, напрямую воздействуют на тучные клетки, вызывая их дегрануляцию по механизму псевдоаллергии. Кстати, заболевания ЖКТ могут способствовать и развитию респираторной аллергии.
Дисбактериоз бывает двух типов: со снижением количества нормальной кишечной микрофлоры или с повышением количества УПФ (табл. 1) [3]. Оба типа дисбактериоза могут привести к формированию АД. При первом типе (дефицит полезных бактерий) аллергические проблемы появляются из-за истончения биопленки, что нарушает барьерную функцию ЖКТ, — развивается пищевая сенсибилизация. Особенно неблагоприятно для организма снижение бифидобактерий, поскольку они составляют не менее 95% биопленки — их значительный дефицит это всегда третья степень дисбактериоза, независимо от количества других представителей нормофлоры. При втором типе дисбактериоза (избыточное количество УПФ) в слизистую оболочку, а затем в системный кровоток поступает большое количество инфекционных антигенов, что в итоге приводит к сенсибилизации организма. Особенно сильно способствует сенсибилизации и развитию АД сочетание дефицита полезных бактерий с избыточным ростом УПФ.
Анализ на «дисбактериоз»: пожалуйста, хватит
Прилетели как-то на Землю инопланетяне. Посмотрели: ледники тают, озоновые дыры растут, панды не размножаются. Стали думать, отчего это все. Спустились в московский район Бирюлево. Взяли сотню человек, раздели, пощупали, допросили. Сделали вывод: озоновые дыры — из-за брюнетов (много их попалось), панды не размножаются из-за мужиков — их на летающей тарелке оказалось больше половины. Ну, а глобальное потепление — из-за рубля: у всех жителей Бирюлево в карманах оказалась эта валюта. Улетели инопланетяне к себе домой и по результатам исследования напечатали своими зелеными щупальцами десять кандидатских диссертаций.
Вот как-то так и проводится «анализ на дисбактериоз». Поговорим об этом диагнозе с гастроэнтерологом GMS Clinic Головенко Алексеем.
Что не так с этим исследованием? Его же так часто назначают врачи!
В питательной среде появились колонии бактерий. К счастью для нас, действительно опасная Сальмонелла растет в питательной среде. Большая часть кишечных бактерий, увы, нет.
Так что, нет такого понятия — «дисбактериоз»?
Конечно, есть. Например, псевдомембранозный колит — тяжелое воспаление толстой кишки после антибиотика — самый настоящий дисбактериоз: погибли конкуренты, и поэтому размножается Clostridium difficile. Только для того, чтобы это лечить, совершенно не нужно констатировать очевидное — состав бактерий в кишке изменился. Достаточно подтвердить инфекцию (выявить токсины C.difficile) и назначить лечение.
Кишечная микрофлора, вне сомнения, влияет на все процессы в нашем организме. Пересадив стул от мыши с ожирением мышке с нормальным весом, у последней мы вызываем ожирение. Состав кишечных бактерий принципиально разный у людей с тревожностью и депрессией. Ну, а добавление пробиотика Bacteroides fragilis мышам, у которых искусственно вызвали аутизм, улучшает их социальные навыки. Прочитайте популярную книгу «Смотри, что у тебя внутри» известного микробиолога Роба Найта: наши знания о микрофлоре колоссальны, но применять их на практике (то есть для лечения болезней) мы пока только начинаем.
Стоп. То есть делать посев стула вообще нет смысла?
Грамотный врач выполняет диагностический тест только тогда, когда его результат может изменить лечение. Если и при «дефиците» лактобактерий, и при «избытке» кишечной палочки будет назначено одно и то же лекарство или диета, анализ является пустой тратой денег.
пока у нас НЕТ способа, избирательно менять состав кишечных бактерий.
Предположим, мы однозначно установили, что у человека имеется дефицит какой-то конкретной микроорганизмы (например, лактобактерий). Мы можем:
Очевидно, избирательным действием можно считать только назначение пробиотика. Максимальная доза лучшего коммерческого пробиотика — это 10 млрд. жизнеспособных бактерий в дозе препарата. В кишечнике обитает около 100 триллионов бактерий. То есть, на каждую бактерию «из аптеки» приходится 10 тысяч бактерий, уже «проживающих» в кишке. Маловероятно, что это ничтожное количество бактерий сможет преодолеть колонизационную резистентность и «заселить» кишку. Кроме того, механизм действия пробиотиков (когда они работают) может вообще быть связан с не с самими бактериями: у трансгенных мышей, предрасположенных в воспалению кишечника это самое воспаление удалось остановить, применяя не «живой» пробиотик, а вообще ДНК и некоторые белки, выделенные из «убитого» температурой препарата.
Ну, а главное: одно дело — теория и лабораторные исследования, другое дело — клинические испытания (то есть изучение эффекта препаратов у людей). Разберем три типовых для России ситуации, когда человеку предлагают сдать «анализ кала на дисбактериоз»:
Колики у новорожденного
Мама жалуется, что ребенок много плачет. К слову, любой ребенок в первые три месяца жизни кричит от 117 до 133 минут в сутки (мета-анализ). Наличие или отсутствие колик (беспричинный крик более 3 часов за день хотя бы 3 дня в неделю), в целом, не влияет на риск задержки развития ребенка. В одном исследовании, простая беседа с родителями о «безопасности» колик уменьшала продолжительность плача с 2,6 до 0,8 часов в день. Дети — эмпаты.
Атопический дерматит у ребенка
Все уверены, что проблемы с кожей — от «живота». Будь это так, наверное, атопический дерматит прекрасно лечился бы пробиотиками. Но этот подход не слишком эффективен. Последний мета-анализ свидетельствует: применение пробиотиков (главным образом, Lactobacillus rhamnosus GG) несколько уменьшает выраженность экземы, но эффект этот весьма символический, а дополнительная терапия пробиотиком не позволяет сократить частоту применения местных стероидов, которые (вместе с увлажнением кожи) остаются основой лечения атопического дерматита. И вновь: назначить этот пробиотик мы можем вне зависимости от «результатов» «анализа на дисбактериоз».
Вздутие и спазмы в животе у взрослого
Так нужно хоть в какой-то ситуации сдавать «кал на дисбактериоз»?
Нет. Никогда. Ни при каких обстоятельствах. Мы не лечим вздутие живота, изучая линии на ладони. Мы не лечим сыпь, глядя в хрустальный шар. Мы не делаем бессмысленный анализ на дисбактериоз, чтобы назначить лечение.
Мы ждем, когда доказательная медицина предложит нам эффективные препараты и практические способы понять, что не так с нашими бактериями.
Расшифровка анализа кала на дисбактериоз
Таблица 1. Качественный и количественный состав основной микрофлоры толстого кишечника у здоровых людей (Кое/г Фекалий)
— представителиродов Klebsiella, Enterobacter, Hafnia, Serratia, Proteus, Morganella, Providecia,
— Pseudomonas, Acinetobacter идр.
Микроорганизмы, перечисленные в бланке анализа на дисбактериоз, можно разделить на три группы:
Молочнокислые бактерии
Патогенные энтеробактерии
Условно-патогенная флора (УПФ)
К условно-патогенной флоре относятся лактозонегативные энтеробактерии, клостридии, различные кокки и др. Суть этих микробов отражена в названии группы: «условно-патогенные». В норме они не вызывают нарушений. Многие из них даже могут быть в определенной степени полезны организму. Но при превышении нормы и/или неэффективности иммунной защиты они могут стать причиной серьезных заболеваний. Конкурируя с полезными бактериями, условно-патогенная флора может войти в состав микробной пленки кишечника и стать причиной функциональных нарушений, воспалительных и аллергических заболеваний.
Возможно попадание условно-патогенной флоры через кишечную стенку в кровь и распространение ее по организму (транслокация), что особенно опасно для детей раннего возраста и лиц с выраженными иммунодефицитами, у которых эти микроорганизмы могут вызвать различные заболевания, в том числе, опасные для жизни.
Пояснения к таблице
Аббревиатура «abs» напротив названия бактерии означает, что данный микроорганизм не был обнаружен в пределах нормы и выше ее, а значения ниже нормы (субнормальные), как несущественные, не смотрели.
Бифидобактерии
Дефицит бифидобактерий приводит к росту интоксикации, нарушению процессов углеводного обмена, всасывания и усвоения в кишечнике витаминов, кальция, железа и других микро- и макроэлементов. Без биопленки из бифидобактерий меняется структура и нарушаются функции слизистой оболочки кишечника, уменьшается количество иммунных клеток и их активность, повышается проницаемость кишечника для чужеродных агентов (токсинов, вредоносных микробов и др.). В результате значительно увеличивается токсическая нагрузка на печень и почки, повышается риск развития инфекций и воспалений, авитаминозов и различных микроэлементозов.
Лактобактерии
Бактероиды
Энтерококки
Фузобактерии
Эубактерии (лат. Eubacterium)
Примерно половина видов эубактерий, обитающих в организме человека, могут участвовать в развитии воспаления ротовой полости, формировании гнойных процессов в плевре и легких, инфекционного эндокардита, артрита, инфекций мочеполовой системы, бактериального вагиноза, сепсиса, абсцессов мозга и прямой кишки, послеоперационных осложнений.
Повышенное содержание эубактерий обнаруживается в фекалиях больных полипозом толстой кишки. Эубактерии редко встречаются у детей, находящихся на грудном вскармливании, но у детей, находящихся на искусственном вскармливании могут выявляться в количестве, соответствующем норме взрослого человека.
Пептострептококки
В комплексе с другой условно-патогенной флорой клостридии могут вызывать разжижение стула, понос, повышенное газообразование, которое наряду с тухлым запахом кала (симптомы гнилостной диспепсии) является косвенным признаком повышенной численности и активности этих бактерий. В определенных условиях они могут быть причиной некротического энтерита, вызывать пищевую токсикоинфекцию, сопровождающуюся водянистой диареей, тошнотой, коликами в животе, иногда лихорадкой.
При приеме некоторых антибиотиков клостридии могут вызывать антибиотикоассоциированную диарею или псевдомембранозный колит. Кроме проблем с кишечником, клостридии могут вызывать заболевания мочеполовых органов человека, в частности, острый простатит. Симптомы воспаления, спровоцированного клостридиями во влагалище, имеют сходство с симптомами кандидозного вагинита («молочницы»).
E.coli типичные (эшехирии, кишечная палочка типичные), т. е. с нормальной ферментативной активностью
Условно-патогенные микроорганизмы, которые вместе с бифидо- и лактобактериями относятся к группе защитной микрофлоры кишечника. Эта палочка препятствует заселению кишечной стенки чужеродными микроорганизмами, создает комфортные условия для других важных бактерий кишечника, например, поглощает кислород, являющийся ядом для бифидобактерий. Это главная «фабрика витаминов» в организме.
Кишечная палочка со сниженной ферментативной активностью (E.coli лактозонегативные).
E.coli гемолитическая (гемолитическая кишечная палочка)
Патогенный вариант кишечной палочки. В норме должна отсутствовать. Ее присутствие требует иммунокоррекции. Может вызывать аллергические реакции и различные кишечные проблемы, особенно у маленьких детей и лиц с ослабленным иммунитетом. Часто образует патогенные ассоциации с золотистым стафилококком, но в отличие от него практически не встречается в составе грудного молока.
Другие условно-патогенные энтеробактерии
(протеи, серрации, энеробактеры, клебсиеллы, хафнии, цитробактеры, морганеллы и др.) Большая группа лактозонегативных энтеробактерий большей или меньшей степени патогенности. Допустимое количество этих микроорганизмов менее 10 4 КОЕ/г. Большее количество этих бактерий является признаком дисбактериоза. Значительное превышение нормы (более 10 6 ) может приводить к воспалительным заболеваниям кишечника (проявляются нарушениями стула, болями), урогенитальной сферы и даже ЛОР-органов, особенно у детей раннего возраста и лиц с пониженным иммунитетом.
Наиболее неприятные бактерии данной группы:
Стафилококк золотистый (S. aureus)
Один из наиболее неприятных представителей условно-патогенной флоры. В норме должен отсутствовать, особенно у детей. Для взрослых допустимо содержание 10 3 КОЕ/г.
Даже небольшие количества золотистого стафилококка могут вызвать выраженные клинические проявления (аллергические реакции, гнойничковые кожные высыпания, дисфункции кишечника), особенно у детей первых месяцев жизни. Кроме кишечника и кожных покровов, стафилококки в немалых количествах живут на слизистых оболочках носа и могут вызывать воспалительные заболевания носоглотки, отиты.
Стафилококки сапрофитный, эпидермальный (S. epidermidis, S. saprophyticus)
Относится к условно-патогенной микрофлоре. При превышении нормальных значений (10 4 КОЕ/г или 25% от общего количества кокков) эти стафилококки способны вызывать определенные нарушения. Как правило, они выступают в роли вторичной инфекции. Кроме кишечника живут в верхних слоях кожи, на слизистых оболочках рта, носа и наружного уха. Патогенность микроорганизма усиливается при значительном снижении защитных сил организма, при длительных хронических заболеваниях, стрессах, переохлаждении, иммунодефицитных состояниях.
Неферментирующие бактерии (в некоторых бланках обозначены как «Прочие микроорганизмы»)