Кумулятивный эффект что это в медицине
Кумулятивный риск: что это, и как он оценивается?
Понятие кумулятивный риск означает вероятность развития какого-либо вредного эффекта в результате комбинированного воздействия нескольких агентов-стрессоров. В самом определении данного понятия заключено несколько важных моментов. Во-первых, кумулятивный риск всегда включает оценку воздействия нескольких агентов-стрессоров. И если ранее данное понятие относилось лишь к определению влияния химических стрессоров, то сегодня агентами, способными оказывать неблагоприятное воздействие, степень которого оценивается при помощи кумулятивного риска, могут быть химические, биологические, физические агенты или какие-либо активности, прямо или косвенно влияющие на организм. Далее, важным является именно комбинированная оценка, что подразумевает не только суммирование воздействия различных факторов, но и учет их взаимодействия друг с другом.
Понятие кумулятивного риска было разработано Агенством по охране окружающей среды США (U.S. Environmental Protection Agency) в 1980-1990-е годы. Толчком к этому послужил переход от поиска связи между одним агентом-стрессором и связанными с ним последствиями к популяционной стратегии, когда в комплексе оцениваются различные факторы, одновременно действующие на популяцию/человека. Далее разрабатывались рекомендательные документы, описывающие методологию оценки кумулятивного риска. Последний из таких документов был выпущен Агенством по охране окружающей среды США в 2003 году.
Так, оценка кумулятивного риска включает три последовательных этапа:
Планирование, поисковый анализ и формулирование проблемы. На этом этапе происходит оценка известных к этому моменту данных, определение цели анализа, подходов и ресурсов, которые будут использованы, в том числе разработка четких методов статистических моделей анализа, а также предварительное заключение об их возможных ограничениях.
Далее следует непосредственно сам анализ данных. Здесь следует отметить, что кумулятивным считается риск не только одновременно действующих и взаимодействующих между собой агентов-стрессоров, но и риск, возникающий при последовательном действии изучаемых факторов. На этапе анализа данных в соответствии с выбранными моделями, факторами риска и популяцией формируются основные количественные показатели оценки кумулятивного риска.
И, наконец, заключительным этапом оценки кумулятивного риска является интерпретация полученных данных, определение степени их достоверности и значимости для дальнейших исследований или практической деятельности. Важным этапом этой части является подробное обсуждение ограничений и неопределенностей, возникших в ходе выполненного анализа. На этом этапе возможно обсуждение вклада отдельных агентов-стрессоров в общий показатель кумулятивного риска, однако важно, что все эти заключения будут носить предварительный поисковый анализ, требующий проверки в последующих исследованиях.
Кумулятивный эффект что это в медицине
Первый МГМУ им. И.М. Сеченова
ФГБУН «Центр теоретических проблем физико-химической фармакологии Российской академии наук», Москва, Россия, 119991
Алгоритм нисходящих доз ретиноидов в терапии акне, резистентных к стандартным методам лечения
Журнал: Клиническая дерматология и венерология. 2016;15(2): 72-76
Сакания Л. Р., Плтева К. Т., Корсунская И. М. Алгоритм нисходящих доз ретиноидов в терапии акне, резистентных к стандартным методам лечения. Клиническая дерматология и венерология. 2016;15(2):72-76.
Sakaniia L R, Plteva K T, Korsunskaia I M. Using algorithm of descending doses of retinoids in treatment of acne resistant to standard therapies. Klinicheskaya Dermatologiya i Venerologiya. 2016;15(2):72-76.
https://doi.org/10.17116/klinderma201615272-76
Первый МГМУ им. И.М. Сеченова
В работе приведен обзор и собственные наблюдения авторов по применению изотретиноина в различных дозах для терапии тяжелых и торпидных к терапии форм акне. Подчеркнута особая роль информированности пациентов и врачей смежных специальностей о ретиноидах для адекватного подхода к терапии. Описаны различные алгоритмы назначения изотретиноина, приведены рекомендации отечественных и зарубежных специалистов. Полученные собственные результаты свидетельствуют о возможности длительного применения изотретиноина по ступенчатой схеме снижения доз, что позволяет избежать негативных эффектов от проводимой терапии и увеличить срок ремиссии.
Первый МГМУ им. И.М. Сеченова
ФГБУН «Центр теоретических проблем физико-химической фармакологии Российской академии наук», Москва, Россия, 119991
Огромное количество как зарубежных, так и отечественных публикаций посвящены терапии акне. Однако, как показала экспертиза качества медицинской помощи пациентам с акне, проведенная в Санкт-Петербурге в 2013 г., доля случаев оказания медицинской помощи надлежащего качества пациентам с акне составляла 49%. В структуре ошибок оказания медицинской помощи преобладали ошибки лечения и диагноза. Ошибки лечения были представлены преимущественно неверным сочетанием препаратов, наиболее часто одномоментным назначением антибактериальных препаратов для наружного и системного применения, поздним назначением комедонолитической терапии, а также применением патогенетически необоснованной терапии. Ошибками постановки диагноза считали отсутствие указаний на форму и/или степень тяжести акне, наиболее важными ошибками сбора информации — отсутствие обследования женщин у гинеколога для решения вопроса о необходимости применения комбинированных оральных контрацептивов, в том числе и при назначении изотретиноина [1].
Необходимо также отметить и не всегда адекватное отношение пациентов к лечению, назначенному врачом, что выражается в боязни системной терапии после прочтения отзывов в средствах массовой информации.
Так, один наш пациент с тяжелой формой акне отказался от приема изотретиноина, поскольку его жена необоснованно опасалась риска для ребенка при будущей беременности, обосновывая это тем, что в аннотации к препарату был указан возможный тератогенный эффект. По совету гинеколога они решили не проводить лечение мужа. Этот пример говорит о низкой информированности некоторых смежных специалистов о системных ретиноидах.
Тяжелые формы акне, а также склонность заболевания к рецидивирующему течению, как правило, обусловлены генетически. В этой связи традиционная терапия антибиотиками, топическими средствами, а также различные косметические воздействия не позволяют добиться стойкого терапевтического результата. Нередко применение топических средств (местно действующие ретиноиды и антибиотики, азелаиновая кислота, комбинированные препараты) оказывается весьма эффективным непосредственно в процессе лечения больных. Однако частые рецидивы заболевания на фоне стандартной терапии не только способствуют формированию постакне, но и оказывают неблагоприятное психологическое воздействие на пациентов подросткового возраста, приводят к формированию дисморфофобии, депрессии, а в ряде случаев — суицидальным мыслям.
Системные ретиноиды являются эффективными терапевтическими средствами при тяжелых формах акне, при неэффективности антибактериальных препаратов, при формировании гипертрофических и келоидных рубцов [2—5].
Доказано, что многообразные биологические эффекты ретиноидов являются результатом их сильного влияния на транскрипцию ДНК. Молекула изотретиноина является пролекарством, клиническая эффективность которого объясняется его внутриклеточной изомеризацией в две основные молекулы — транс-ретиноевую кислоту и 9-цис-ретиноевую кислоту, которые затем окисляются до самого активного метаболита 4-оксо-13-цис-ретиноевой кислоты и самого стабильного 4-окси-9-цис-ретиноевой кислоты [6]. Выраженный себостатический эффект (снижение секреции кожного сала и уменьшение размера сальных желез в 10 раз за 12 нед терапии) является результатом воздействия 4-оксо-9-цис-ретиноевой кислоты на рецепторы α-RXR себоцитов и влияет на процессы дифференцировки и кератинизации корнеоцитов протока сально-волосяного фолликула, что сопровождается уменьшением размера и количества комедонов [6—8]. Подавляя продукцию провоспалительных цитокинов и лейкотриена В4, препарат также оказывает выраженное влияние на воспалительные элементы при акне.
С начала 1990-х годов прошлого века дерматологи во всем мире стали активно использовать изотретиноин при умеренно выраженных и даже легких формах акне; акне, резистентных к стандартным методам лечения, а также при наличии у пациента склонности к образованию рубцов, что является косвенным подтверждением того, что зачастую польза, получаемая от применения препарата, значительно выше возможного риска побочных эффектов [9, 10].
Руководствуясь мнениями ряда дерматологов [12, 13], мы считаем, что применение системного изотретиноина в режиме стандартных доз показано при следующий состояниях:
а) тяжелое узловато-кистозное акне;
б) улучшение состояния менее чем на 50% после 6 мес стандартной терапии антибиотиками и наружными средствами;
в) акне с осложнениями в форме рубцов;
г) акне с сопутствующими психологическими расстройствами;
е) рецидивирующее акне.
При этом оптимальной является суточная доза 0,5—0,75 мг/кг, обеспечивающая более быстрый терапевтический эффект при минимальном побочном действии [11, 12, 14]. Длительность лечения стандартными дозами изотретиноина устанавливают индивидуально, но, как правило, она составляет 5—8 мес при условии достижения суммарной курсовой дозы [11].
По мнению ряда зарубежных и российских дерматологов [15, 16], для минимизации проявлений ретиноидного дерматита оптимальна ступенчатая методика повышения изначально минимальной дозы (0,2—0,3 мг/кг) до предполагаемых значений. Корректировать дозу рекомендуют через 3—5 нед после начала терапии в зависимости от эффекта и переносимости препарата. Спустя несколько месяцев при условии достижения стойкого положительного терапевтического эффекта суточная доза может быть адаптирована до поддерживающей (0,1—0,3 мг/кг).
Некоторые дерматологи в России [15] используют другие схемы лечения, начиная терапию со стандартных доз изотретиноина (0,35—0,8 мг/кг в сутки) на протяжении 1—2 мес, после чего, при достижении положительной динамики в клинической картине заболевания, суточную дозу постепенно снижают до 0,2—0,4 мг/кг в сутки, при этом общая длительность курса терапии составляет 8—11 мес.
Мнения специалистов о допустимых сроках лечения и необходимости пролонгации терапии расходятся. Ряд авторов [17] считают, что максимальный период приема системного изотретиноина не должен превышать 8 мес, другие назначают его на срок 1—3 года при условии отсутствия значительных отклонений в соматическом и психологическом состоянии здоровья пациентов. При более длительном лечении (1—3 года) 720 больных и последующем наблюдении от 2—12 лет было показано, что изотретиноин является безопасным препаратом, который не дает каких-либо серьезных побочных эффектов.
Остается неоспоримым тот факт, что именно от достижения курсовой дозы зависят устойчивость результатов лечения и отсутствие рецидивов, а отнюдь не от длительности терапии. Причем кумулятивная доза может быть получена либо более коротким курсом терапии, либо более длительным с меньшими значениями суточной дозы [12, 16, 18].
Результаты исследования, проведенного А.Л. Бакулевым и соавт. [26], показали, что различные (высокие и малые) терапевтические дозы системного изотретиноина были одинаково эффективны в лечении пациентов с тяжелыми формами акне. Значение имела только длительность курса терапии с учетом кумулятивной дозы препарата. Однако небольшие дозы, назначаемые длительно, позволяли избежать выраженных нежелательных эффектов применения ретиноидов.
В последнее время в литературе все чаще появляются исследования применения изотретиноина в режиме низких доз, при котором, во-первых, используют дозы ниже 0,5 мг/кг в сутки, во-вторых — отсутствует подсчет курсовой дозы препарата. При данном методе критерием излечения служат удовлетворительная клиническая картина и отсутствие новых высыпаний в течение 1—2 мес после снижения дозы препарата.
Согласно экспериментальным данным других зарубежных дерматологов, применение системного изотретиноина приводит к уменьшению экскретируемого себума до 75% при дневной дозе 0,1 мг/кг и до 90% при дневной дозе 0,3—0,5 мг/кг уже после 4—8 нед применения [19, 20]. Ни один из известных препаратов для лечения акне не дает подобного выраженного терапевтического эффекта. Ремиссия после отмены системного изотретиноина сохраняется в течение многих месяцев и даже лет, при этом продолжительность антисеборейного эффекта является дозозависимой [21].
Существуют данные об одновременном назначении препаратов системного изотретиноина и местных препаратов для лечения акне. Согласно результатам работы K. Sardana и соавт. [22], эффективность использования изотретиноина через день в сочетании с топическим клиндамицином оказалась равной 87%. Препараты клиндамицина, эритромицина используют для уменьшения воспалительных элементов в первые месяцы терапии, также они могут применяться как поддерживающая терапия после окончания лечения системным изотретиноином.
Наружные ретиноиды также могут быть рекомендованы в качестве поддерживающей терапии после завершения курса приема системного изотретиноина [23].
В 2010 г. Экспертный совет Российского общества дерматовенерологов счел целесообразным рекомендовать практическим врачам новую стратегию ведения пациентов со среднетяжелыми формами заболевания на основе использования режима «малых доз» изотретиноина [24, 25]. Прежде всего данная стратегия направлена на ведение пациентов, страдающих рецидивирующими акне средней степени тяжести, у которых наблюдался неплохой терапевтический результат от применения топических средств, но процесс возобновлялся вновь после отмены топической терапии. В таких случаях инициальная доза препарата должна рассчитываться либо в интервале 0,1— 0,15— 0,3 мг/кг/сут в перманентном (ежедневно) или интермиттирующем (через день) режимах приема, либо назначаться в стандартной дозе 10 мг (8 мг) в сутки независимо от массы тела с последующим ступенчатым снижением (через 1 мес — до 5 раз в неделю; еще через 1 мес — до 3 раз в неделю, еще через 1 мес — до 2 раз в неделю; еще через 1 мес — до 1 раза в неделю). Продолжительность лечения изотретиноином по схеме «малых доз» в среднем не должна превышать 3—6 мес. С практической точки зрения, важным преимуществом данной методики использования изотретиноина является отсутствие необходимости расчета суммарной курсовой дозы лекарственного препарата.
Однако учитывая наш опыт в течение последних 5 лет, мы считаем целесообразным начинать терапию ретиноидами с дозы 0,5—0,6 мг/кг массы тела пациента 1—2 раза в сутки с контролем биохимических анализов крови раз в 1 мес. В качестве препарата выбора чаще назначаем Акнекутан, так как он лучше переносится пациентами, суточная доза препарата ниже, а клинический эффект выражен заметнее, чем у аналогов (рис. 1, 2).


Согласно инструкции к препарату, стандартные схемы лечения акне предполагают назначение 0,4—0,8 мг/кг Акнекутана в сутки в зависимости от тяжести заболевания, при этом достижение суммарной кумулятивной дозы в 100—120 мг/кг обеспечивает стойкий терапевтический эффект [27].
При достижении заметных улучшений (отсутствие узелковых и пустулезных элементов) мы начинаем постепенное снижение суточной дозы на 8 мг/сут. Как правило, такие изменения в терапии наблюдаются через 2—3 мес от начала приема препарата (рис. 2). В дальнейшем продолжаем снижение суточной дозы до достижения приема 8 мг/сут (см. рис. 3). Достижение этой дозы наступает в среднем через 8—10 мес от начала терапии. Постепенное снижение дозы препарата позволяет избежать нежелательных изменений со стороны гепатобилиарной системы. При наборе суммарной дозы 100—120 мг/кг следует перейти на прием препарата 1—2 раза в неделю, сочетая его с топическими препаратами адапалена на 1—2 мес до полной отмены Акнекутана.

Применение системных ретиноидов даже в небольших суточных дозах необходимо сочетать с назначением топических увлажняющих средств.
Отдаленные результаты терапии 96 пациентов показали, что у большинства из них ремиссия сохраняется свыше 1 года. Появившиеся единичные комедоны или папулы легко нивелируются применением топических ретиноидов или даже лечебной косметики с анти-акне эффектом.
Выводы
Назначение препаратов системного изотретиноина (Акнекутан) в стандартных дозировках, с постепенным ступенчатым снижением дозы дает выраженный клинический эффект и позволяет избежать негативных явлений при проведении длительной терапии. Достижение курсовой кумулятивной дозы изотретиноина в 100—120 мг/кг обеспечивает длительную ремиссию заболевания.
Кумулятивный эффект что это в медицине
Данная обзорная статья посвящена основным характеристикам широко применяемого в медицине цитостатического препарата – циклофосфана (ЦФ). Несмотря на то, что прошло более 60 лет с момента открытия ЦФ, данный препарат не утратил своей актуальности. Он до сих пор используется в составе различных комбинаций препаратов, применяемых для лечения злокачественных новобразований [1, 13, 24, 25, 34, 38]. Велико его значение и в теоретическом плане при разработке моделей индуцированной иммуносупрессии в эксперименте с целью понимания процессов формирования вторичных иммунодефицитов и методов их иммунокорреции [3, 14, 18, 19, 20, 21, 23, 33, 40].
Лекарственное лечение злокачественных новобразований – химиотерапия
Химиотерапия является одним из способов воздействия на злокачественные новообразования наряду с оперативным вмешательством и лучевой терапией [26]. В химиотерапии могут применяться алкилирующие средства, антиметаболиты, антибиотики а также препараты растительного происхождения [36].
Лекарственная терапия может быть:
Первичную (или индуктивную) химиотерапию применяют при местно распространённом неоперабельном опухолевом процессе.
Неоадъювантную терапию проводят при операбельных опухолях до выполнения оперативного вмешательства. Адъювантное лечение используют после оперативного вмешательства (в том числе циторедуктивного) при отсутствии клинических проявлений отдалённых метастазов. Цель адъювантной терапии – снижение частоты системных рецидивов заболевания путём уничтоженияотдалённых микрометастазов. Паллиативную химиотерапию осуществляют при наличии отдалённых метастазов [11].
Общие сведения о цитостатических препаратах
Цитостатические препараты (цитостатики) – группа противоопухолевых лекарственных веществ, которые задерживают развитие перерожденных клеток злокачественных опухолей (рак и др.) и форменных элементов крови (лейкозы и др.) [27].
Под действием цитостатиков поражаются преимущественно клетки, обладающие высоким митотическим индексом, либо клетки, биохимические процессы которых в наибольшей степени подвергаются дестабилизации [28]. Примерами цитостатиков могут служить доксорубицин, фторурацил, циклофосфан.
Циклофосфан или циклофосфамид – производное азотистого иприта (горчичного газа), использовавшегося как боевое отравляющее вещество в годы Первой мировой войны. Помимо противоопухолевого воздействия, на которое делается акцент в данной статье, препарат используют как иммунодепрессант для профилактики отторжения трансплантанта и при аутоиммунных процессах [37].
Данный препарат разработан в 1957 году, после открытия в 40-х годах цитостатического действия бис-(B-хлорэтил) аминов (ипритов), которое привело со временем к созданию большого количества препаратов разной направленности, эффективных в онкологии [16]. Несмотря на то, что со времени открытия препарата прошло около 60 лет, он не потерял своей актуальности и до сих пор широко используется в клинической практике.
Циклофосфан относится к группе алкилирующих соединений, а конкретнее – к хлорэтиламинам. По физическим свойствам ЦФ представляет собой белый кристаллический порошок, растворимый в воде (1:50), легко растворяющийся в спирте, трудно – в изотоническом растворе хлорида натрия [17].
Получают препарат путём конденсации дихлорангидрида амидофосфорной кислоты с 3-амино-1-пропанолом в присутствии триэтиламина в растворе этилацетата с последующей обработкой продукта конденсации водой [29].
Противоопухолевое действие ЦФ реализуется непосредственно в клетках опухоли, где циклофосфамид биотрансформируется с образованием активного метаболита, обладающего алкилирующим действием [39].
Циклофосфан хорошо всасывается из желудочно-кишечного тракта, максимальная концентрация в крови его достигается через 1 час, связь с белком минимальная. Он может накапливаться в почках, печени, селезёнке. Выводится из организма в неизменённом виде (20% введённой дозы) и в виде активных и неактивных метаболитов. Период полувыведения составляет 7 часов [12].
В экспериментах на животных показано, что однократное введение ЦФ сразу повышает концентрации реактивных метаболитов ЦФ в плазме крови, которые достигают максимума через 10 минут после введения препарата и снижаются до нуля через 3 часа [15]. Максимум концентрации реактивных метаболитов наблюдается через 15 мин после двукратного введения ЦФ. Максимальная концентрация реактивных метаболитов при двукратном введении ЦФ была меньше, чем при однократном. Это связано с тем, что изначально ЦФ не обладает ни цитотоксической, ни алкилирующей активностью. Для появления реактивных метаболитов ЦФ нуждается в метаболической активации монооксигеназами печени. Однако при образовании реактивных метаболитов ЦФ они повреждают гепатоциты (в которых находятся монооксигеназы), и активность ферментных систем клеток печени снижается. Полное исчезновение реактивных метаболитов ЦФ в плазме крови экспериментальных мышей наблюдалось через 5 часов при любом режиме введения цитостатика.
Таким образом, изучение фармакокинетики реактивных метаболитов ЦФ показывает, что препарат быстро метаболизируется в печени и обладает выраженным кумулятивным эффектом. Установлено изменение фармакокинетики циклофосфана, снижение уровня его реактивных метаболитов и расширение пика их максимальной концентрации. Трёхкратное введение ЦФ оказывает общетоксическое действие, но не приводит к гибели животных. Продолжительность нарушений позволяет использовать данные режимы для создания модели индуцированной иммуносупрессии [15].
Механизм действия циклофосфана
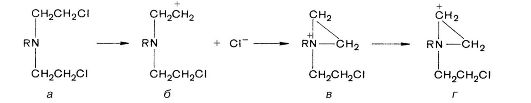
ЦФ относится к хлорэтиламинам, которые в растворах и биологических жидкостях отщепляют ионы хлора. При этом образуется электрофильный карбониевый ион (б), который переходит в этиленимоний (в). Последний также образует функционально активный карбониевый ион (г), взаимодействующий, согласно имеющимся представлениям, с нуклеофильными структурами ДНК (с гуанином, фосфатными, аминосульфгидрильными группами и др.). Таким образом происходит алкилирование субстрата.
Рис. 1 Метаболиты циклофосфана
Взаимодействие алкилирующих веществ с ДНК, в том числе поперечное связывание молекул ДНК, нарушает ее стабильность, вязкость и впоследствии целостность. Все это приводит к резкому угнетению жизнедеятельности клеток и изменению их функциональных свойств [8, 40, 42]. Их способность к делению подавляется, многие клетки гибнут путём апоптоза [24, 35, 36].
Применение циклофосфана в медицине
Циклофосфан широко используется в современной медицине, как средство, тормозящее развитие злокачественных новообразований [1].
Использование циклофосфана при лечении рака легких
Химиотерапию рака легкого назначают при невозможности хирургического вмешательства и лучевой терапии или ее неэффективности, отдаленных метастазах, метастатическом плеврите. Эффективность химиотерапии определяется гистологической структурой опухоли. Циклофосфан может применяться в качестве противоопухолевого препарата в случаях и немелкоклеточного, и мелкоклеточного рака лёгких [2].
Использование циклофосфана при лечении рака шейки матки
С начала 1970-х гг. интенсивно изучаются возможности внедрения в клиническую практику химиотерапевтического лечения и его сочетания с лучевой терапией и/или хирургическим лечением. В первую очередь этому способствовали результаты исследований, которые показали, что цитостатики усиливают лучевое повреждение опухолевых клеток за счёт нарушения механизмов репарации ДНК и способны девитализировать злокачественные клетки, которые резистентны к лучевой терапии. Кроме того, в других исследованиях было показано, что рак шейки матки наиболее чувствителен к цитостатикам перед лучевой терапией или операцией. В связи с этим уменьшение опухолевой массы с помощью использования химиотерапии приводит к увеличению эффективности лучевой терапии.
Согласно недавнему исследованию, которому подвергли 50 препаратов, было выяснено, что применение циклофосфана имеет 15% эффективность (процент означает количество пациенток, у которых наступила ремиссия), что является низкой эффективностью по сравнению с использованием других препаратов. В связи с этим в лечении злокачественных образований шейки матки ЦФ используется не очень часто [9].
Использование циклофосфана при лечении рака молочной железы
Лечебная химиотерапия рака молочной железы проводится в случае генерализованного рака молочной железы (при наличии отдаленных метастазов). Целью этого вида химиотерапии является уменьшение размеров метастатических опухолей [30].
В настоящее время используются следующие схемы лечения рака молочной железы: CMF (Циклофосфан, Метотрексат, Фторурацил), FAC (Фторурацил, Адриабластин, Циклофосфан), CAF (Циклофосфан, Адриабластин, Фторурацил). Таким образом, циклофосфан присутствует в каждой из схем лечения [31].
Побочные эффекты действия циклофосфана
Следует иметь в виду наличие побочных эффектов действия циклофосфана при его применении в терапии злокачественных новообразований. Кроме нарушения роста волос, типичного для химиотерапии, существуют другие изменения связанные с использованием циклофосффана
Все препараты алкилирующей группы характеризуются местно раздражающим действием, воздействуют на ЖКТ, гемопоэз, иногда проявляют нефро- и нейротоксичность. Некоторые препараты мутагенны, в частности, и циклофосфан [25]. Он является сильным канцерогеном в экспериментах на животных. У некоторых пациентов ЦФ вызывал развитие миелокарцином. Описан случай развития карциномы почечной лоханки у пациента, длительное время получавшего циклофосфан [32]. Необходимо помнить об инфекционных заболеваниях, возникающих у пациентов в результате подавления иммунитета, связанного с иммуносупрессирующим действием циклофосфана [45].
В исследовании, проведенном с целью оценки побочных эффектов, возникающих у пациентов, которые проходили курс лечения циклофосфаном, было установлено следующее: из 168 пациентов у 68 наблюдались побочные эффекты со стороны жеудочно-кишечного тракта (понос, рвота), потеря волос отмечена в 38-ми случаях. Кроме того зарегистрировано 58 случаев возникновения инфекций. Также были выявлены единичные случаи аменореи у женщин [43].
Следует обратить внимание на исследование побочных действий циклофосфана в экспериментах на животных [10, 15, 20, 21, 22, 23, 40, 42]. Например, при изучении морфологических изменений в печени крыс с продвинутой стадией развития карциносаркомы на фоне противоопухолевой терапии выявлено, что в печени животных спустя 14 дней после однократного введения циклофосфана наблюдаются дистрофические и некробиотические изменения, связанные с возросшей функциональной нагрузкой на орган [22]. Однако в работе отмечено также, что противоопухолевый эффект циклофосфана обеспечивает снижение степени влияния интоксикации, что выражается в уменьшении застойных явлений в сосудистом русле печени и активации иммунных реакций.
Проведённые исследования показали, что однократное введение ЦФ не влияет на массу тела животных по сравнению с контрольной группой (21,7±2,1). На третьи сутки после двукратного введения ЦФ масса мышей составляла 19,8±1,7 г. Статистически значимое уменьшение массы тела наблюдалось на третьи (до 17,9±1,1 г) и шестые (до 18,7±1,1 г) сутки после трёхкратного введения цитостатика. К двенадцатым суткам при данном режиме введения ЦФ масса тела животных составляла 20,1±1,3 г. Общетоксическое действие ЦФ проявляется в изменении числа лейкоцитов периферической крови. На 3 – 5-й день после введения ЦФ формируется выраженная лейкопения. При двукратном введении ЦФ лейкопения наблюдалась с 3 по 8-й день, а при трёхкратном введении ЦФ возникает стойкая лейкопения, которая держится более 10 суток [15].
В одном из экспериментальных исследований было выяснено, что введение циклофосфана мышам с карциномой легких приводит к торможению роста опухоли и метастазов, однако сопровождается длительной лейкопенией на протяжении всего периода исследования [23].
Комбинации циклофосфана с различными лекарственными препаратами с целью коррекции его иммуносупрессивного воздействия
Ряд экспериментальных исследований на лабораторных животных показали возможности коррекции супрессивного влияния циклофосфана на иммунную систему [4, 5, 6, 7, 14, 18, 19, 20, 28].
Исследовалось действие ЦФ, введёние которого в определённых дозах мышам линии СВА приводило к значительному уменьшению абсолютного количества лимфоцитов в периферической крови и селезенке, изменению структуры органов иммуногенеза, субпопуляционного состава лимфоцитов и снижению их функциональной активности. В работах установлена возможность коррекции изменений, вызванных циклофосфаном, с помощью отечественного бактериального иммуномодулятора Иммуновак ВП-4, который способен дать быстрый нормализующий эффект [5, 6, 20]. Это может иметь большое значение для предупреждения инфекционных осложнений у онкологических больных с проявлениями индуцированной химиопрепаратами иммуносупрессии. Авторы делают вывод о том, что полученные данные о способности Иммуновак ВП-4 стимулировать противоинфекционный и противоопухолевый иммунитет, представляется целесообразным проведение клинических испытаний этого препарата для профилактики нарушений иммунного статуса у онкологических больных после проведения курсов химиотерапии.
Также отмечена возможность совместного применение циклофосфана и стимфорте – иммуномодулирующего препарата животного происхождения. Стимфорте способен восстанавливать структуру центральных и периферических органов лимфопоэза и иммуногенеза, эффекторные функции клеток врожденного иммунитета, которые могут быть нарушенны при введении цитостатика [4, 7].
Исследователями показано, что циклофосфан в комбинации с потенцированым циклофосфаном увеличивает антиметастатическую активность противоопухолевого агента, снижая таким образом риск возникновения метастазов [28].
При изучении возможности использования ЦФ для лечения меланомы кожи было выяснено, что он оказывает положительный эффект в комбинированной иммунотерапии совместно с вакциной БЦЖ, а также тамоксифеном и индометацином. Такая комбинация обеспечивает эффективность в виде ремиссии в 42% случаев и стабилизации процесса – в 35% [13].
Также, введение мелатонина совместно с циклофосфаном при опухолевом росте стимулирует биосинтетическую функцию эпителия концевых отделов поднижнечелюстной слюнной железы [33].
Исследования, связанные с дальнейшим использованием циклофосфана
Следует отметить, что в настоящее время действие циклофосфана в качестве цитостатического препарата активно исследуется, что свидетельствует о его перспективности и вновь открывающихся возможностях использования в медицине. Исследования направлены на поиск эффективного комбинирования препаратов и методов лечения, а также поиск новых областей применения ЦФ.
Установлено, что комбинированное применение красного света и циклофосфана при фотомодифицированной химиотерапии, например, приводит к увеличению его противоопухолевой эффективности [41].
Выявлено, что ЦФ обладает циторедуцирующим эффектом при обработке трансплантанта Кребс-2 [34]. Недавние исследования объясняют связь между потерей веса у раковых больных и введением им совместно циклофосфана и метотрексата [44]. Также проверена на практике возможность использования ЦФ для лечения острых отторжений, возникающих при трансплантациях почек [46].
Таким образом, циклофосфан является достаточно перспективным препаратом в плане его применения в медицине. Это обусловлено не только широким использованием его в клиничекой практике до настоящего времени, но в большей степени научными исследованиями, повышающими его значимость как для теоретической медицины при разработке экспериментальных моделей индуцированной циклофосфаном иммуносупрессии, так и для открытия новых, в том числе комбинированных вариантов его применения в лечебных целях.