Ксенографт в стоматологии что такое
Остеопластические материалы в хирургической стоматологии
Использование костного материала в стоматологии широко распространено. С его помощью удается выполнять остеопластику – восстанавливать утраченный объем альвеолярного гребня. Это позволяет избежать дальнейшее разрушение костной ткани и появления ряда негативных последствий, которые возникают на фоне изменения внешнего вида и ухудшения здоровья человека. Часто к процедуре прибегают перед установкой имплантатов, когда костной ткани пациента не хватает. Рассмотрим подробнее специфику материалов, позволяющих провести данные мероприятия.
Характеристика костнопластического материала в стоматологии
Остеопластические материалы в хирургической стоматологии должны быть высокого качества, обладать следующими характеристиками:
В настоящее время на рынке представлено множество видов остеопластических материалов. При выборе наиболее подходящего материала надо учитывать все вышеуказанные характеристики. Кроме того, он должен быть готов к незамедлительному использованию, иметь высокие показатели адгезии, чтобы имплантат с его помощью максимально прилегал к кости.
Классификация остеопластических материалов
Остеопластические материалы представляют собой имплантаты, способствующие формированию кости. При этом они обеспечивают локальную остеокондуктивную, остеоиндуктивную или остеогенную активность. В соответствии с происхождением все остеопластические материалы разделяют на четыре основные группы:
Рассмотрим подробнее особенности каждой группы в отдельности.
Аутогенные
Аутогенный костнозамещающий материал в стоматологии используют чаще остальных. Аутокость получают путем забора с донорского внутриротового или внеротового участка с последующей пересадкой в принимающий участок. В ходе ряда клинических исследований было доказано, что он способствует ускоренному замещению послеоперационных и других костных дефектов новообразованной тканью. Он характеризуется пластичностью, не обладает свойствами иммунной несовместимости. При этом финансовые затраты, связанные с его забором, небольшие.
В соответствии с происхождением различают два вида – эндохондрального (хрящевого) и эктомезенхимального (мебранного) происхождения. Среди недостатков можно отметить вероятность инфицирования, травматичность получения аутоматериала и долгую продолжительность самого оперативного вмешательства. Зачастую аутокость применяют в сочетании с иными материалами, к примеру, аллокостью или ксенокостью. Это позволяет избежать усадки аутокости
Аллогенные
Аллогенный костный материал для синус лифтинга в РФ в соответствии с законодательством не применяют. Аллогенные имплантаты представляют собой костнопластические материалы, которые получают из человеческих трупов, в последствие, подвергая специальной обработке. Это может быть кортикальная и губчатая часть подвздошной кости или аллоимплантат деминерализованной лиофилизированной кости. К основным достоинствам данной группы в сравнении с аутоматериалами относятся:
Помимо этических проблем к недостаткам применения данных материалов относят вероятность возможного инфицирования реципиентов ВИЧ-инфекцией и гепатитом.
Ксеногенные
В крайне редких случаях специалисты прибегают к использованию ксеногенного костного материала для имплантации. Он обладают остеокондуктивными свойствами, сохраняет исходную минеральную структуру кости. Ксенокость (природный гидроксиапатит) получают из костной ткани млекопитающих. Структура костей животных идентична кости человека, что позволяет их использовать в стоматологической практике. Ксенокость предварительно подвергают специальной обработке и деантигенизации. Это позволяет устранить из ее состава все факторы, провоцирующие развитие иммунологической и аллергической реакции.
В зависимости от типа обработки различают ксеноматериалы с низкотемпературной обработкой, ксеноматериалы с высокотемпературной обработкой и ксеноматериалы на основе энзимных технологий. Различают два основных метода деантигенизации. Самый эффективный и популярный – термическая обработка при повышенной температуре (около 700-1000 С°), после которой все органические вещества испаряются. Ксенокость не дает усадку. За счет синхронности процессов разрушения и восстановления костной возникает физиологическое замещение искусственных костных гранул натуральной костью, без утраты объема.
Синтетические
Синтетический костный материал выполнен на основе солей кальция. В особо сложных клинических случаях, когда требуется наращивать большие объемы кости в горизонтальном или вертикальном направлении, ксеногенная костная ткань сочетают с аутогенной костью в равных соотношениях. Синтетика является достойной альтернативой ауто-, алло- и ксеноматериалам. По некоторым признакам они превосходят остеопластические материалы натурального происхождения (к примеру, отсутствует необходимость забора костной ткани, исключена вероятность заражения инфекционными патологиями).
Главным недостатком большинства синтетических материалов в сравнении с ауто-, алло- и ксеноматериалами, является отсутствие свойств остеоиндукции (способности вызывать эктопическое формирование костной ткани). В том случае, если в их состав добавить компоненты, которые будут стимулировать регенерацию костной ткани (к примеру, коллагена), они способны приобрести остеоиндуктивные свойства.
Необходимые процедуры перед увеличением костной ткани
После устранения моляра или премоляра на кость больше не оказывается регулярная нагрузка, что со временем приводит к ее атрофии и утрате объема. Наряду с этим появляются воспалительные процессы в пародонтальной ткани. В результате, чем больше дней проходит после утраты моляра или премоляра, тем сильнее кость начинает испытывать дефицит. На этом фоне становится намного сложнее провести имплантацию.
Методика, к которой прибегают для увеличения объема костной ткани, в каждом клиническом случае подбирают в индивидуальном порядке. Для этого врач-стоматолог предварительно оценивает ротовую полость и при необходимости назначает инструментальную диагностику. Зачастую случается, что необходимость в применении другой методики возникает только в период проведения оперативного вмешательства. За счет этого специалист должен быть осведомлен обо всех разновидностях остеопластики и уметь применять их на практике.
Разновидность остеопластики
Ниже представлены основные виды остеопластики, чтобы разобраться, для каких оперативных вмешательств применяют конкретный тип материала:
Увеличить объем костной ткани удается за счет применения материалов синтетического происхождения. К помощи барьерных мембран прибегают с целью фиксации пересаженных костных тканей или предохранении костной ткани человека после того, как ему устранили моляр или премоляр. Для восстановления костной ткани используют аллотрансплантаты. Наиболее распространенными являются аутотрансплантаты.
Операция с остеопластическим материалом в «А-Медик»
Остеопластические операции признаны одними из самых сложных (с технической точки зрения) в области стоматологической хирургии. Чтобы избежать ряда негативных последствий после оперативного вмешательства, выполнять их следует только в проверенных клиниках. Высококвалифицированные специалисты стоматологии «А-Медик» долгие годы специализируются на проведении данных операций. Клиника оснащена современными инструментами, модернизированным оборудованием и необходимым освещением, что гарантирует положительный результат терапии.
Врачи качественно проводят оперативное вмешательство любой сложности с использованием различных остеопластических материалов. Стоимость процедуры значительно ниже, чем в других частных клиниках Москвы. На официальном сайте можно подробнее ознакомиться с прайсом. Чтобы записаться на первичный прием к врачу-стоматологу достаточно позвонить в клинику по указанным номерам или оставить заявку в онлайн режиме (с указанием имени и контактного номера).
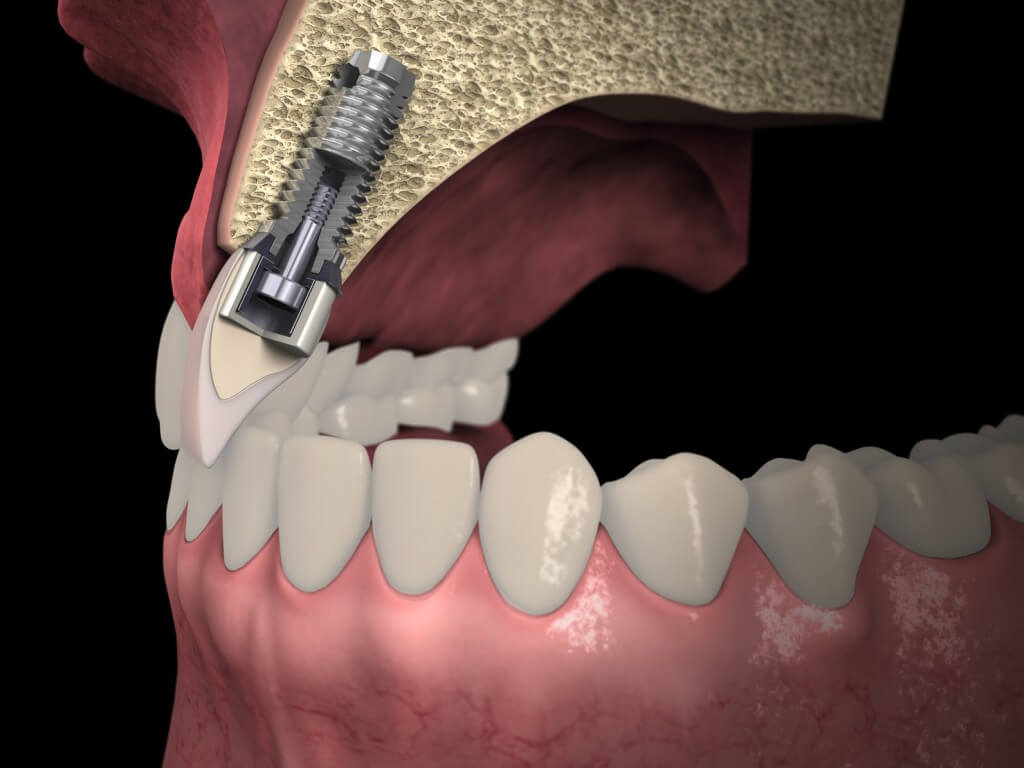
Ксенографт в стоматологии что такое
В клинической практике часто встречается ситуация, когда объем костной ткани недостаточен для идеального размещения дентального имплантата. В этих случаях требуется дополнительная структурная поддержка, которая обеспечивается путем наращивания кости.
Синус-лифтинг и увеличение альвеолярного отростка — это процедуры с высочайшей степенью успеха, которые применяются у 10-20% пациентов, нуждающихся в дентальной имплантации. С 1980-х лечение проводят с помощью различных природных или синтетических костных материалов, ассортимент которых расширяется.
Процедуры регенерации кости становятся все более важными с принятием концепции дентальной имплантации как идеальной опции для стоматологической реабилитации.
Эти процедуры критически важны для успеха дентальной имплантации в случаях, когда существует значительный дефицит костной ткани по высоте или ширине. Краеугольным камнем успешного лечения считают правильный выбор костного материала, чтобы сформировать костную мантию, надежно покрывающую имплантат.
Эффективность костного материала для синус-лифтинга является решающим фактором стабильности дентального имплантата и конечного результата лечения. Для этого материал должен быть остеогенным, остеоиндуктивным, остеокондуктивным и биодеградируемым.
Альвеолярный отросток верхней челюсти имеет компактный кортикальный слой с высокой плотностью и внутреннюю пористую губчатую кость, заполненную костным мозгом.
Кость пронизана цилиндрическими каналами, называемыми гаверсовыми каналами, и содержит кровеносные сосуды, снабжающие ее питательными веществами и кислородом.
Костные клетки включают остеогенные клетки и остеокласты, которые различаются по структуре и функциям. Остеогенные клетки подразделяются на остеопрогениторные клетки, простеобласты, остеобласты и остеоциты. Мезенхимальные клетки сначала превращаются в остеопрогениторные, а затем в клетки-преостеобласты, которые, в свою очередь, трансформируются в клетки-остеобласты.
Остеобласты продуцируют так называемый остеоид — некальцифицированную основу, которая содержит коллагеновый и неколлагеновый белковый костный матрикс. Остеобласты также секретируют несколько цитокинов и костных морфогенетических протеинов (ВМР).
Цитокины и гормоны играют важную роль в регенерации кости. Когда остеобласты перестают продуцировать матрикс, они превращаются в остеоциты и погружаются в кальцинированную кость.
Недостаток объема костной ткани можно лечить с помощью различных методов костной пластики перед установкой имплантата. Boyne и James (1980) были первыми, кто предложил увеличение дна верхнечелюстной пазухи с помощью аутологичного костного трансплантата.
Методика была существенно изменена и улучшена Tatum (1986), который внедрил латеральный доступ путем фенестрации щечной стенки верхнечелюстной пазухи, с подъемом шнейдеровой оболочки. Этот метод был изменен Wood и More в 1988 году.
Процедуру аугментации дна верхнечелюстной пазухи можно разделить на две техники. Первая называется техникой остеотомии и выполняется с применением остеотомов для создания контролируемого разреза дна верхнечелюстной пазухи.
Этот метод создает пространство путем поднятия слизистой оболочки, что обеспечивает достаточно места для дентального имплантата и материала для костной трансплантации.
Преимущество техники заключается в том, что она менее инвазивная и, следовательно, сокращает время операции и снижает риск осложнений. Данную технику рекомендуется использовать, когда вертикальная высота кости превышает 4-6 мм.
Вторая техника — метод бокового окна, который выполняется хирургической подготовкой латеральной к верхнечелюстной пазухе кости. Во время процедуры обнажается шнейдерова оболочка, которая будет приподнята в процессе операции.
Костный материал для синус-лифтинга тщательно укладывают на дно пазухи. Данная техника более инвазивна по сравнению с использованием остеотома из-за фенестрации боковой стенки верхнечелюстной пазухи.
Техника бокового окна предпочтительна, когда остаточная высота кости меньше 6 мм.
Процесс заживления кости
Заживление кости после заполнения костным материалом происходит в два этапа: регенерация с воспалительным ответом и последующее ремоделирование кости.
На первом этапе в поврежденной области образуется сгусток крови, где наружная часть кости становится некротической. Начинают формироваться капилляры, в дальнейшем наблюдается миграция воспалительных клеток — лимфоцитов, гранулоцитов, моноцитов.
Этот процесс сопровождается восстановлением кровотока, и через 1-3 дня активируется воспалительная реакция с образованием грануляционной ткани. Последняя превращается в коллагеновый матрикс, и мезенхимальные стволовые клетки начнут дифференцироваться в клетки остеобластов, образуя новую кость.
Во время второй фазы кость ремоделируется, заменяется более зрелой пластинчатой костью. Полное заживление дефекта происходит, когда вся кость подвергается ремоделированию.
Костные материалы для синус-лифтинга
Идеальный костный материал (графт) должен обладать остеоиндуктивными и остеокондуктивными свойствами, а также способностью интегрироваться с поверхностью имплантата. Данные свойства у современных материалов выражены в различной степени.
Остеоиндуктивные свойства обеспечиваются примитивными, недифференцированными плюрипотентными клетками, которые трансформируются в остеогенные клетки и отвечают за процесс остеогенеза. Остеокондуктивные свойства относятся к способности материала обеспечивать рост кости на его микрорельефной поверхности.
Предполагается, что идеальный костный материал для синус-лифтинга позволяет индуцировать образование новой кости путем капиллярной инфильтрации и обеспечивает поддержку дентальных имплантатов достаточным объемом полноценной костной ткани.
С этой целью в верхнечелюстную пазуху помещают аутологичную кость, аллогенные, ксеногенные и синтетические костные материалы. Рассмотрим эти группы подробнее.
Аутогенный костный материал
Аутогенный материал, или аутографт — костная ткань, полученная и имплантированная обратно одному и тому же человеку. Следовательно, аутографт нужно взять в одной части тела и пересадить в другую, выполнив дополнительное хирургическое вмешательство.
Клеточный компонент губчатого костного графта содержит небольшое количество остеобластов и много клеток-предшественников, которые выживают при трансплантации. Эти клетки-предшественники объясняют высокий остеоогенный потенциал аутографта.
Аутогенный костный материал для синус-лифтинга справедливо считается золотым стандартом, поскольку обладает перечисленными остеоиндуктивными, остеогенными, остеокондуктивными свойствами, а также способностью к остеоинтеграции.
Тем не менее, аутографтам присущи значительные недостатки, которые ограничивают практическое использование. Во-первых, это необходимость выполнения двух вмешательств с соответствующими рисками осложнений и болью. Во-вторых, это ограничение по количеству, форме и размеру получаемых графтов.
Аутогенный костный материал подразделяется на две группы — губчатый и кортикальный.
После трансплантации большинство клеток, присутствующих в губчатом аутографте, погибают в результате ишемии. Мезенхимальные стволовые клетки, присутствующие в костном мозге, устойчивы к ишемии и способны пережить процедуру.
Способность стволовых клеток к выживанию и пролиферации после пагубных изменений в насыщении кислородом, pH и цитокиновой среде является основной причиной надежности вмешательств в области аутотрансплантации губчатой кости.
Инкорпорация губчатой кости происходит быстро, в течение примерно 8 недель.
Кортикальные аутографты — это сегменты компактной кортикальной кости, обеспечивающие остеокондуктивную поддержку при формировании новой костной ткани, однако не предоставляющие существенного числа жизнеспособных остеогенных клеток.
По этой причине реваскуляризация и интеграция кортикальных аутографтов протекает медленно. Основным их преимуществом является механическая поддержка.
Аллогенный костный материал
Аллогенный костный материал, или аллографт, представляет собой ткань, собранную у одного индивидуума и имплантированную другому в пределах того же самого вида.
Использование костной ткани трупного происхождения для получения аллографта рассматривается как более доступная альтернатива аутографтам благодаря сходным биологическим характеристикам.
Несмотря на превосходные свойства аутографта, аллогенный материал обычно предпочитают пациенты, не желающие подвергаться дополнительному хирургическому вмешательству.
Лиофилизированный костный аллотрансплантат (FDBA) и деминерализованный лиофилизированный костный аллотрансплантат (DFDBA) для стоматологического использования получают в специальных банках.
Источником FDBA и DFDBA служит кортикальная костная ткань длинных костей, отличающаяся повышенным содержанием костных морфогенетических протеинов и меньшей антигенной активностью по сравнению с губчатой костью.
Костные аллографты производятся в различных формах и видах, включая порошок, кортикальные чипсы, кубики губчатой кости и кортикальные гранулы.
Гранулированный костный материал производится путем измельчения кортикальной кости в стерильных условиях до получения частиц размером от 250 до 750 микрометров.
В настоящее время доступны разные формы костных блоков для синус-лифтинга, механические свойства которых несколько хуже по сравнению с костными блоками кортикальной аутогенной кости.
После сбора аллотрансплантата его обрабатывают несколькими способами:
физическая обработка для удаления мягких тканей и снижения клеточной нагрузки
ультразвуковая промывка для удаления остатков клеток и крови
обработка этанолом для денатурации белков и дезактивации вирусов
промывка антибиотиками для уничтожения бактерий
стерилизация гамма-излучением и этиленоксидом для устранения спор.
Минерализованный костный матрикс не имеет активных костных морфогенетических протеинов (BMP). Следовательно, ему не хватает остеоиндуктивных свойств, хотя он и обладает остеокондуктивными свойствами.
Инкорпорация качественно похожа на аутотрансплантат, но происходит медленнее.
Кортикальные аллотрансплантаты в конечном итоге напоминают аналог аутотрансплантата, хотя в первых будет присутствовать больше некротизированной костной ткани.
Измельченные костные материалы имеют «открытую» структуру, которая способствует проникновению клеток крови, улучшает инкорпорацию графта и позволяет смешиваться с кровью, концентратами тромбоцитов и другими материалами, образуя композиты.
DFDBA подвергают кислотной деминерализации в 0,5-0,6 молярной соляной кислоте, в результате чего 40% минерального содержимого удаляется, оставляя органический матрикс нетронутым. Технология сохраняет BMP, присутствующие в кости, и, следовательно, поддерживает присущие ей остеоиндуктивные свойства.
Кроме того, коллагеновый матрикс, присутствующий в DFDBA, действует как каркас, который обеспечивает материалу выраженные остеокондуктивные свойства.
Остеоиндуктивность DFDBA была впервые описана Urist и соавт., которые наблюдали образование эндохондральной кости на графте при помещении в мягкие ткани. Тогда же было обнаружено, что костные морфогенетические протеины являются ключевыми факторами, отвечающими за формирование новой кости.
ВМР связаны с органическим матриксом кости и включены в минеральное содержимое, поэтому процесс деминерализации повышает биодоступность. Костные морфогенетические протеины привлекают многочисленные мезенхимальные стволовые клетки и заставляют их дифференцироваться в хондроциты, образующие эндохондральную кость.
Эндохондральное окостенение связано с остеоиндуктивным ответом, в то время как внутримембранное образование кости указывает на остеокондуктивный ответ.
Тем не менее, остеоиндуктивность DFDBA была недавно поставлена под сомнение, поскольку это свойство сильно зависит от технологических процедур.
Основными преимуществами аллотрансплантатов является доступность, отсутствие необходимости получать ткань у пациента, снижение потребности в анестезии (общая анестезия не требуется) и сокращение времени хирургического вмешательства.
Тем не менее, многие специалисты избегают использования трупной кости для трансплантации из-за возможного риска передачи инфекционных заболеваний.
Аллогенные костные материалы доступны в виде гранул и блоков.
Внешний вид гранул аллотрансплантата похож на другие гранулы-заменители кости; они идеально подходят для заполнения костных полостей дефектов альвеолярного отростка и верхнечелюстной пазухи.
С другой стороны, блоки аллогенной кости особенно полезны как при вертикальном, так и при горизонтальном увеличении участков атрофированной кости.
Ксеногенный костный материал
Ксеногенный костный материал для синус-лифтинга получают от организмов других видов, отличных от человека. Одним из наиболее распространенных ксенографтов является чистый скелетный гидроксиапатит (ГАП), или неорганическая бычья кость.
Скелетный гидроксиапатит имеет ультраструктурные особенности аналогичные человеческой кости. Гидроксиапатит проходит специальную обработку с целью удаления любых органических компонентов, поэтому может использоваться в стоматологической практике без риска иммунного ответа со стороны реципиента.
Благодаря многостадийной химической и термической обработке гидроксиапатит практически лишен антигенной активности и не вызывает воспалительного ответа.
Структура неорганической бычьей кости представляет собой систему широких взаимосвязанных пор диаметром 0,25-1 миллиметр, которые могут быть с легкостью пронизаны кровеносными сосудами. Такая структура способствует миграции клеток-остеобластов, обеспечивая скорейший результат лечения.
Бычий гидроксиапатит может на 75% состоять из микропор с общей площадью поверхности до 100 квадратных метров на 1 грамм. Столь высокая пористость костного материала должна создавать оптимальные остеокондуктивные условия для роста кости.
С другой стороны, повышенная пористость ГАП иногда ухудшает механические свойства материала и первоначальную стабильность. Гидроксиапатиту не хватает остеоиндуктивных свойств, а использование гранул может оказаться технически затруднительным.
Более того, бычий гидроксиапатит не является резорбируемым in vivo. ГАП может обнаруживаться в прооперированном участке через 3-6 лет после имплантации, что подтверждает крайне медленную резорбцию.
Согласно Skoglung и соавт., гранулы гидроксиапатита при синус-лифтинге обнаруживаются даже после 44 месяцев после операции. Присутствие нерезорбированных частиц материала внутри новой костной ткани нежелательно, поскольку это может влиять на качество образованной кости и ее ремоделирование.
Хотя скелетный гидроксиапатит обычно используется в форме гранул, существуют блоки ГАП. В целом, ГАП подходит для вертикальной и горизонтальной аугментации альвеолярного отростка верхней челюсти.
Недостатком считается хрупкость материала, что не только усложняет хирургическую процедуру, но и препятствует процессу заживления кости.
Другие разновидности ксеногенных костных блоков (свиной) демонстрируют противоречивые результаты и разные механические свойства.
Ксеногенный костный материал продолжает интенсивно изучаться в контексте стоматологического использования, однако на данный момент в научной литературе существуют значительные пробелы в понимании его поведения in vivo.
Учитывая неограниченные источники и доступность, он остается в центре внимания.
Синтетический фосфат кальция
Биоматериалы на основе синтетического фосфата кальция химически напоминают естественный костный минерал. Кальция фосфат при синус-лифтинге обладает рядом преимуществ, среди который биосовместимость, остеокондуктивность и остеоинтеграция.
Материал содержит высокую концентрацию ионов кальция со щелочной рН, вследствие чего демонстрирует низкую резорбцию, хотя богатые Ca2+ материал с более кислой рН отличаются более высокой резорбцией (дикальций фосфат).
Синтетические фосфаты кальция можно разделить на высокотемпературные (трикальцийфосфатная керамика, гидроксиапатит, бифазный фосфат кальция) и низкотемпературные (так называемые цементы).
Такие костные материалы различаются по скорости резорбции in vivo, прочности, щелочности и кислотности, а также кристаллографической структуре.
Как правило, они являются хрупкими материалами, а потому должны использоваться исключительно в тех зонах, которые не несут высокой механической нагрузки.
Гидроксиапатит (ГАП) и бета-трикальцийфосфат (бета-ТКФ) — это керамика, которая используется в основном для лечения дефектов костей и полостей.
Биологический стехиометрический гидроксиапатит с отношением Ca/P 1,67 очень стабилен, и его очень медленная деградация опосредована фагоцитозом. Такой недостаток устраняется путем введения примесей, таких как ионы карбоната, ионы кремния и другие ионные частицы, присутствующие в костном минерале.
Существует и пористый гидроксиапатит с нативной костной архитектурой и высокой резорбцией, который в значительной мере усиливает тканевую реакцию ангиогенеза и новообразования новой кости.
Открытия в данном направлении привели к созданию апатита и карбоната кальция искусственного происхождения, сохраняющих архитектуру живых источников. Например, органической бычьей кости, кораллового апатита, апатита некоторых морских водорослей.
Бифазный фосфат кальция разработан так, чтобы совмещать в себе преимущества как гидроксиапатита, так и бета-ТКФ. Соотношение 60% гидроксиапатита и 40% бета-ТКФ является наиболее частым среди коммерческих бифазных фосфатов кальция.
Кальций-фосфатные цементы классифицируют в соответствии с конечным продуктом реакции превращения в гидроксиапатитные и брушитные цементы.
Гидроксиапатитный цемент впервые разработан Брауном и его сотрудниками, но с того времени были получены и запатентованы различные составы. К таким составам относится система безводный фосфат тетракальций / дикальцийфосфат (DCPA), а также широко известная система на основе бета-трикальцийфосфата.
Реакция схватывания гидроксиапатитного цемента происходит при нейтральной реакции среды, что является биологически благоприятным свойством.
Гидроксиапатит является низкокристаллическим, а стехиометрия может варьировать для получения гидроксиапатита с меньшим содержанием кальция (отношение Ca/P до 1,67).
Эти особенности и развитие карбонатного апатитного цемента позволяют регулировать биодеградацию гидроксиапатитного цемента.
Со времен создания Mirtchi и соавторами брушитного цемента эти продукты привлекают интерес в качестве заменителя костной ткани. Они бывают разного состава, включая бета-ТКФ + монокальцийфосфат моногидрат (МСРМ) и бета-ТКФ + фосфорная кислота.
Реакция схватывания брушитных цементов представляет собой механизм непрерывного растворения / осаждения при низкой рН, поскольку брушит осаждается при рН Оцените статью