Кровь на гви что это
Вирус простого герпеса 1,2 IgG (кол) в Сортобе
Лабораторное исследование для выявления в сыворотке крови антител IgG к вирусу простого герпеса. Исследование позволяет определить тип вируса, вызвавший заболевание, а также подтвердить предварительный диагноз (герпесвирусная инфекция).
Приём и исследование биоматериала
Когда нужно сдавать анализ Вирус простого герпеса 1,2 IgG (кол)?
Подробное описание исследования
Вирус простого герпеса — распространенная вирусная инфекция, вызываемая вирусом простого герпеса (ВПГ/HSV). Чаще всего протекает в скрытой — латентной, бессимптомной — форме. Появление клинических признаков герпетической инфекции у человека всегда связано с ослаблением иммунной системы организма, и чем сильнее иммунные нарушения, тем тяжелее проявляется заболевание.
Всего насчитывают около двухсот разновидностей вируса, но человека поражает только 8 из них. У каждого из типов имеются свои особенности. Вирусы простого герпеса первого (ВПГ-1 / HSV-1) и второго (ВПГ-2 / HSV-2) типов наиболее изучены. HSV-1, как правило, поражает губы, кожу лица и слизистую оболочку рта. HSV-2 — гениталии.
Заражение вирусом простого герпеса 1-го типа у подавляющего числа людей происходит в раннем детском возрасте, после того как у младенца исчезает пассивный иммунитет, полученный от матери. Основной путь передачи вируса герпеса 1-го типа — контактный или контактно-бытовой. Вирус со слюной передается через плохо вымытые руки, предметы общего пользования.
Заражение вирусом простого герпеса 2-го типа в основном происходит при половом контакте с инфицированным партнером. Также описаны случаи передачи инфекции во время родов, когда новорожденный, проходя через родовые пути, контактирует с вагинальными выделениями, содержащими вирус.
Острая инфекция после заражения может протекать бессимптомно или иметь некоторые клинические проявления.
К характерным клиническим проявлениям острой формы относят формирование маленьких прозрачных пузырьков (везикул) на слизистых оболочках рта или на лице (HSV-1) либо в области гениталий (HSV-2). В месте формирования везикул человек ощущает зуд и жжение.
После первичного заражения вирус простого герпеса остается в клетках центральной нервной системы, где его размножение сдерживает иммунная система, но при ослаблении иммунитета вирус снова поступает в кровь (рецидив, реактивация). Как правило, рецидив инфекции возникает из-за иммунодефицита на фоне:
Для диагностики герпесвирусной инфекции проводят осмотр больного, а также используют лабораторное подтверждение, которое может быть проведено с помощью классических лабораторных методов диагностики — определяют наличие вируса в образцах биоматериала, полученных из везикул. Также используются серологические методы исследования, которые выявляют специфические антитела в сыворотке крови. Определение стадии герпетической инфекции возможно по классам специфических антител — IgМ и IgG.
IgM вырабатываются сразу после инфицирования и служат маркером острого периода заболевания, IgG начинают вырабатываться примерно через 2-4 недели после инфицирования и могут оставаться в крови на протяжении многих месяцев, указывая на хроническую стадию инфицирования.
Данное исследование позволяет выявить реактивацию инфекции, определить тип вируса, вызвавшего заболевание, а также подтвердить предварительный диагноз (герпесвирусная инфекция).
Кровь на гви что это
Т.Н. Савченко (1), В.А. Алешкин (2), Ю.Э. Доброхотова (1), С.С. Афанасьев (2), М.И. Агаева (1)
1) Кафедра акушерства и гинекологии лечебного факультета ФГБОУ ВО «Российский национальный исследовательский медицинский университет им. Н.И. Пирогова» Минздрава России, Москва; 2) Московский научно-исследовательский институт эпидемиологии и микробиологии им. Г.Н. Габричевского Роспотребнадзора, Москва
Герпесвирусы (ГВ) широко распространены в человеческой популяции, они способны поражать практически все органы и системы организма хозяина, вызывая латентную, острую и хроническую формы инфекции. Свыше 90% людей инфицированы одним или несколькими ГВ человека. Особое значение герпесвирусная инфекция (ГВИ) имеет во время беременности [1]. Установлено, что при ГВИ имеет место серьезный риск внутриутробного инфицирования и неблагоприятного исхода беременности: ее следствием являются до 30% спонтанных абортов на ранних и до 50% – на поздних сроках гестации [2].
В настоящее время известно 8 антигенных серотипов семейства Herpesviridae: вирусы простого герпеса 1-го и 2-го типов (ВПГ-1 и ВПГ-2); Herpesvirus varicellae – возбудитель ветряной оспы и опоясывающего герпеса; цитомегаловирус (ЦМВ); вирус Эпштейна–Барр (ВЭБ); ГВ 6– 8-го типов. Все ГВ способны к пожизненной персистенции в организме человека и обладают выраженными иммуносупрессорным и онкогенным эффектами.
Изучение цитокинового статуса у беременных с различным течением ГВИ очень важно в практическом плане, будет способствовать пониманию патогенеза ГВИ в современных условиях, позволит оптимизировать методы диагностики и терапии беременных, инфицированных ГВ, а также способы прегравидарной подготовки.
Цель исследования: изучение цитокиновой регуляции иммунного ответа на локальном и системном уровнях у беременных женщин с различным течением ГВИ.
Материал и методы
Нами были обследованы 100 пациенток в I и II триместрах гестации в возрасте от 18 до 33 лет (средний возраст – 27±7,5 лет). Всем беременным с помощью твердофазного иммуноферментного анализа оценивали концентрации иммуноглобулинов G и M (IgG и IgМ) в сыворотке крови к ВПГ-1, ВПГ-2, ЦМВ и ВЭБ; путем полимеразной цепной реакции (ПЦР) определяли наличие вирусной ДНК в образцах периферической крови и соскобах эндоцервикса для оценки спектра урогенитальных инфекций. Путем твердофазного иммуноферментного анализа с использованием тест-систем ООО «Цитокин» исследовались уровни ИЛ-4, ИЛ-8, ИЛ-10, ИФН-γ, ФНО-α в плазме крови и цервикальной слизи, с использованием тест-систем ООО «Биохиммак» определяли концентрации ИЛ-17 и трансформирующего фактора роста β (TФР- β) в плазме крови.
Статистический анализ полученных результатов проведен с использованием программы Statistica 8.0.
Результаты и обсуждение
На основании анализа данных клинико-лабораторного обследования у 35 (35,0%) беременных выявлены диагностические маркеры активации ГВИ. При этом у 8 пациенток в сыворотке крови были обнаружены IgM к ЦМВ, у 5 – к ВЭБ, у 4 – к ВПГ-1 и ВПГ-2. При ПЦР-исследовании образцов крови ДНК ВЭБ обнаружена у 9 беременных, ДНК ЦМВ – у 7 и ДНК ВПГ-1 и ВПГ-2 – у 5 обследованных. При ПЦР-исследовании соскобов эпителиальных клеток цервикального канала наличие ЦМВ выявлено у 8 женщин, а ВПГ-1 и ВПГ-2 – у 4. В 30% случаев отмечены ассоциации маркеров активации ГВИ. Клинические проявления ГВИ в виде лабиального герпеса имели место у 3 пациенток, генитальный герпес был выявлен у 2 беременных, 10 женщин отмечали ОРВИ-подобные симптомы, у всех остальных наблюдалась бессимптомная форма ГВИ.
В I (основную) группу были включены 35 (35%) пациенток, у которых выявлены прямые (обнаружение вирусных антигенов) и косвенные (наличие IgM к ГВ) признаки вирусной репликации. Группу сравнения (II группа) составили 65 (65%) беременных с латентным течением инфекции, у которых по данным клинико-лабораторного обследования определялись специфические IgG к ГВ в низких диагностических титрах в отсутствие клинических и лабораторных признаков активации ГВИ.
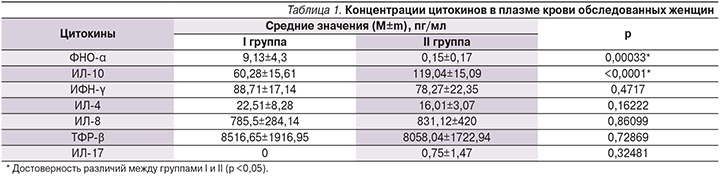
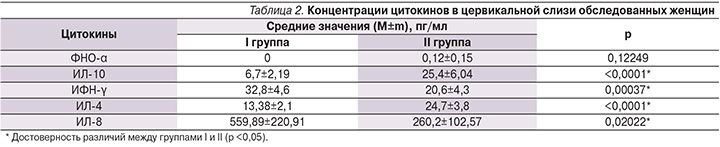
При изучении цитокинового статуса женщин исследуемых групп выявлено, что у беременных I группы был нарушен баланс между противовоспалительными и провоспалительными цитокинами на системном и местном уровнях в пользу последних (табл. 1, 2). При сравнении уровней цитокинов в плазме крови отмечено достоверное увеличение концентрации ФНО-α в I группе по сравнению со II (9,13±4,3 против 0,15±0,17 пг/мл; р
1. Исаков В.А., Архипова Е.И., Исаков Д.В. Герпесвирусные инфекции человека. СПб., 2013. C. 51–198.
2. Макаров О.В., Савченко Т.Н., Сумеди Т.Н., Доброхотова Ю.Э., Гиммельфарб Е.И. Изменение показателей иммунитета на локальном уровне у женщин с невынашиванием беременности инфекционного генеза. Материалы юбилейного сборника, посвященного 200-летию ГКБ №1 им. Н.И. Пирогова и 80-летию совместной работы кафедры и больницы. М., 2002. С. 126–32.
3. Макаров О.В., Савченко Т.Н., Шайков К.А., Алешкин В.А., Доброхотова Ю.Э., Панурина Р.Л. Показатели местного иммунитета при воспалительных заболеваниях органов малого таза. Материалы юбилейного сборника, посвященного 200-летию ГКБ № 1 им. Н.И. Пирогова и 80-летию совместной работы кафедры и больницы. М., 2003. С. 126–30.
4. Савченко Т.Н., Мельников А.В. Показатели локального иммунитета и микробиоценоза половых путей при полипах цервикального канала. Трудный пациент. 2011;9(8–9):16–20.
5. Carville A., Mansfield K.G. Comparative pathobiology of macaque lymphocryptoviruses. Comp. Med. 2008;58 (1):57-67.
6. Бахарева И.В. Роль механизмов врожденного иммунитета в реализации внутриутробной инфекции при беременности высокого инфекционного риска. Автореф. дисс. докт. мед. наук. М., 2009. 50 с.
7. Доброхотова Ю.Э., Джобава Э.М., Озерова Р.И. Неразвивающаяся беременность. М., 2010. С. 44–8.
8. Долгушина Н. В., Макацария А.Д. Вирусные инфекции у беременных. М., 2004. 137 с.
Клинико-лабораторная характеристика персистирующих форм герпес-вирусной инфекции у детей
Герпес-вирусные инфекции (от греч. herpes — ползучий) — группа инфекционных заболеваний, вызываемых представителями семейства герпес-вирусов (Herpesviridae). Антигенных серотипов, выделенных от человека, восемь: вирус простого герпеса 1-го и 2-го типов, вирус ветряной оспы — опоясывающего герпеса или вирус герпеса человека 3-го типа, вирус герпеса человека 4-го типа — вирус Эпштейна–Барр (ВЭБ) — вызывает инфекционный мононуклеоз; вирус герпеса человека 5-го типа — цитомегаловирус (ЦМВ), вирус герпеса человека 6-го, 7-го типов — вызывают внезапную экзантему и синдром хронической усталости, вирус герпеса человека 8-го типа ассоциирован с саркомой Капоши [1]. Все герпес-вирусы являются ДНК-содержащими и сходны по морфологии, типу нуклеиновой кислоты, способу репродукции в ядрах инфицированных клеток.
В РФ сохраняется высокий уровень детской инфекционной заболеваемости [2]. Отмечается возрастание роли инфекций, вызванных вирусами цитомегалии, ВЭБ, герпеса 1-го, 2-го, герпеса 6-го и 8-го типов. Среди детской популяции герпетическая инфекция широко распространена. Так, 70–90% детей 3-летнего возраста имеют достаточно высокий титр вируснейтрализующих антител к вирусу простого герпеса 1-го типа [3]. Эти инфекции у детей часто принимают хроническое течение вследствие персистенции возбудителя и формирования необратимых изменений в органах и системах.
За последние пять лет увеличилось число детей в возрасте до одного года, умерших от генерализованных вирусных инфекций [4]. Велика роль герпес-вирусных инфекций, особенно цитомегаловирусной, в формировании перинатальной патологии и младенческой смертности. Риск развития внутриутробной инфекции зависит от характера взаимоотношений между организмом беременной женщины и микроорганизмом (первичное заражение во время беременности или реактивация ранее приобретенной инфекции).
Проблема врожденной инфекционной патологии является приоритетной для России [5].
Иммуногенез герпес-вирусной инфекции. Длительное нахождение герпес-вируса в организме человека становится возможным благодаря сложной стратегии противоборства и ускользания от иммунной системы хозяина. В достижении этого состояния можно выделить три пути стратегии возбудителя:
Именно стратегия «саботажа», как считают, лежит в основе индуцированной вирусом иммуносупрессии, препятствующей полному удалению патогена и, как следствие, поддерживающей хроническое течение инфекции.
Вирус простого герпеса. В инфицированных клетках вирус простого герпеса образует внутриядерные включения и гигантские клетки, оказывает выраженное цитопатическое действие, проявляющееся округлением и образованием многоядерных клеток. Вирус является слабым индуктором интерферона, в связи с чем инактивация вирусной ДНК внутри клеток не наступает и он сохраняется внутри клеток длительное время, периодически вызывая рецидивы заболевания.
ЦМВ. Сущность проблемы ЦМВ-инфекции в том, что последняя относится к так называемым оппортунистическим инфекциям, клинические проявления которых возможно в условиях первичного или вторичного иммунодефицита.
ЦМВ поражает разнообразные клетки, чаще всего лейкоциты (лимфоциты, моноциты), эпителиальные клетки (дыхательных путей, слюнных желез, почек). С клеток крови ЦМВ с большим постоянством переходит на эндотелий, тропизм к которому у него весьма выражен. Поврежденные эндотелиальные клетки постоянно обнаруживаются в токе крови при активной/реактивированной ЦМВ-инфекции. Повреждение эндотелия сосудов имеет собственное патогенетическое значение в формировании органных поражений, так как вызывает ишемию или кровоизлияния в различные ткани [6].
В раннем неонатальном периоде (0–7 дней) у детей с ЦМВ-инфекцией наблюдались симптомы интоксикации, серый колорит кожи, выраженная мышечная гипотония, большая первоначальная потеря массы тела, синдром рвоты или срыгиваний, признаки угнетения ЦНС. В позднем неонатальном периоде (от 7 дней до одного мессяца) анализ клинических проявлений острой ЦМВ-инфекции выявляет поражение многих органов и систем. Так, у всех детей обнаруживаются гипоксически-ишемическая энцефалопатия с трансформацией синдрома угнетения в синдром гипервозбудимости, проявления анемии, патологическая гипербилирубинемия, увеличение печени и селезенки.
ВЭБ относится к подсемейству бета-герпес-вирусов. Вирусный геном заключен в нуклеокапсид, который покрыт гликопротеидным тегументом gp350, являющимся фактором рецепторного взаимодействия [7]. Проникновение вируса в В-лифоциты осуществляется через рецептор этих клеток CD21-рецептор к C3d-компоненту комплемента. ВЭБ-инфекция широко распространена среди людей, причем первичное инфицирование, как правило, происходит в антенатальном или детском возрасте, но манифестация ВЭБ-инфекции в виде отчетливых клинических проявлений инфекционного мононуклеоза в большинстве случаев происходит в школьном возрасте при различного рода иммунопатологических реакциях. Манифестация инфекции в виде инфекционного мононуклеоза может осложняться поражением печени, слизистой оболочки желудка, ткани почек, лимфоидного аппарата.
Особый характер взаимодействия микро- и макроорганизма при хронических персистирующих инфекциях обусловливают трудности лабораторной диагностики. Обнаружение возбудителя не может быть единственным критерием подтверждения диагноза. Необходима комплексная оценка клинических и лабораторных данных для постановки диагноза.
Цель исследования. Определить клинические особенности течения персистирующих герпес-вирусных инфекций у детей и оценить значимость комплекса лабораторных исследований, в том числе показателей общей иммунологической реактивности у больных при персистирующем у них инфекционном процессе.
Материал и методы исследований. Под наблюдением находилось 63 пациента в возрасте от одного месяца до 7 лет, из них детей до одного года было 25, от одного года до трех лет — 22 и старше трех лет — 15 больных. Среди обследованных детей преобладали пациенты первых двух лет жизни — 47 детей (74,6%) и старше двух лет было 15 больных (25,4%).
В комплекс исследований наблюдаемых детей были включены традиционные методы обследования — клинические анализы крови, мочи, копрограммы, УЗИ мозга, УЗИ внутренних органов, биохимические печеночные и почечные тесты (по показаниям), микробиологический анализ кала на дисбактериоз кишечника, бактериологические посевы на острую патогенную кишечную инфекцию, иммуноферментный анализ (ИФА) на ротавирусы, ИФА на внутриутробные инфекции: герпес-вирусы, цитомегаловирусы, ВЭБ, хламидии, микоплазмы. Определение специфических антител классов IgM и IgG в сыворотке крови к герпес-вирусам проводили непрямым твердофазным иммуноферментным методом с использованием стандартных наборов реактивов фирмы «Вектор-Бест», г. Новосибирск. Использовался молекулярно-биологический метод определения герпес-вирусов — полимеразная цепная реакция (ПЦР) с помощью набора реагентов производства «АмплиСенс» (ЦНИИ эпидемиологии МЗ РФ). В качестве материала использовали биосубстраты: периферическая кровь, моча, секрет из зева, слюна, отделяемое из глаз, вульвы. Оценивались показатели общей иммунологической реактивности: коэффициент фагоцитарной защиты (КФЗ), иммунный лимфомоноцитарный потенциал (ИЛМП) и лейкоцитарный индекс интоксикации (ЛИИ).
Результаты. В клинической диагностике персистирующих инфекций у детей следует отводить первостепенное значение неблагополучию акушерского анамнеза матерей больных детей.
Беременность и роды были осложненными у большинства матерей наблюдаемых детей, чаще всего у них отмечались гестозы и угроза выкидыша, рождение недоношенных, в родах гипоксия плода, преждевременная отслойка плаценты, кесарево сечение и др. У 32 женщин из 63 (50,7%) были различные соматические заболевания (хронический пиелонефрит, кольпит, анемия, аутоиммунный тиреоидит и др.). При обследовании беременных женщин было выявлено как моноинфицирование (у 30 из 63–47,6%), так и сочетания инфекций (у 16 из 63–25,4%). Наиболее часто обнаруживались герпес-вирусы и цитомегаловирусы (суммарно у 27 женщин из 63–43%) и реже другие возбудители — хламидии, микоплазмы (у 11 беременных — 17,4%). Высокая частота вышеуказанных осложнений свидетельствует о несомненной роли инфекции как отягощающего фактора в течение гестационного периода и родов.
Заподозрить внутриутробную или персистирующую инфекцию у детей можно было по высокой степени поражения у детей различных органов и систем: ЦНС (71,4%), органов дыхания (88,8%), желудочно-кишечного тракта (95,2%), поражению глаз (31,7%), лимфатического аппарата (15,9%).
В процессе наблюдения за детьми в недалеком прошлом все дети обследовались на состояние микробиоценоза кишечника.
У всех детей обнаруживались нарушения как в основных компонентах биоценоза, так и в составе условно-патогенной флоры. Следует отметить, что у всех пациентов проводилась коррекция микробиоценоза повторными курсами пре- и пробиотиков, однако восстановления микрофлоры до нормобиоценоза не наблюдалось ни у одного пациента. Следовательно, без выявления и адекватного лечения основного заболевания не удается курировать дисбиотические нарушения в организме ребенка.
Закономерен вопрос о правильности выбора комплекса диагностики внутриутробной и персистирующей инфекции у детей. В зависимости от возраста пользуются разными методами диагностики. Важное значение отводится сбору семейного анамнеза. Диагностика внутриутробных инфекций у детей должна опираться на клинические проявления как общего характера, так и на типоспецифические ее признаки, а также основываться на анализе комплекса лабораторных методов обследования [8].
При оценке клинических анализов крови у наблюдаемых детей обращали на себя внимание значительные отклонения в различных показателях гемограммы: выраженная анемизация (у 31,7% пациентов), нейтропения (у 19%), лимфоцитоз (у 27%), лейкопения с лимфоцитопенией (36,5%), ускорение СОЭ (у 27%), что в совокупности свидетельствовало о наличии воспалительного процесса в организме с выраженным снижением иммунореактивности у детей.
При скрининговом серологическом обследовании методом ИФА на внутриутробные инфекции у детей наиболее часто выявлялись положительные титры типоспецифических антител класса IgM и/или IgG к герпес-вирусам. Диагностические титры антител класса IgM и IgG определялись к ЦМВ (у 9 детей), к HV 1-го, 2-го типа (у 9 детей). Антитела к антигенам ВЭБ обнаруживались у 20 детей, из них у 10 детей были антитела класса IgG к раннему антигену ВЭБ и антитела класса IgM к капсидному антигену ВЭБ, что свидетельствовало об активной фазе ВЭБ-инфекции. Остальные 10 пациентов имели антитела класса IgG к нуклеарному (ядерному) антигену ВЭБ, что расценивалось как поздняя стадия инфекции.
У детей при персистирующем течении с реактивацией инфекции, которое чаще возникало после провоцирующих воздействий (ротавирусные диареи, ОРВИ, профилактические прививки) ПЦР-тесты при исследовании биосубстратов: кровь, осадок мочи, секрет из зева давали положительные результаты с последующим нарастанием титра типоспецифических антител по данным ИФА.
Совокупность проведенных исследований позволила выделить у обследованных больных следующие формы инфекций: моноинфекции были у 21 пациента — 31,8% (ЦМВ — у 5 детей, HV 1-го, 2-го типа — у 6 детей и ВЭБ — у 10), у 42 детей из 63 (68,2%) обнаруживались микст-инфекции. У 23 детей была ассоциация ЦМВ с герпес-вирусами (у 9 детей с HV 1-го, 2-го типа, у 3 детей — с HV 6-го типа и у 11 детей — с C. albicans и хламидиями). Микст-формы герпеса 1-го, 2-го типа были выявлены у 9 больных, у них были ассоциации с микоплазмами и хламидиями. Ассоциации ВЭБ были обнаружены у 10 детей (5 больных имели ассоциацию с ЦМВ, пациента — с HV 6-го типа и 2 больных — с Yersinia pseudotuberculosis).
Из 63 больных у 21 (33,3%) с моноинфекцией течение заболевания расценивалось как латентное (с ЦМВ-инфекцией у 5 и HV 1-го, 2-го типа у 6) и как персистирующее (у 10 детей с ВЭБ-инфекцией). У 14 детей из 42 с микст-инфицированием (у 1/3) было персистирующее течение инфекционного процесса (у 3 детей с ЦМВ-инфекцией в ассоциации с HV 6-го типа и у 11 детей с ЦМВ-инфекцией в ассоциации с C. albicans и хламидиями). У 28 детей из 43 (у 2/3) наблюдалось персистирующее течение с реактивацией инфекции (у 9 детей с ЦМВ-инфекцией в ассоциации с HV 1-го, 2-го типа; у 9 детей с HV 1-го, 2-го типа в ассоциации с хламидиями или микоплазмами и у 10 детей с ВЭБ инфекцией в ассоциации с ЦМВ, HV 6-го типа и ВЭБ в ассоциации с Y. pseudotuberculosis).
Коэффициент фагоцитарной защиты у детей с моноинфицированием и микст-формами герпесвирусной инфекции оказался достоверно сниженным по сравнению со средневозрастной нормой для здоровых детей (0,634 ± 0,05 усл. ед. и 0,540 ± 0,03 усл. ед. соответственно при норме 0,946 ± 0,03, Р1–2 и Р2–3 0,05). Недостаточность защиты клеточно-фагоцитарного звена иммунитета играет важную роль в патогенезе герпес-вирусных инфекций, что должно учитываться в лечении этих заболеваний.
Отклонение величины показателя ИЛМП имело противоположную направленность, она оказывалась достоверно повышенной как при моноинфекции, так и при микст-формах герпес-вирусных инфекций по сравнению с контролем (Р1–3 и Р2–3 0,05. Увеличение показателя ИЛМП у детей с герпес-вирусной инфекцией еще раз подтверждает лимфотропность вирусных антигенов.
ЛИИ оказался достоверно повышенным у больных с микст-формами герпес-вирусной инфекции по сравнению со средневозрастной нормой в контроле (Р2–3 0,05), они имели лишь тенденцию к повышению. Однако при оценке индивидуальных показателей ЛИИ у детей с моноинфицированием герпес-вирусами выявились существенные особенности. У 13 детей из 21 (61,9%) ЛИИ был ниже возрастной нормы, что отражало фазу положительной анергии к совершенно определенному антигену. Это свидетельствует, что организм защищен сейчас только от специфических антигенов, однако он остается уязвимым в отношении других патогенов, то есть низкий индекс интоксикации отнюдь не указывает на полное благополучие организма.
Полученные результаты исследований подтверждают выраженность иммунного дисбаланса как в клеточно-фагоцитарном звене иммунитета, так и в гуморальном, а также свидетельствуют о значимости эндогенной интоксикации у больных с микст-формами герпес-вирусной инфекции и уязвимости иммунной защиты у детей и при моноинфицировании.
Клинический пример. Андрей С., 2 года 5 мес., поступил в стационар с жалобами на высокую температуру — 39 °С, однократную рвоту, сниженный аппетит и жидкий стул 5 раз в сутки. Болен в течение двух недель ОРВИ, получил амбулаторно симптоматическое лечение. К концу второй недели ухудшилось состояние, рецидив лихорадки — 39 °C и дисфункция кишечника. Направлен на госпитализацию.
Анамнез жизни. От первой беременности, протекала с угрозой выкидыша, нефропатией, преэклампсией в родах. Во время беременности перенесла ОPВИ с лимфаденитом. Обследование на пренатальные инфекции, обнаруживались антитела класса IgG к антигенам ЦМВ и вирусу герпеса 1-го, 2-го типа. Лечение не проводилось. Роды в срок, масса при рождении 3500 г, длина 51 см. К груди приложен сразу, сосал активно, грудное вскармливание до года, прикормы вводились в 5 и 6 месяцев. Адаптация к пище нормальная. В массе прибавки достаточные, в 2 г. 5 мес — масса 14 кг 810 г, рост 93 см.
Состояние здоровья в течение первого года жизни неблагополучное. Длительно держалась желтуха, в возрасте 3 недель: общий билирубин — 315,1 мкмоль/л, непрямой — 297,3 мкмоль/л, прямой — 17,8 мкмоль/л. Одновременно с желтухой был неустойчивый стул. В 1-месячном возрасте неврологом установлен диагноз перинатального поражения ЦНС, гипоксическо-ишемического генеза, гипертензионный синдром.
К возрасту 6 мес были обнаружены изменения в гемограмме: гемоглобин — 112 г/л, эритроциты — 4,2 × 10 12 /л, лейкоциты — 7,8 × 10 9 /л, сегментоядерные нейтрофилы — 12%, лимфоциты — 67%, моноциты — 12%, эозинофилы — 8%, базофилы — 1%, СОЭ — 3 мм/час. В повторных анализах крови во 2-м полугодии продолжала выявляться нейтропения. Консультирован гематологом, установлен диагноз доброкачественной нейтропении детского возраста. В 10 мес в анализе крови выявлена анемия (гемоглобин — 107 г/л, эритроциты — 3,81 × 10 12 /л, цветовой показатель — 0,84, тромбоциты — 280 × 10 9 /л, сегментоядерные нейтрофилы — 11%, лимфоциты — 76%, моноциты — 90%, эозинофилы — 3%, базофилы — 1%). Гематологом назначено лечение Сорбифером дурулесом, курс 1 месяц.
Осмотрен ортопедом: отмечено ограниченное отведение бедер. В один год на УЗИ органов брюшной полости определялся перегиб в области шейки желчного пузыря, холестаз. Осмотр генетика: диагностирована недифференцированная дисплазия соединительной ткани с поражением костно-мышечной системы. В 1 г. 5 мес перенес острый энтероколит неуточненной этиологии, госпитализировался в стационар на 10 дней, получал лечение метронидазолом и Энтеролом. В течение 1,5 лет переносит частые ОРВИ с повышением температуры до 38,8 °С в течение 3–4 дней и катаральными явлениями.
Объективные данные. При последней госпитализации отмечались явления назофарингита в течение 5 дней, лихорадка до 39 °С 2 дня, кожные покровы без сыпи. При осмотре — гиперемия зева и увеличение подчелюстных, передних и заднешейных лимфоузлов, стул учащенный до 3 раз в сутки, с 5 дня лечения — оформленный. ЛОР-врачом диагностирован хронический тонзиллит и аденоидит, в фазе обострения.
Обследование. В мазке из зева — высев гемолитического стрептококка. Посевы на патогенную кишечную флору отрицательные. ИФА на ротавирус — отрицательный. Реакция непрямой гемагглютинации (РНГА) с кишечными диагностикумами — отрицательные.
Гемограмма при поступлении: гемоглобин 104 г/л, эритроциты — 3,7 × 10 12 /л, цветовой показатель — 0,85, лейкоциты — 6,4 × 10 9 /л, палочкоядерные нейтрофилы — 4%, сегментоядерные — 72%, лимфоциты — 18%, моноциты — 4%, эозинофилы — 2%, СОЭ — 4 мм/час.
Гемограмма в динамике: гемоглобин — 109 г/л, эритроциты — 3,4 × 10 12 /л, лейкоциты — 7,8 × 10 9 /л, палочкоядерные нейтрофилы — 19%, сегментоядерные — 42%, лимфоциты — 28% (широкоплазменные лимфоциты), моноциты — 8%, плазматические клетки — 1%, эозинофилы — 2%, СОЭ — 13 мм/час. В дальнейшем — красная кровь оставалась без динамики, число лейкоцитов не изменялось, нарастал лимфоцитоз до 43% (широкоплазменные формы), моноцитов до 12%, СОЭ повысилась до 20 мм/час.
Анализ мочи без отклонений от нормы (пятикратно). В биохимическом анализе крови — умеренная гипоальбуминемия, печеночные пробы — в норме. ИФА на специфические антитела к антигенам ЦМВ класса IgM — отрицательный, класса IgG — положительный. Маркеры ДНК-ЦМВ в осадке мочи и в секрете из зева методом ПЦР не найдены. ИФА на специфические антитела к хламидийному антигену (Chlamydia pneumoniae) — положительный в титре 1:80. Маркеры ДНК Ch. pneumoniae в мазке из носоглотки методом ПЦР — положительный. ИФА с микоплазменным антигеном — IgM и IgG — отрицательные, с герпес-вирусами 1-го, 2-го типа — IgM и IgG отрицательные. ИФА на специфические антитела к антигенам ВЭБ: IgM к капсидному антигену — отрицательный, IgG к раннему антигену — положительный и IgG к ядерному антигену (IgGNA) — положительный (> 0,5 ед.). Совокупность данного анализа была индикатором активной фазы мононуклеозной инфекции.
Таким образом, на основе ретроспективной оценки анамнеза ребенка становится ясным, что у пациента, инфицированного с рождения вирусом цитомегалии и хламидиями, в течение первого и второго года жизни инфекция персистировала и, как следствие, — была пролонгированная желтуха, наблюдалось поражение органов дыхания в виде «масок» многократных ОРВИ и эпизодов дисфункций кишечника, формированием дисбактериоза и иммунодефицитного состояния. Поражение ЦНС зарегистрировано неврологом в ранние сроки (в возрасте 1 месяца). В пользу вирусной персистенции свидетельствовал постоянный лимфоцитоз и как следствие — нейтропения, что очень часто недооценивается консультантами-гематологами и не назначается вирусологическое тестирование пациентов. После 2 лет на фоне персистирующей хламидийно-цитомегаловирусной инфекции наслоилась постнатальная инфекция ВЭБ, что в совокупности у ослабленного ребенка в дальнейшем можно ожидать персистирование микст-инфекции (ЦМВ + хламидии + ВЭБ).
После проведенного обследования ребенку была назначена адекватная комплексная терапия (Cумамед, Ликопид с последующим переходом на Виферон, витамины А, Е, Пиридоксин, пробиотики — курс Примадофилуса). Наблюдение за ним продолжается.
Выводы
Литература
Ф. Н. Рябчук, кандидат медицинских наук, доцент
З. И. Пирогова, кандидат медицинских наук, доцент
СПбМАПО, Санкт-Петербург