Костная пролиферация что такое
ПРОЛИФЕРАЦИЯ
Пролиферация (лат. proles потомство + ferre носить, создавать) — новообразование клеток и внутриклеточных структур (митохондрий, эндоплазматической сети, рибосом и др.).
Пролиферация — явление широко распространенное в норме и патологии. Оно лежит в основе роста и дифференцировки тканей в процессе индивидуального развития, обеспечивает непрерывное обновление клеток и внутриклеточных структур, колебания функциональной активности органов, особенно при длительном их функциональном напряжении. Пролиферация. различных клеток иммунокомпетентной системы (лимфоцитов, плазматических клеток, макрофагов и др.) и их органелл является структурной основой иммуногенеза. При патологических процессах, сопровождающихся повреждением органов и тканей, с помощью Пролиферации ликвидируется образовавшийся дефект и нормализуется нарушенная функция. Пролиферация может возникать вследствие нарушений гормональных влияний и приводит к уродливому увеличению органа, напр, при акромегалии. В результате пролиферации клеток, утративших способность дифференцироваться в клетки того или иного органа, развивается опухоль. Пролиферация также лежит в основе метаплазии (см.).
Источником Пролиферации являются недифференцированные, так наз. стволовые клетки данной ткани, которые, периодически подвергаясь делению и последующей дифференцировке, постепенно превращаются в специфические клетки этой ткани, выполняющие характерную для нее функцию. Пролиферация клеток осуществляется путем их прямого или непрямого деления (см. Амитоз, Митоз). Новообразование ультраструктур клеток происходит посредством их деления, почкования и др.
Ряд органов и тканей (кроветворная, волокнистая соединительная, костная ткань, эпидермис, эпителий слизистых оболочек) обладает очень высокой способностью к Пролиферации клеток, другие — более умеренной (скелетная мышца, поджелудочная, слюнная железы и др.), третьи — совсем или почти лишены этой способности (ц. н. с., миокард). В последних репарация повреждения и нормализация функций после перенесенных болезней, а также длительное функциональное напряжение обеспечиваются гл. обр. за счет Пролиферации внутриклеточных структур в сохранившихся клетках, которые при этом увеличиваются в объеме, подвергаются гипертрофии. При этом гипертрофия органа может произойти как в результате Пролиферации клеток (см. Гиперплазия), так и только ультраструктур сохранившихся клеточных элементов.
Библиография: Давыдовский И. В. Общая патология человека, с. 376, М., 1969; Струков А. И. и Серов В. В. Патологическая анатомия, с. 99, М., 1979.
Костная пролиферация что такое
Пролиферативная активность клеток отражает интенсивность роста опухолей. В статье приведены данные изучения уровня пролиферации клеток базалиомы — наиболее частой злокачественной опухоли кожи. Исследование проводили иммуногистохимическим методом с маркером пролиферации Ki67. По характеру пролиферации базалиома представляла гетерогенную группу. Солидный, аденоидный, поверхностный мультицентрический тип базалиомы отличались низкой пролиферативной активностью с преимущественным распределением клеток, экспрессирующих Ki67, по периферии комплексов. Высокую пролиферативную активность выявляли в инфильтративном, склерозирующем и микронодулярном типе при равномерном распределении пролиферирующих клеток.
Пролиферативная активность клеток отражает интенсивность роста опухолей. В статье приведены данные изучения уровня пролиферации клеток базалиомы — наиболее частой злокачественной опухоли кожи. Исследование проводили иммуногистохимическим методом с маркером пролиферации Ki67. По характеру пролиферации базалиома представляла гетерогенную группу. Солидный, аденоидный, поверхностный мультицентрический тип базалиомы отличались низкой пролиферативной активностью с преимущественным распределением клеток, экспрессирующих Ki67, по периферии комплексов. Высокую пролиферативную активность выявляли в инфильтративном, склерозирующем и микронодулярном типе при равномерном распределении пролиферирующих клеток.
В структуре злокачественных эпителиальных опухолей кожи первое место занимает базалиома, на долю которой приходится от 75 до 94% [1, 2]. В подавляющем большинстве случаев регистрируются солитарные опухоли, локализующиеся на открытых участках кожи, подверженных инсоляции. Опухоль отличается медленным течением и относительно благоприятным прогнозом. Однако в ряде случав она может значительно увеличиваться в размере, характеризуясь выраженным экзофитным ростом, либо приобретать инвазивные черты, проникая в окружающие и подлежащие ткани, приводя к их разрушению. Подобный рост опухоли обычно ассоциируется с определенными морфологическими типами, которые рассматривают как агрессивные [3].
Показателем интенсивности роста ткани является пролиферативная активность клеток. Она относительно спокойна в доброкачественных процессах и резко возрастает в злокачественных опухолях. Аналогичные тенденции присущи и эпителиальным опухолям кожи. Так, пролиферативная активность клеток базальноклеточного рака кожи выше, чем в очагах лейкоплакии [4], а при раке in situ индекс пролиферации превосходит таковой при предраковом актиническом кератозе [4,5]. Плоскоклеточный рак кожи отличается высоким уровнем пролиферации, который следует за снижением степени его дифференцировки [6, 7, 8].
Предыдущие исследования показали, что по характеру пролиферативной активности клеток базалиома представляет гетерогенную группу. Наиболее интенсивный рост имела язвенная форма, тогда как нодулярная и поверхностная характеризовались умеренными и низкими показателями [9]. Высокий уровень пролиферации отмечали в микронодулярном, метатипическом типе базалиомы и типе морфеа [10, 12]. Также отмечали повышение индекса Ki67 в инфильтративном и метатипическом типе по сравнению с нодулярным и поверхностным [11, 13]. В то же время единого мнения о связи уровня пролиферации с гистологическим типом базалиомы до сих пор нет, так как другие исследования свидетельствовали, что индекс Ki67 в нодулярном и поверхностном мультицентрическом типе базальноклеточного рака значительно превосходил аналогичный показатель в склерозированном и типе морфеа [14, 15]. Учитывая противоречивые данные, представляется интересным и актуальным продолжить изучение пролиферативной активности клеток в различных морфологических типах базалиомы, что позволит более детально понимать маркеры и предикторы агрессивного течения опухоли.
Материалы и методы
В работе исследования использовали 36 биоптатов кожи больных базальноклеточным раком кожи. Биопсию кожи размером 0,5 х 0,5 см проводили под местной анестезией 2% раствором новокаина, биоптаты фиксировали в 10% растворе формалина, забуфференом по Лилли при рН-7,4. Материал заливали в парафин по обычной методике. Серийные срезы толщиной 3–5 мкм депарафинировали по стандартной схеме, затем окрашивали гематоксилином и эозином. Иммуногистохимическое исследование проводили в соответствии со стандартным протоколом. Парафиновые срезы наносили на стекла с адгезивным покрытием, депарафинировали по стандартному протоколу. Срезы, погруженные в цитратный буфер, инкубировали в микроволновой печи при мощности 690 Вт два раза по пять минут. Двадцать минут при комнатной температуре, срезы охлаждали, подсушивали и наносили первичные антитела. Для определения уровня пролиферации использовали моноклональные антитела к протеину Ki67 (DAKO), разведение 1:200. Использовались соответствующие позитивные и негативные контроли – иммунные и неиммунные сыворотки. Срезы промывали в буфере, подсушивали, затем на них наносили EnVision (anti-mouse и anti-rabbit, фирмы DAKO, Дания) на 30–40 минут. Для визуализации реакции наносили DAB+ (3, 3 ґ– диаминобензидин), что позволяло получать специфическую коричневую окраску. Затем срезы докрашивали гематоксилином Майера. Определение уровня пролиферации оценивалась с помощью индекса, который вычислялся как среднее от числа меченных ядер на 100 учтенных ядер (при учете 500–1000 опухолевых клеток). Подсчет меченных ядер проводился в репрезентативных полях зрения с относительно равномерным распределением опухолевых клеток, сверху вниз и слева направо. Клетки на периферии срезов, где чаще всего наблюдается фоновое окрашивание, не учитывались.
Среди 36 базалиом пять имели поверхностный мультицентрический тип строения, четыре – поверхностный мультицентрический в сочетании с солидным, семь – солидный, два – аденоидный, два – солидно-аденоидный, пять – инфильтративный, три – микронодулярный. В восьми случаях отмечали различные варианты сочетания солидного, инфильтративного, микронодулярного, склерозирующего строения.
Индекс пролиферации Ki67 в поверхностном мультицентрическом типе и при сочетании его с солидным компонентом варьировал от 14,9 до 31,1%. Средний индекс составлял 22,2%. Пролиферирующие клетки в шести случаях располагались преимущественно по периферии клеточных комплексов, в трех – равномерно по клеточным комплексам. При солидных опухолях средний индекс составил 26,5%, он варьировал от 14,5 до 38,2% (рис.1). Периферическое распределение наблюдали в четырех случаях, равномерное – в трех. При аденоидном строении пролиферирующие клетки распределялись равномерно, индекс пролиферации составлял 22,6 и 31,3%. В случаях, когда имелось сочетание солидного и аденоидного компонентов, индекс пролиферации составлял 36,8 и 19,2%, В первом случае клетки распределялись равномерно, во втором – равномерно в аденоидном компоненте и по периферии – в солидном. В опухолях инфильтративного, микронодулярного строения и при их сочетании клетки, экспрессирующие маркер Ki67, диффузно регистрировались по всем клеточным комплексам. В инфильтративном типе минимальное и максимальное значение индекса было 27,6 и 47,8% (среднее значение – 35,4%) (рис.2). Микронодулярные базалиомы имели средний индекс Ki67 26,9%. В случаях инфильтративно-склерозирующего строения индекс имел значение 40,2 и 31,6%, пролиферирующие клетки равномерно распределялись в комплексах (рис.3). При сочетании инфильтративного, солидного и микронодулярного строения преимущественно отмечали равномерное распределение пролиферирующих клеток, и средний индекс составлял 36,5% (значения варьировали от 22,1 до 50,4%). Солидное строение в сочетании с инфильтративным склерозирующим имели опухли с индексом Ki67 26,7 и 35,3%, в солидном компоненте пролиферирующие клетки располагались преимущественно по периферии комплексов, инфильтративном склерозирующем – равномерно.
При анализе пролиферативной активности клеток мы сгруппировали опухоли в зависимости от характера течения и роста. В группу неинвазивного роста мы включили опухоли, имеющие поверхностный мультицентрический, солидный, аденоидный, сочетание поверхностного мультицентрического и солидного компонентов. В группу с инвазивным ростом нами были включены опухоли инфильтративные, микронодулярные, инфильтративно склерозирующие, а также опухоли сложного строения (инфильтративный + микронодулярный + солидный и солидый + инфильтративный склерозирующий).
Средний индекс пролиферации неагрессивных типов составил 24,77 ± 7, 47 с доверительным интервалом 95% 21,27–28,26 (табл. 1). Средний индекс Ki67 агрессивных типов составлял 33,53 ± 8,94 с доверительным интервалом 95% 28,77–38,29 (табл. 1). Различия в уровне пролиферации между агрессивными и неагрессивными типами носили статистически значимый характер (р = 0,003). Анализ характера распределения пролиферирующих клеток в опухолевых комплексах показал, что в неагрессивных типах периферическое распределение клеток наблюдалось в 50% случаев, равномерное – в 45%, в 5% случаев ряд комплексов в опухоли имели один тип распределения, другие комплексы – иной тип распределения (табл.2). В агрессивных типах 81,25% случаев имели равномерное распределение пролиферирующих клеток, сочетание двух типов распределения – 18,75% (табл. 2). Периферическое распределение пролиферирующих клеток в агрессивных типах не встречалось. При сравнении распределения клеток между агрессивными и неагрессивными типами опухоли было показано, что различия носят статистически достоверный характер (р = 0,003).
Таблица 1. Индекс пролиферации Ki67 в агрессивных и неагрессивных морфологических типах базалиомы
Костная пролиферация что такое
Современная лабораторная диагностика остеопороза.
Значимость заболевания в современном обществе и медицине определяется его распространённостью среди населения, тяжестью течения и исходов, экономическими потерями больного, семьи и общества в целом. Остеопороз (ОП) — системное метаболическое заболевание скелета, характеризующееся снижением массы костной ткани и нарушением микроархитектоники её строения, что снижает прочность кости и увеличивает риск переломов. По мнению экспертов ВОЗ, ОП сегодня — одно из наиболее распространённых заболеваний, которое наряду с инфарктом миокарда, инсультом, раком и внезапной смертью занимает ведущее место в структуре заболеваемости и смертности населения.
Результаты многочисленных исследований убедительно доказали, что костная масса является главной детерминантой механических свойств костной ткани и определяет 75-80% её крепости. Риск переломов прямо связан с абсолютными значениями минеральной плотности костной ткани (МПКТ) позвоночника и шейки бедра, а костная денситометрия — единственный достоверный метод, позволяющий установить степень снижения костной массы. Риск перелома увеличивается с возрастом, который главным образом связан у пожилых людей с низкой МПКТ. Риск перелома бедра возрастает в 2-3 раза при каждом снижении МПКТ шейки бедра на одно стандартное отклонение в соответствии с критериями ВОЗ.
Патогенез остеопороза.
ОП сегодня широко используется как модель фундаментальных исследований в изучении молекулярных механизмов межклеточного взаимодействия. ОП – многофакторное заболевание, в основе которого лежат процессы нарушения костного ремоделирования с повышением резорбции костной ткани и снижением костеобразования. Ремоделирование костной ткани начинается с резорбции, осуществляемой в процессе остеокластогенеза с образованием полости резорбции. Остеобласты (ОБ) «атакуют» полость резорбции, где строят новый костный матрикс для последующей минерализации. Оба процесса костеобразования тесно связаны. Образование кости превышает резорбцию в течение роста скелета, и наоборот, резорбция превалирует в течение последующего периода жизни человека. Оба процесса костеобразования являются результатом тесного клеточного взаимодействия ОБ иостеокластов (ОК), которые берут начало от предшественников различных клеточных линий, а именно: ОБ — из мезенхиальных стволовых клеток, ОК — из макрофагально-моноцитарных клеток крови.
Кость формируется остеобластами. Основная их функция – синтез остеоида (протеинового матрикса), который на 90-95% состоит из коллагена 1 типа, на 5% из белка остеокальцина и впоследствии минерализуется кальцием и фосфатом из внеклеточной жидкости. ОБ содержат фермент щёлочную фосфатазу, несут рецепторы к паратиреоидному гормону (ПТГ) и кальцитриолу и способны к пролиферации. Минеральная часть кости состоит из гидроксиапатита и аморфного фосфата кальция, которые нековалентно связаны с белками органического матрикса
Резорбция кости осуществляется остеокластами. Это подвижные клетки. Выделяя протеолитические ферменты и кислую фосфатазу, вызывают деградацию коллагена, разрушение гидроксиапатита и выведение минералов из матрикса. Имеется корреляция между активностью тартратрезистентной кислой фосфатазы в сыворотке крови и выраженностью резорбтивных процессов в кости.
В норме оба процесса – образование и разрушение уравновешены.
Сроки физиологического ремоделирования кости.
| Фаза резорбции кости | 14-30 дней |
| Switch-over фаза (простагландин Е2 ответственен за апоптоз остекластов) | 10 дней |
| Фаза формирования кости | 90 дней |
| Фаза отдыха | 900 дней |
Биологический смысл феномена ремоделирования кости состоит в приспособлении механических свойств кости к постоянно меняющимся условиям окружающей среды. Рост и обновление скелета сопровождается регенерацией микроповреждений и поддержанием возможности перехода минералов в кровь и обратно. У взрослых людей остеобласты продуцируют чуть меньше костной ткани, чем требуется. Следствием этого является отрицательный баланс кости, который составляет 0,5-1% ежегодно. Данный феномен известен как «ассоциированная с возрастом остеопения».
OPG-остеопротегерин – остеокластингибирующий фактор, гликопротеин, широко экспрессированный в различных тканях, является мощным ингибитором костной резорбции. OPG действует для RANKL как «мнимый» рецептор, блокирует взаимодействие с RANK и таким образом ингибирует формирование зрелых ОК, нарушает процесс остеокластогенеза и резорбцию костной ткани. Баланс между RANKL и OPG фактически определяет количество резорбированной кости.
Недавно были получены данные, что Т-клетки принимают участие в регуляции костного метаболизма. При индукции интерлейкина-17 (IL-17),который в эксперименте индуцировал экспрессию СОХ-2-зависимого простагландина Е2 и RANKL в ОБ, авторы пришли к заключению, что IL-17 — важный цитокин для остеокластной резорбции. Однако наиболее важными медиаторами для действия различных систем в процессе ремоделирования костной ткани как в норме, так и при ОП является в настоящее время система RANKL-RANK-OPG.
Факторы, играющие важную роль в патогенезе ОП и его переломов: генетические, формирование низкого пика костной массы, потеря минеральной плотности кости, ассоциированная с возрастом и постменопаузой, нарушение архитектоники строения кости, особенности геометрии кости (бедра), травмы и падения, питание с низким содержанием кальция и витамина D, белка и др., низкая двигательная активность, вредные привычки (курение, алкоголь). При вторичном ОП к перечисленным факторам присоединяются факторы заболевания, отрицательного действия лекарственных препаратов (глюкокортикостероиды, иммунодепрессанты и др.), которые вызывают потерю костной массы и ОП.
Снижение костной массы при ОП, которое является основным фактором его патогенеза, рассматривается сегодня как следствие формирования неадекватно низкого пика костной массы в молодом возрасте и интенсивной потери кости, связанной с возрастом, в пожилом возрасте. Генетические факторы — главные детерминанты пика костной массы. Вклад генетических факторов составляет 60-80% в зависимости от методов исследования (близнецы, семьи). Различные гены рассматриваются в качестве кандидатов, участвующих в сложном процессе ремоделирования, формирования и эволюции костной массы, приводящих к ОП и переломам. Многочисленные комплексные исследования различных лабораторий мира направлены на поиск конкретных генов, изучение их полиморфизма, функции и взаимодействия в процессе костного ремоделирования и ОП.
Первичный остеопороз
Остеопороз, развивающийся в периоде постменопаузы, относится к классу первичных остеопорозов. Известно, что снижение секреции половых гормонов в период климактерия оказывает прямое и опосредованное влияние на состояние костного метаболизма. Снижение содержания эстрогенов приводит к нарушению кальциевого обмена, что сопровождается уменьшением минеральной плотности костной ткани. Кроме того, имеет место подавление активности остеобластов, что приводит к преобладанию резорбции над процессами формирования костной ткани. Постменопаузальный остеопороз составляет 85% общего количества первичного остеопороза.
Сенильный остеопороз — так называемый второй тип остеопороза, в патогенезе которого важную роль играет снижение всасываемости кальция в кишечнике, чему также способствует дефицит витамина D, вызванный уменьшением поступления его с пищей, замедлением образования его в коже из провитамина D. Наибольшее значение в патогенезе сенильного остеопороза имеет дефицит активных метаболитов витамина D вследствие снижения его синтеза в почках. При сенильном остеопорозе определённую роль играет развитие резистентности к витамину D — т.е. дефицит рецепторов 1,25(ОН)2D. Указанные факторы вызывают развитие транзиторной гипокальциемии, что приводит к усилению продукции паратиреоидного гормона. В результате вторичного гиперпаратиреоза усиливается резорбция костной ткани, в то время как костеообразование к старости снижено.
Вторичный ОП
Серьёзной медицинской проблемой является и вторичный ОП, возникающий при различных заболеваниях: ревматологических, эндокринологических, онкологических, обструктивных заболеваниях лёгких и бронхиальной астмы, заболеваниях почек, щитовидной железы, органов пищеварения, при иммобилизации и длительном приёме ряда медикаментов (кортикостероиды, иммунодепрессанты, антиконвульсанты, тиреоидные гормоны и др.).
Снижение МПКТ при вторичном ОП часто достигает критериальных величин ОП (-2,5 SD и более по Т-критерию) и даёт основание поставить диагноз.
У больных ревматоидным артритом (РА) в постменопаузе развитие ОП имело место в поясничном отделе позвоночника и шейке бедра у 36%, в предплечье у 40%, а у пациентов с сохранённым менструальным циклом — у 7 и 10% соответственно. Возраст больных и длительность менопаузы, наличие факторов риска, активность и длительность заболевания, степень функциональной недостаточности суставов, проводимая терапия (особенно назначение глюкокортикоидов — ГК) оказывают влияние на величину потери МПКТ и развитие остеопении. При обследовании больных с эндогенным гиперкортицизмом (синдром и болезнь Иценко-Кушинга) ОП обнаружен у 91%, переломы тел позвонков или рёбер — у 58%. ОП у больных бронхиальной астмой значительно утяжеляет течение основного заболевания, увеличивает стоимость лечения. По данным доктора И.А.Барановой, снижение МПКТ было выявлено у 42,8% больных бронхиальной астмой 20-49 лет, ранее не получавших гормональную терапию, и потеря МПКТ увеличивалась в 5 раз при среднетяжёлом течении (53,5%) по сравнению с легким (11%). У больных молодого и среднего возраста, принимавших ГК в средней дозе 10,20±5,99 мг/сут на протяжении 8-14 лет, снижение МПКТ обнаружено у 85%, у 13% зарегистрированы переломы скелета. В качестве причины развития ОП при РА, ряде воспалительных заболеваний, бронхиальной астме обсуждается непосредственное влияние самого заболевания на костную ткань, поскольку известно большое число общих цитокинов, принимающих участие в патогенезе хронического воспалительного процесса и костного ремоделирования, а также ГК, которые наиболее эффективны для базисной терапии при ряде системных заболеваний и в то же время занимающих ведущее место в индукции вторичного ОП. Изучение переломов при вторичном ОП остаётся актуальной задачей.
Стероидный остеопороз также относится к классу вторичных остеопорозов и вызывается патологическим повышением эндогенной продукции глюкокортикоидов надпочечниками или возникает при введении синтетических аналогов кортикостероидов, применяемых для лечения ревматологических, аллергических, гематологических, глазных болезней, заболеваний кожи, желудочно-кишечного тракта (ЖКТ), почек, печени. Стероидный остеопороз возникает при заболеваниях, характеризующихся повышенной секрецией кортикостероидов надпочечниками (Иценко-Кушинга).
Биохимические маркеры костного метаболизма
Их исследуют для оценки скорости протекания процессов костного ремоделирования и диагностики остеопороза с высоким или низким темпом костного обмена, разобщённости или дисбаланса его составляющих: костной резорбции и костеобразования. Разделение показателей на маркеры образования и резорбции кости является условным. Совместно они отражают итоговые изменения резорбции и костеобразования, направленные в ту или иную сторону.
Наиболее точными маркерами костного образования в настоящее время признают исследование содержания остеокальцина, коллагена 1 типа, остеопротегерина (OPG), Интерлейкина 17 в крови.
Исследование маркеров костного ремоделирования целесообразно для:
1. Динамической оценки костного метаболизма;
2. Прогноза потери костной массы (вторичная профилактика при выявленной остеопении);
3. Прогноза перелома костей;
4. Отбора пациентов для проведения терапии;
5. Быстрого мониторинга терапии.
Процесс костного ремоделирования регулируется многими системными гормонами, цитокинами, факторами роста, идентифицированы многие локальные факторы костного ремоделирования. При изучении ОП важна оценка параметров минерального кальций-фосфор-магниевого обмена (уровень общего и ионизированного кальция, фосфора, магния, меди, цинка, витаминов С и К), которые вовлечены в процесс костеобразования.
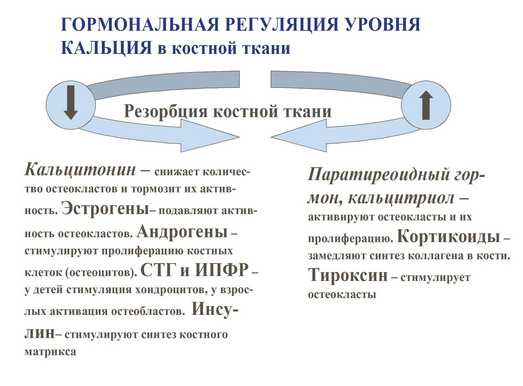
Гормональная регуляция уровня кальция в кости.
— паратиреоидный гормон – стимулирует резорбцию кости опосредованно воздействуя на остеокласты;
— кальцитонин – снижает количество остеокластов и тормозит их активность;
— эстрогены – подавляют активность остеокластов;
— андрогены – стимулируют пролиферацию остеоцитов и усиливают процессы костного синтеза;
— гормон роста и инсулинподобный фактор роста 1 (соматомедин-С) – активируют процесс синтеза кости за счёт стимуляции остеобластов;
— инсулин – стимулирует синтез костного матрикса;
— тироксин – стимулирует остеокласты, усиливая резорбцию костной ткани;
— кортикостероиды – замедляют синтез коллагена в костной ткани;
Из вышеперечисленного следует, что изучение уровня этих гормонов и маркеров костного ремоделирования на ранней стадии развития остеопении, особенно при вторичном ОП, позволит спрогнозировать и оценить вероятность дальнейшей резорбции костной ткани, провести профилактику ОП, назначить лечение.
Алгоритм лабораторной оценки костного ремоделирования.