Коронарные артерии кровоснабжают что
Коронароангиография
Физиологические основы
В университетскую программу первых курсов входит изучение строения сердца и его коронарных сосудов. Но чаще всего авторы учебников ограничиваются описанием только крупных сосудов. Клиницисты же используют совершенно иную, но также международную номенклатуру. Коронароангиография и имплантация стентов требуют более подробного описания сосудов сердца, что нашло применение и в международной практике.
Из курса анатомии каждый узнал, что от аорты отходят две артерии, кровоснабжающие само сердце: левая и правая коронарные артерии. Утолщения на корне аорты, из которых и выходят эти артерии, называются соответственно левым и правым коронарными синусами.
Огибающая артерия всегда располагается на задней поверхности сердца. В ее проксимальной части от нее отходит ветвь тупого края (obtuse marginal artery, obtuse marginal branch, OMB). В зависимости от места этого ответвления различают проксимальную и дистальную части огибающей ветви. Очень редко от главного ствола между передней межжелудочковой ветвью и огибающей ветвью посередине отходит еще одна ветвь, берущая начало непосредственно из общего ствола — промежуточная артерия (RIM, ramus intermedius).
Итак, перечислим еще раз все сокращения:
Левая коронарная артерия — left coronary artery (LCA):
— Передняя межжелудочковая ветвь (ПМЖВ), или передняя нисходящая артерия — left anterior descending artery (LAD); иначе — ramus interventricularis anterior (RIVA/RIA);
— Диагональные артерии (ветви) — ДА; ramus diagonalis (RD/Diag);
— Огибающая ветвь (ОВ) левой коронарной артерии, огибающая артерия — left circumflex coronary artery (LCх));
— Ветвь тупого края, obtuse marginal artery, obtuse marginal branch, (OMB);
— Перегородочные межжелудочковые ветви, ramus septalis (RSA);
— Промежуточная артерия, ramus intermedius (RIM).
Правая коронарная артерия — right coronary artery (RCA):
— Ветвь острого края, acute marginal artery, (AMB);
— Артерия синоатриального узла — ramus nodi sinuatrialis (S-A node artery, SNASA/RNS);
— Задняя межжелудочковая ветвь (ЗМЖВ), или задняя нисходящая артерия — posterior descending artery (PDA); иначе — ramus interventricularis posterior (RIVP/RIP).
И еще раз для повторения (важное задание для диагностики локализации ишемии при инфаркте миокарда): LAD/RIVA, LCx кровоснабжает левую камеру спереди и сбоку, а RCA — сзади. Левое предсердие кровоснабжают LCx, RCA. Перегородку — RSA от LAD. Правую камеру сзади — RCA, спереди — RCA, LAD. Правое предсердие — RCA.
Следует также напомнить о доминантности кровоснабжения миокарда. При так называемом правом типе кровоснабжения сердца, наблюдающемся у 70 % людей, задняя нисходящая артерия (PDA) отходит от правой коронарной артерии. При левом типе кровоснабжения сердца (10 % людей) огибающая артерия (LCx) достигает уровня задней межжелудочковой борозды и образует заднюю нисходящую артерию (PDA). При еще более редком, так называемом смешанном содоминантном типе (20 % людей), имеются две задних желудочковых ветви (RIVP/RIP), отходящих от правой венечной и огибающей артерий.
Электрокардиограмма представляет собой не что иное, как запись распространяемых электрических потенциалов сердца, фиксируемых электродами на конечностях и грудной стенке. ЭКГ включает в себя три стандартных отведения по Эйнтховену (I, II, III), и три усиленных по Гольдбергу (aVR, aVL, aVF). Прикрепление еще шести грудных электродов по Вильсону (V1-V6) позволяет зарегистрировать распространение возбуждение по сердечной стенке в горизонтальной проекции. В зависимости от изменений в этих отведениях еще на догоспитальном этапе при помощи ЭКГ можно предположить локализацию инфаркта и возможную «проблемную» артерию.
Например, при инфаркте правых отделов сердца (задней стенки) часто особенно сильно поражается правый желудочек. Чаще всего это происходит из-за тромба в RCA. Правые отделы сердца не способны сокращаться должным образом, что приводит к снижению преднагрузки левой камеры сердца, поскольку таким образом снижается объем крови, транспортируемый к левому предсердию. Сниженный сердечный выброс сердце пытается компенсировать увеличением частоты сокращений. При инфаркте же левых отделов сердца основным осложнением является кардиогенный шок.
Специально для наших подписчиков мы сделали таблицу, в которой показаны изменения ЭКГ в зависимости от локализации возможного повреждения коронарных артерий.
Стоит также повторить и классификацию острых коронарных синдромов:
I — недавно возникшая боль за грудиной (менее 2-х месяцев, более 3-х раз в день);
II — боль за грудиной в покое (минимум один раз за прошедший месяц, но не в течении последних 48 часов);
III — боль за грудиной в покое (минимум один раз за последний 48 часов).
Нестабильную стенокардию классифицируют на 3 группы по причинам возникновения:
А — вторичная нестабильная стенокардия (инфаркт миокарда, анемия, повышение температуры, гипотензия, тахиаритмия, тиреотоксикоз, дыхательная недостаточность);
B — первичная нестабильная стенокардия;
C — нестабильная стенокардия после инфаркта (минимум 2 недели после инфаркта).
ПБКА и стентирование
Sones еще в 1959 году описал метод, позволяющий оценить состояние отдельных коронарных сосудов. Judkins модифицировал описанный метод в 1967 году. Именно этот способ исследования коронарных сосудов применяется и по сей день. Первая транслюминальная баллонная коронарная ангиопластика (ТБКА) была проведена 16 сентября 1977 в Цюрихе в Швейцарии. С этого момента количество пациентов с ОКС, подвергшихся ТБКА, возросло с 10 до 65 %. По последним данным, недавно опубликованным в журнале The Lancet, смертность вследствие сердечно-сосудистых заболеваний в 2010 году снизилась на четверть по сравнению с 1950 годом, когда 400 из 100 000 случаев заканчивались летальным исходом. Первым пациентом был 38-летний мужчина-курильщик, у котого наблюдался стеноз LAD. После операции мужчина прожил еще 37 лет.
При ПБКА баллонный катетер с помощью проводника вводится вплоть до места стеноза. Баллон раздувается и тем самым «сплющивает» атеросклеротические бляшки, растягивая сосудистую стенку. Мелкие повреждения интимы во время раздувания баллона часто не имеют последствий, однако иногда именно в этих местах позже начинается пролиферация тканей, что в 30–40 % случаев приводит к рестенозам и рецидивам в течение последующих трех месяцев. Частота экстренных операций по созданию шунтов (bypass) составляет менее 0,5 %. С помощью имплантации стента сосудистая стенка стабилизируется. Существовала также техника primary stenting — имплантация стента без предшествующего дилатирования сосудов баллоном, однако ныне она используется крайне редко и только на начальных этапах сужения просвета сосуда. Исследования последних лет показали, что при значительных сужениях просвета сосуда, у таких пациентов в первые часы после ангиопластики наблюдалась ишемия миокарда, что требовало немедленного повторного хирургического вмешательства или повторной дилатации. Это осложнение возникает вследствие отрыва бляшки от эндотелия. Обнажение поверхности гладкомышечных клеток приводит к тромбообразованию за счет высвобождения молекул коллагена и тканевых факторов, запускающих каскад свертывания крови. Во избежание развития тромбов и рестеноза в настоящее время чаще всего ангиопластику совмещают с имплантацией стентов на месте стеноза.
Первую имплантацию стента провел Sigwart в 1987 году. Тогда стенты монтировались непосредственно на баллон самим врачом. Сейчас же вся конструкция идет в комплекте, что позволило снизить риск потери стента в кровеносном русле при его недостаточной фиксации.
Появились и новые типы самих баллонов. Некоторые из них имеют на своей поверхности режущие зубцы, что расположены параллельно оси сосуда, а также баллоны из нитинола и нейлона хеликальные или же параллельные оси сосуда. Эти конструкции позволяют создать идеальную площадку для имплантации будущего стента. Сперва в процессе исследований ученые не заметили разницы между такими баллонами и стандартными, однако недавно выяснилось, что такие надсекающие баллоны, покрытые лекарственными средствами, показывают лучшие результаты.
Различают два типа металлических стентов: саморасширяющиеся и прикрепленные к дилатирующему баллону. Исследования показывают, что применение первого типа стентов чаще вызывает развитие неоинтимальной гиперплазии. Поэтому в настоящее время часто используются стенты второго типа. Как правило, они состоят из металлической трубочки, в которой с использованием различных техник создаются отверстия. После расширения сосуда баллонным катетером в его просвете создается сеть, обволакивающая его стенки изнутри. Прототипом такого типа стентов являлся стент Palmaz-Schatz, который сейчас уже не применяется.
Исследование 1994 года не показало разницы между имплантацией такого стента и обычной ангиопластикой. Развитие этого направление позволило разработать новые типы стентов. Чаще всего они состоят из нескольких модулей, соединенных коннекторами. Изначально их производили из стали, однако сейчас в качестве материала для изготовления стентов используется платина, кобальт, нитинол (никель-титан), а также только титан. Из-за этого они стали существенно меньше и легче. РКИ выявили преимущества стентов с толстым каркасом перед таковыми с тонким. Предполагают, что они меньше травмируют сосуды, предотвращая таким образом реэндотелизацию.
Существуют также стенты с особым покрытием, создающим непроницаемый для крови барьер. К таким вещества относят политетрафторэтилен и полиэтилен. Сперва их использовали для экстренного закрытия небольших перфораций коронарных артерий, однако сейчас их применяют в профилактике коронарных аневризм и артериовенозных фистул.
Drug-eluting-stents (DES) покрыты специальными веществами, подавляющими пролиферацию клеток эндотелия, таким образом препятствуя рестенозированию сосуда, чаще всего развивающемуся в течение 4–8 месяцев после имплантации.
Стенты – ферромагнетики, плотно устанавливающиеся в сосудистом русле не являются противопоказанием для проведения МРТ.
Существуют специальные стенты для позиционирования их в устьях и разветвлениях сосудов. Как и любой инородный объект в кровеносном русле, стенты являются дополнительным фактором тромбообразования. Поэтому после самой процедуры пациенту всегда назначают ДААТ или ТАТ.
Брахитерапия
Этот метод основан на радиоактивном облучении коронарных артерий при рецидивах после имплантации стентов. Для этого используется бета-излучение, поскольку оно способно проникать лишь на несколько миллиметров внутрь толщи ткани. При этом методе катетер вводят в место стеноза, который прежде был дилатирован баллоном. С помощью этого катетера зону определенное количество времени (3–5 минут) облучают рассчитанной дозой. Васкулярная брахитерапия используется с 1996 года. В феврале 2005 года прекратила свое существование фирма, разрабатывающая аппараты для брахитерапии коронарных сосудов (Beta-Cath-System).
Ротаблационная пластика
Этот метод используется с 1989 года. В сосуд вводится алмазный бор, способный вращаться с частотой 190 000 об. в минуту. С его помощью удаляются ткани в месте рестенозирования. Величина таким образом измельченных частиц составляет 5–10 микрометров (длина эритроцита — 7,5 микрометров). Образуемый канал очень небольшой в диаметре, но достаточный для проведения ПТКА. Как правило, метод используют в случае образования на месте рестеноза кальцификатов. Диаметр головки бора варьируется от 1,25 до 2,5 мм. Поскольку кабель для ротаблационного бора плохо проходит место стеноза, успех операции составляет 80–95 %. К осложнениям относят спазмы сосудов, возникающие чаще (5 %), чем при ПТКА.
Интраваскулярный ультразвук
Еще одним инструментом кардиолога является метод интраваскулярного ультразвука (IVUS). В сосуд вводят ультразвуковой зонд.
Порядок манипуляций напоминает таковой при ПТКА: после позиционирования проводника зонд проводят к месту стеноза. Ультразвук позволяет просмотреть 1 мм тканей на расстоянии от излучателя. Всего на верхушке катетера используется 64 таких кристалла (пьезоэлемента). С помощью этого метода возможно определить состав бляшек и их фибринные, липидные и кальциевые составляющие. Чаще всего к ультразвуку прибегают при неоднозначности ангиографической картины, используя как дополнительный метод обследования.
Всех нас на физиологии мучили графиками давления в сосудах. Мало кто на младших курсах мог подумать, что эти данные действительно используются в диагностике. При каждой коронароангиографии исследуют давление в коронарных артериях и его изменения в зависимости от наличия стенозированных участков. Для этого к исследуемому участку подводят детектор диаметром 0,014 дюймов. Этот катетер продвигают до самого конца коронарной артерии. Потом его тянут обратно. Таким образом фиксируется давление на всем протяжении артерии. На мониторе врачи наблюдают изменение давления; в месте наибольшего его перепада чаще всего и оказывается самый стенозированный участок. Постепенное изменение давления является свидетельством диффузного заболевания сосудов. Важно откалибровать детектор до самого исследования. После аппликации аденозина наблюдается гиперемия, то есть увеличение циркуляции крови, что симулирует состояние нагрузки. После этого давление на протяжении сосуда измеряется еще раз, что позволяет определить, являются ли места стенозирования важными, вызывают ли именно они боли у пациента при физических нагрузках. Аденозиновый тест не является безопасным: возможно развитие нарушений сердечного ритма, однако из-за короткого периода полувыведения аденозина лишь кратковременно.
Спазмы коронарных сосудов и ацетилхолиновый тест
Спазмы коронарных артерий часто являются причиной болей за грудиной в ночное время суток у пациентов без видимых изменений коронарных сосудов. Таким пациентам также назначают коронароангиографию и проводят вышеуказанный провокационный тест, чтобы исключить психогенные или некардиальные причины таких симптомов. Сейчас у каждого человека, уже сдавшего физиологию, должна промелькнуть мысль: «Почему ацетилхолин?». Если вы не находите ответа, возможно, придется снова открыть учебник. Дело в том, что эндотелий сердца при аппликации ацетилхолина вырабатывает NO, что приводит к расширению сосудов. Ацетилхолин оказывает вазоконстрикторное действие на гладкомышечные клетки сосудов в результате прямой их стимуляции, если эндотелий поврежден. Таким образом можно отличить здоровый эндотелий от поврежденного. Здоровые сосуды реагируют на ацетилхолин расширением, поврежденные же сужаются. При сужении сосудов более чем на 75 % по сравнению с аппликацией нитроглицерина внутрикоронарно говорят о коронарном спазме.
Источники
Эндоваскулярное лечение многососудистого поражения венечного русла (клинический пример)
За последнее десятилетие во всем мире выросла доля эндоваскулярных методов лечения ишемической болезни сердца (ИБС). Выбор данной тактики лечения ИБС, в противовес хирургическому лечению, в сочетании с консервативной терапией обусловлен
За последнее десятилетие во всем мире выросла доля эндоваскулярных методов лечения ишемической болезни сердца (ИБС). Выбор данной тактики лечения ИБС, в противовес хирургическому лечению, в сочетании с консервативной терапией обусловлен непосредственной эффективностью и безопасностью эндоваскулярной процедуры, позволяющей добиться адекватного восстановления коронарного кровотока в большинстве случаев.
При атеросклеротическом поражении коронарного русла вид эндоваскулярного вмешательства выбирают на основании рентгенморфологических характеристик поражения венечных сосудов. У пациентов с поражением одного коронарного сосуда основным вмешательством является процедура транслюминальной баллонной ангиопластики (ТЛАП) или стентирования пораженного сегмента коронарной артерии. Операция аортокоронарного шунтирования (АКШ) рекомендуется преимущественно пациентам с поражением ствола ЛКА или пациентам с многососудистым поражением венечного русла. Однако в этом случае при наличии серьезных сопутствующих заболеваний, являющихся противопоказанием к проведению операции АКШ, бывает необходимо проведение эндоваскулярных вмешательств. При выявлении многососудистого поражения коронарных артерий возможно выполнение одномоментной эндоваскулярной процедуры реваскуляризации миокарда на нескольких коронарных сосудах или же выполнение поэтапной эндоваскулярной процедуры.
Увеличивающееся из года в год количество эндоваскулярных вмешательств на коронарных сосудах делает проблему лечения выявленных хронических окклюзий весьма актуальной. Хронически окклюзированные коронарные артерии составляют значительную часть коронарных поражений, выявляемых у пациентов при проведении диагностической коронароангиографии (КАГ) и, в определенной клинической ситуации, требуется проведение реваскуляризации миокарда.
Так, окклюзированные коронарные артерии выявляются примерно у 38% пациентов, а коронарная ангиопластика на хронически окклюзированных коронарных артериях составляет 10–20% всех интервенционных процедур [1, 2, 4].
Выявление полной окклюзии коронарной артерии при КАГ у больных с ИБС может серьезно влиять на выбор дальнейшей лечебной тактики. Хронически окклюзированная коронарная артерия часто является фактором, определяющим выбор специалистов в пользу проведения хирургического лечения, а не эндоваскулярной процедуры.
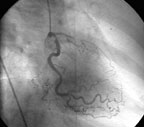 |
| Рисунок 2. Хроническая окклюзия ПМЖВ в средней трети и гемодинамически значимый стеноз ОВ в проксимальной трети у пациентки Ш. |
В Научно-практическом центре интервенционной кардиоангиологии (НПЦИК) Департамента здравоохранения г. Москвы при проведении плановой КАГ также довольно часто обнаруживаются полные хронические окклюзии одной, двух или более коронарных артерий.
Соотношение между общим количеством больных, которым в период с октября 1997 г. по декабрь 2002 г. выполнялась в НПЦИК диагностическая КАГ, и числом пациентов, у которых были выявлены одна или более хронически окклюзированные коронарные артерии, представлено на рисунке 1.
Большинство исследователей в своих работах показали, что одной из главных причин, определяющих различия в тактике лечения больных с наличием или отсутствием окклюзии коронарной артерии, является преобладание больных с трехсосудистым поражением коронарного русла. Считается, что наличие перенесенного инфаркта миокарда в области, кровоснабжаемой окклюзированной артерией, может препятствовать проведению более агрессивной процедуры реваскуляризации миокарда [3].
По данным большинства авторов, наличие окклюзии коронарной артерии у больных ИБС может изменить терапевтическую тактику по нескольким причинам.
Как было сказано выше, коронарная ангиопластика хронических окклюзий составляет, по данным разных авторов, 10–20% всех интервенционных процедур [1, 2, 4]. Наряду с этим, эндоваскулярное восстановление просвета коронарной артерии при ее хронической окклюзии часто остается технически сложной задачей.
Реканализация становится более проблематичной при наличии негативных факторов, влияющих на успех процедуры, таких, как старые повреждения, протяженные, ангиографически неблагоприятные окклюзии, наличие мостовых коллатералей.
Проведению эндоваскулярной реваскуляризации при этом типе поражений препятствуют не только технические трудности, связанные с проведением проводников и других устройств, но и повышенный уровень рестеноза в отдаленном периоде [5, 6, 7].
Известно, что частота непосредственного успеха при ангиопластике на хронически окклюзированных артериях ниже, тогда как времени на облучение, использование аппаратуры затрачивается больше и стоимость процедуры выше, чем при ангиопластике у больных со стенотическими поражениями венечного русла [8].
В НПЦИК в период с октября 1997 г. по декабрь 2002 г. проведено 380 попыток механической реканализации хронически окклюзированных коронарных артерий у 375 больных. При этом успех процедуры был достигнут у 253 больных (67,5%), которым было реканализировано 258 сегментов. В 122 случаях (32,5%) процедура реканализации была безуспешной. Проводниковая реканализация и коронарная ангиопластика окклюзированной коронарной артерии выполнялись 107 больным на 107 сегментах; реканализация, ТЛАП и стентирование — 146 больным, которым был реканализирован 151 сегмент.
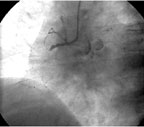 |
| Рисунок 3. Хроническая окклюзия ПКА в проксимальной трети у пациентки Ш. |
По результатам исследований, проведенных в НПЦИК, с технической стороны успех процедуры определялся как способность пройти окклюзированный сегмент и проводником, и баллонным катетером и успешно открыть окклюзированную артерию с величиной остаточного стеноза менее 40%.
При этом эффективной процедура считалась, если не было серьезных кардиальных осложнений на госпитальном этапе. Серьезные кардиальные осложнения определялись как случаи смерти, развития острого инфаркта миокарда или необходимость в проведении экстренной процедуры реваскуляризации миокарда.
По нашему мнению, важным в данной клинической ситуации, является проведение обязательного всестороннего контрольного обследования через 6 мес после эндоваскулярного вмешательства, включающего в себя проведение нагрузочных проб и контрольной КАГ для выявления возможного прогрессирования атеросклеротического процесса в коронарных артериях и развития in-stent стеноза.
Мы хотим продемонстрировать целесообразность проведения эндоваскулярных процедур у больной с двумя хронически окклюзированными коронарными артериями и несколькими гемодинамически значимыми стенозами, с высоким риском проведения операции аортокоронарного шунтирования, обусловленным тяжелой сопутствующей патологией.
Больная Ш., 59 лет поступила в мае 2001 г. в НПЦИК для планового обследования с диагнозом ИБС. Стенокардия напряжения III функционального класса (ФК), гипертоническая болезнь II степени, аутоиммунный тиреоидит Хашимото, гипотиреоз на стадии компенсации, ожирение III степени.
При поступлении в стационар пациентка предъявляла жалобы на давящие боли за грудиной при незначительной физической нагрузке и в покое, кратковременный эффект достигался при приеме нитроглицерина.
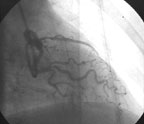 |
| Рисунок 4. Механическая реканализация, баллонная ангиопластика и стентирование средней трети ПМЖВ и прямое стентирование проксимальной трети ОВ у пациентки Ш. |
Из анамнеза было известно, что больная длительное время отмечает подъемы артериального давления до максимальных цифр 200/120 мм рт. ст. Около 6 лет беспокоят приступы стенокардии напряжения и покоя. Ухудшение самочувствия с 19.04.2001 г., когда при незначительной физической нагрузке стали возникать интенсивные загрудинные боли, с кратковременным эффектом от приема нитратов. Была госпитализирована в НПЦИК с подозрением на прогрессирующую стенокардию для обследования и лечения.
Состояние при поступлении: средней степени тяжести. Пациентка повышенного питания. В легких дыхание везикулярное, хрипов нет, ЧДД 16/мин. Тоны сердца приглушены, ритмичные, шумов нет. ЧСС 74/ мин. АД 140/90 мм рт. ст. Со стороны желудочно-кишечного тракта без патологии. Неврологический статус без особенностей.
В биохимических анализах крови у пациентки обращала на себя внимание гиперхолестеринемия — 6,7 ммоль/л.
На ЭКГ: ритм синусовый, нарушение кровоснабжения передне-перегородочно-верхушечно-боковой области левого желудочка, Т(-)III, aVF, V1 — V5.
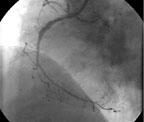 |
| Рисунок 5. Механическая реканализация, ТЛАП и стентирование проксимальной трети ПКА, ТЛАП дистальной трети ПКА у пациентки Ш. |
При проведении суточного мониторирования ЭКГ было выявлено два эпизода депрессии сегмента S-T по 1 каналу до 2 мм, связанных с болевыми ощущениями.
По данным велоэргометрической пробы, на фоне отмены за 1 сут до исследования антиангинальной и гипотензивной терапии результат расценен как положительный: на нагрузке
75 Вт/мин появились типичные ангинозные боли без изменений на ЭКГ. Толерантность к нагрузке низкая.
Учитывая данные клинического течения основного заболевания, жалобы при поступлении в стационар, а также данные инструментальных методов обследования, пациентке было решено провести диагностическую вентрикулографию и коронароангиографию с целью выявления поражения коронарного русла и выработки дальнейшей тактики лечения основного заболевания. Вентрикулография: КДО — 91,3 мл, КСО — 21,2 мл,
Пациентке были выполнены механическая реканализация, баллонная ангиопластика и стентирование средней трети ПМЖВ (баллонная дилятация U-Pass 2 x 20, 17 атм 120 с — три дилятации давлением 14, 17, 12 атм по 120 с и установка стента Bx Velocity 2,5 х 23 мм, 13 атм, 45 с), прямое стентирование проксимальной трети ОВ (стентом Bx Velocity 3,5 х 8мм, 14 атм, 45 с) (рис. 4), проведена механическая реканализация, ТЛАП и стентирование проксимальной трети ПКА (баллон Raptor 2,5 х 15, 18 атм, 120 с, установка стента Multilink Tetra 3,5 х 13, 12 атм, 45 с, с последующей оптимизацией просвета сосуда в проксимальных и дистальных сегментах стента доставочным баллоном под давлением 12 атм по 120 с) и ТЛАП дистальной трети ПКА — баллонная дилятация (баллон Raptor 2,5 х 18, 15 атм, 150 с) (рис. 5).
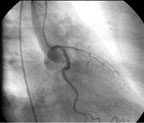 |
| Рисунок 6. Выявленный через 6 месяцев после эндоваскулярного лечения in-stent стеноз ПМЖВ и ОВ у пациентки Ш. |
После механической реканализации, ТЛАП и стентирования ПКА и ПМЖВ — определялся кровоток TIMI 3, диффузные изменения без резких стенозов.
С целью оценки отдаленного результата процедуры стентирования при выявленных хронических окклюзиях коронарных артерий пациентка Ш. была вновь обследована. При поступлении в стационар — жалобы на редкие приступы болей за грудиной при физической нагрузке.
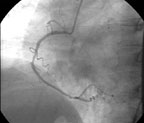 |
| Рисунок 7. Удовлетворительный среднеотдаленный результат механической реканализации, ТЛАП и стентирования проксимальной трети ПКА |
В биохимических анализах крови выявлены гиперхолестеринемия, гипертриглицеридемия: холестерол 7,4 ммоль/л, триглицериды 2,8 ммоль/л.
При обследовании — на ЭКГ: ритм синусовый, правильный, ЧСС 68/мин, отрицательные зубцы Т в грудных отведениях.
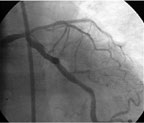 |
| Рисунок 8. Процедура ангиопластики in-stent стеноза среднего сегмента ПМЖВ на нескольких уровнях (в устье ПМЖВ и после отхождения диагональной ветви), процедура баллонной ангиопластики in-stent стеноза ОВ |
С целью оценки результатов ТЛАП in-stent стенозов ПМЖВ и ОВ через 6 мес после проведения эндоваскулярного вмешательства пациентке была вновь проведена диагностическая коронароангиография. Эффективность ТЛАП in-stent стенозов была подтверждена (рис. 9).
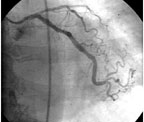 |
| Рисунок 9. Отдаленные ангиографические результаты ТЛАП in-stent стенозов ПМЖВ и ОВ у пациентки Ш. |
Таким образом, на данном клиническом примере показано, что эндоваскулярные процедуры при многососудистом поражении венечного русла являются альтернативой аортокоронарного шунтирования у больных с тяжелыми сопутствующими заболеваниями. Кроме этого, применение интервенционных методов лечения ИБС эффективно и безопасно.
Литература
Д. Г. Иоселиани, доктор медицинских наук, профессор
А. В. Кононов
М. В. Яницкая, кандидат медицинских наук
О. В. Захарова
Научно-практический центр интервенционной кардиоангиологии, Москва