Корнеоциты что это такое
Эпидермальный барьер: от нормы к патологии
В представленной статье обобщены современные данные о строении и функции эпидермального барьера, рассмотрены вопросы его роли в развитии атопического дерматита.
This article summarizes current data on the structure and function of the epidermal barrier, we also considered its role in development of atopic dermatitis.
С тех пор как наземная жизнь стала угрожать млекопитающим обезвоживанием, все более становятся актуальными исследования структурных, клеточных, биохимических и регуляторных механизмов организма, участвующих в поддержании гомеостаза проницаемости эпидермального барьера [1].
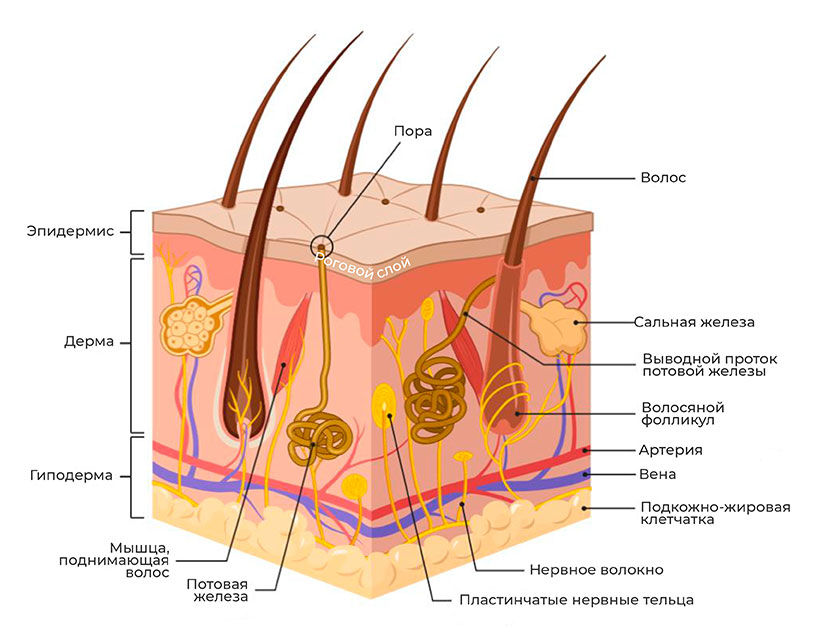
Кожа обеспечивает жизненно важную функцию, защищая позвоночных от повседневных и экстремальных влияний факторов внешней среды, таких как воздействие антигенов, ультрафиолетового света, моющих средств, микроорганизмов, токсинов, наночастиц и иных повреждений [2]. Таким образом, эпидермальный барьер, являясь физическим барьером [3], обеспечивает защиту организма на границе двух сред, ограничивая как потерю воды из организма, так и попадание патогенных микроорганизмов в организм [4].
Важнейшая составная часть эпидермального барьера, от которой зависит проникновение раздражителей и аллергенов, находится в нижней части рогового слоя [5]. Несмотря на минимальные размеры (толщина около 7–35 мкм), он играет определяющую роль в формировании защитного барьера и способствует предотвращению чрезкожного проникновения патогенов. Кроме роли физического барьера, роговой слой участвует в терморегуляции, газообмене, гидратации, обеспечении врожденного иммунитета, а создавая определенную pH поверхности кожи (слегка кислую), обеспечивает дополнительную защиту от болезнетворных микроорганизмов [6].
Во время терминальной дифференцировки кератиноциты зернистого слоя «заменяют» свою клеточную мембрану на нерастворимый белковый слой — роговую оболочку [7]. Она придает прочность корнеоцитам и является «платформой» для прикрепления липидов. Роговая оболочка в основном сформирована структурными белками, такими как лорикрин, инволюкрин, филаггрин (ФЛГ) и малыми пролин-богатыми белками. Особенно важен филаггрин, объединяющий кератиновые волокна клеток, «скручивая» кератиноциты в уплощенные диски с большой площадью поверхности [8].
Вокруг корнеоцитов расположены холестерин, фосфолипиды и церамиды, создавая многослойную мембрану из липидных пластинок [3, 9]. Последние играют важную роль в регуляции водного гомеостаза кожи, помогают сохранять воду в организме, а также предотвращают проникновение патогенных микроорганизмов и аллергенов [10].
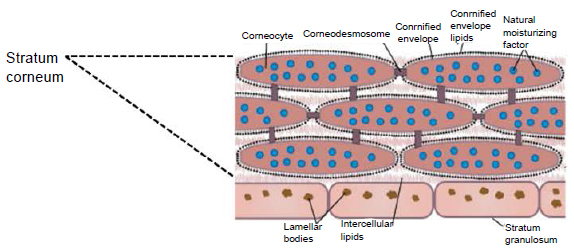
На границе между роговым и зернистым слоями происходит секреция ламеллярных телец, содержащих предшественники липидов, а также необходимые ферменты для переработки этих прекурсоров в зрелые составляющие липидной матрицы [11]. Перед секрецией происходит сборка ламеллярных телец в пластинчатом комплексе, посредством дифференцированной их упаковки с различным содержимым [12]. Кроме вышеупомянутых метаболитов липидов, липидные тельца доставляют в межклеточное пространство рогового слоя протеолитически активные ферменты, такие как сериновые протеазы семейства калликреина, а также их ингибиторов, в том числе и лимфоэпителиальный ингибитор сериновых протеаз типа Kazal-5 (LEKTI) [13].
Единство между корнеоцитами рогового слоя зависит прежде всего от корнеодесмосом. Подобно десмосомам, они поддерживают целостность тканей посредством молекул межклеточной адгезии с помощью кальций-зависимых взаимодействий между двумя представителями семейства кадгерина, внеклеточных трансмембранных гликопротеинов — десмоглеина и десмоколлина. Внутри корнеоцитов десмоглеин и десмоколлин соединяют кератиновые филламенты корнеодесмосом посредством «соединительной бляшки», состоящей из плакоглобина, десмоплакина и плакофиллина. Десмоглеин и десмоколлин перемещаются от оболочки корнеоцитов в липидную пластину между корнеоцитами и связывают воедино белки соседних клеток. Кроме того, в процессе кератинизации эпителия экспрессируется специфический белок с молекулярной массой 52 кДа — корнеодесмосин [8, 14]. После секреции в экстрацеллюлярное пространство корнеодесмосин перемещается в область между зернистым и роговым слоями и проникает в десмосому. Появление корнеодесмосина знаменует переход от десмосом к корнеодесмосомам [3, 12].
Во время «нормальной» десквамации рогового слоя самые поверхностные корнеоциты «уходят» с поверхности кожи, замещаясь кератиноцитами, подвергшимися терминальной дифференцировке [14, 15]. Таким образом, существует «тонкий» баланс между базальной клеточной пролиферацией и десквамацией рогового слоя. Это обеспечивает постоянное обновление клеток эпидермиса, а также способствует поддержанию одинаковой толщины эпителия [14, 16]. Caubet и соавт. [15] описали несколько деградационных протеаз, которые разрушают внеклеточные корнеодесмосомальные адгезивные белки, связывающие корнеоциты вместе.
В роговом слое среди протеаз, вовлеченных в процесс десквамации, присутствуют хемотрипсиновые (SCCE) и трипсиновые ферменты (SCTE), которые экспрессируются кератиноцитами зернистого слоя и находятся во внеклеточном пространстве рогового слоя [14]. Данные протеазы гидролизуют корнеодесмосин и десмоколлин [15]. Их активность контролируется семейством специфических ингибиторов, в которое входит LEKTI [17]. При этом скорость десквамации коррелирует с количеством ингибиторов протеаз, поступивших из ламеллярных телец [3].
На барьерную функцию эпидермиса влияют структура, дифференцировка, функциональная активность кератиноцитов, качественный и количественный состав липидов рогового слоя эпидермиса, наличие веществ, относящихся к естественному увлажняющему фактору, а также рН поверхности кожи [18]. При изменении каких-либо из перечисленных показателей барьерная функция эпидермиса нарушается, что приводит к усиленному испарению воды через роговой слой. У человека эпидермальный барьер восстанавливается на 60% через 12 часов, а полное восстановление занимает 72 часа [19]. Полагают, что быстрое восстановление эпидермального барьера происходит за счет массового выброса из клеток готовых ламеллярных телец. В медленную фазу восстановления усиливается синтез жирных кислот, холестерина, церамидов, а также образование новых ламеллярных гранул. Нарушение восстановления кожного барьера приводит к обезвоживанию эпидермиса и развитию выраженной сухости кожи, что и наблюдается при развитии атопического дерматита (АД) [20].
Повреждение эпидермального барьера способствует проникновению через кожу микробов, аллергенов и различных поллютантов (токсины, раздражающие и загрязняющие вещества). Проникновение агентов с антигенными свойствами увеличивает риск сенсибилизации, поскольку взаимодействие аллергенов и аллерген-представляющих клеток кожи инициирует воспаление [14]. Степень дисфункции барьера коррелирует со степенью воспаления и тяжестью АД [11]. Впервые Y. Werner и M. Lindberg (1985 г.) привели доказательства нарушений барьерной функции кожи, измерив трансэпидермальную потерю воды (ТЭПВ) у лиц с АД. Авторам удалось показать, что у больных АД нарушения эпидермального барьера отмечаются не только в очагах активного воспаления, но и на клинически неизмененной коже [10, 21].
Изменения в свойствах эпидермального барьера, которые наблюдаются при АД, включают увеличение ТЭПВ, изменения рН поверхности кожи, повышение ее проницаемости, увеличение бактериальной колонизации, изменение в экспрессии антимикробных пептидов, а также нарушение его целостности. При аномалии эпидермального барьера аллергены, раздражающие и другие вещества могут проникать через кожу, способствуя обострению АД [6].
В настоящее время нарушение функции кожного барьера является одним из ведущих этиопатогенетических факторов АД. По данным разных авторов у 30–66% больных АД протекает без изменения уровня общего IgE в сыворотке крови и специфичных IgE к аллергенам. Полагают, что именно у этих пациентов нарушение функции кожного барьера играет ведущую роль в развитии и прогрессировании заболевания [22].
В последние годы определен ряд генетических мутаций, приводящих к изменениям в роговом слое эпидермиса. Так, у больных АД определяются мутации гена профилаггрина [23], способствующие нарушению синтеза белка ФЛГ — одного из компонентов цитокератинового скелета, обеспечивающего ороговение кератиноцитов. В результате изменения терминальной дифференцировки кератиноцитов развивается их функциональная несостоятельность [24]. Кроме того, снижение экспрессии гена ФЛГ уменьшает уровень «натурального увлажняющего фактора» [25]. Дефицит ФЛГ и/или продуктов его деградации способствует сухости кожи, что коррелирует с клинической картиной нарушения эпидермального барьера при АД [26]. Более того, при уменьшении ФЛГ усиливается «раздражающий» эффект аллергенов на дендритные клетки, понижая при этом порог их чувствительности к воспалению, что демонстрирует важность этого белка в предотвращении пенетрации аллергенов [27].
Кроме того, у больных АД выявлены полиморфные варианты гена SPINK5, приводящие к дизрегуляции синтеза ингибитора сериновой протеазы LEKTI, который в норме блокирует избыточную продукцию SCCE [28]. Активность деградационных протеаз также значимо связана с дефектом кожного барьера при АД [23]. Разбалансировка функционирования этих ферментов ведет к усиленному отшелушиванию клеток и истончению рогового слоя, увеличивая проницаемость эпидермального барьера [14]. Установлено, что у больных АД изменена липидная мантия рогового слоя, предупреждающая ТЭПВ. Отмечается низкий уровень церамидов первого и третьего типов в сочетании с повышением уровня свободного холестерола [29]. Повышение уровня рН на поверхности кожи приводит к снижению синтеза липидов и активизации ферментов (в частности, SCCE), повреждающих корнеодесмосомы. Уменьшение количества веществ, относящихся к «натуральному увлажняющему фактору», также способствует нарушению функционирования эпидермального барьера [30].
Таким образом, у больных АД отмечается комплекс нарушений, приводящих к дисфункции кожного барьера, усилению ТЭПВ и обезвоживанию кожных покровов [14]. Из вышеуказанного следует, что пациенты с АД могут иметь дефект кожного барьера, в основе которого лежат как генетические, так и приобретенные механизмы. Этот дефект способны спровоцировать внешние факторы, такие как царапины, использование моющих средств, микробная колонизация, а также воздействие протеаз различных аллергенов (в частности, протеаз клещей домашней пыли) [10]. Распознание конкретных механизмов, участвующих в патогенезе воспалительных заболеваний кожи, в частности, АД, безусловно, будет способствовать поиску и разработке новых, более эффективных методов воздействия на патологический процесс с минимальным количеством системных эффектов [8].
Литература
ГБОУ ВПО БГМУ МЗ РФ, Уфа
Кожа под микроскопом: эпидермис
Строение кожи — это основа основ, азбука для понимания действия косметических средств и процедур. Необязательно углубляться в анатомию, но базовые знания — это абсолютный must. А понимание науки о коже и того, как наша кожа защищает и омолаживает себя, поможет вам правильно ухаживать за ней.
Например, если ваша кожа очень сухая от природы, вы можете использовать средства по уходу за кожей, которые помогут укрепить кожный барьер, удерживая влагу и восполнять дефицит жиров. Для жирной кожи можно использовать продукты, контролирующие избыток липидов на поверхности кожи.
ИЗ ЧЕГО СОСТОИТ НАША КОЖА
Кожа — это самый большой орган нашего тела, который отделяет внутреннюю среду организма от внешней. С одной стороны кожа выступает щитом, отражающим внешнюю агрессию, а с другой — определять самооценку и успехи человека в личной и общественной жизни.
Миллионы лет эволюции оптимизировали нашу кожу и сделали ее такой, какая она есть:
На этом рисунке хорошо видно три слоя кожи: эпидермис, дерму и гиподерму.
КАКИЕ ФУНКЦИИ ВЫПОЛНЯЕТ КОЖА
Помимо этого кожа – это зеркало, отражающее состояние внутренних органов:
Рассмотрим кожу под микроскопом и в этой статье поговорим о самом верхнем слое – эпидермисе.
Самый верхний слой кожи. Именно на него мы наносим кремы, лосьоны и сыворотки, точнее мы наносим на самый верхний его слой.
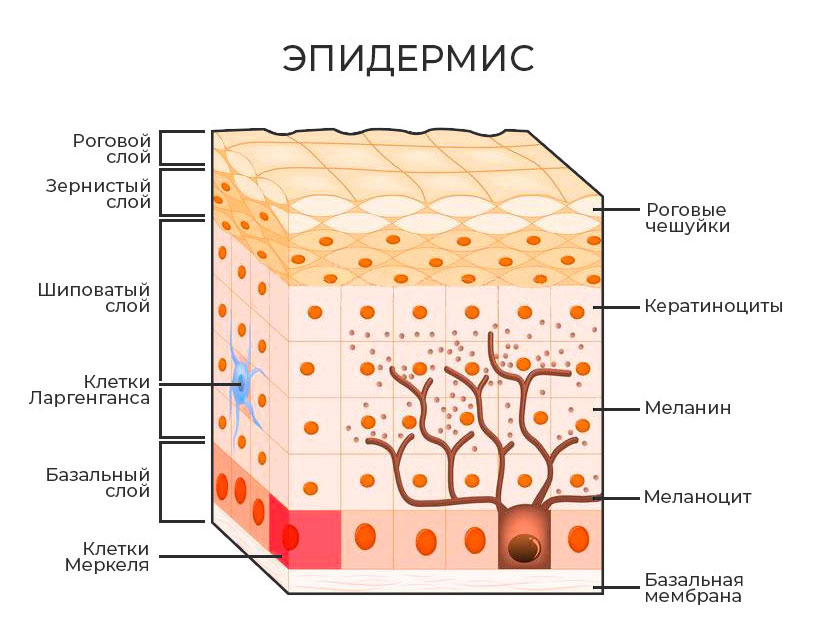
Вы уже, наверное, поняли, что многослойность – это не только модный тренд в одежде, но и девиз нашей кожи, поэтому уже не удивитесь, узнав, что эпидермис также состоит из 5 слоев (идем снизу вверх – от базальной мембраны к самой поверхности):
Базальный. Самый глубокий слой эпидермиса называется базальным слоем, иногда его называют зародышевым слоем. Здесь находятся стволовые клетки. Поскольку этот слой является самым внутренним слоем, многие продукты для местного применения, которые вы наносите на поверхность кожи, не могут достичь этого слоя и оказать воздействие. В базальном слое «рождаются» новые клетки кожи, известные как «кератиноциты». По мере производства эти новые клетки перемещаются вверх, подталкивая существующие старые клетки еще выше в процессе, известном как «кератинизация». В конце концов, эти клетки кожи достигают внешнего слоя кожи, где они отталкивают отмершие шелушащиеся клетки и заменяют их. Этот процесс может занять 26-40 дней и зависит от возраста, генетики, гидратации и космецевтики.
Шиповатый. Самый обширный слой, придает эпидермису прочность. Именно в нем запускается синтез кератина.
Зернистый. Кератиноциты в этом слое также производят липиды и естественный увлажняющий фактор (NMF), которые делают вашу кожу водонепроницаемой и помогают ей удерживать влагу. NMF в основном состоит из аминокислот. Он находится внутри ваших клеток и помогает им удерживать воду. Если у вас недостаточно NMF, ваша кожа будет с трудом удерживать воду и станет обезвоженной, если у вас нет других вещей, таких как сильный липидный барьер или чрезмерное производство кожного сала, чтобы помочь вашим клеткам удерживать воду
В верхних слоях эпидермиса (прозрачный слой и роговой слой) гранулы раскрываются, высвобождая свое содержимое в пространство между клетками. Это «омывает» прозрачный и роговой слой важными липидами, которые составляют кожный барьер, и многими защитными белками. Чрезмерное использование гидроксикислот, ретиноидов и других отшелушивающих ингредиентов может повредить этот важный слой.
Блестящий. Получил свое название от того факта, что здесь больше нет гранул, поэтому клетки выглядят прозрачными. Этот тонкий слой клеток находится только в толстой коже на ладонях и пальцах рук, а также на подошвах ног.
Роговой. Это самый внешний слой эпидермиса, поэтому он подвергается воздействию атмосферы за пределами вашего тела. В роговом слое обычно имеется от 15 до 30 слоев клеток, которые играют важную защитную роль. Клетки в этом слое помогают предотвратить проникновение бактерий, вирусов и грибков в более глубокие слои кожи, а также обеспечивают защиту от стирания и трения более нежных нижележащих слоев. Под воздействием солнца и трения роговой слой грубеет и утолщается.
Здесь же находится «кожный барьер», предотвращающий испарение воды. Весь роговой слой заменяется новыми клетками в процессе, известном как десквамация. Новые клетки поднимаются от базального слоя, где они образовались, и выталкивают «старые» клетки на поверхность. Этот процесс обычно занимает около четырех недель.
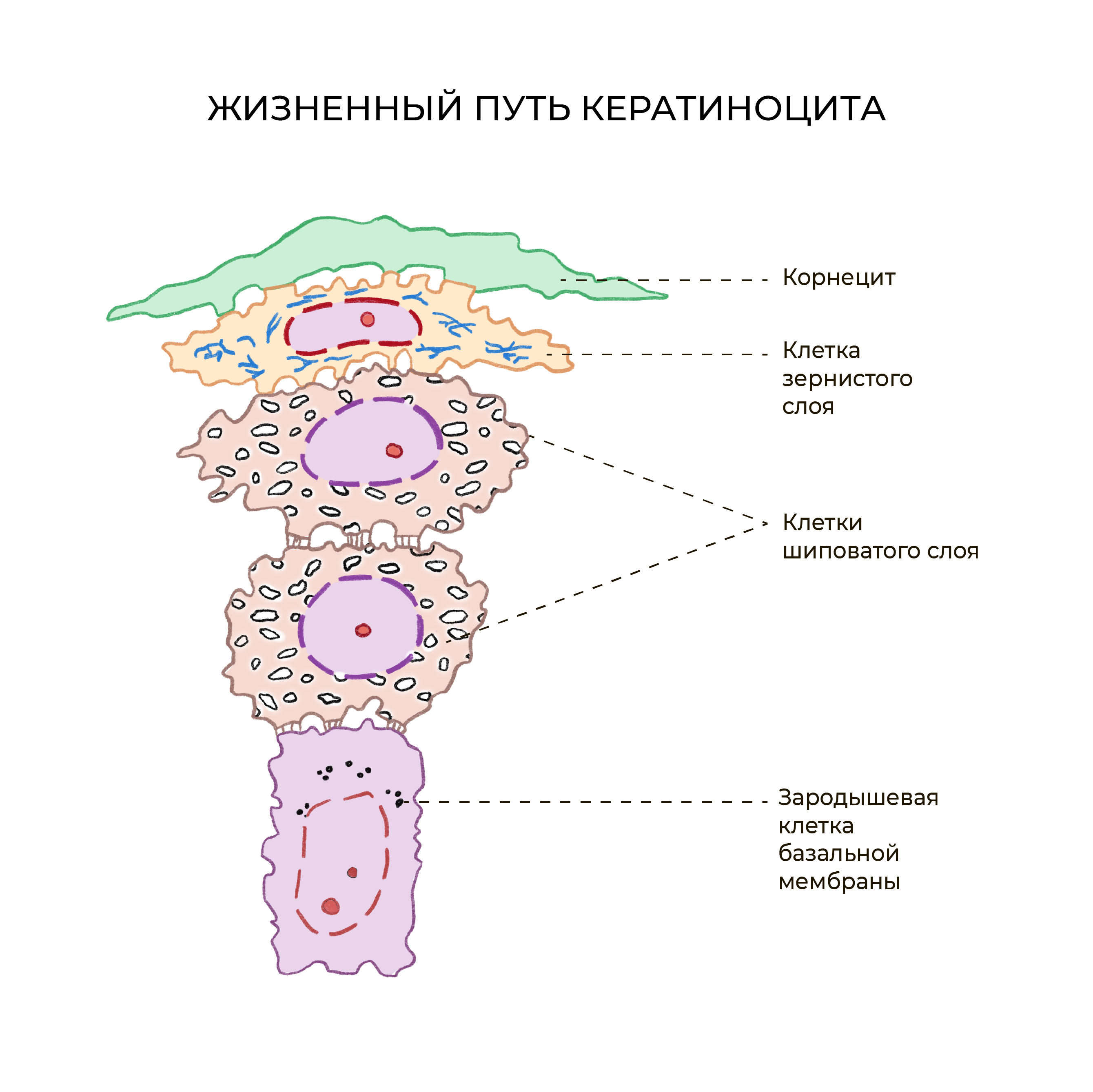
ЖИЗНЕННЫЙ ПУТЬ ПУТЕШЕСТВЕННИКА-КЕРАТИНОЦИТА
Самые многочисленные клетки эпидермиса называются кератиноциты. Они образуются в базальном слое, затем в течение 28 дней поднимаются все выше к роговому, становятся более плоскими и в конечном итоге превращаются в мертвые корнеоциты.
Корнеоциты почти полностью состоят из кератина.
Мертвые чешуйки из рогового слоя эпидермиса слетают с нашей кожи в огромных количествах практически ежеминутно и образуют обычную бытовую пыль, которую мы потом смахиваем с книжным полок и из-под дивана во время уборки.
Понимание жизненного цикла кератиноцитов очень важно для нас в контексте уходовых процедур. Если что-то пошло не так, и на пути кератиноцита возникли препятствия, то это непременно отразится на внешнем виде кожи:
Помимо кератиноцитов в эпидермисе встречаются и другие клетки:
Все клетки кожи тесно связаны между собой и образуют единое сообщество.
Теперь, когда вы знаете строение эпидермиса и жизненный цикл путешественника-кератиноцита, вы сможете лучше понимать, как именно работают все наши кремы, лосьоны и сыворотки, которые мы ежедневно на себя наносим.
В следующем выпуске «Кожа под микроскопом» мы копнем еще глубже и рассмотрим средний слой кожи – дерму. Так что не переключайтесь!
Если у Вас остались или появились вопросы, не стесняйтесь и задавайте их под последним постом в Instagram,
а также подписывайтесь на Telegram-канал.
Корнеоциты что это такое
Анатомия и физиология кожи
Кожа – наш самый большой орган, составляющий 15% от общей массы тела. Она выполняет множество функций, прежде всего защищает организм от воздействия внешних факторов физической, химической и биологической природы, от потери воды, участвует в терморегуляции. Последние научные данные подтверждают, что кожа не только обладает собственной иммунной системой, но и сама является периферическим иммунном органом.
Структура кожи
Кожа состоит из 3 слоев: эпидермиса, дермы и подкожной жировой клетчатки (ПЖК) (рис. 1). Эпидермис – самый тонкий из них, представляет собой многослойный ороговевающий эпителий. Дерма – средний слой кожи. Главным образом состоит из фибрилл структурного белка коллагена. ПЖК содержит жировые клетки – адипоциты. Толщина этих слоев может значительно варьировать в зависимости от анатомического места расположения.
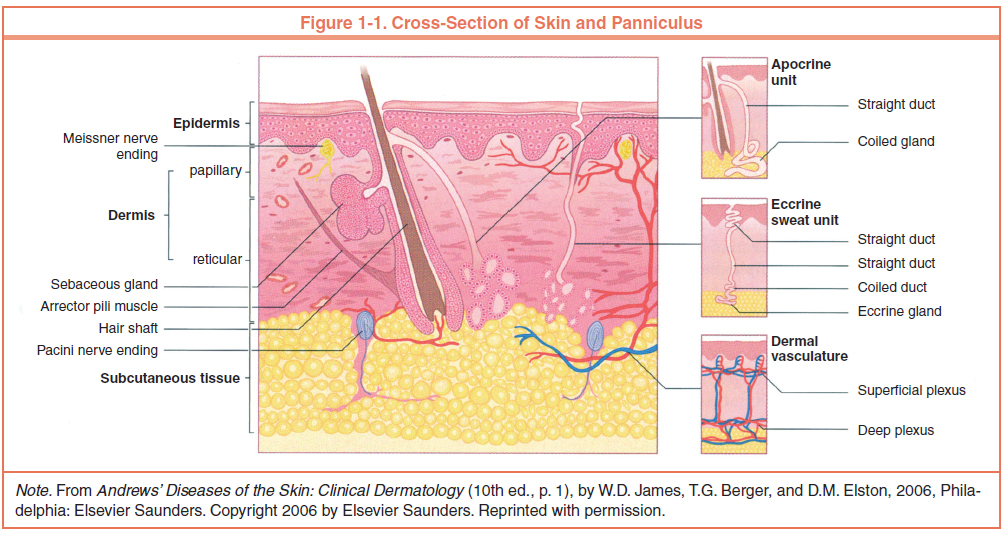
Эпидермис
Кератинизация. По мере дифференцировки кератиноцитов и продвижения от базального слоя до рогового происходит их кератинизация (ороговевание) – процесс, начинающийся с фазы синтеза кератина кератиноцитами и заканчивающийся их клеточной деградацией. Кератин служит строительным блоком для промежуточных филаментов. Пучки из этих филаментов, достигая цитоплазматический мембраны, формируют десмосомы, необходимые для образования прочных контактов между соседними клетками. Далее, по мере процесса эпителиальной дифференцировки, клетки эпидермиса вступают в фазу деградации. Ядра и цитоплазматические органеллы разрушаются и исчезают, обмен веществ прекращается, и наступаетапоптозклетки, когда она полностью кератинизируется (превращается в роговую чешуйку).
Базальный слой эпидермиса состоит из одного ряда митотически активных кератиноцитов, которые делятся в среднем каждые 24 часа и дают начало новым клеткам новым клеткам вышележащих эпидермальных слоев. Они активируются только в особых случаях, например при возникновении раны. Далее новая клетка, кератиноцит, выталкивается в шиповатый слой, в котором она проводит до 2 недель, постепенно приближаясь к гранулярному слою. Движение клетки до рогового слоя занимает еще 14 дней. Таким образом, время жизни кератиноцита составляет около 28 дней.
Надо заметить, что не все клетки базального слоя делятся с такой скоростью, как кератиноциты. Эпидермальные стволовые клетки в нормальных условиях образуют долгоживущую популяцию с медленным циклом пролиферации.
Шиповатый слой эпидермиса состоит из 5-10 слоев кератиноцитов, различающихся формой, структурой и внутриклеточным содержимым, что определяется положением клетки. Так, ближе к базальному слою, клетки имеют полиэдрическую форму и круглое ядро, но по мере приближения клеток к гранулярному слою они становятся крупнее, приобретают более плоскую форму, в них появляются ламеллярные гранулы, в избытке содержащие различные гидролитические ферменты. Клетки интенсивно синтезируют кератиновые нити, которые, собираясь в промежуточные филаменты, остаются не связанными со стороны ядра, но участвуют в образовании множественных десмосом со стороны мембраны, формируя связи с соседними клетками. Присутствие большого количества десмосом придает этому слою колючий вид, за что он и получил название «шиповатый».
Зернистый слой эпидермиса составляют еще живые кератиноциты, отличающиеся своей уплощенной формой и большим количеством кератогиалиновых гранул. Последние отвечают за синтез и модификацию белков, участвующих в кератинизации. Гранулярный слой является самым кератогенным слоем эпидермиса. Кроме кератогиалиновых гранул кератиноциты этого слоя содержат в большом количестве лизосомальные гранулы. Их ферменты расщепляют клеточные органеллы в процессе перехода кератиноцита в фазу терминальной дифференцировки и последующего апоптоза. Толщина гранулярного слоя может варьировать, ее величина, пропорциональная толщине вышележащего рогового слоя, максимальна в коже ладоней и подошв стоп.
Блестящий слой эпидермиса (назван так за особый блеск при просмотре препаратов кожи на световом микроскопе) тонкий, состоит из плоских кератиноцитов, в которых полностью разрушены ядра и органеллы. Клетки наполнены элейдином – промежуточной формой кератина. Хорошо развит лишь на некоторых участках тела – на ладонях и подошвах.
Роговой слой эпидермиса представлен корнеоцитами (мертвыми, терминально-дифференцированными кератиноцитами) с высоким содержанием белка. Клетки окружены водонепроницаемым липидным матриксом, компоненты которого содержат соединения, необходимые для отшелушивания рогового слоя (рис. 3). Физические и биохимические свойства клеток в роговом слое различаются в зависимости от положения клетки внутри слоя, направляя процесс отшелушивания наружу. Например, клетки в средних слоях рогового слоя обладают более сильными водосвязывающими свойствами за счет высокой концентрации свободных аминокислот в их цитоплазме.
Дерма
Дерма представляет собой сложноорганизованную рыхлую соединительную ткань, состоящую из отдельных волокон, клеток, сети сосудов и нервных окончаний, а также эпидермальных выростов, окружающих волосяные фолликулы и сальные железы. Клеточные элементы дермы представлены фибробластами, макрофагами и тучными клетками. Лимфоциты, лейкоциты и другие клетки способны мигрировать в дерму в ответ на различные стимулы.
Дерма, составляя основной объем кожи, выполняет преимущественно трофическую и опорную функции, обеспечивая коже такие механические свойства, как пластичность, эластичность и прочность, необходимые ей для защиты внутренних органов тела от механических повреждений. Также дерма удерживает воду, участвует в терморегуляции и содержит механорецепторы. И, наконец, ее взаимодействие с эпидермисом поддерживает нормальное функционирование этих слоев кожи.
В дерме нет такого направленного и структурированного процесса клеточной дифференцировки, как в эпидермисе, тем не менее в ней также прослеживается четкая структурная организация элементов в зависимости от глубины их залегания. И клетки, и внеклеточный матрикс дермы также подвергаются постоянному обновлению и ремоделированию.
Коллаген – один из главных компонентов ВКМ дермы. Синтезируется фибробластами. Процесс его биосинтеза сложный и многоступенчатый, в результате которого фибробласт секретирует в экстрацеллюлярное пространство проколлаген, состоящий из трех полипептидных α-цепей, свернутых в одну тройную спираль. Затем мономеры проколлагена ферментивным путем собираются в протяженные фибриллярные структуры различного типа. Всего в коже не менее 15 типов коллагена, в дерме больше всего I, III и V типов этого белка: 88, 10 и 2% соответственно. Коллаген IV типа локализуется в зоне базальной мембраны, а коллаген VII типа, секретируемый кератиноцитами, играет роль адаптерного белка для закрепления фибрилл ВКМ на базальной мембране (рис. 4). Волокна структурных коллагенов I, III и V типов служат каркасом, к которому присоединяются другие белки ВКМ, в частности коллагены XII и XIV типов. Считается, что эти минорные коллагены, а также небольшие протеогликаны (декорин, фибромодулин и люмикан) регулируют формирование структурных коллагеновых волокон, их диаметр и плотность образуемой сети. Взаимодействие олигомерных и полимерных комплексов коллагена с другими белками, полисахаридами ВКМ, разнообразными факторами роста и цитокинами приводит к образованию особой сети, обладающей определенной биологической активностью, стабильностью и биофизическими характеристиками, важными для нормального функционирования кожи. В папиллярном слое дермы волокна коллагена располагаются рыхло и более свободно, тогда как ее ретикулярный слой содержит более крупные тяжи коллагеновых волокон.
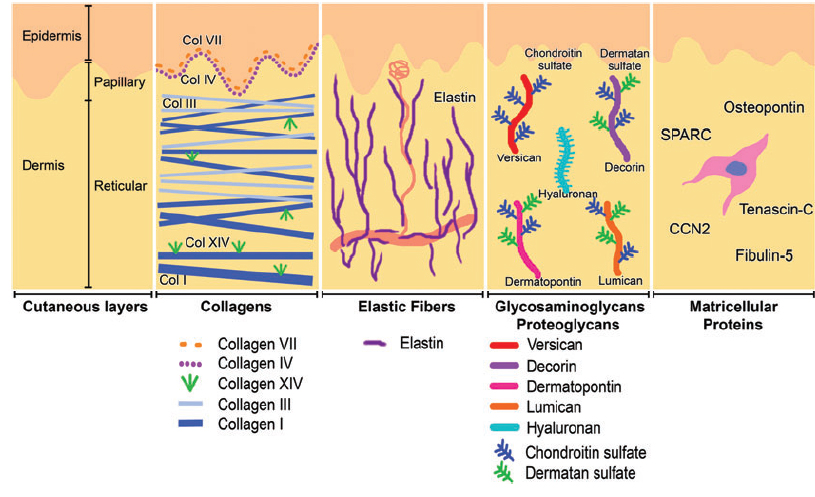
Коллаген постоянно обновляется, деградируя под действием протеолитических ферментов коллагеназ и замещаясь вновь синтезированными волокнами. Этот белок составляет 70% сухого веса кожи. Именно коллагеновые волокна «держат удар» при механическом воздействии на нее.
Эластин формирует еще одну сеть волокон в дерме, наделяя кожу такими качествами, как упругость и эластичность. По сравнению с коллагеном эластиновые волокна менее жесткие, они скручиваются вокруг коллагеновых волокон. Именно с эластиновыми волокнами связываются такие белки, как фибулины и фибриллины, с которыми, в свою очередь, связывается латентный TGF-β-связывающий белок (LTBP). Диссоциация этого комплекса приводит к высвобождению и к активации TGF-β, самого мощного из всех факторов роста. Он контролирует экспрессию, отложение и распределение коллагенов и других матриксных белков кожи. Таким образом, интактная сеть из волокон эластина служит депо для TGF-β.
ГК с легкостью образует вторичные водородные связи и внутри одной молекулы, и между соседними молекулами. В первом случае они обеспечивают формирование относительно жестких спиральных структур. Во втором – происходит ассоциация с другими молекулами ГК и неспецифическое взаимодействие с клеточными мембранами, что приводит к образованию сети из полимеров полисахаридов с включенными в нее фибробластами. На длинную молекулу ГК, как на нить, «усаживаются» более короткие молекулы протеогликанов (версикана, люмикана, декорина и др.), формируя агрегаты огромных размеров. Протяженные во всех направлениях, они создают каркас, внося вклад в стабилизацию белковой сети ВКМ и фиксируя фибробласты в определенном окружении матрикса. В совокупности все эти свойства ГК наделяют матрикс определенными химическими характеристиками – вязкостью, плотностью «ячеек» и стабильностью. Однако сеть ВКМ является динамической структурой, зависящей от состояния организма. Например, в условиях воспаления агрегаты ГК с протеогликанами диссоциируют, а образование новых агрегатов между вновь синтезированными молекулами ГК (обновляющимися каждые 3 дня) и протеогликанами блокируется. Это приводит к изменению пространственной структуры матрикса: увеличивается размер его ячеек, меняется распределение всех волокон, структура становится более рыхлой, клетки меняют свою форму и функциональную активность. Все это сказывается на состоянии кожи, приводя к снижению ее тонуса.
Помимо регуляции водного баланса и стабилизации ВКМ, ГК выполняет важную регуляторную роль в поддержании эпидермального и дермального гомеостаза. ГК активно регулирует динамические процессы в эпидермисе, включая пролиферацию и дифференцировку кератиноцитов, окислительный стресс и воспалительный ответ, поддержание эпидермального барьера и заживление раны. В дерме ГК также регулирует активность фибробластов и синтез коллагена. Ремоделируя матрикс, ГК управляет функционированием клеток в матриксе, влияя на их доступность для различных факторов роста и изменяя их функциональную активности. От действия ГК зависит миграция клеток и иммунный ответ в ткани. Таким образом, изменения в распределении, организации, молекулярном весе и метаболизме ГК имеют значимые физиологические последствия.
Фибробласты представляют собой основной тип клеточных элементов дермы. Именно эти клетки отвечают за продукцию ГК, коллагена, эластина, фибронектина и многих других белков межклеточного матрикса, необходимых для формирования соединительной ткани. Фибробласты в различных слоях дермы различаются и морфологически, и функционально. От глубины их залегания в дерме зависит не только количество синтезируемого ими коллагена, но и соотношение типов этого коллагена, например I и III типов, а также синтез коллагеназы: фибробласты более глубоких слоев дермы производят меньшее ее количество. Вообще, фибробласты – очень пластичные клетки, способные менять свои функции и физиологический ответ и даже дифференцироваться в другой тип клеток в зависимости от полученного стимула. В роли последнего могут выступать и сигнальные молекулы, синтезированные соседними клетками, и перестройка окружающего ВКМ.