Концентрическое ремоделирование лж что это
Концентрическое ремоделирование лж что это
а) Патогенез. Концентрическая гипертрофия левого желудочка или его дилатация. При аортальном стенозе левый желудочек реагирует на перегрузку давлением развитием концентрической гипертрофии, направленной на поддержание постоянного напряжения желудочковой стенки (закон Лапласа). Однако реакция желудочка на перегрузку давлением не у всех больных проявляется развитием гипертрофии. Так, существуют отчетливые половые различия: у женщин аортальный стеноз значительно чаще приводит к гипертрофии миокарда левого желудочка, чем у мужчин (81% против 54%).
Если хроническая постнагрузка не сопровождается адекватной гипертрофией левого желудочка, направленной на компенсацию повышенного напряжения его стенки, то происходит расширение его полости и глобальное снижение сократительной функции [феномен «несоответствия постнагрузке» (англ, «afterload mismatch»)]. Такая форма ремоделирования при аортальном стенозе у мужчин наблюдается чаще, чем у женщин. Снижение фракции выброса левого желудочка сопровождается уменьшением потока крови через аортальный клапан вследствие снижения градиента давления на аортальном клапане.
Даже если сократимость левого желудочка не нарушена и фракция выброса еще нормальная, то уже на ранней стадии заболевания вследствие увеличения постнагрузки и гипертрофии левого желудочка развивается диастолическая дисфункция и снижается мощность систолического выброса.
б) Значение эхокардиографии:
1. Стадии ремоделирования левого желудочка. Важными задачами эхокардиографического исследования у больных аортальным стенозом являются определение стадии ремоделирования левого желудочка и количественная оценка такой геометрической перестройки. Особенно важна своевременная диагностика сниженной систолической функции левого желудочка, так как у больных с высокой степенью аортального стеноза и сниженной сократительной функцией прогноз неблагоприятный, даже при отсутствии клинических проявлений, что делает целесообразным протезирование аортального клапана.
2. Фракция выброса левого желудочка (LVEF). Выполняя ЭхоКГ, следует дать как количественную, так и качественную оценку систолической функции левого желудочка в целом. Для количественной оценки наряду с определением фракции укорочения при ЭхоКГ в М-режиме следует определить также фракцию выброса левого желудочка по Симпсону.
Редактор: Искандер Милевски. Дата публикации: 5.1.2020
Концентрическое ремоделирование левого желудочка: что это такое
Что такое концентрическое ремоделирование левого желудочка
Концентрическое ремоделирование миокарда левого желудочка считается наиболее распространенной формой данной болезни. Как правило, оно развивается в первую очередь у людей, имеющих артериальную гипертензию. Данный тип не имеет способности изменять внутреннее пространство левого желудочка, происходит лишь изменение стенок сердца и увеличение перегородки между сердечными отделами. Стоит сказать, что эта форма может начать свое развитие на фоне имеющейся гипертрофии левого желудочка. Кстати, гипертрофия, как правило, развивается при увеличенных физических нагрузках, либо же, как следствие гипертонии. Помимо стандартных причин возникновения, имеются и другие, которые не лучшим образом влияют на здоровье человека, а это могут быть пагубные привычки, такие как курение, злоупотребление алкоголем и др.
Начинается заболевание с гипертрофии левого желудочка и проявляется повышением толщины его стенки
Важно знать, что самостоятельная диагностика ремоделирования миокарда не приведет ни к чему хорошему, но, все-таки следует разбираться в первоначальных признаках, которые способствуют возникновению болезни, это такие, как:
При первых же проявлениях подобных симптомов необходимо обратиться к специалисту, который должен назначить кардиограмму. Только этот метод исследования поможет определить наличие данной болезни. Следует сказать, что запущенная форма может привести к необратимым последствиям, например, к развитию хронической сердечной недостаточности.
Ремоделирование сердца
Нет ничего сложнее, нежели перенести тяжелую болезнь сердца, которая приводит также к определенным последствиям. Одной из таковых является ремоделирование сердца. Ремоделирование сердца — это структурные изменения органа, разрушающие его свойства в ответ на внешние воздействия и другие патологические процессы в организме человека.
Ремоделирование сердца проишодит под воздействием негативных факторов и заболеваний
Причины возникновения
Необходимо уточнить, что данный недуг может развиваться и на почве других сердечных заболеваний, это и приводит к особенным формам развития. Помимо таких негативных факторов, как болезни, ремоделирование миокарда может проявиться и как следствие некачественного лечения. Важно знать, что абсолютно разные причины влияют на развитие той или иной физиологической особенности сердца. О важности правильного диагностирования причин возникновения говорить не стоит, ведь это и так понятно, что следует в первую очередь обращать внимание на фактор, который способствовал возникновению данного анатомического изменения.
Вследствие повышенного артериального давления возникают некоторые болезни, которые приводят к данным изменениям. Помимо этих деформаций сердца, можно также наблюдать и другие нарушения:
Большое значение имеет масштабность ремоделирования миокарда, которое имеет разные значения и объясняется двумя основными причинами возникновения:
| активация нейрогормонов | Подобный случай возникает в результате поражения организма инфарктом миокарда. Стоит сказать, что данная активация обусловлена значительным повреждением сердечной мышцы. Кстати, данная повышенная активация должна работать над регулированием общей работы сердечного органа и нормализацией артериального давления. Но, если не принять вовремя меры предосторожности, то такая патология перерастает в более тяжелую форму ремоделирования миокарда |
| симпатическая нервная система и ее активация | Данная причина возникновения основного недуга объясняется увеличенным напряжением левого желудочка. Это приводит к тому, что данному отделу необходимо большее количество кислорода |
Если говорить об эксцентрическом ремоделировании миокарда, то оно может быть вызвано значительной перегрузкой данной мышечной ткани. Кроме того, это сопровождается удлинением одноядерных клеток и уменьшением в размерах стенок сердца.
Патофизиология болезни
Сегодня инфаркт миокарда звучит не так страшно, как несколько лет назад. В большинстве случаев пациенты имеют возможность продолжать свою стандартную жизнедеятельность, несмотря на перенесенный стресс для сердца, да и всего организма. Стоит сказать, что качественное лечение и хорошая реабилитация, дают свои плоды, но, к сожалению, помимо этого, все же остаются последствия перенесенного инфаркта. Ремоделирование миокарда патофизиология которого только обостряется, имеет достаточно неприятные последствия. В данном случае, если своевременно не проводить квалифицированные осмотры, можно придать свой организм осложнениям, таким как плохое кровообращение и хроническая сердечная недостаточность.
Инфаркт миокарда, как правило, приводит к серьезным физиологическим изменениям левого желудочка, что не очень хорошо сказывается на общем состоянии пациента. Такое изменение структуры сердечного отдела приводит также к следующим изменениям:
Если проследить данную особенность, то можно заметить, что все процессы в организме взаимосвязаны, и ничего не возникает просто так. Из-за того что постоянно повышается артериальное давление, наша сердечная мышца пытается приспособиться к данному явлению. Как следствие, происходит изменение в размерах мышечной ткани. Именно так возникает данное заболевание, которое сопровождается рядом других недугов.
Опубликовано в журнале:
Резюме
Проведено ультразвуковое и ангиографическое обследование 75 больных с диагнозами миокардита, подтвержденного данными патоморфологического исследования биоптатов, полученных с помощью прижизненной эндомиокардиальной биопсии.
Установлено, что ремоделирование миокарда является ключевым звеном в патогенезе развития недостаточности кровообращения при миокардите. Данный процесс характеризуется первоначальным поражением левого желудочка с последующим вовлечением правых отделов сердца. Признаки ремоделирования миокарда (изменение геометрии сердца, преобладание дилатации над гипертрофией миокарда) возникают на начальных стадиях миокардита и прогрессируют на стадии хронического воспаления.
Ключевые слова: миокардит, недостаточность кровообращения, ремоделирование миокарда.
Одним из осложнений многих заболеваний сердечно-сосудистой системы является сердечная недостаточность. Несмотря на снижение смертности от сердечно-сосудистых заболеваний (ССЗ) в развитых странах, в настоящее время отмечается стойкая тенденция к увеличению показателей смертности от недостаточности крообращения (НК).
Материал и методы исследования
Результаты исследования
Таблица 1
Показатели центральной гемодинамики у больных миокардитом с НК (М+/-m)
Изучение показателей ренин-ангиотензин-альдостероновой системы у исследуемых больных продемонстрировало, что при остром миокардите активность ренина была меньше, чем при хроническом (1,7+/-0,1 нг/мл/час и 2,0+/-0,1 нг/мл/час, р 0,05).
Обсуждение
Поражение мышцы сердца при миокардите происходит, чаще всего, вследствие токсического воздействия вирусного агента. При этом происходит не только гибель кардиомиоцитов [1], но и такие явления, как ускорение апоптоза [5], активизация фагоцитарной функции лейкоцитов, макрофагов с выделением цитотоксина TNFcc [3], являющегося одним из факторов с негативным инотропным эффектом и способностью стимулировать гипертрофию кардиомиоцитов. Одновременно, при миокардите в биоптатах обнаруживается повышенный уровень энзима конверсии ангиотензина и ангиотензина II, который обладает вазоконстриктивным эффектом и стимулирует развитие коллагена [8]. Микротромбоз, обнаруживаемый в капиллярном русле, приводит к диффузной ишемии миокарда. Весь этот комплекс изменений вызывает прогрессирующую дилатацию сердца, ведет к систолической и диастолической дисфункции, ухудшению насосной функции сердца. Появление и прогрессирование сердечной недостаточности при миокардите, как продемонстрировано и в нашем исследовании, сопровождается изменением конфигурации сердца, которая становится более сферичной. Ранее аналогичные данные были получены при изучении процессов ремоделирования сердца у больных с постинфарктным кардиосклерозом [9]. При этом, несмотря на прогрессирующее увеличение массы миокарда, процессы дилатации преобладают над процессами гипертрофии. Ремоделирование миокарда является бивентрикулярным процессом, паралельно вовлекающим левый и правый желудочки с едиными патофизиологическими механизмами.
Как видно из полученных данных, можно заключить, что, в основном, ремоделирование миокарда, а не сократительная дисфункция мышцы сердца, является ключевым фактором развития хронической сердечной недостаточности. При этом, первые признаки ремоделирования возникают на этапе первичного поражения миокарда. Другие звенья прогрессирующей сердечной недостаточности (активизация нейрогуморальной системы, вазоконстрикция) возникают уже при хронизации воспалительного процесса на стадии выраженного нарушения диастолической и систолической функции миокарда.
Заключение
1. Первичное повреждение миокарда приводит к нарушению сократительной функции миокарда с включением всех патофизиологических механизмов развития сердечной недостаточности.
2. Ремоделирование миокарда является ключевым звеном в патогенезе развития недостаточности кровообращения при миокардите и характеризуется поражением левого желудочка с последующем вовлечением в процесс правых отделов сердца.
3. Изменение формы сердца от эллипсоидной к более сферичной сопровождается преобладанием дилатации над гипертрофией миокарда. Признаки ремоделирования миокарда возникают уже на начальных этапах воспалительного процесса и усугубляются на хронической стадии миокардита.
ЛИТЕРАТУРА
1. Anversa P., Kajstura J., Olivetti G. Myocyte death in heart failure. // Current opinion in Cardiology, 1996, №11, p. 245-251.
Abstract
We have studied 75 patients with a verified pathologically (by means of endomyocardial biopsy) myocarditis with the usage of ultrasound and angiography.
We have found myocardial remodeling to be the key process in the development of heart failure in myocarditis. The process is characterized by the initial involvement of the left ventricle with the later influence upon the right heart. Remodeling patterns (altered heart geometry, dilation dominating over myocardial hypertrophy) are assessable on the early stages and an subject to further progress.
Key words: myocarditis, heart failure, myocardial remodeling.
Ремоделирование левого желудочка
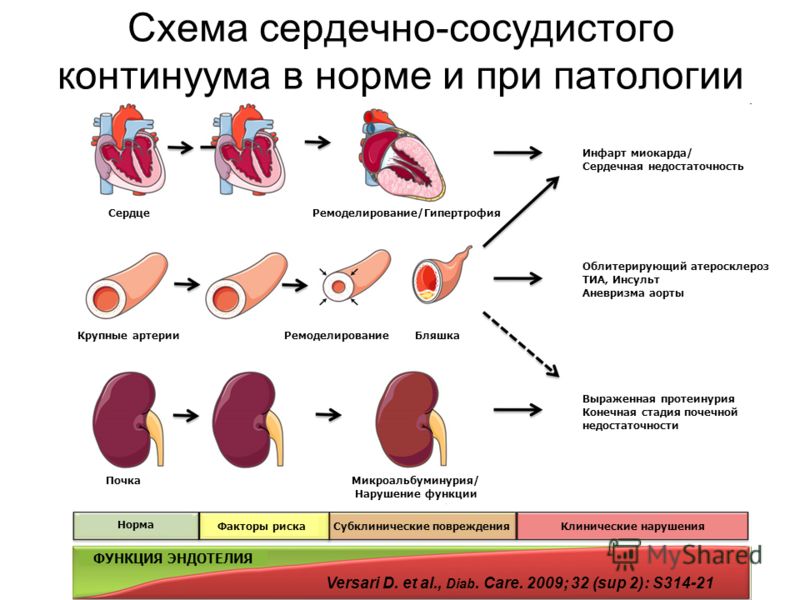
Термин «ремоделирование сердца» был предложен N. Sharp в конце 70-х годов прошлого века для обозначения структурных и геометрических изменений после острого инфаркта миокарда (ОИМ). Затем он получил более широкое толкование.
Ишемическое ремоделирование – динамический, обратимый процесс изменения толщи миокарда,
размера и формы камер сердца, дисфункции левого желудочка (ЛЖ).
Гипертрофия левого желудочка – начальный этап ремоделирования при артериальной гипертензии (АГ),
зависит не столько от уровня АД – гемодинамическая перегрузка, сколько от активности РААС.
Риск развития хронической сердечной недостаточности (ХСН) увеличивается в 15 раз. ГЛЖ развивается по концентрическому типу (добавление саркомеров внутри кардиомиоцита). А11 стимулирует рост мышечных волокон, альдостерон изменяет внутриклеточный матрикс с формированием диастолической дисфункции – ДД.
ДД – ранний этап ремоделирования ЛЖ, маркер фиброза миокарда.
Расслабление – наиболее энергозависимый процесс, при ГЛЖ страдает в первую очередь. Наибольшую гемодинамическую перегрузку при ДД испытывает ЛП. Дилатация ЛП вызывает митральную регургитацию.
Важный этап – переход концентрической ГЛЖ в эксцентрическую. К систолической перегрузке давлением добавляется диастолическая перегрузка объемом. Дилатация ЛЖ сопровождается систолической дисфункцией. А это увеличивает летальность на 50%. ХСН движется к финишной стадии.
ИАПФ вызывают регресс концентрической гипертрофии, уменьшая толщину стенок ЛЖ; нормализуют диастолу Уменьшается объем мышечных волокон и миокардиальный фиброз.
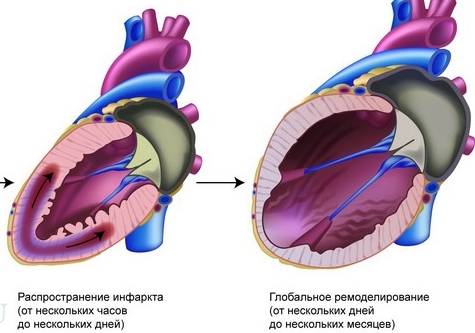
архитектурная перестройка, определяющая прогноз заболевания. После повреждения и гибели части кардиомиоцитов и в нормальной, и поврежденной зоне идет процесс склерозирования. Миоциты гипертрофируются, меняется их взаимное расположение; нарушается соотношение: «основание/верхушка». Активизируются процессы поддержания сердечного выброса и нормализации напряжения стенки ЛЖ. Изменяется радиус кривизны стенок ЛЖ, от которого зависит разная жесткость стенок ЛЖ и распределение внутрижелудочкового объема. Механизм поддержания сердечного выброса и нормализации напряжения стенки ЛЖ реализуется через РААС и гипертрофию не поврежденных сегментов миокарда.
В 1978 г. G. Hutchius и B. Bulkley описали процесс острого увеличения и истоньчения зоны инфаркта без дополнительного некроза миокарда. В первые часы после гибели миоцитов отек и воспаление локализуют зону инфаркта. Дальше наблюдается пролиферация фибробластов и замещение этого участка коллагеном. Зона инфаркта может истончаться и расширяться. Длина сариомеров не изменяется. Таким образом, увеличение объема ЛЖ происходит вследствие перегруппировки миофибрилл без их растяжения. Стенка истончается из-за скольжения мышечн.ых волокон друг относительно друга в результате ослабления связей между миоцитами в инфарктной зоне. При ЭХО КГ определяется увеличение зоны акинезии без ферментативного сдвига.
Экспансия вероятнее всего при трансмуральном ИМ и заканчивается ХСН, аневризмой и разрывом миокарда. Передне-верхушечная область более уязвимая, так как она наиболее изогнута. Возможна дилатация непораженной зоны с тотальным расширением ЛЖ.
Постинфарктное ремоделирование ЛЖ (ПРЛЖ)
Резкое растяжение жизнеспособного миокарда по закону Франка – Старлинга, увеличение
хроно-ино-тропных эффектов при стимуляции адренорецепторов поддерживает насосную
функцию в условиях уменьшения сокращающейся части миокарда. При поражении более
20% массы ЛЖ компенсация будет неадекватной.
Увеличение полости ЛЖ помогает восстановить УО на фоне снижения ФВ.
Дилатация увеличивает миокардиальный стресс, порочный круг замыкается. В качестве компенсации наступает гипертрофия миоцитов: до 78% от исходного объема.
Гипертрофия может быть концентрическая без увеличения полости и эксцентрическая с дилатацией Гипертрофия может восстановить напряжение стенки ЛЖ При обширном ИМ дилатация не пропорциональна приросту массы миокарда
Роль цитокинов. Цитокины – маркеры ХСН
Развитие ХСН сопровождается увеличением провоспалительных цитокинов – интерлейкина— – 1,6; в плазме крови и в миокарде. Без увеличения антивоспалительных цитокинов, что приводит к усилению воспаления. Экспрессия цитокинов и их рецепторов на мембранах кардиомиоцитов подтверждает центральную роль цитокинов в патогенезе ХСН.
В норме вырабатывается кардиомиоцитами предсердий и регулирует водно-солевое равновесие и снижает АД. При уменьшении сердечного выброса у больных асимптоматической дисфункцией ЛЖ и ФК I ХСН растет синтез НП в желудочках сердца. Это блокирует активность циркулирующего звена РААС и компенсирует состояние больных. Прогрессирование ХСН активизирует РААС. Снижается натрий-уретический ответ на рост активности НП. Это приводит к задержке натрия и воды, системной и почечной вазоконстрикции.
Постинфарктная аневризма ЛЖ
Классическим вариантом постинфарктного ремоделирования ЛЖ является постинфарктныая аневризма ЛЖ (ПА), развивается в 8-34% случаев трансмурального инфаркта миокарда: характеризуется акинезией или дискинезией стенки ЛЖ. Изменяется геометрия, объем и масса ЛЖ. Клинически проявляется в виде ХСН у 50% больных и более, желудочковых нарушений ритма, тромбоэмбоэмболического синдрома.
Хирургическим методом лечения является реваскуляризация миокарда и пластика
ЛЖ. Прогностически неблагоприятны ранние аневризмы при переднем ИМ.
— более 2-х ИМ в анамнезе;
— поражение трех основных бассейнов коронарных артерий.
Прогноз ремоделирования ЛЖ
Рентгенологически видимое увеличение ЛЖ неблагоприятно и увеличивает летальность в 3 раза, прогнозирует развитие ХСН. Подъем с. SТ со снижением или отсутствием з. R на ЭКГ помогает не только диагностировать ИМ, определить его размеры, но и предполагать ремоделирование ЛЖ. Компенсаторные процессы зависят от состояния коронарного кровотока уцелевшего миокарда, при неадекватном кровоснабжении дилатация больше, выше летальность. Стеноз артерий ограничивает компенсаторную гипертрофию миокарда и повышенную нагрузку. Дилатация полостей прямо коррелирует с риском фатальных аритмий.
Первичная профилактика не вызывает сомнений: это наиболее раннее и адекватное восстановление перфузии у больных ОКС. Профилактика ХСН начинается в первые часы ОИМ. Надо ограничить зону некроза: тромболитики, нитраты. БАБ, антиагреганты.
1 Доказан эффект ИАПФ: предпочтительны пролонгированные препараты и действующие на тканевой АПФ. Летальность от ХСН достоверно снижается, ФВ – увеличивается.
ИАПФ более эффективны при переднем ИМ. Терапия ИАПФ назначается в первые сутки
2 БАБ оказывают не только антиаритмическое действие, но и тормозят ремоделирование ЛЖ. K. Shiono не отметил эффект от атенолола. Метопролол вызывает редукцию объема и регрессию массы ЛЖ; улучшает геометрию ЛЖ.
3 Эффективны антагонисты кальция: амподипин, дилтиазем и изоптин, но лечение
должно быть длительным.
4 Нитраты ограничивают раннее постинфарктное ремоделирование ЛЖ.
5 Дигоксин в результате инотропной стимуляции при переднем ИМ может увеличивать инфарктное выпячивание ЛЖ без снижения содержания коллагена.
6 L- карнитин в остром и отдаленном периоде ИМ уменьшал дилатацию ЛЖ (S. Iliceto).
1 Кардиология, 2003, 8, стр. 83-94.
2 Кардиология, 2003, 8, стр. 68-72.
3 Бузиашвили ЮИ и др Кардиология, 2002, 10, стр. 88-94.
Ремоделирование левого желудочка у больных артериальной гипертензией с добавочными почечными артериями: ассоциации с уровнем ренина и скоростью клубоч

Статья посвящена анализу взаимосвязи ремоделирования левого желудочка, плазменного уровня ренина, скорости клубочковой фильтрации у больных артериальной гипертензией с добавочными почечными артериями. Показано, что гормональный и гемодинамический факторы
The article is devoted to analysis of relationship of left ventricular remodeling, plasma renin level, glomerular filtration rate in patients with arterial hypertension and renal additional arteries. It is shown that hormonal and hemodynamic factors in young patients with arterial hypertension of 1–2 degrees with renal additional arteries create a load on left ventricle, contributing to pathological myocardial remodeling in the form of eccentric hypertrophy and concentric remodeling.
Добавочные почечные артерии не фигурируют в качестве признанного экспертами варианта реноваскулярной артериальной гипертензии (АГ), однако вполне очевидны теоретические предпосылки для ее развития и прогрессирования [1]. В почке, кровоснабжающейся добавочными почечными артериями, снижен кровоток за счет уменьшения площади поперечного сечения добавочных почечных артерий по сравнению с основной [2, 3]. Нарушение почечного кровотока оказывает неблагоприятное влияние не только на выделительную функцию почек, но и на гормональную систему, регулирующую артериальное давление [4].
Снижение скорости клубочковой фильтрации (СКФ), активация ренин-ангиотензин-альдостероновой системы (РААС) являются основными факторами развития гипертрофии левого желудочка, которая, как известно, увеличивает риск внезапной смерти, желудочковых аритмий и хронической сердечной недостаточности [5–7]. Однако структурно-функциональные изменения миокарда не всегда сопровождаются увеличением массы миокарда. В связи с этим в настоящее время принят термин «ремоделирование». Ремоделирование миокарда проявляется изменением размеров, формы и функции сердца в результате его повреждения и перегрузки. При этом варианты ремоделирования левого желудочка (нормальная геометрия, эксцентрическая гипертрофия, концентрическое ремоделирование, концентрическая гипертрофия) имеют различный прогноз [8].
Можно предположить, что степень активации РААС и снижения СКФ будут определять особенности ремоделирования миокарда у больных АГ с добавочными почечными артериями. Вместе с тем частота и характер ремоделирования миокарда у молодых больных АГ с добавочными почечными артериями остаются неизученными. Выявление взаимосвязи уровня ренина, СКФ с ремоделированием миокарда позволит не только конкретизировать патогенетические звенья формирования и прогрессирования АГ у больных с добавочными почечными артериями, но и улучшить процесс диагностики, а следовательно, правильный выбор антигипертензивной терапии, что замедлит прогрессирование заболевания, увеличит продолжительность и качество жизни данной категории пациентов.
Целью настоящего исследования было установить ассоциации патологического ремоделирования левого желудочка с уровнем ренина и СКФ у молодых больных АГ и добавочными почечными артериями.
Материалы и методы исследования
Обследовано 40 пациентов (33 мужчины и 7 женщин, средний возраст 27,05 ± 0,92 года) с АГ и добавочными почечными артериями. Критерии включения: подписание информированного согласия на участие в исследовании; мужчины и женщины с добавочными почечными артериями в возрастном диапазоне 18–35 лет. Критерии исключения: отказ пациента от участия на любом этапе исследования; вторичная АГ (стеноз магистральных ренальных сосудов, заболевания почек, надпочечников, опухоли, системные заболевания соединительной ткани и др.); сахарный диабет; хроническая сердечная недостаточность; беременность.
АГ устанавливали в соответствии с клиническими рекомендациями [9]. Добавочные почечные артерии верифицировали методом мультиспиральной компьютерной томографии, выполненной по сосудистой программе, и ретроградной (трансфеморальной) аортонефрографии.
АГ у обследуемых пациентов соответствовала 1–2 степени. Добавочные почечные артерии отходили от латеральной части аорты и чаще всего входили в верхний полюс (60% случаев), реже — в нижний (32,5%), в единичных случаях (5%) — одномоментно в оба полюса и в одном случае (2,5%) отмечена ранняя бифуркация. В случаях билатерального характера добавочных почечных артерий преобладала их верхнеполюсная локализация (78,57%), а при одностороннем отхождении — в равной степени верхне- и нижнеполюсная (соответственно 53,85% и 46,15%). В 60% случаев наблюдалось по 1 добавочной почечной артерии, в 32,5% — по 2 и в 7,5% — по 5.
Проводили иммуноферментный анализ плазменного уровня ренина (BCM Diagnostic). Диапазон нормы — 4,0–37,52 пг/мл.
Сформировывали группы сравнения из 15 пациентов с добавочными почечными артериями без АГ (12 мужчин и 3 женщины, средний возраст 26,27 ± 1,14 года) и 15 здоровых людей (12 мужчин и 3 женщины, средний возраст 26,0 ± 1,03 года).
Статистическая обработка осуществлялась с помощью программы IBM SPSS Statistics (версия 21 для Windows). Данные представлялись в виде среднего значения со стандартной ошибкой (M ± SЕ). Анализ проводили с помощью однофакторного дисперсионного анализа с поправкой Bonferroni. Различия считались статистически значимыми при величине р 2 ), чем у здоровых людей (110,29 ± 1,85 мл/мин/1,73 м 2 ; р = 0,010), и характеризовалась тенденцией к снижению в сравнении с пациентами с добавочными почечными артериями без АГ (106,59 ± 2,96 мл/мин/1,73 м 2 ; р = 0,069). Существенное снижение СКФ (36,42 мл/мин/1,73 м 2 ) выявлено у 2,5% больных, а у 37,5% — незначительное (60–89 мл/мин/1,73 м 2 ). Полученный результат свидетельствует о формировании сниженного функционального резерва почек у 40% молодых больных АГ 1–2 степени с добавочными почечными артериями. Нарушения, в том числе ранние субклинические, функции почек являются одним из важнейших факторов риска сердечно-сосудистых осложнений [4].
Мы сделали попытку уточнить взаимосвязь СКФ с развитием патологического ремоделирования левого желудочка у больных АГ и добавочными почечными артериями. Оказалось, что у больных АГ с добавочными артериями почек и патологическим ремоделированием левого желудочка СКФ была отчетливо ниже, чем в группах с добавочными артериями без АГ и здоровых людей (рис. 2).
Таким образом, взаимообусловленность патологических процессов сердечно-сосудистой системы и почек позволяет рассматривать кардиоренальные взаимосвязи как непрерывную цепь событий, составляющих своеобразный порочный круг — кардиоренальный континуум [13]. Гормональный и гемодинамический факторы у молодых больных АГ 1–2 степени с добавочными почечными артериями создают нагрузку на левый желудочек, способствуя патологическому ремоделированию миокарда в виде эксцентрической гипертрофии и концентрического ремоделирования. Это позволяет выделить ведущий патофизиологический механизм повышения артериального давления, а также определить более успешную стратегию антигипертензивной терапии.
Выводы
Литература
Ю. П. Редько 1
Н. Н. Гладких, доктор медицинских наук, профессор
А. В. Ягода, доктор медицинских наук, профессор
ФГБОУ ВО СтГМУ Минздрава России, Ставрополь
Ремоделирование левого желудочка у больных артериальной гипертензией с добавочными почечными артериями: ассоциации с уровнем ренина и скоростью клубочковой фильтрации/ Ю. П. Редько, Н. Н. Гладких, А. В. Ягода
Для цитирования: Лечащий врач № 7/2019; Номера страниц в выпуске: 24-27
Теги: сердце, почки, артериальное давление, выделительная функция
- Концентрическое ремоделирование лж что это такое
- Концентрическое ремоделирование миокарда левого желудочка что это такое лечение препараты
.gif)