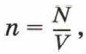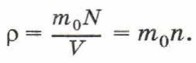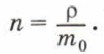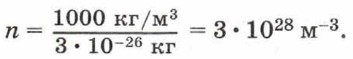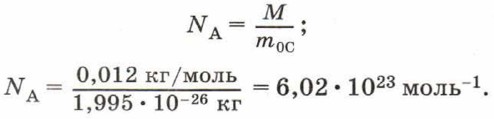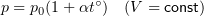Концентрация в чем измеряется физика
Концентрация частиц
Концентрация частиц — физическая величина, равная отношению числа частиц N к объёму V, в котором они находятся:

Размерность в системе СИ 

Если концентрация является функцией координаты 

Однако, такое представление является в большой степени условным, поскольку концентрация (как, например, и температура) относится к макропараметрам и при переходе к бесконечно малому объёму, по большому счету, теряет смысл.
Формулы, в которых присутствует концентрация
Полезное
Смотреть что такое «Концентрация частиц» в других словарях:
концентрация частиц — — [А.С.Гольдберг. Англо русский энергетический словарь. 2006 г.] Тематики энергетика в целом EN particle concentration … Справочник технического переводчика
концентрация частиц — 3.2.7 концентрация частиц (particle concentration): Число частиц в единице объема воздуха. Источник: ГОСТ Р ИСО 14644 3 2007: Чистые помещения и связанные с ними контролируемые среды. Часть 3. Методы испытаний … Словарь-справочник терминов нормативно-технической документации
концентрация частиц в атмосфере планеты — концентрация Число частиц данного вида в единице объема атмосферы планеты. Примечание Подразумеваются как микрочастицы (атомы, молекулы, ионы или электроны), так и макрочастицы (капли, кристаллы, пылинки). [ГОСТ 25645.143 84] Тематики атмосферы… … Справочник технического переводчика
концентрация частиц в устройстве для определения запылённости дымовых газов — — [А.С.Гольдберг. Англо русский энергетический словарь. 2006 г.] Тематики энергетика в целом EN concentration of specie in the impingerCi … Справочник технического переводчика
концентрация частиц на входе — — [А.С.Гольдберг. Англо русский энергетический словарь. 2006 г.] Тематики энергетика в целом EN concentration at inletCin … Справочник технического переводчика
концентрация частиц на выходе — — [А.С.Гольдберг. Англо русский энергетический словарь. 2006 г.] Тематики энергетика в целом EN concentration at outletCout … Справочник технического переводчика
концентрация частиц ( particle concentration) — 2.2.3 концентрация частиц ( particle concentration): Число отдельных частиц в единице объема воздуха. Источник: ГОСТ Р ИСО 14644 1 2000: Чистые помещения и связанные с ними контролируемые среды. Часть 1. Классификация чистоты воздуха … Словарь-справочник терминов нормативно-технической документации
относительная концентрация частиц в атмосфере планеты — относительная концентрация Отношение концентрации частиц данного вида к сумме концентраций всех частиц в атмосфере планеты. [ГОСТ 25645.143 84] Тематики атмосферы планет Синонимы относительная концентрация EN relative concentration of particles… … Справочник технического переводчика
массовая нагрузка [концентрация] частиц пыли в газовом потоке электрофильтра — — [А.С.Гольдберг. Англо русский энергетический словарь. 2006 г.] Тематики энергетика в целом EN ESP mass loading … Справочник технического переводчика
счетная концентрация частиц — 6.1.5 счетная концентрация частиц: По ГОСТ Р 50766. Источник: ГОСТ Р 51109 97: Промышленная чистота. Термины и определения оригинал документа … Словарь-справочник терминов нормативно-технической документации
Концентрация растворов. Способы выражения концентрации растворов.
Концентрация раствора может выражаться как в безразмерных единицах (долях, процентах), так и в размерных величинах (массовых долях, молярности, титрах, мольных долях).
Способы выражения концентрации растворов.
1. Массовая доля (или процентная концентрация вещества) – это отношение массы растворенного вещества m к общей массе раствора. Для бинарного раствора, состоящего из растворённого вещества и растворителя:

ω – массовая доля растворенного вещества;
mв-ва – масса растворённого вещества;
Массовую долю выражают в долях от единицы или в процентах.
2. Молярная концентрация или молярность – это количество молей растворённого вещества в одном литре раствора V:

C – молярная концентрация растворённого вещества, моль/л (возможно также обозначение М, например, 0,2 М HCl);
n – количество растворенного вещества, моль;
V – объём раствора, л.
Раствор называют молярным или одномолярным, если в 1 литре раствора растворено 1 моль вещества, децимолярным – растворено 0,1 моля вещества, сантимолярным – растворено 0,01 моля вещества, миллимолярным – растворено 0,001 моля вещества.
3. Моляльная концентрация (моляльность) раствора С(x) показывает количество молей n растворенного вещества в 1 кг растворителя m:

С (x) – моляльность, моль/кг;
n – количество растворенного вещества, моль;
4. Титр – содержание вещества в граммах в 1 мл раствора:

T – титр растворённого вещества, г/мл;
mв-ва – масса растворенного вещества, г;
5. Мольная доля растворённого вещества – безразмерная величина, равная отношению количества растворенного вещества n к общему количеству веществ в растворе:

N – мольная доля растворённого вещества;
n – количество растворённого вещества, моль;
nр-ля – количество вещества растворителя, моль.
Сумма мольных долей должна равняться 1:
Иногда при решении задач необходимо переходить от одних единиц выражения к другим:
М(Х) – молярная масса растворенного вещества;
ρ= m/(1000V) – плотность раствора. 6. Нормальная концентрация растворов (нормальность или молярная концентрация эквивалента) – число грамм-эквивалентов данного вещества в одном литре раствора.
Грамм-эквивалент вещества – количество граммов вещества, численно равное его эквиваленту.
Эквивалент – это условная единица, равноценная одному иону водорода в кислотоно-основных реакциях или одному электрону в окислительно – восстановительных реакциях.
Для записи концентрации таких растворов используют сокращения н или N. Например, раствор, содержащий 0,1 моль-экв/л, называют децинормальным и записывают как 0,1 н.

СН – нормальная концентрация, моль-экв/л;
z – число эквивалентности;
Коэффициент растворимости – отношение массы вещества, образующего насыщенный раствор при конкретной температуре, к массе растворителя:
Физика. 10 класс
Конспект урока
Урок 18. Основное уравнение МКТ
Перечень вопросов, рассматриваемых на уроке:
1) средняя кинетическая энергия молекулы;
3) основное уравнение МКТ;
Давление идеального газа пропорционально произведению концентрации молекул и средней кинетической энергии поступательного движения молекул.
Средняя кинетическая энергия молекул – усреднённая величина, равная половине произведения массы молекулы на среднюю величину квадрата её скорости.
Концентрация – число молекул в единице объёма.
Масса молекулы (или атома) – чрезвычайно маленькая величина в макроскопических масштабах (граммах и килограммах), вычисляется через отношение массы вещества к количеству содержащихся в ней молекул (или атомов).
Изменение импульса тела – произведение силы на время действия силы. Импульс силы всегда показывает, как изменяется импульс тела за данное время.
Основная и дополнительная литература по теме урока:
Открытые электронные ресурсы по теме урока:
Теоретический материал для самостоятельного изучения
Давление газа на стенку сосуда обусловлено ударами молекул, давление газа пропорционально концентрации молекул: чем больше молекул в единице объема, тем больше ударов молекул о стенку за единицу времени. Каждая молекула при ударе о стенку передает ей импульс, пропорциональный импульсу молекулы m0v.
Давление пропорционально второй степени скорости, так как, чем больше скорость молекулы, тем чаще она бьется о стенку сосуда. Расчеты показывают, что основное уравнение молекулярно-кинетической теории идеального газа имеет вид:
n— концентрация молекул,

Средняя кинетическая энергия поступательного движения
тогда уравнение примет вид:
Давление идеального газа пропорционально произведению концентрации молекул на среднюю кинетическую энергию поступательного движения молекулы.
Примеры и разбор решения заданий.
1. К каждой позиции первого столбца подберите соответствующую позицию второго:
А)
2) средняя кинетическая энергия молекул
Б)
3) давление газа на стенку сосуда
В)
4) концентрация молекул
Г)
Правильный ответ: вспомнив формулы величин, устанавливаем соответствие:
В)
2) средняя кинетическая энергия молекул
А)
3) давление газа на стенку сосуда
Г)
4) концентрация молекул
Б)
2. Кислород находится при нормальных условиях. Средняя квадратичная скорость молекул кислорода в этом случае равна ___ м/с.
§ 20. Атомы и молекулы, их характеристики (окончание)
Концентрация молекул
7. Постоянная Авогадро. Поскольку молекулы имеют малые размеры, их число в любом макроскопическом теле очень велико.
Число молекул в единице объёма называют концентрацией. Концентрация n вычисляется по формуле
где N — число молекул в теле, V — его объём.
Концентрацию молекул в теле также можно определить, зная плотность вещества ρ и массу молекулы этого вещества m0. Поскольку 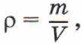
Чтобы представить себе, насколько велико это число, предположим, что в воздушном шаре сделали настолько тонкий прокол, что за каждую секунду через него проходит 10 молекул. В этом случае, для того чтобы вышли все молекулы, потребуется 30 миллиардов лет.
Из определения моля следует, что 1 моль любого вещества содержит одинаковое число молекул (атомов). Это число называют постоянной Авогадро.
Постоянная Авогадро NА — число молекул или атомов в количестве вещества 1 моль.
Поскольку в одном моле любого вещества содержится одинаковое число молекул, то при одинаковых условиях 1 моль любого газа занимает одинаковый объём.
Вопросы для самопроверки
1. Сформулируйте первое положение молекулярно-кинетической теории строения вещества.
2. Поясните выражение: «Молекула — мельчайшая частица вещества, сохраняющая его химические свойства».
3. Опишите опыт, позволяющий оценить размеры молекулы. Предложите способ измерения объёма капли масла.
4. Что называют относительной молекулярной массой; количеством вещества; молярной массой; концентрацией молекул; постоянной Авогадро?
5. Что такое один моль?
6. Каков порядок значений размеров, массы молекул, их концентрации, числа молекул в одном моле вещества?
1Д. Подготовьте краткое сообщение об исследованиях М. В. Ломоносова, результаты которых внесли вклад в развитие учения о строении вещества. Воспользуйтесь для этого интернет-ресурсами и другими источниками информации. Докажите, что результаты исследований М. В. Ломоносова имели принципиальное значение для развития взглядов на строение вещества.
2. Сравните количество вещества, содержащееся в телах равной массы из алюминия и железа.
3. Найдите число атомов в алюминиевой ложке массой 30 г.
4. Деталь площадью 30 см 2 покрыли слоем серебра толщиной 2 мкм. Сколько атомов серебра содержится в покрытии?
5. Сравните массы и объёмы двух тел, сделанных из свинца и меди, если в них содержатся равные количества вещества.
Вопросы для дискуссии
Почему мы уверены в существовании молекул и атомов, ведь мы их не видим?
Молекулярная физика Основные формулы
1. Основы молекулярно-кинетической теории. Газовые законы
1.1 Количество вещества
μ — молярная масса вещества;
1.2 Основное уравнение молекулярно-кинетической теории идеального газа
p — давление идеального газа;
m — масса одной молекулы;
n = N/V — концентрация молекул;

1.3 Средняя квадратичная скорость молекул идеального газа
R = kNA = 8,31 Дж/(моль·К) — универсальная газовая постоянная;
T = t+273 — абсолютная температура;
t — температура по шкале Цельсия.
1.4 Средняя кинетическая энергия молекулы одноатомного газа
1.5 Давление идеального газа
n — концентрация молекул;
k — постоянная Больцмана;
T — абсолютная температура.
1.6 Закон Бойля-Мариотта
1.7 Закон Шарля
p0 — давление газа при 0 °С;
1.8 Закон Гей-Люссака
V0 — объем газа при 0 °С.
1.9 Уравнение Менделеева-Клапейрона
1.10 Объединенный закон газового состояния (уравнение Клапейрона)
1.11 Закон Дальтона
pi — парциальное давление i-й компоненты смеси газов.
2. Основы термодинамики
2.1 Внутренняя энергия идеального одноатомного газа
ν — количество вещества;
R = 8,31 Дж/(моль·К) — универсальная газовая постоянная;
T — абсолютная температура.
2.2 Элементарная работа, совершаемая газом,
при изменении объема на бесконечно малую величину dV
2.3 Первый закон термодинамики
ΔQ — количество подведенной теплоты;
ΔA — работа, совершаемая веществом;
ΔU — изменение внутренней энергии вещества.
2.4 Теплоемкость идеального газа
ΔQ — количество переданной системе теплоты на участке процесса;
ΔT — изменение температуры на этом участке процесса.