Конфлюенс долевых протоков что это
Применение ультразвукового исследования и компьютерной томографии в диагностике опухоли Клацкина
УЗИ аппарат HS40
Лидер продаж в высоком классе. Монитор 21,5″ высокой четкости, расширенный кардио пакет (Strain+, Stress Echo), экспертные возможности для 3D УЗИ в акушерско-гинекологической практике (STIC, Crystal Vue, 5D Follicle), датчики высокой плотности.
Введение
Впервые первичная злокачественная опухоль желчных протоков была описана Durand-Fardel в 1840 г. Термин «опухоль Клацкина» (Klatskin tumour) появился позже, когда Джеральд Клацкин в 1965 году сообщил об опухоли (холангиокарциноме), исходящей из области бифуркации общего печеночного протока.
Рак желчных протоков составляет около 2% от всех злокачественных опухолей и, таким образом, является пятой по распространенности злокачественной опухолью желудочно-кишечного тракта [1-3, 5, 6, 9].
Опухоли развилки желчных протоков представляют определенные трудности для хирургов, что связано прежде всего со сложностью выполнения операции, а также тяжестью состояния данной категории больных. У таких больных выполнение любых хирургических вмешательств имеет высокий операционно-анестезиологический риск. Даже после радикальной резекции опухоли выживаемость в течение 5 лет составляет всего от 23 до 46%, и лишь от 9 до 34%, если опухоль была обнаружена микроскопически в области края резекции [1, 3, 5, 7-9].
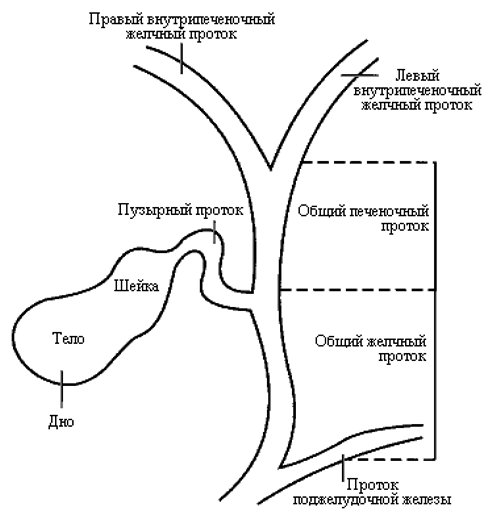
Для лучшего понимания расположения опухоли ниже приводим схему билиарного древа (рис. 1).
Рис. 1. Схема билиарного древа.
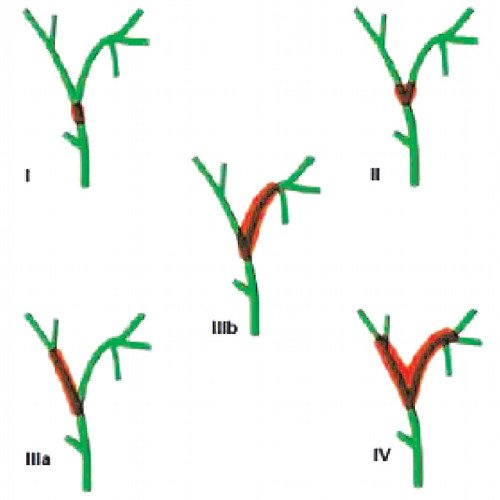
Эта опухоль развивается в верхних отделах желчных путей, в области их разделения между правой и левой долями печени. Желчные протоки, находящиеся внутри печени, подразделяют на правый и левый протоки. Опухоль может развиваться как в одном из них, так и в обоих этих протоках, в области, где они выходят из печени. Согласно классификации Bismuth-Corlette [9], различают опухоли, которые не достигают бифуркации желчных протоков (тип I), и опухоли, которые распространяются на бифуркацию (тип II). III тип опухоли прорастает бифуркацию и распространяется на правый (тип III а) или левый (тип III b) желчный проток. Тип IV опухоли Клацкина распространяется от бифуркации на левый или правый желчные протоки и является мультитцентрической опухолью (рис. 2). Желчные протоки расположены рядом с кровеносными сосудами печени, поэтому часто в процессе бывают задействованы и они.
Рис. 2. Классификация опухоли Клацкина по Bismuth-Corlette.
Различают опухоли, которые не достигают бифуркации желчных протоков (тип I), и опухоли, которые распространяются на бифуркацию (тип II). III тип опухоли прорастает бифуркацию и распространяется на правый (тип IIIа) или левый (тип IIIb) желчный проток. Тип IV опухоли Клацкина распространяется от бифуркации на левый или правый желчный проток и является мультицентрической опухолью.
В клинической картине имеют место все признаки механической желтухи.
Ультразвуковое исследование (УЗИ) и компьютерная томография (КТ).
При УЗИ визуализация самой опухоли крайне затруднена. Однако выявляют ее косвенные признаки: наличие билиарной гипертензии (высокого блока).
На нативных КТ-томограммах холангиокарцинома выглядит как гиподенсное объемное образование с единичными кальцификатами в нем. Определяется также расширение внутрипеченочных желчных протоков проксимальнее места расположения опухоли. После болюсного введения контрастного вещества может возникать слабое периферическое «усиление» опухоли и отсутствие накопления контраста в центральной ее части даже в поздней фазе. По другим данным, после контрастирования в раннюю артериальную фазу холангиокарцинома быстро и неравномерно по всей площади накапливает контрастное вещество. Характерна для холангиокарциномы задержка опухолью контраста в отстроченную фазу (гиперденсность), что затрудняет ее дифференциальную диагностику с гемангиомой.
Оптимальным методом исследования при опухоли Клацкина можно считать магнитно-резонансную томографию, которая позволяет не только определить четкую локализацию опухоли, но и детально визуализировать строение сосудов печени.
При МРТ наиболее иформативны Т2-взвешенные изображения: на них опухоль дает относительно высокий по интенсивности сигнал, особенно по своей периферии; участки низкого сигнала в центральной части опухоли, по- видимому, соответствуют рубцовой зоне. Из-за низкой васкуляризации холангиокарцином динамическая контрастная МР-томография оказывается не очень эффективной. В ранней, артериальной фазе контрастирования, как и при КТ, происходит невыраженное периферическое контрастирование опухоли, которое в более поздней, паренхиматозной, фазе сменяется появлением гипоинтенсивного ободка.
В качестве иллюстрации приводим собственные клинические наблюдения
Клиническое наблюдение 1
Больная С., 63 года, поступила в стационар с жалобами на пожелтение кожных покровов. Считает себя больной с февраля 2013 г., когда стала отмечать боли в эпигастрии. При появлении желтухи, была госпитализирована в наш стационар, где при биохимическом анализе крови были выявлены: билирубин 233 мкмоль/л, билирубин прямой 140,8 мкмоль/л, билирубин непрямой 92,2 мкмоль/л, АСТ 181 Е/л, АЛТ 101, амилаза 25 Е/л.
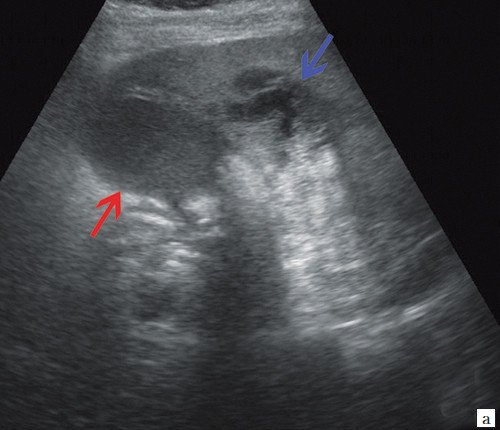
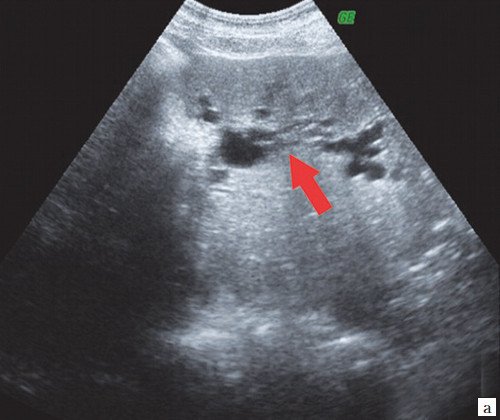
a) Желчный пузырь с двойным контуром (красная стрелка) и паравезикальное жидкостное образование (синяя стрелка).
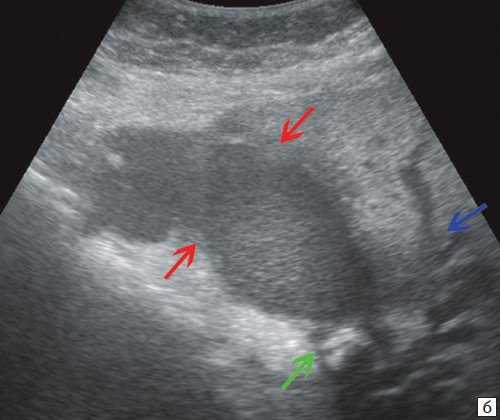
b) Увеличенный желчный пузырь, заполненный густой желчью (красные стрелки), неподвижный конкремент в шейке желчного пузыря (зеленая стрелка), расширенные внутрипеченочные протоки (синяя стрелка).
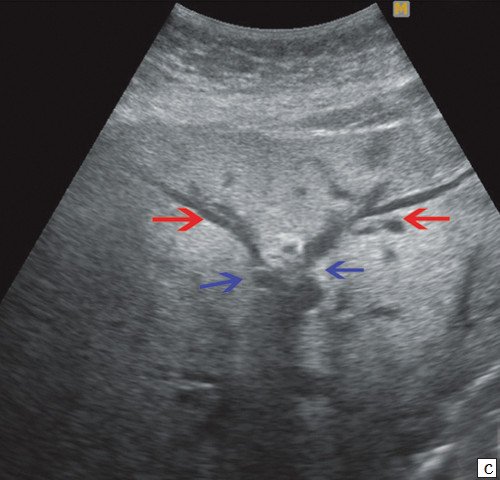
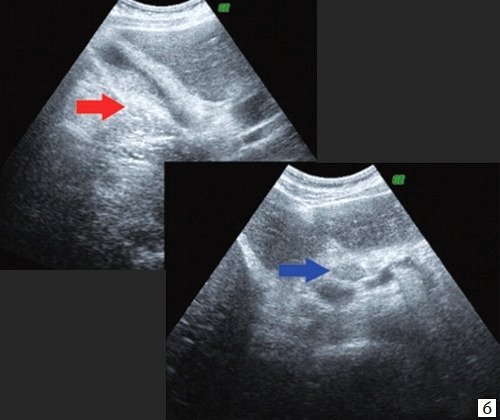
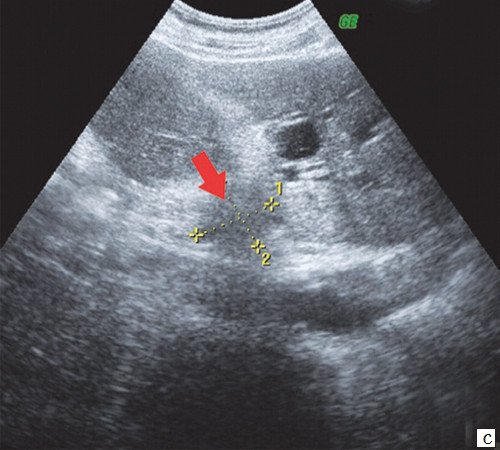
c) Прерывание визуализации протоков в области слияния долевых протоков печени (синие стрелки), долевые протоки (красные стрелки).
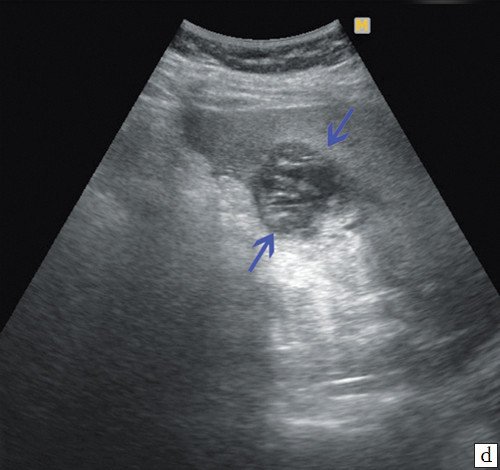
d) Паравезикальные образования жидкостного характера, с большим количеством перегородок внутри и густой жидкостью (синие стрелки).
По заключению МРТ определяется грубое расширение протоков правой и левой долей печени с их обрывом в проекции слияния (ворота печени). ОЖП выглядит обычно, дефектов наполнения не найдено, диаметр 6 мм. В желчном пузыре большое количество мелких округлых камней, содержимое с пониженным процентом жидкости. Вирсунгов проток 3 мм, не деформирован, контуры ровные. Заключение: опухоль ворот печени с раздельным блоком (рис. 4).
С лечебной и диагностической целью наложена чрескожная чреспеченочная холецистостома, проведены диагностическая пункция паравезикального абсцесса и фистулография.
Под местной анастезией 25% раствором новокаина 60,0 мл в полость желчного пузыря установлен дренаж Pigteil 9 Fr и фиксирован к коже двумя швами. Удалено около 130 мл мутной жидкости грязно-серого цвета. Полость промыта водным раствором хлоргексидина.
Из отдельного доступа проведена пункция паравезикального образования, получено около 7 мл мутной желчи.
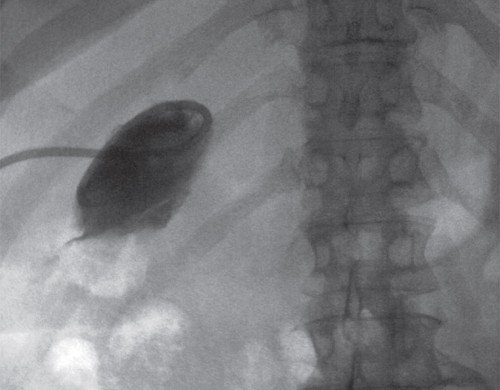
Фистулография. Через дренажную трубку введен водорастворимый контраст, контрастирован желчный пузырь размером 60х30 мм. Остальные отделы не контрастируются (рис. 5).
Рис. 5. Фистулография больной С. Опухоль ворот печени. После чрескожной чреспеченочной холецистостомы. Дренаж в полости желчного пузыря.
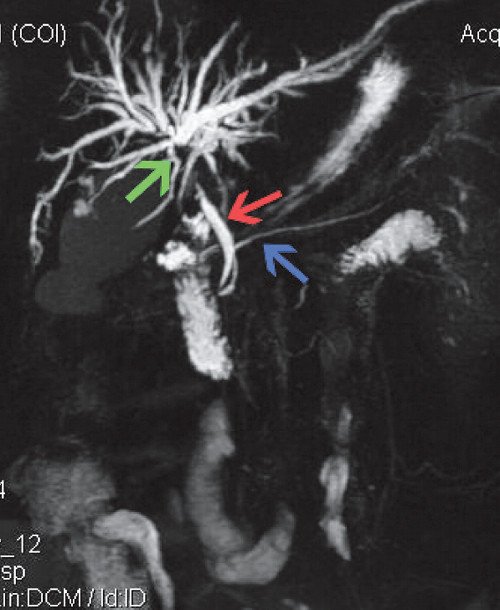
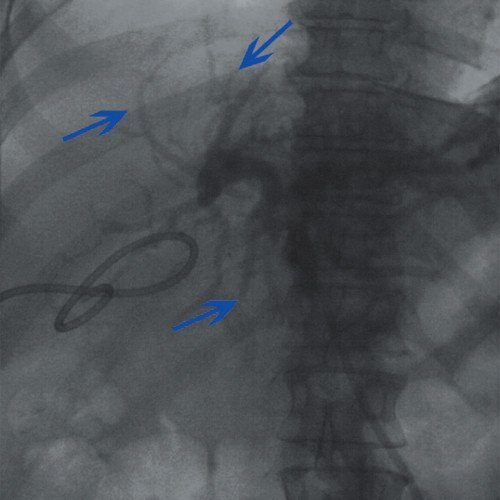
Рис. 6. Холангиография больной С. Опухоль ворот печени. Контрастирование протоков левой доли печени (синие стрелки).
УЗИ после установки холангиостомы. В динамике свободной жидкости в брюшной полости и поддиафрагмальном пространстве слева нет. Степень расширения протоков в левой доле уменьшилась.
Окончательный диагноз. Опухоль ворот печени T4NXMX с раздельным блоком (опухоль Клацкина). Механическая желтуха. ЖКБ острый калькулезный холецистит. Паравезикальный абсцесс. Подпеченочный инфильтрат.
Выполнить биопсию малоинвазивно невозможно в связи с недоступностью. Выполнить лапаротомию невозможно в связи с выраженным нарушением гемостаза. Пациента выписана на амбулаторное долечивание.
Клиническое наблюдение 2
Пациент М., 36 лет, поступил с жалобами на пожелтение кожных покровов без болей, похудание.
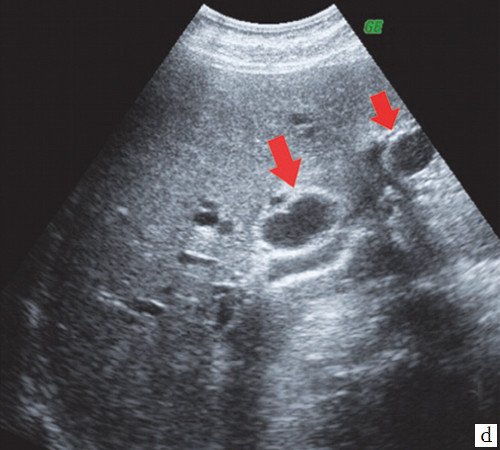
a) Расширение внутрипеченочных протоков (стрелка).
b) Спавшийся желчный пузырь (красная стрелка), парапортальный лимфоузел (синяя стрелка).
c) Гипоэхогенное образование 28 х 26 мм с неровными нечеткими контурами в воротах печени (стрелка).
d) Расширение правого долевого и левого сегментарного протоков (стрелки).
При проведении КТ брюшной полости на границе правой и левой долей печени, с распространением в ворота печени неправильной формы (инфильтративного типа) образование размером 25х37х59 мм, неравномерно средней интенсивности, накапливает контраст (КТ тумор) на его уровне не визуализируется левый долевой проток и обрывается правый долевой проток (диаметр правого долевого до 22 мм). Внутрипеченочные желчные протоки обеих долей грубо расширены. ОЖП не расширен. Лимфоузлы ворот печени до 16 мм. Желчный пузырь спавшийся. Левая ветвь воротной вены сдавлена опухолевым инфильтратом. Селезенка обычной формы, не увеличена, структура и плотность паренхимы не изменена. ПЖ диффузно неоднородна, контуры ровные, четкие (рис. 8).
Конфлюенс долевых протоков что это
ФГБУ «Институт хирургии им. А.В. Вишневского» Минздрава России, Москва
ФГБУ «Институт хирургии им. А.В. Вишневского» Минздрава России, Москва
ФГБУ «Институт хирургии им. А.В. Вишневского» Минздрава России, Москва
Взгляд на проблему опухоли Клатскина
Журнал: Хирургия. Журнал им. Н.И. Пирогова. 2015;(4): 62-67
Чжао А. В., Шевченко Т. В., Жариков Ю. О. Взгляд на проблему опухоли Клатскина. Хирургия. Журнал им. Н.И. Пирогова. 2015;(4):62-67.
Chzhao A V, Shevchenko T V, Zharikov Yu O. View of the problem of Rlatskin tumor. Khirurgiya. 2015;(4):62-67.
https://doi.org/10.17116/hirurgia2015462-67
ФГБУ «Институт хирургии им. А.В. Вишневского» Минздрава России, Москва
Опухоль Клатскина представляет собой первичное злокачественное новообразование, исходящее из внепеченочных желчных протоков и составляющее на сегодняшний день от 50 до 70% всех холангиокарцином. В связи с длительным бессимптомным течением заболевания, обусловливающим позднюю обращаемость за медицинской помощью, сложностью анатомического строения области ворот печени опухоль имеет низкую резектабельность, высокие уровни послеоперационных летальности и осложнений, плохой прогноз. Улучшение инструментальной диагностики, совершенствование оперативной техники позволяют выполнять обширные и комбинированные резекционные вмешательства на печени, желчных протоках и сосудистых структурах в области ворот печени при опухолях Клатскина. Роль химиолучевой терапии и фотодинамической терапии в лечении этой группы больных остается до конца не изученной. Таким образом, вопросы лечения и прогноза заболевания остаются актуальными в настоящее время и требуют дальнейшего изучения.
ФГБУ «Институт хирургии им. А.В. Вишневского» Минздрава России, Москва
ФГБУ «Институт хирургии им. А.В. Вишневского» Минздрава России, Москва
ФГБУ «Институт хирургии им. А.В. Вишневского» Минздрава России, Москва
Опухоль Клатскина (воротная холангиокарцинома — ВХ) представляет собой злокачественное новообразование внепеченочных желчных протоков и составляет на сегодняшний день от 50 до 70% всех холангиокарцином. Центральная локализация опухоли и близкое расположение к сосудистым структурам ворот печени обусловливают ее низкую резектабельность, высокие уровни летальности и осложнений, плохой прогноз. ВХ была впервые описана William Altemeier (1957 г.) и Gerald Klatskin (1965 г.) [2, 3, 6, 10, 15, 18, 20, 23—25, 27].
Холангиокарцинома составляет менее 2% всех злокачественных новообразований человека, при этом она является второй по распространенности среди первичных опухолей печени после гепатоцеллюлярного рака [21, 23, 25, 27].
В западных странах это заболевание встречается относительно редко (от 2 до 6 человек на 100 000 населения) по сравнению со странами Азии, где заболеваемость среди мужчин составляет 113 на 100 000 населения, среди женщин — 50 на 100 000. В Японии и Израиле частота возникновения холангиокарцином составляет 5,5 и 7,3 на 100 000 населения в год. В США ежегодно регистрируется примерно 3000 новых случаев опухоли Клатскина. Средний возраст развития болезни 50—60 лет [1, 2, 13, 23, 25—27].
Факторы риска опухоли Клатскина разнообразны, к ним относятся возраст старше 60 лет, мужской пол, наличие алкогольного и неалкогольного цирроза печени, воспалительные заболевания кишечника, хронический панкреатит, кисты желчных протоков, паразитарные болезни печени, желчнокаменная болезнь, метаболический синдром. Ряд авторов указывают, что наиболее хорошо изучен вопрос развития ВХ на фоне первичного склерозирующего холангита (ПСХ). У большинства пациентов при выявлении ПСХ заболеваемость холангиокарциномой в течение 2,5 года составляет от 6 до 36%. В связи с тем, что при ПСХ поражаются как внутри-, так и внепеченочные желчные протоки, этот фактор риска относится равноправно как к внутри-, так и к внепеченочным холангиокарциномам [23—27].
В настоящее время используются различные классификации опухолей Клатскина, каждая описывает конкретные аспекты опухоли [25].
Классификация Bismuth—Corlette (1975 г.) позволяет оценить локальное распространение опухоли и определить объем резекции, однако при этом не учитывается информация о сосудистых структурах, метастатическом поражении, что ограничивает прогностическую ценность классификации [2, 3, 6, 10, 14, 24].
Классификация MSKCC (Тhe Memorial Sloan Kettering Cancer Center, 1998 г.) уточняет локализацию опухоли, а также оценивает инвазию в воротную вену и атрофию печеночной ткани. В этой классификации, как и в классификации Bismuth—Corlette, не рассматриваются метастатическое поражение и вовлечение лимфатических узлов [12, 14, 24, 25].
Американским объединенным комитетом, занимающимся проблемой рака (American Joint Committee on Cancer — AJCC), была предложена классификация холангиокарцином. В VII ее издании внепеченочные холангиокарциномы были классифицированы отдельно и подразделены на воротные опухоли и опухоли дистальных желчных протоков [11, 14, 25]. В отличие от классификаций Bismuth—Corlette и MSKCC в классификации AJCC учитываются сосудистое поражение (портальной вены и печеночной артерии), вовлечение регионарных лимфатических узлов (N 1 — узлы вдоль пузырного протока, общего желчного протока, печеночной артерии и воротной вены, и отдаленные метастазы; N 2 — парааортальные, паракавальные, лимфатические узлы верхней брыжеечной артерии и чревного ствола) и отдаленные метастазы (в легких, надпочечниках, печени, брюшины и других локализаций) [24, 25].
В основном классификация AJCC применяется как послеоперационная система оценки опухолевого процесса, при этом польза в предоперационной диагностике резектабельности минимальна [24].
На согласительной конференции, организованной Европейской гепатопанкреатобилиарной ассоциацией (The European Hepato-Pancreato-Biliary Association) в 2007 г., была определена необходимость разработки новой классификации опухоли Клатскина. Учитывая наличие различных классификаций и сложность сопоставления результатов исследований в различных центрах, M. Deoliveira и соавт. [10] в 2011 г. предложили новую систему классификации, включающую размер опухоли, распространенность патологического процесса по билиарному тракту, вовлечение сосудов, лимфатических узлов, отдаленные метастазы и объем предполагаемой культи печени после резекции [10, 14, 22, 25].
При этом авторы создали новый реестр, который дает возможность каждому медицинскому центру вводить проспективно данные о наблюдавшихся в нем пациентах с опухолью Клатскина (www.cholangioca.org). Наличие таких стандартизированных и многоцентровых данных, по их мнению, позволит определить основные принципы терапии для формирования в дальнейшем руководств по лечению больных с ВХ.
Японская группа ученых, изучающих проблему рака печени (The Liver Cancer Study Group of Japan), в 2000 г. предложила классификацию, основанную на особенностях роста опухоли: объем-формирующий тип (mass-forming), перидуктально-инфильтративный (periductal-infiltrating) и внутрипротоковый тип (intraductal-growing) [25].
Около 90—94% внепеченочных опухолей представлено аденокарциномами. Согласно классификации Всемирной организации здравоохранения, основанной на степени дифференцировки клеток, аденокарциномы желчных протоков в зависимости от процентного соотношения железистых клеток в опухолевой ткани подразделяются на высоко-, умеренно- и низкодифференцированные, что составляет 95, 40—94 и 5—39% желез соответственно [1, 7, 8, 10, 18, 24, 27].
По данным Н.А. Майстренко и соавт. [1], холангиоцеллюлярный рак также подразделяется на аденосквамозный, плоскоклеточный, перстневидноклеточный, муцинозный и анапластический.
Для опухоли Клатскина характерны многочисленные участки пери- и интраневральной инвазии. Периневральная инвазия является специфическим путем распространения рака желчных протоков и представляет важный прогностический фактор. Распространение заболевания путем инвазии в прилежащие структуры ворот печени, в ветви воротной вены и печеночной артерии, прилегающую паренхиму печени является характерным признаком ВХ [8, 11, 24].
Гистологически опухоль Клатскина подразделяется на папиллярную, узловую и склерозирующую. Узловая и папиллярные формы выступают в просвет желчного протока. Склерозирующий тип диффузно инфильтрирует на протяжении стенки протока с образованием небольших слизистых выступов, он встречается наиболее часто. По данным литературы, папиллярная ВХ чаще резектабельна, с лучшим прогнозом вследствие менее выраженного инвазивного роста [8, 18, 24, 27].
В исследовании S. Rizvi и G. Gores [23] при сравнительном геномном анализе методом гибридизации образцов ткани ВХ показано наличие мутаций в локусах хромосом 16q, 17p, 17q, 19p и 19q, причем эти локусы кодируют белки ERBB2 (V-erb-b2 avian erythroblastic leukemia viral oncogene homolog 2), митогенактивируемую протеинкиназу 2 (MEK2) и фактор роста тромбоцитов β (PDGFB). Особенностями В.Х. являются также активизации воспалительных патологических путей, избыточная экспрессия цитокинов и активация белков STAT3 (signal transducer and activator of transcription). На фоне хронического воспаления происходит активация онкогенных сигнальных путей, включающих RAS-, MAPK- и MET-пути. Активация мутаций семейства KRAS белков часто отмечается при холангиокарциноме. По данным авторов, частота указанных мутаций у больных с опухолью Клатскина составляет 53%.
Предраковые состояния включают билиарную интраэпителиальную неоплазию (BiIN) и внутрипротоковую папиллярную неоплазию желчных протоков (IPN-B), которые рассматриваются как аналоги панкреатической интраэпителиальной неоплазии (PanIN) и внутрипротоковая муцинозная неоплазия поджелудочной железы (IPMN-P) соответственно [8, 24, 27].
По данным ряда авторов, механическая желтуха при опухоли Клатскина является самым распространенным признаком болезни и встречается в 69,1% наблюдений. Однако при неполной билиарной обструкции желтуха может отсутствовать, при этом о наличии заболевания косвенно могут свидетельствовать наличие повышенных уровней печеночных ферментов, зуд, увеличение массы тела. Некоторых больных беспокоят боли в верхнем правом квадранте живота [3, 14, 18, 27].
K. Soares и соавт. [24] указывают также на наличие сопутствующих заболеваний у больных с ВХ, а именно билиарных конкрементов, воспалительных заболеваний кишечника, ПСХ, гепатитов вирусной этиологии.
Несмотря на достижения в области диагностики, основанные на лабораторных и инструментальных технологиях, ранняя диагностика опухоли Клатскина остается проблемой современной медицины.
Оценка данных инструментальных методов исследования трудна вследствие сложности строения области ворот печени, близости главных сосудов и малых размеров опухоли. В диагностическом плане при подозрении на поражение билиарного тракта используются компьютерная томография (КТ), магнитно-резонансная томография (МРТ) и ультразвуковое исследование (УЗИ) [18, 24, 27].
При проведении УЗИ, ввиду низкой стоимости и доступности метода, возможно получить информацию о наличии расширения желчных протоков, однако выявить локализацию обструкции и степень опухолевого поражения, пораженные лимфатические узлы, метастазы печени и брюшины затруднительно, что требует использования других методов диагностики [2, 24, 27].
Мультиспиральная компьютерная томография обладает приемлемой точностью в диагностике (более 80%) вовлечения в патологический процесс протоков, воротной вены и печеночной артерии, однако диагностическая ценность в выявлении пораженных лимфатических узлов остается низкой. Артериальная и венозная фазы исследования позволяют выявить сосудистую инвазию соответствующих патологических образований структур ворот печени [2, 4, 9, 24, 27].
Роль холангиографии при опухоли Клатскина заключается в оценке распространения опухолевого процесса, определении ее возможной резектабельности и помощи в выполнении билиарного дренирования как паллиативного вмешательства у неоперабельных больных и как предоперационной подготовки у больных с потенциально резектабельными опухолями [2, 27].
Приблизительно у 10—15% больных, которым выполнено оперативное вмешательство при подозрении на ВХ, впоследствии диагностируют доброкачественные новообразования. Наиболее распространенными методами взятия образцов ткани для гистологического исследования являются brush-цитология и щипковая биопсия при эндоскопической ретроградной холангиопанкреатографии. Однако чувствительность brush-цитологии в выявлении злокачественных клеток составляет 18—60%, чувствительность биопсии — 43—81%. Авторы пришли к выводу, что дифференциальная диагностика доброкачественных стриктур и рака желчных протоков остается в настоящее время трудной задачей, и, как следствие, при подозрении на опухоль Клатскина методом лечения должна оставаться резекция предполагаемого злокачественного новообразования [18].
Такие же данные приводят и K. Soares и соавт. [24], указывая, что в 15—20% наблюдений обструкция проксимальных отделов билиарного тракта обусловлена воспалительными заболеваниями желчных протоков, ПСХ, желчнокаменной болезнью, а также раком желчного пузыря с прорастанием в гепатодуоденальную связку. Предоперационное выявление этиологии билиарной стриктуры остается в некоторых наблюдениях затруднительным, поэтому наиболее подходящим методом лечения в таких ситуациях являются резекционные вмешательства [24].
При опухоли Клатскина также используется определение уровня опухолевых маркеров раковоэмбрионального антигена и СА 19—9, чувствительность и специфичность этих маркеров при комбинации с другими методами обследования составляют 89 и 86% соответственно [2, 5].
Ряд авторов считают, что диагностическая лапароскопия может помочь в диагностике нерезектабельных внепеченочных билиарных карцином в 20—30% наблюдений, предотвращая проведение непоказанной в таких ситуациях лапаротомии [13, 18]. В статье S. Joseph и соавт. [13] отмечено, что дополнение диагностической лапароскопии УЗИ позволяет оценить местную стадию процесса, а также обследовать интраоперационно ткань печени на наличие метастатического поражения.
G. Nuzzo и соавт. [18] были проанализированы результаты лечения 440 больных опухолью Клатскина в период с 1992 по 2007 г., карциноматоз брюшины был выявлен у 1 (1,1%) больного. Авторы считают, что диагностическая лапароскопия показана при раке желчного пузыря, при котором нерезектабельность обусловлена наличием метастазов брюшины и печени, а не В.Х. Для опухоли Клатскина, при которой нередко имеет место сосудистая и билиарная инфильтрация, вопрос о возможности проведения резекции часто решается во время лапаротомии после обширной диссекции портальных и билиарных структур.
В течение последних двух десятилетий отмечается рост резекционных вмешательств на печени, в том числе более широкое применение обширных хирургических вмешательств, сопровождающихся резекцией сосудов с их дальнейшей реконструкцией, что позволило улучшить ранние и отдаленные результаты лечения этой группы больных [3, 15, 17, 18].
Радикальное хирургическое лечение, которое включает резекцию конфлюэнса печеночных протоков и гепатэктомию с удалением хвостатой доли печени, является единственным методом, позволяющим увеличить выживаемость в отдаленные сроки. По данным зарубежной литературы, менее чем в половине наблюдений опухоли Клатскина резектабельны [12, 14, 17, 18, 24].
Большинство больных с опухолью Клатскина поступают с признаками механической желтухи, проведение резекции печени в этих условиях связано с высоким риском послеоперационных осложнений. В метаанализе G. Nuzzo и соавт. [18] из 440 больных предоперационное дренирование было проведено 294 (66,8%), в 47,5% наблюдений развились послеоперационные осложнения: билиарный свищ (25,3%), печеночная недостаточность (17,1%), поддиафрагмальный абсцесс (13,7%), сепсис (12,3%), легочные осложнения (9,6%), сердечно-сосудистые осложнения (5,5%), внутрибрюшное кровотечение (4,8%), асцит (2,7%) и другие (8,9%). Таким образом, по данным литературы, необходимо проведение билиарного дренирования предполагаемой в дальнейшем культи печени, что позволит снизить уровень билирубина, тем самым облегчая развитие в дальнейшем гипертрофии печеночной ткани и снижая риск развития послеоперационных осложнений [2, 4, 18, 24].
Все же дренирование билиарного тракта у пациентов с механической желтухой перед резекцией печени остается предметом дискуссий. Обширная резекция печени у таких пациентов повышает риск развития послеоперационной печеночной недостаточности. Напротив, предоперационное дренирование в 20—30% наблюдений приводит к развитию холангита и сепсиса, повышая частоту послеоперационных инфекционных осложнений [14, 18].
В исследовании J. Belghiti и S. Ogata [4] было показано, что билиарное дренирование необходимо в предоперационном периоде в связи с тем, что эта манипуляция облегчает в дальнейшем течение процессов гипертрофии оставшейся после резекции печеночной ткани. В случае, если ожидается, что остаток печени будет менее 30—40%, как предоперационный метод лечения должна быть рассмотрена эмболизация воротной вены. Авторы отмечают, что проведение резекции показано через 4—6 нед после дренирования и эмболизации воротной вены [4, 14].
G. Nuzzo и соавт. [18] выполнили эмболизацию правой воротной вены в 37 (21,5%) из 172 наблюдений, после правосторонней или расширенной правосторонней гепатэктомии. Резекцию печени проводили в среднем через 47 дней (в сроки от 30 до 90 дней) [18].
Группой ученых из Германии под руководством P. Neuhaus была предложена методика резекции ворот печени единым блоком (hilar en bloc resection) при опухолях Клатскина IIIa по Bismuth—Corlette, которая включает резекцию внепеченочных желчных протоков, резекцию воротной вены, правой печеночной артерии, c резекцией I сегмента и с IV по VIII сегмент печени. Авторы начали применять методику с 1990 г. и в своем исследовании, опубликованном в 2012 г., провели сравнение результатов лечения с таковыми после традиционной расширенной гепатэктомии при ВХ. 1-, 3- и 5-летняя выживаемость после резекции единым блоком составила 87, 70 и 58% соответственно (p=0,021), при традиционном вмешательстве — 79, 40 и 29% соответственно. Характер опухолевого поражения был сравним в обеих группах. Большое число больных с опухолями рТ3 и рТ4 и с поражением регионарных лимфатических узлов были в обеих группах [17].
M. Machado и соавт. [15] в своей статье указали, что применение описанной ранее методики обосновано частой инфильтрацией опухолью правой ветви воротной вены и печеночной артерии в связи с их тесным контактом, левая же печеночная артерия проходит вдоль левого края ворот печени и чаще не вовлечена в патологический процесс. Этим авторы объясняют высокую частоту резекции R0.
M. Machado и соавт. приводят клиническое наблюдение, в котором у больного имелась опухоль Клатскина с вовлечением желчных протоков правой доли печени, что привело к развитию прогрессирующей желтухи, в связи с чем пациент обратился за медицинской помощью. После разрешения симптомов желтухи с помощью чрескожного билиарного стентирования металлическим стентом пациент был повторно осмотрен. КТ показало малый объем левой доли печени. Проведена эмболизация правой воротной вены. При дообследовании через 4 нед определялась адекватная компенсаторная гипертрофия паренхимы печени. Выполнено оперативное вмешательство в объеме правосторонней расширенной гемигепатэктомии с удалением единым блоком воротной вены и желчных протоков с использованием техники no-touch. Через 14 мес признаков заболевания нет.
G. Nuzzo и соавт. [18] показали, что частота резекции R0 была выше после комбинированной резекции печени, чем после резекции только конфлюенса желчных протоков, и составила 79,2 и 65,6% соответственно. При этом летальность после обширной резекции печени составила 10,1% (38 из 376 больных). В этом исследовании также отмечено, что 5-летняя общая выживаемость после резекции R0 составляет в среднем 35,2%. При этом авторами было определено, что 5-летняя выживаемость при резекции печени в сочетании с резекцией конфлюенса печеночных протоков составила 26,6%, 10-летняя общая выживаемость — 20,0%, в то же время выживших в течение 5 лет при резекции только конфлюенса печеночных протоков отмечено не было.
В этом исследовании резекция сосудов была выполнена 42 (11,2%) из 376 больных. Резекция воротной вены произведена 35 (83,3%) больным, печеночной артерии — 5 (11,9%) пациентам, в 2 (4,8%) наблюдениях вмешательства осуществлены на воротной вене и печеночной артерии. Послеоперационная летальность после гепатэктомии в сочетании с сосудистой резекцией (19,0%, или 8 из 42 больных) превысила летальность при гепатэктомии без резекции сосудов (9,0%, или 30 из 334 больных). Сосудистая инвазия подтверждена гистологически в 52,4% наблюдений (у 22 из 42 больных). Общая 5-летняя выживаемость после резекции сосудов составила 22,8%.
За последнее десятилетие ортотопическая трансплантация печени продемонстрировала перспективы в лечении нерезектабельных форм опухолей Клатскина. В обзорной статье K. Soares и соавт. [14, 24] указывается, что на начальных этапах внедрения методики результаты были низкими, 5-летняя выживаемость составляла 20—30%.
В клинике Мейо при комбинированном подходе в лечении опухолей Клатскина использовался протокол, позволивший добиться 60% 5-летней выживаемости тщательно отобранных больных с нерезектабельными ВХ, возникшими на фоне ПСХ. Протокол лечения включал внешнюю лучевую терапию (40—45 Гр), транскатетерное облучение (20—30 Гр) при эндоскопической ретроградной холангиографии или чрескожной чреспеченочной холангиографии с радиочувствительным 5-фторурацилом и последующим пероральным приемом капецитабина до дня трансплантации. Критериями исключения были локализация новообразования ниже пузырного протока, размер опухоли более 3 см, наличие внутри- и внепеченочных метастазов, наличие в анамнезе чрезбрюшинной биопсии [14, 22, 24].
S. Lau и W. Lau [14] указывают, что при невозможности проведения радикального вмешательства, выявленной интраоперационно, в качестве паллиативных методов лечения используются послеоперационное стентирование пластиковыми или металлическими стентами (эндоскопически или чрескожно), интраоперационная установка стента через опухоль (включая использование Т-образного дренажа, транспеченочного стента или U-образного стента) или формирование обходных билиодигестивных анастомозов [14].
Современные стандарты химиотерапии при нерезектабельных формах ВХ основаны на применении препаратов платины в комбинации с гемцитабином. Однако результативность лечения остается низкой с незначительным улучшением показателей выживаемости в этой группе больных [24].
В настоящее время с учетом понимания допустимых доз лучевой нагрузки с целью исключения лучевого поражения органов риска (особенно толстой кишки и желудка) применяют в качестве методов лечения интенсивную модуляционную радиотерапию и стереотаксическую радиотерапию (SBRT). Использование SBRT позволяет доставить высокие дозы радиации в необходимые места за более короткий временной интервал (менее 2 нед), что имеет перспективы при развитии местных рецидивов [19].
Ряд авторов считают, что в дополнение к внешней лучевой терапии внутрипротоковая брахитерапия нитями иридия-192, вводимыми через чрескожную гепатикостому к месту локализации злокачественной опухоли, в дальнейшем поможет улучшить результаты лечения этой группы больных [14].
В настоящее время проводятся исследования, посвященные применению при лечении больных опухолью Клатскина фотодинамической терапии (ФДТ), суть которой заключается во внутривенном введении фоточувствительного агента, накапливающегося в опухолевой ткани. При активации препарата образуются свободные радикалы кислорода, приводящие к повреждению окружающих клеток опухоли. В ряде исследований было показано, что медиана выживаемости при ФДТ как неоадъювантного метода терапии составила от 330 до 493 дней после постановки диагноза и однолетняя выживаемость — от 45 до 83% [20, 24].
По данным современной литературы, 5-летняя выживаемость после хирургического лечения ВХ составляет от 10 до 58%. При этом даже при выполнении резекции R0, частота рецидивов достигает 50—70% [1, 2, 15, 17, 18, 24].
Низкая общая выживаемость обусловлена следующими факторами: периневральной инвазией, резекцией R1, метастазами в лимфатические узлы, стадией заболевания III и выше, Т-стадией 3 и выше, степенью дифференцировки клеток 2 и выше, возрастом старше 60 лет, инвазией в хвостатую долю печени [18].
Таким образом, вопросы диагностики, лечения и прогноза при опухолях Клатскина в настоящее время сохраняют актуальность. Выполнение обширных резекций печени, сочетание оперативных вмешательств с резекцией сосудистых структур с их последующей реконструкцией, разработка новых препаратов и внедрение новых протоколов предоперационной подготовки и послеоперационного ведения больных позволили улучшить отдаленные результаты лечения. Расширение знаний о процессах, происходящих на молекулярно-генетическом уровне и лежащих в основе патогенеза заболевания, даст возможность в дальнейшем совершенствовать и улучшать методы обследования и лечения таких пациентов, откроет новые пути для таргетной терапии, что повлияет на результаты лечения и прогноз при воротной холангиокарциноме в лучшую сторону.