гийена барре заболевание что это такое фото
Лечение больных синдромом Гийена-Барре
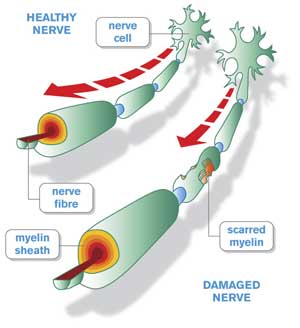
Острая воспалительная демиелинизирующая полирадикулоневропатия или синдром Гийена-Барре (СГБ) – это аутоиммунная полинейропатия, характеризующаяся быстро развивающимися (менее чем за 4 недели) двигательными нарушениями в конечностях и (или) поражением черепных нервов в сочетании с белково-клеточной диссоциацией в цереброспинальной жидкости.
Частота заболеваемости СГБ в мире составляет 0,6-2,4 случая на 100 тыс. населения [1,2,3]. Согласно данным, представленными Супоневой Н.А. и соавт. (2014), в России ежегодно СГБ заболевают около 2700 человек [4].
В зависимости от начала аутоиммунного процесса выделяют четыре клинических вариантов СГБ [2,5,6,7]:
1. Острая воспалительная демиелинизирующая полиневропатия (ОВДП) (70-80% случаев) считается классической формой СГБ.
2. Острая моторная аксональная невропатия (ОМАН) (10-15%) характеризуется изолированным поражением двигательных волокон.
3. Острая моторно-сенсорная аксональная невропатия (ОМСАН) (5%) проявляется в виде поражения двигательных и чувствительных волокон.
4. Синдром Миллера-Фишера (не превышает 3%) характеризуется офтальмоплегией, мозжечковой атаксией при слабовыраженных парезах.
В двух трети случаев развитию СГБ предшествует вирусная или кишечная инфекция [4]. В качестве инфекционных агентов могут выступать такие возбудители, как Campylobacter jejuni, Mycoplasma pneumonia, цитомегаловирус, вирус Эпштейна-Барр и вирус гриппа [3,8].
Инфекционные агенты являются пусковым механизмом, который приводит к развитию аутоиммунного поражения периферической нервной системы. В настоящее время доказано, что в основе патогенеза СГБ лежит механизм молекулярной мимикрии, которая приводит к продукции аутоантител к антигенам периферической нервной системы [7,9]. Одним из доказательств участия в воспалении инфекционных агентов является обнаружение у больных высокого титра антител к ганглиозидам GM1, GD1a, GD1b и GQ1b на фоне возросшего титра антител к предполагаемому возбудителю [9,11,13].
Клиническая картина в развернутой стадии СГБ, обычно складывается из двигательных, чувствительных и вегетативных нарушений; сухожильной гипо- или арефлексии. Наиболее часто встречаются двигательные расстройства, характеризующиеся периферическими, преимущественно дистальными парезами с мышечной гипотонией и угасанием сухожильных рефлексов, Возможно развитие диффузной спонтанной (симметричной, двусторонней) миалгии до проявления двигательных расстройств. Примерно у 25% больных в результате дальнейшего прогрессирования заболевания развивается парез диафрагмы и дыхательной мускулатуры, что приводит к дыхательной недостаточности [1,8].
Плазмаферез (ПФ) и внутривенное введение иммуноглобулина класса G (IgG) являются эффективным методом лечения СГБ в течение первых недель заболевания [1,5].
ПФ применяется у больных СГБ с 1985 года. Согласно рекомендациям Американского Общества Афереза (2010) целью ПФ является удаление 200-250 мл/кг плазмы в течение 7-14 дней. Замещение удаляемого объёма плазмы производится 5% альбумином. Показаниями для проведения ПФ является нарастающая неврологическая симптоматика, требующая искусственной вентиляции лёгких, неспособность пройти более 5 м с опорой или поддержкой, или неспособность встать и пройти 5 м самостоятельно в соответствии с Североамериканской шкалой тяжести двигательного дефицита (САШ) (табл. 1) [12,13,14].
Североамериканская шкала тяжести двигательного дефицита
Минимальные двигательные расстройства
Способность проходить 5 м без поддержки (опоры)
Способность проходить 5 м с поддержкой (опорой)
Невозможность проходить 5 м с поддержкой или опорой (прикованность к постели или инвалидной коляски)
Необходимость проведения ИВЛ
Внутривенное введение высоких доз IgG было признано эффективным методом лечения СГБ, способным существенно уменьшать продолжительность и тяжесть заболевания [14]. Для лечения СГБ IgG используются в дозе 0,4 г/кг в течение 2-5 суток. Американская Неврологическая Академия (2003) рекомендовала применение IgG у больных с продолжительностью заболевания не превышающей 2 недели [15].
В настоящее время в нашем стационаре накоплен опыт лечения больных СГБ.
Целью исследования является изучение клинической эффективности патогенетической терапии у больных СГБ.
Материалы и методы
В исследование был включён 21 больной СГБ (12 мужчин и 9 женщин). Возраст больных колебался от 19 до 77 лет. Средний возраст всех больных СГБ составлял 53,5±3,74 года.
Больные по этиологической причине СГБ распределились следующим образом: «острая респираторная вирусная инфекция» – 71,4%, «кишечная инфекция» – 23,8% и не установленная этиологическая причина – 4,8%.
Распределение больных по формам СГБ и степени тяжести двигательного дефицита представлено в таблице 2.
Распределение больных синдромом Гийена-Барре по форме заболевания, времени года.
Примечание: СГБ – синдром Гийена-Барре; ОВДП – острая воспалительная демиелинизирующая полиневропатия; ОМАН – острая моторная аксональная невропатия; ОМСАН – острая моторно-сенсорная аксональная невропатия.
Всем больным, поступавшим в стационар, проводили следующие виды терапии (табл. 3).
Распределение больных синдромом Гийена-Барре в зависимости
Процент от общего количества больных
Примечание: ПФ – плазмаферез; IgG – иммуноглобулин класса G.
1. ПФ проводился на сепараторе клеток крови AS-204 (Fresenius, Германия) с непрерывно-поточным разделением крови на клеточные элементы и плазму. Объём удаляемой плазмы за курс ПФ строился из расчёта 200 мл удаляемой плазмы на 1 кг веса больного, замещение удаляемого объёма плазмы проводилось растворами кристаллоидов, коллоидов и 10% или 20% альбумина. Протокол терапии состоял из 4-6 сеансов ПФ, в течение 7-12 суток. Антикоагуляцию осуществляли постоянной инфузией гепарина в экстракорпоральный контур в дозе 5 ед/кг/час.
Для обеспечения сосудистого доступа во время сеансов ПФ катетеризировали одну из центральных вен (подключичную или внутреннюю ярёмную вену). Для адекватного кровотока использовали двухпросветный рентгеноконтрастный катетер 9 Fr, установленный по методу Сельдингера.
2. Внутривенное введение иммуноглобулина класса G (IgG) проводилось из расчёта 0,4 г на 1 кг веса больного в течение 5 суток.
Больным, поступившим в стационар, проводилось комплексное обследование. Включавшее в себя сбор анамнеза, общий осмотр, оценка неврологического статуса и определение степени тяжести двигательного дефицита по Североамериканской шкале тяжести двигательного дефицита (САШ) (табл. 1), лабораторные исследования, применение методов нейровизуализации, выполнение люмбальной пункции и электронейромиографии.
Эффективность терапии оценивалась по динамике изменения неврологической симптоматики и изменению степени тяжести двигательного дефицита по САШ.
Результаты и их обсуждение
Срок госпитализации в стационар пролеченных больных от момента появления симптомов заболевания составил 10,6±2,36 суток. У всех больных в клинической картине наблюдался периферический парез различной степени выраженности, снижение или отсутствие сухожильных рефлексов, онемение в конечностях и миалгии. Электронейромиография выполнялась 47,6% больным. В стационаре преобладали больные с тяжёлой степенью двигательного дефицита по САШ (табл. 4).
Распределение больных синдромом Гийена-Барре по степени тяжести двигательного дефицита в баллах, САШ
Степень тяжести двигательного дефицита, балл
Процент от общего количества больных
СГБ является одним из самых частых причин острых периферических параличей в мире. Как видно из таблицы 2 набольшее число случаев СГБ регистрировалось в зимний и весенний периоды года. В нашем исследовании основным пусковым фактором заболевания являлась острая респираторная вирусная инфекция, которая составила 71,4% от всех этиологических причин, которые предшествовали развитию СГБ. Существенных различий в половой структуре не было, количество мужчин и женщин, заболевших СГБ, было практически одинаково, что соответствует результатам, полученным Супоневой Н.А. и соавт. (2014) [4].
У 23,8% больных отмечались бульбарные расстройства и у 14,3% больных в связи с тяжёлой дыхательной недостаточностью, проводилась искусственная вентиляция лёгких, продолжительностью 19,7±4,58 суток.
По результатам лабораторных методов диагностики белково-клеточная диссоциация ликвора отмечалась у 57,1% больных.
Лечение больных с использованием указанных выше методов терапии начиналось на 2,7±0,43 сутки от момента госпитализации и постановки окончательного диагноза. На фоне проводимой терапии регресс неврологической симптоматики и изменение степени тяжести двигательного дефицита по САШ регистрировали у 71,4% больных. В двух случаях удалось остановить прогрессирование дыхательной недостаточности и необходимость в искусственной вентиляции лёгких. У 19,0% больных после проведенной терапии достигнут эффект «плато», неврологический дефицит остался на прежнем уровне без ухудшения состояния.
Время пребывания больных в стационаре составило 30,8±3,87 суток.
Заключение.
В настоящее время патогенетической терапией СГБ считается ПФ и внутривенное введение IgG. Эффективность данных методов доказана многочисленными рандомизированными исследованиями [1,13,15]. Как видно из таблицы 3 основным методом лечения СГБ являлся ПФ, который применялся у 95,2% больных, как монотерапия, так и в сочетании с внутривенным введением IgG. Высокая частота применения ПФ связана с возможностью быстрого начала лечения больных СГБ по сравнению с IgG. Для эффективного лечения препаратами IgG необходимо чтобы концентрация IgG превышала 90% [1]. Данное условие не всегда можно выполнить в короткий период времени. Это становиться особенно актуальным у больных с тяжёлой и крайне тяжёлой стадиями заболевания, когда существует реальная угроза развития дыхательной недостаточности или больной уже находится на искусственной вентиляции лёгких. Сочетание ПФ и IgG у одного из больных было связано с рефрактерным течением ОВДП.
Таким образом, подводя итоги можно отметить, что патогенетическая терапия с использованием ПФ, является эффективным методом лечения больных СГБ, позволяющая купировать прогрессирование периферических парезов и предупредить развитие жизнеугрожающих осложнений. Полученные нами положительные результаты, сопоставимы с литературными данными [5,7,13,15]. Достигнутые результаты лечения больных СГБ на наш взгляд связаны с тем, что нам удалось максимально сократить сроки начала патогенетической терапии, в первую очередь ПФ, от момента поступления больного в стационар и постановки диагноза до начала лечения, тем самым уменьшить прогрессирование неврологической симптоматики, риска присоединение гнойно-септических осложнений, прогрессирования дыхательной недостаточности и сроков проведения ИВЛ. В совокупности это позволило уменьшить сроки госпитализации.
Список литературы
Автор статьи:
Кутепов Дмитрий Евгеньевич
Синдром Гийена — Барре: причины, симптомы и лечение

Свое название недуг получил по имени французских врачей, впервые опубликовавших его подробное описание, — Жоржа Гийена и Жана Барре. Это было в 1916 году.
Симптомы заболевания
Синдром Гийена — Барре имеет три формы:
В первые дни пациент испытывает симптомы, характерные для ОРВИ:
Может присутствовать тошнота, рвота, диарея. Из-за этого человек не сразу может догадаться о серьезных нарушениях в организме. И пользуется противовирусными, противовоспалительными препаратами, которые бесполезны при повреждении нервов.
Далее проявляются специфические признаки синдрома. В первую очередь это слабость в конечностях. Из-за поражения нервных клеток мышцы утрачивают чувствительность. Как правило, сначала дискомфорт появляется в ногах, затем распространяется на руки. Характерным симптомом выступает симметричное поражение конечностей — беспокоить начинают сразу две руки либо ноги.
Второй признак — выпяченный живот. Он увеличивается потому, что больной вынужден дышать по брюшному типу из-за ослабления диафрагмы.
Нарушается работа мышц глотки и челюстей: человеку становится тяжело пережевывать и проглатывать пищу. При острой форме заболевания развивается паралич конечности.
Причины возникновения синдрома Гийена — Барре
Поскольку полирадикулоневрит носит аутоиммунный характер, доподлинно не ясны причины его появления.
Ученые выяснили, что в 80 % случаев болезнь — это следствие тяжело протекающих вирусных инфекций, в том числе ВИЧ и герпеса. Так, после энтерита, вызванного бактериями Campylobacter jejuni, риск развития синдрома увеличивается в 100 раз.
Спровоцировать недуг могут и травмы, вызвавшие отек или рост новообразований в мозге.
Среди других причин синдрома Гийена — Барре также отмечают:
Лечение
Синдром Гийена — Барре хорошо поддается лечению: в 80 % случаев пациенту удается полностью избавиться от недуга. Летальность заболевания низкая — всего 5 % от числа заболевших.
Поскольку пациенту нужно регулярное аппаратное наблюдение, особый уход и постоянный контроль медикаментозной терапии, лечение проводится в стационарных условиях.
В тяжелых случаях больные нуждаются в госпитализации в отделение интенсивной терапии и почасовом наблюдении. Оценивается дыхательная функция, сердечный ритм, давление и состояние мышц.
При синдроме Гийена — Барре назначают:
Срок лечения составляет от 2 до 6 недель.
Реабилитация и профилактика
После купирования синдрома следует период реабилитации — от нескольких недель до 2—3 лет. Больным назначаются процедуры массажа, лечебные ванны, магнитотерапия и курс лечебной гимнастики.
После восстановления не рекомендуется делать вакцинации. Также необходимо беречь себя от инфекций.
Аутоиммунные заболевания невозможно предупредить. Лучшая профилактика полирадикулоневрита — это своевременное лечение инфекционных болезней и немедленное обращение к врачу при появлении характерных симптомов.
Симптомы
Симптомы синдрома Гийена-Барре могут включать в себя:
Большинство пациентов с синдромом Гийена-Барре начинают испытывать выраженную слабость в течение четырех недель после появления симптомов. В некоторых случаях, симптомы могут прогрессировать очень быстро, вызывая полный паралич ног, рук и дыхательных мышц в течение нескольких часов. Поэтому с учетом возможного быстрого прогрессирования заболевания необходимо обязательно обратиться к врачу при наличии следующих симптомов:
Синдром Гийена-Барре является серьезным заболеванием, которое требует немедленной госпитализации из-за возможного быстрого прогрессирования. Чем раньше начато соответствующее лечение, тем выше шансы на хороший результат.
Причины
Точная причина синдрома Гийена-Барре неизвестна. Примерно в 60 процентах случаев синдрому предшествует инфекция дыхательных путей или желудочно-кишечного тракта. Недавно проведенная операция беременность вакцинация также были связаны с синдромом Гийена-Барре. Но ученые не могут пока объяснить, почему инфекции у одних людей приводят к развитию синдрома, а у других нет. Тем более много случаев возникновения этого синдрома без каких-либо триггеров.
Факторы риска
Синдром Гийена-Барре может возникнуть в любой возрастной группе, но наиболее подвержены взрослые пациенты молодого и пожилого возраста.
Синдром Гийена-Барре может быть вызван:
Осложнения
Синдром Гийена-Барре оказывает влияние на нервы и может вызвать эффект домино на другие системы в организме, такие как дыхание и сердечнососудистая деятельность. Осложнения Синдрома Гийена-Барре включают в себя:
Тяжелая, ранняя симптоматика при синдроме Гийена-Барре значительно увеличивает риск серьезных долгосрочных осложнений. В редких случаях возможно наступление смерти от осложнений, таких как респираторный дистресс-синдром и острая сердечно-сосудистая недостаточность.
Диагностика
Нередко синдром Гийена-Барре бывает трудно диагностировать на ранних стадиях. Его симптомы, аналогичны другим неврологическим расстройствам и могут варьировать у разных людей.
Лечение
И хотя некоторым пациентам требуются месяцы или даже годы для выздоровления в большинстве случаев синдром Гийена-Барре протекает в определенные сроки:
Специфического лечения синдрома Гийена-Барре нет, только симптоматическое. Но два вида лечения значительно ускоряют восстановление и уменьшают тяжесть синдрома Гийена-Барре:
Эти процедуры являются одинаково эффективными. Нецелесообразно одновременное использование этих методов.
ЛФК. Для восстановления физической активности необходимо активное применение лечебной физкультуры, что позволяет быстрее вернуться к нормальной физической активности. Нередко на начальных этапах выздоровления требуется инвалидная коляска или ходунки.
Эмоциональные нарушения могут быть очень сильными при синдроме Гийена-Барре. Связано это с определенным периодом нарушения двигательных функций и страхом остаться обездвиженным. В таких случаях требуется помощь психотерапевта.
Использование материалов допускается при указании активной гиперссылки на постоянную страницу статьи.
Синдром Гийена-Барре: этиология, клиника, лечение
Синдром Гийена-Барре – это острая воспалительная демиелинизирующая полирадикулоневропатия аутоиммунной этиологии, характеризующеяся периферическими параличами и в большинстве случаев белково-клеточной диссоциацией в ликворе. Частота заболеваемости синдром Гийена-Барре – 0,6-2,4 случая на 100 тысяч населения. Развития заболевания предшествует контакт организма с вирусной или бактериальной инфекцией, например Campylobacter jejuni, Mycoplasma pneumonia, цитомегаловирус, вирус Эпштейна-Барр и вирус гриппа. В основе патогенеза синдрома Гийена-Барре лежит «молекулярная мимикрия» между инфекционными агентами на своей поверхности и структурами периферических нервов. В сыворотке крови больных обнаруживается высокий титр антител к ганглиозидам GM1, GD1a, GD1b и GQ1b. Диагностическими критериями постановки диагноза синдрома Гийена-Барре являются данные осмотра, анализ спинномозговой жидкости и электронейромиографическое исследование. Плазмаферез и терапия иммуноглобулинам класса G в настоящее время являются основными видами лечения больных синдром Гийена-Барре. Благоприятный прогноз в виде регресса клинических проявлений заболевания достигает 60-80%.
Синдром Гийена-Барре (СГБ) – это острая воспалительная демиелинизирующая полирадикулоневропатия аутоиммунной этиологии, характеризующеяся периферическими параличами и в большинстве случаев белково-клеточной диссоциацией в ликворе.
Первые упоминания о заболевании относятся к XVIII веку. В 1859 году Landry J. описал острый восходящий паралич. В 1916 году французские врачи Guillain G., Barre J. и Strohl A. описали клиническую картину острого периферического паралича с белково-клеточной диссоциацией ликвора у двух французских солдат. В 1949 году Haymaker W.E. и Kemohan J.W. описали клиническую картину и гистологические изменения периферической нервной системы у 50 больных СГБ [9].
Частота заболеваемости СГБ – 0,6-2,4 случая на 100 тыс. населения. СГБ встречается с одинаковой частотой среди мужчин и женщин [3,10,23]. По данным, представленным Супоневой Н.А. и соавт. (2013) в 7 городах и 2 субъектах Российской Федерации заболеваемость СГБ составила от 0,34 до 2,5 на 100 тыс. населения [4]. В Москве СГБ ежегодно заболевают около 200 человек [6].
Развития заболевания предшествует контакт организма с вирусной или бактериальной инфекцией. По литературным данным через 10-14 дней после перенесённой вирусной респираторной инфекции возникают симптомы данного заболевания [10,33]. В качестве инфекционных агентов могут выступать такие возбудители, как Campylobacter jejuni, Mycoplasma pneumonia, цитомегаловирус, вирус Эпштейна-Барр и вирус гриппа В клинической практике описаны случаи СГБ после хирургических операций и вакцинаций [9,33].
СГБ характеризуется аутоиммунным поражением периферической нервной системы, которая чаще приводит к демиелинизации и затем к вторичной аксональной деструкции нервных волокон, иногда поражение миелина и аксонов может возникать одновременно. В основе СГБ лежат аутоиммунные механизмы, которые запускаются в результате перенесённой вирусной или бактериальной инфекцией. Инфекционные агенты на своей поверхности имеют структуры (олигосахариды), схожие со структурами периферических нервов, в результате чего возникает «молекулярная мимикрия» [5]. В результате «молекулярной мимикрии» происходит продукция аутоантител к антигенам периферической нервной системы [5].
В острой фазе заболевания происходит изменение клеточного и гуморального иммунитета. В сыворотке крови больных обнаруживаются антитела к миелину периферических нервов, повышается активность Т-клеток и уменьшается число Т-супрессоров. В результате активации гуморального и клеточного иммунитета концентрация IgM, IgA и циркулирующих иммунных комплексов (ЦИК) увеличивается. Это приводит к накоплению ЦИК по ходу миелиновых оболочек периферических нервов [5,9,10].
Одним из доказательств участия в воспалении инфекционных агентов является обнаружение у больных высокого титра антител к ганглиозидам GM1, GD1a, GD1b и GQ1b на фоне возросшего титра антител к предполагаемому возбудителю [20,28,34]. При этом более высокий уровень антител к ганглиозиду GM1 является фактором риска для развития острой моторной аксональной невропатии, которая является более тяжелой формой СГБ, проявляющейся преимущественно чувствительными нарушениями и худшим восстановлением [33].
Значение «молекулярной мимикрии» отчётливо проявляется у больных с синдромом Миллера-Фишера (СМФ). «Молекулярная мимикрия» между инфекцией (Campylobacter jejuni) и структурами периферических нервов играет ключевую роль в повреждении терминальных отделов аксонов [5,32]. У больных с СМФ в крови выявляются антитела к ганглиозидам GQ1b и GT1а, целью которых являются глазодвигательные и бульбарные нервы [18,25,26,32].
Конечным этапом патогенеза СГБ является поступление Т-клеток и ЦИК в эндоневрий вместе с макрофагами. Это приводит к выраженному тканевому повреждению, которому сопутствует активный фагоцитоз, осуществляемый клетками моноцитарно-макрофагальной линии [3,20].
СГБ обычно начинается с мышечной слабости и/или сенсорных расстройств в нижних конечностях, которые затем распространяются на верхние конечности. По литературным данным прогрессирование заболевания у 50% больных отмечается ко 2-й недели от момента появления первых клинических симптомов. К 4-й недели диагноз СГБ выставляется у 90% больных. Приблизительно 80-90% больных требуют госпитализации в стационар [9,10,16].
Клиническая симптоматика в развернутой стадии СГБ, обычно складывается из двигательных, чувствительных и вегетативных нарушений; сухожильной гипо- или арефлексии. Двигательные нарушения (парезы конечностей различной степени выраженности, часто вплоть до параличей) наблюдаются практически у всех больных. В тяжелых случаях у большинства отмечается также поражение мышц туловища, включая мышцы шеи, спины, живота. Мышечная слабость в конечностях, как правило, симметрична и больше выражена в ногах, однако возможно небольшое преобладание ее на одной стороне тела.
Неврологический осмотр позволяет выявить двигательные нарушения, которые носят симметричный характер. При СГБ могут поражаться черепные нервы (VII, IX X), в результате чего нарушается глотание, фонация и возникают глазодвигательные расстройства.
Необходимо помнить, что кроме неврологических проявлений заболевания у больных могут возникать осложнения со стороны других органов и систем. По данным Сhio A. et al (2003) приблизительно у одной трети больных развивается дыхательная недостаточность, возникающая в результате пареза диафрагмы и дыхательной мускулатуры [3,14,15,33]. Для больных СГБ характерны осложнения со стороны сердечно-сосудистой системы, которые проявляются в виде артериальной гипертензии, тахикардии или брадикардии [15]. В связи с нарушением нервно-мышечной проводимости у одной трети больных наблюдается дисфункция мочевого пузыря, проявляющаяся в виде задержки мочи. Расстройства желудочно-кишечного тракта обнаруживаются у 15% больных СГБ, включая такое грозное осложнение, как кишечная непроходимость [9].
В настоящее время описаны четыре основных клинических вариантов СГБ. Наиболее частым (классическим) вариантом является острая восполительная демиелинизирующая полирадикулоневропатия (85-90%) [14,23]. На долю аксональной формы СГБ и острой моторной аксональной невропатии приходится 10-15% от всех случаев СГБ [27]. Данные варианты СГБ значительно чаще встречаются в странах Азии и Южной Америки (30-47%) по сравнению со странами Европы и Северной Америки [7]. Синдром Миллера-Фишера встречается не более чем в 3% случаев и характеризуется офтальмоплегией, мозжечковой атаксией при слабовыраженных парезах [7,21,23].
Обновленными диагностическими критериями СГБ являются следующие признаки: прогрессирующая двигательная слабость с вовлечением более чем одной конечности, арефлексия или выраженная гипорефлексия. Для подтверждения диагноза СГБ используют анализ спинномозговой жидкости и электронейромиографическое исследование. При анализе спинномозговой жидкости к числу диагностических критериев, подтверждающих СГБ, относят повышение концентрации белка и отсутствие цитоза. По данным Ropper A.H. (1992) характерные изменения в спинномозговой жидкости диагностируются более чем у 90% больных в период разгара заболевания [27,28]. Электронейромиографическое исследование выявляет замедление скорости нервной проводимости, поздние ответы F-волн [9].
Для оценки неврологического статуса у больных СГБ используется Североамериканская шкала тяжести двигательного дефицита (САШ). САШ позволяет оценить состояние больного и его двигательную возможность от 0 (норма) до 5 стадии (потребность в проведении ИВЛ) (табл. 1).
Североамериканская шкала тяжести двигательного дефицита
