гипертрофия стенок мочевого пузыря что это такое
Влияние терапии α-адреноблокаторами и комплексом противоишемических препаратов на обратимость гипертрофии детрузора и его дисфункции после ликвидации инфравезикальной обструкции
Кирпатовский В.И., Иванов А.П., Кудрявцева Л.В., Фролова Е.В.
Сведения об авторах:
ВВЕДЕНИЕ
В предыдущих публикациях нами было показано, что экспериментально вызванная у крыс доброкачественная гиперплазия предстательной железы (ДГПЖ), а также инфравезикальная обструкция (ИВО), вызванная сужением предпузырного отдела уретры, приводит к развитию выраженной гипертрофии детрузора, ухудшению функционального состояния мочевого пузыря со снижением его контрактильной активности и развитием признаков детрузорной гиперактивности и эти изменения сопровождаются ухудшением кровоснабжения мочевого пузыря [13]. Терапия комплексом противоишемических препаратов (альфа-токоферол, мексидол, пентоксифиллин и дилтиазем), проводимая как на фоне острой задержки мочи, так и при хронической обструкции мочевых путей позволяет уменьшить выраженность функциональных нарушений и терапевтический эффект этого комплекса сопоставим с эффективностью α-адреноблокаторов [2,3], традиционно используемых для терапии расстройств мочеиспускания у больных ДГПЖ [4,5]. Однако не исследованным остается вопрос, способствует ли противоишемическая терапия ускорению обратного развития морфологических изменений и функциональных нарушений мочевого пузыря после ликвидации обструкции. В отношении терапии α-адреноблокаторами также нет ясности в этом вопросе. Одни авторы сообщают о возможности уменьшения гипертрофии мочевого пузыря на фоне терапии препаратами этой группы [6,7], тогда как другие авторы не находили этих изменений [8]. Изучение этого вопроса важно в плане доказательства целесообразности продолжения медикаментозной терапии у ряда пациентов в раннем послеоперационном периоде после трансуретральной резекции предстательной железы (ТУР ПЖ), поскольку примерно в 15-30% случаев после операции сохраняются выраженные ирритативные симптомы, ухудшающие качество жизни пациентов 10.
В соответствии с этими предпосылками мы провели экспериментальное и клиническое исследование влияния медикаментозной терапии, проводимой после ликвидации ИВО, на обратимость имеющихся морфологических и функциональных нарушений.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Проведено 30 экспериментов на самках белых беспородных крыс и анализ историй болезни 76 пациентов, оперированных по поводу ДГПЖ.
Экспериментальные исследования
У крыс моделировали хроническую инфравезикальную ИВО путем дозированного сужения предпузырного отдела мочеиспускательного канала, как описано нами ранее [2]. Через 1 месяц крыс повторно оперировали для удаления суживающей лигатуры с проверкой восстановления проходимости уретры путем наполнения мочевого пузыря физ. раствором через уретру. Со следующего дня начинали терапию комплексом противоишемических препаратов, эффективность которых доказана в предыдущих исследованиях (а-токоферола ацетат, мексидол, пентоксифиллин и дилтиазем из расчета 10 мг/кг в сутки, 5 мг/кг в сутки, 4 мг/кг в сутки и 2 мг/кг в сутки, соответственно), или терапию а-адреноблокатором доксазозином из расчета 40 мкг/кг в сутки, как описано в ранее опубликованных работах [2,3].
В конце периода наблюдения исследовали функциональное состояние мочевого пузыря методом цистометрии наполнения [2], определяли массу мочевого пузыря взвешиванием и проводили его гистологическое исследование.
Удаленный мочевой пузырь после взвешивания фиксировали в 9% нейтральном формалине с последующим стандартным приготовлением гистологических препаратов и их окрашиванием гематоксилином и эозином.
Клинические исследования
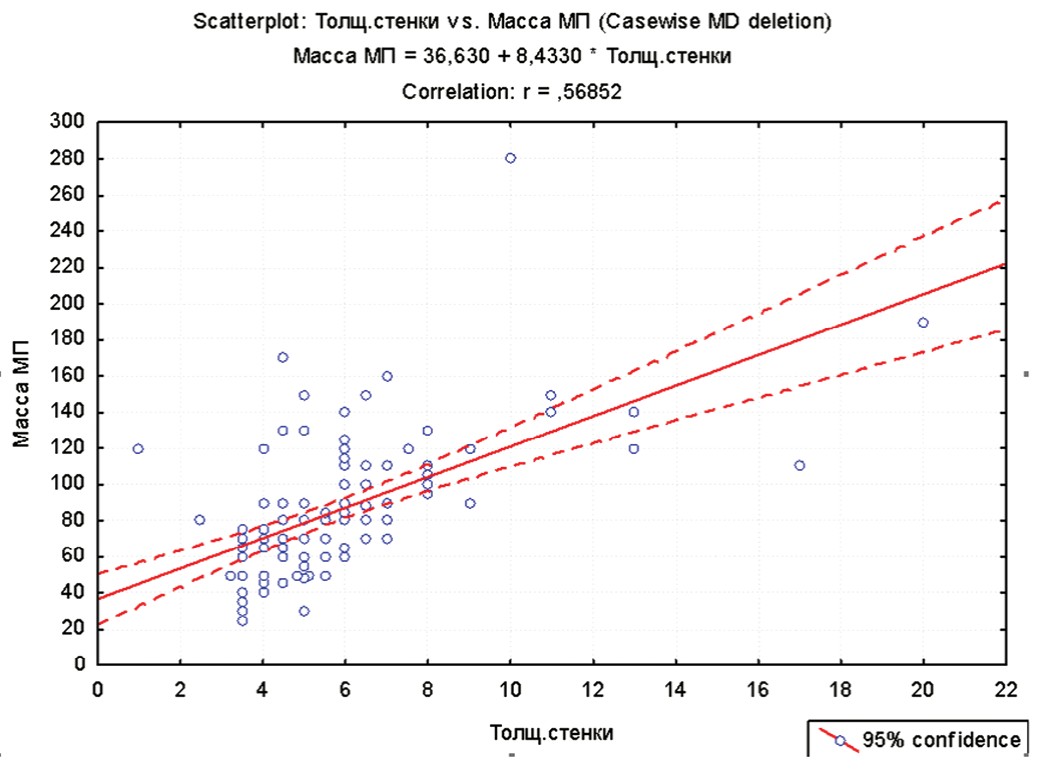
Более точным методом оценки степени гипертрофии мочевого пузыря является определение его массы с расчетом по специально разработанной формуле путем определения объема мочевого пузыря, определенного по наружному контуру, с вычитанием объема полости мочевого пузыря 15. Ранее проведенные исследования показали, что в норме показатель массы мочевого пузыря (ПММП) составляет 40-70 усл. ед. [14].
Рис. 1 Корреляционный анализ взаимосвязи индивидуальных значений толщины стенки мочевого пузыря и его массы.
Fig. 1. Correlation analysis of the relationship of the individual values of the bladder wall thickness and its mass
Возраст больных в группе исследования варьировал от 51 до 72 лет, составляя в среднем 65,1±0,6 лет. Длительность заболевания по результатам сбора анамнеза колебалась от 3 до 20 лет (в среднем 4,5±0,3 года).
Всем больным проведено оперативное лечение, заключающееся в трансуретральной резекции предстательной железы
Через 1 месяц все больные были повторно обследованы с УЗ-оценкой выраженности гипертрофии детрузора, наличия остаточной мочи и выраженности симптомов нарушения функции мочевыводящих путей (СНМП) по опроснику IPSS.
Уротелиальная гиперплазия, реактивные и метапластические изменения уротелия
Плоскоклеточная метаплазия – это доброкачественное пролиферативное и метапластическое образование, в котором нормальный уротелий замещен неороговевающим плоским эпителием. Она наиболее часто проявляется в виде белесых округлых участков в области треугольника мочевого пузыря у женщин. Является вариантом нормы. При цистоскопии участки плоскоклеточной метаплазии без ороговения выглядят как бледные серовато-белые островки с неровными контурами, чаще всего локализуются в области треугольника и иногда окружены зоной гиперемии. Другой вариант плоскоклеточной метаплазии уротелия характеризуется выраженными признаками ороговения и является лейкоплакией. Лейкоплакия мочевого пузыря обычно развивается как защитная реакция на хроническое воспаление или длительное воздействие повреждающих факторов (конкрементов, катетеров, дренажных трубок). По международной классификации лейкоплакию относят к неопухолевым изменениям эпителия. Тем не менее многие исследователи склонны считать плоскоклеточную метаплазию с ороговением «фоновым процессом для карциномы мочевого пузыря». При лейкоплакии риск развития рака возрастает при условии развития акантоза и дисплазии уротелия. Цистоскопическая картина сформировавшихся очагов лейкоплакии характеризуется наличием серовато-белых или желтого цвета бляшек, возвышающихся над уровнем слизистой оболочки. Применяемые методы оперативного лечения хронического цистита с лейкоплакией мочевого пузыря – трансуретральная резекция, электрокоагуляция, вапоризация.
Практически неотличимые от рака мочевого пузыря по цистоскопической картине изменения могут быть обусловлены так называемой нефрогенной метаплазией уротелия. Речь идет о процессе, морфологическим отражением которого является формирование в стенке мочевого пузыря очагов, напоминающих при микроскопическом исследовании дистальные извитые канальцы почки. Развитие нефрогенной метаплазии принято связывать с травмой мочевыводящих путей, хирургическими вмешательствами на органах таза, проведением внутрипузырной химиотерапии и иммунотерапии (тиофосфамид, вакцина BCG). Клинически нефрогенная метаплазия может протекать бессимптомно или проявляться гематурией и дизурией. Единственным методом исследования, позволяющим достоверно диагностировать нефрогенную метаплазию и отличить ее от опухоли, является биопсия пораженного участка стенки мочевого пузыря. При бессимптомном течении рекомендует ограничиться наблюдением с ежегодным цистоскопическим контролем и цитологическим исследованием мочи, при наличии клинических проявлений выполняют трансуретральную резекцию.
Несмотря на то, что изучению хронического цистита посвящено множество исследований, эпидемиология заболевания свидетельствует об актуальности проблемы. Существует настоятельная необходимость углубленного изучения симптомов, клинических проявлений воспалительных заболеваний мочевого пузыря для усовершенствования диагностики больных хроническим циститом. Выявление корреляции клинических и морфологических проявлений воспалительных заболеваний мочевого пузыря позволит оценить гистоморфологические изменения стенки мочевого пузыря в зависимости от вида воспалительного процесса. Необходимо определить прогностическую значимость биопсии мочевого пузыря у больных неспецифическим циститом и хронической тазовой болью. Понимание патогенеза и клинических проявлений воспалительных заболеваний мочевого пузыря невозможно без детального изучения морфологических изменений.
Гиперактивный мочевой пузырь: как справиться с деликатной проблемой
Гиперактивный мочевой пузырь (гиперрефлекторный, ГАМП или ГМП) – форма нейрогенного мочевого пузыря (НМП), при котором у человека появляются проблемы с произвольным сознательным контролем мочеиспускания. Эта форма НМП встречается чаще, чем гипорефлекторная. Основной симптом – частое мочеиспускание, которое может сопровождаться увеличением объема мочи. ГАМП – серьезная проблема, поскольку по распространенности сравним с гипертонией, хроническим бронхитом, астмой и заболеваниями сердца.
Из-за чего может развиться гиперактивный мочевой пузырь
Гиперактивный мочевой пузырь у женщин встречается чаще, чем у мужчин – 60% против 40%. Основной причиной выступают нарушения в работе нервной системы, вызванные:
Еще ГАМП развивается на фоне сахарного диабета, отравления организма алкоголем или химическими веществами. Также расстройство может быть врожденным из-за аномалий в строении мочевыделительного канала.
У мужчин ГАМП может вызывать аденома простаты, из-за которой сужается мочеиспускательный канал. У женщин синдром гиперактивного мочевого пузыря имеет факторы риска, которые увеличивают вероятность столкнуться с таким заболеваниям. В список таких факторов включают:
Еще с ГАМП можно столкнуться в период климакса, когда организму недостает гормонов эстрогенов. Чувствительность детрузора (его сокращение приводит к мочеиспусканию) может повышаться при заместительной гормонотерапии при раке молочной железы. Не меньшее значение в развитии ГАМП имеют стрессовые ситуации и вредные условия труда.
Признаки гиперактивного мочевого пузыря
Нейрогенный гиперактивный мочевой пузырь проявляется в частом мочеиспускании (поллакиурии), причем малыми порциями при незаполненном пузыре. На его фоне может наблюдаться полиурия – увеличенное количество мочи, свыше 1800-2000 мл при норме 1000-1500 мл. В ряде случаев за сутки может выделяться более 3 л мочи. Причем желание помочиться может вызывать звук льющейся воды.
Еще при ГМП возможно недержание мочи, иногда возникающее даже от любого напряжения брюшных мышц. Чаще всего это ургентное недержание, при котором резко появляется желание помочиться, после чего происходит непроизвольное выделение мочи. Другой характерный признак – ноктурия. Это необходимость просыпаться ночью для мочеиспускания более 1-2 раз. Ноктурия, поллакиурия и полиурия могут возникать как одновременно, так и изолировано.
Нередко ГМП сопровождается симптомами, которые указывают на расстройство вегетативной нервной системы. К таким признакам относятся повышение артериального давления и гипергидроз (усиленное потоотделение). Еще ГАМП влияет на социализацию. Человек постоянно боится не успеть в туалет, переживает из-за неприятного запаха. Из-за произвольного выделения мочи может развиваться экзема или мочевой дерматит.
Как лечат ГАМП
Лечение гиперактивного мочевого пузыря у мужчин и женщин производится по одним и тем же принципам. Но терапия не имеет единой схемы. Она носит, в основном, паллиативный характер, т. е. проводится для улучшения качества жизни пациента. Можно сказать одно – лечение гиперактивного мочевого пузыря всегда сложное и комплексное. К основным методам относятся:
В самых сложных случаях, когда не помогают режим и лекарства, прибегают к малоинвазивным операциям. Но решение об их проведении принимает врач. При ГАМП необходимо обратиться к урологу. В Государственном центре урологии вы можете получить квалифицированную медицинскую помощь в рамках ОМС. Для этого вам необходимо записаться на прием к урологу, воспользовавшись формой на сайте или нашим контактным номером.
Современные возможности диагностики и лечения больных раком мочевого пузыря
На рак мочевого пузыря, по данным ВОЗ 2001 г., приходится около 3% всех злокачественных новообразований. По степени распространенности он уступает только опухолям желудка, пищевода, легких и гортани. По количеству клинических
На рак мочевого пузыря, по данным ВОЗ 2001 г., приходится около 3% всех злокачественных новообразований. По степени распространенности он уступает только опухолям желудка, пищевода, легких и гортани. По количеству клинических проблем, разнообразию и сложности хирургических операций раку мочевого пузыря отводится одно из первых мест в онкоурологии.
Среди всех онкоурологических заболеваний новообразования мочевого пузыря занимают второе место по заболеваемости после рака предстательной железы. Ежегодно в мире регистрируется более 150 тыс. новых случаев рака мочевого пузыря. Рак мочевого пузыря занимает пятое место у мужчин и 11-е у женщин по распространенности в Европе из всех форм этого заболевания (А. С. Переверзев, С. Б. Петров, 2001). Из морфологических форм наиболее часто встречается переходно-клеточный рак, на него приходится до 90%. Менее 10% составляют аденокарцинома, плоскоклеточный рак и сквамозно-клеточная карцинома.
Около 80% всего первичного рака мочевого пузыря (РМП) представлено поверхностными опухолями. Лечение данного вида заболевания включает трансуретральную резекцию (ТУР), иммуно- и химиотерапию. Но риск рецидива у этих пациентов составляет до 70%. Почти в 30% случаев рецидивов отмечается повышение стадии заболевания и/или степени злокачественности, т. е. поверхностный РМП прогрессирует в инвазивную форму. У 50% таких больных через два года после подобного локального лечения выявляются метастазы.
Несмотря на успехи в диагностике и лечении, все последние годы отмечается рост заболеваемости раком мочевого пузыря. Все вышесказанное объясняет внимание клиницистов к этому опасному заболеванию.
В самом начале заболевания клинические проявления рака мочевого пузыря скудные и во многом зависят от стадии болезни, наличия осложнений, сопутствующих заболеваний, особенно хронического пиелонефрита и хронической почечной недостатости. Основными симптомами эпителиальных опухолей мочевого пузыря следует считать гематурию и дизурию.
Гематурия является самым частым и наиболее ранним признаком опухоли мочевого пузыря. Как первый признак болезни макрогематурия отмечается примерно у 70% больных раком мочевого пузыря. Гематурия при опухоли мочевого пузыря может быть терминальной и тотальной. Длительность и частота кровотечений при опухолях мочевого пузыря колеблются в широких пределах. Иногда гематурия бывает кратковременной, повторяется с многомесячными и даже многолетними интервалами. В ряде случаев она длится несколько дней (и даже недель) подряд и повторяется часто. При запущенных распадающихся опухолях мочевого пузыря гематурия обычно имеет постоянный характер.
Вторым по распространенности симптомом является дизурия, которая наблюдается в 15—37% случаях. Она обусловлена раздражением слизистой мочевого пузыря и характеризуется жжением при мочеиспускании, частыми позывами на мочеиспускание, поллакиурией. В основном дизурия характерна для опухолей, локализующихся в области шейки и опухолей с инфильтративным ростом. Мочеиспускание становится не только учащенным, но и затрудненным и болезненным. При прогрессировании опухолевого процесса у больных появляются боли в надлобковой области, которые носят постоянный характер. Боли усиливаются в конце мочеиспускания. Интенсивность боли зависит от локализации и характера роста опухоли. При шеечной локализации боль появляется рано. Экзофитные новообразования могут достигать больших размеров, не вызывая болей. Эндофитный рост опухолей сопровождается постоянной тупой болью над лоном и в полости малого таза. В случае прорастания опухоли стенки мочевого пузыря с переходом на паравезикальную клетчатку и соседние органы могут возникать симптомы тазовой компрессии, проявляющиеся отеком нижних конечностей, мошонки, флебитом, болевым синдромом в промежности, ягодицах, крестце, поясничной области, половых органах.
При прогрессировании заболевания происходит сдавление устьев мочеточников, что и определяет клинические проявления.
Диагностика рака мочевого пузыря включает также определение функции почек и состояния уродинамики верхних и нижних мочевых путей. Такая задача не менее важна, чем определение стадии опухоли, ее локализации и распространенности. Традиционные методы, применяемые для этих целей (экскреторная урография, цистография), находят сейчас ограниченное применение. Их используют в настоящее время по показаниям.
Следует упомянуть о таком простом методе, как бимануальная пальпация мочевого пузыря, которая не утратила своей значимости и в наши дни, несмотря на то что многие урологи пренебрегают ею. При первом же осмотре этот метод позволяет определить величину опухоли и ее «взаимоотношения» с окружающими тканями и, значит, уже на начальном этапе правильно выбрать тактику дальнейшего обследования и лечения.
Еще недавно цистоскопия была первой диагностической процедурой, которая выполнялась при подозрении на РМП. В настоящее время она проводится на завершающем этапе диагностики, когда больному назначается лечение. Как отдельная процедура цистоскопия выполняется только при моноторинге больных РМП. В основном цистоскопию совмещают с лечебно-диагностической трансуретральной резекцией мочевого пузыря.
Ультразвуковая диагностика — высокоинформативный безболезненный и абсолютно безвредный метод, позволяющий оценить состояние внутренних органов. При плановом обследовании больных РМП ведущим методом диагностики сейчас считается ультрасонография мочевого пузыря. Ультразвуковое исследование (УЗИ) позволяет в какой-то мере оценивать опухоль по стадиям, выявлять изменения в забрюшинной и тазовой клетчатке и пораженные метастазами лимфоузлы. При этом используют трансабдоминальное и трансректальное исследования. Но проведение УЗИ только с каким-то одним из датчиков нецелесообразно. Ошибки в оценке местного распространения РМП возможны и при всех видах ультрасонографии (УС). Они могут быть вызваны рубцовыми изменениями стенок мочевого пузыря вокруг опухоли, их трабекулярностью, наличием цистита и многими другими причинами. УЗИ также не позволяет с высокой степенью точности выявлять опухоли небольшого размера (менее 10 мм) и опухоли в трабекулярном мочевом пузыре. По оценкам разных авторов, частота ошибок при таких исследованиях составляет от 17 до 30%.
С внедрением в практику внутриполостных датчиков значительно повысились диагностические возможности выявления ранних стадий рака мочевого пузыря. Трансуретральная ультрасонография (цистоэндосонография) достаточно достоверно позволяет диагностировать поражение мышечного слоя. В отличие от трансабдоминальной и трансректальной УС, цистоэндосонография делает возможным детальное изучение местного распространения процесса даже при очень небольших размерах ( 0,5 Т) МРТ-систем компактностью и экономичностью при удовлетворительном качестве изображений и значительно меньшей стоимости.
В настоящее время разработаны методы ранней диагностики РМП, основанные на тумор-ассоциированных антигенах. Кроме этого, создано большое количество моноклональных антител, специфичных для переходно-клеточного РМП. Данные антитела взаимодействуют с антигенными структурами, присутствующими только на клетках переходно-клеточного РМП и отсутствующими на клетках нормального уротелия. К ним относятся тест ВТА-Stat, ВТА-Stat и NMP22. Многие из перечисленных маркеров еще изучаются и не нашли своего практического применения.
Отдельно хочется остановиться на тесте ВТА-Stat, который представляет собой иммуннохроматографический метод, позволяющий производить с использованием моноклональных антител быстрый специфический анализ антигена опухоли мочевого пузыря в моче. Большим достоинством метода является простота и доступность выполнения в амбулаторных условиях. Техника исследования проста: моча обследуемого пациента вносится в тест-лунку, спустя 5 мин оценивается результат. Положительной проба может считаться в том случае, если в окошечке появится красно-коричневая полоска.
Для проведения флюоресцентной цистоскопии необходимы некоторый минимальный набор оборудования, основной частью которого является источник света, обладающий, прежде всего, в синей области спектра очень высокой мощностью для возбуждения флюоресценции, и специальный эндоскоп. Особое преимущество заключается в том, что все приборы, разработанные для флюоресцентной цистоскопии, без ограничения могут использоваться и для цистоскопии в белом свете. Кроме того, их можно как угодно комбинировать с подходящими стандартными инструментами. Побочные явления в результате внутрипузырной инстилляции 5-аминолевулиновой кислоты минимальны. До настоящего времени не было сообщений о проявлении кожной сенсибилизации. Также не наблюдалось и фототоксических реакций кожи, как это случается при системно применяемых синтетических порфиринах. При этом только около 7% больных жалуются на учащенное мочеиспускание.
Лечение больных раком мочевого пузыря
Касаясь вопросов лечения больных РМП, следует отметить, что в настоящее время хирургические методы являются ведущими в лечении. В большинстве случаев они дополняются иммунохимиотерапией или, реже, лучевой терапией. Все виды хирургических вмешательств у больных раком мочевого пузыря разделяют на четыре группы: 1) трансуретральная резекция (ТУР) мочевого пузыря, которая может сочетаться с лазерным воздействием; 2) открытая резекция мочевого пузыря, в том числе резекция «в ложках», плазменное или лазерное выпаривание опухоли; 3) цистэктомия с различными вариантами деривации мочи; 4) паллиативные операции.
В большинстве стран мира в последние годы у больных раком мочевого пузыря выполняют только два вида оперативных вмешательств: ТУР и цистэктомию. При поверхностном раке мочевого пузыря трансуретральная резекция мочевого пузыря является «золотым стандартом», так как обеспечивает подтверждение диагноза, адекватность резекции и возможность минимального по объему вмешательства.
При инвазивном РМП ТУР рассматривается как диагностическая процедура, позволяющая выявить степень инвазии. С паллиативной целью ТУР выполняется у больных, которые отказываются от цистэктомии или из-за фона сопутствующих заболеваний не в состоянии перенести. Цель резекции — удаление всей опухоли с участком нормальной мышечной ткани с целью определения степени инвазии. ТУР может выполняться также под фотодинамическим контролем.
На современном этапе хирургическое лечение поверхностного рака мочевого пузыря должно обязательно дополняться внутрипузырной иммунохимиотерапией для профилактики рецидивов и предупреждения прогрессирования опухоли. Для этой цели используется целый ряд препаратов для внутрипузырной химиотерапии.
Все вышеуказанные вещества обладают приблизительно одинаковой эффективностью. Возможно, единственное исключение составляет митомицин, который показывает более высокие результаты.
В последние годы иммунопрофилактика и иммунотерапия рака мочевого пузыря получили широкое распространение. Из числа известных иммуномодуляторов чаще всего используют вакцину БЦЖ. Механизм противоопухолевого действия вакцины БЦЖ до конца не изучен, однако многочисленные исследования показали, что в его основе лежит стимуляция клеточных механизмов иммунитета, в которой задействованы Т-лимфоциты, макрофаги и целый ряд цитокинов. БЦЖ вводится внутрипузырно и по эффективности превосходит все другие препараты. Существуют различные схемы применения вакцины БЦЖ, но указаний на то, что какая-либо из них предпочтительней другой, нет. Мы применяем схему 120 мг в 50 мл физраствора в течение шести недель еженедельно через три-четыре недели после ТУР. БЦЖ терапия назначается: 1) для профилактики рецидивов у пациентов без опухолей; 2) при лечении больных с рецидивными опухолями; 3) при лечении пациентов с карциномой in situ. Помимо БЦЖ заслуживают упоминания еще два препарата, оказывающих иммуномодулирующее действие: интерлейкин-2 и ИФ. Они обладают доказанной иммуномодулирующей и противоопухолевой активностью, но по эффективности уступают БЦЖ.
Радикальная цистэктомия является методом выбора в лечении инвазивного рака мочевого пузыря при благоприятном прогнозе, касающемся продолжительности жизни пациента. Большинство урологов выполняют это вмешательство на стадиях Т2b и Т3, а также при мультифокальном и\или быстрорецидивирующем поражении в стадии Т1 с гистологическими признаками низкодифференцированного роста, раке in situ, резистентном к БЦЖ терапии. В зависимости от степени прорастания околопузырной клетчатки, предстательной железы у мужчин и внутренних половых органов у женщин, а также вовлечения в процесс регионарных лимфатических узлов, выполняют удаление одного только мочевого пузыря или расширенную цистэктомию, включающую, наряду с удалением пузыря, удаление предстательной железы с семенными пузырьками у мужчин и удаление уретры, передней стенки влагалища и матки у женщин. При расширенной цистэктомии во всех случаях подлежат удалению околопузырная клетчатка, тазовые лимфоузлы и прилегающая брюшина.
Предложено множество различных методик деривации мочи после цистэктомии, которые можно разделить на шесть основных групп. Выбор способа лечения связан, прежде всего, с возрастом пациента, соматическим статусом, тяжестью основного заболевания и наличием осложнений: 1) создание артифициального мочевого пузыря; 2) пересадка мочеточников в непрерывную кишку; 3) пересадка мочеточников в изолированный сегмент кишки; 4) непосредственное дренирование почек (нефро- или пиелостомия); 5) пересадка мочеточников на кожу; 6) трансуретероанастомоз с односторонней нефростомией.
Послеоперационная летальность при раке мочевого пузыря за последние 25 лет снизилась с 46% до 3-4%. Но в большинстве медицинских центров она по-прежнему достаточно высока. Основными причинами летальных исходов являются перитонит, почечная недостаточность, восходящий пиелонефрит и уросепсис.
Учитывая большой объем операции, неудовлетворительное качество жизни с мочеприемниками, многие больные отказываются от цистэктомии.
В этом случае, как и при отдаленных метастазах, единственный метод помощи — химиотерапия. РМП чувствителен к цисплатину, доксорубицину, винбластину, ифосфамиду, фторурацилу, циклофосфамиду, карбоплатину, митоксантрону, метотрексату. Из препаратов, появившихся в 90-х гг., привлекают внимание паклитаксел, доцетаксел и гемзар; комбинация из препаратов выбора — М-VАС (метотрексат, винбластин, доксорубицин и цисплатин). Эффект достигается у 40—60% пациентов, в том числе и симптоматический, средняя выживаемость — 13 месяцев. Хорошие результаты показывает гемцитабин — это одно из наиболее эффективных средств для монотерапии. Кроме того, он хорошо переносится пациентами.
Лучевая терапия
В мировой практике сложилось неоднозначное отношение к лучевой терапии при раке мочевого пузыря. В США первичная лучевая терапия рака мочевого пузыря практически не применяется. В Великобритании и Европе это основной метод лечения распространенного рака мочевого пузыря, а цистэктомия выполняется лишь при снижении радиочувствительности. В нашей стране лучевая терапия при раке мочевого пузыря применяется как самостоятельно, так и в сочетании с хирургическим и/или химиотерапевтическим лечением. Облучение может осуществляться как на аппаратах для дистанционной, так и контактной лучевой терапии. Причем оптимальная методика лучевой терапии выбирается в зависимости от локализации опухолевого процесса в мочевом пузыре и степени его внепузырного распространения. Так, при прорастании опухолью мышечной стенки или наличии метастатического поражения зон регионарного лимфооттока, необходимо проведение послеоперационной лучевой терапии. При раке мочевого пузыря можно применять и брахитерапию (внутриполостная и внутритканевая лучевая терапия). Однако из-за сложности проведения и дороговизны она проводится, в основном, в экономически развитых странах, где есть крупные специализированные центры. При внутриполостном облучении разовая очаговая доза составляет, как правило, 3—5 Гр, а суммарная очаговая доза доводится до 45—50 Гр. При сочетанном облучении доза при внутриполостной лучевой терапии составляет, в среднем, 30—35 Гр.
До настоящего времени весьма остро стоит проблема лечения местнораспространенного рака мочевого пузыря, при котором радикальным методом можно считать цистэктомию. Вместе с тем, комбинированное лечение с использованием на первом этапе лучевой терапии в полной дозе, а затем, при частичной регрессии, выполнение органосохраняющих операций позволяет решить задачу радикального лечения с сохранением «собственного» мочевого пузыря.
На основании личного клинического опыта мы можем утверждать, что при лечении опухолей мочевого пузыря есть возможность ограничиться одной лишь ТУР только при наличии поверхностного (неинвазивного) дифференцированного рака. Во всех остальных случаях за ней должна следовать цистэктомия или лучевая терапия по радикальной программе.
Несомненно, наилучшие результаты при лечении рака мочевого пузыря, как и большинства других злокачественных новообразований, получены при использовании комбинированного метода. Так, Б. П. Матвеев (1999) указывает на то, что, в среднем, рецидив опухоли после ТУР мочевого пузыря в течение трех лет встречается у 45—55% больных. В то же время даже после радикальных операций рецидивы возникают в 30—60% случаев, тогда как после комбинированного лечения — всего в 28%. В связи с этим не стоит забывать о вопросах, связанных с качеством жизни больных после проведенного лечения. На наш взгляд, приоритетными направлениями в лечении рака мочевого пузыря станут органосохраняющие или максимально щадящие мочевой пузырь методики, основанные на сочетании неоадъювантной и адъювантной химиолучевой терапии, и разработка адекватного способа деривации мочи с созданием ортотопического мочевого пузыря.
А. Д. Каприн, кандидат медицинских наук
А. А. Костин
Российский научный центр рентгенорадиологии МЗ РФ, Москва