гипертрофия и гиперплазия что это такое
Гиперплазия
Оглавление
Под гиперплазией понимают изменение строения тканей, сопровождающееся увеличением в них количества составляющих их клеток. При этом в клеточных элементах растет количество внутренних структур. Такое разрастание тканей связано с тенденцией к ускоренному клеточному делению под действием физиологических (естественных) или патологических причин. Оно может привести к увеличению органа или его части в размере, что напоминает доброкачественную опухоль.
Гиперплазия может быть предраковым состоянием. При дальнейшем увеличении количества клеток в них появляются мутации, характерные для опухолевого роста, меняется форма. Поэтому необходимо своевременное распознавание этого процесса и лечение соответствующих заболеваний.
Классификация гиперплазии
Гиперплазии в первую очередь подвергаются клетки, которые и в норме достаточно быстро делятся. Чаще всего они выстилают слизистые оболочки (эндотелий), образуют железы (железистая гиперплазия) или входят в состав иммунной системы (лимфоидная гиперплазия).
В зависимости от распространенности патологического процесса различается очаговая гиперплазия, диффузная, а также подобные клетки могут образовывать ограниченные образования – узлы и полипы.
Примером физиологического процесса служит гиперплазия молочных желез во время беременности и грудного вскармливания. При этом разрастаются клетки, секретирующие молоко. Этот процесс обратимый, впоследствии железистая ткань постепенно сменяется жировой.
При заболевании в начальной стадии под действием патологических стимулов возникает доброкачественная гиперплазия. Она проявляется лишь увеличением количества клеток в ткани без изменения их свойств. В дальнейшем в таких клетках происходят структурные изменения, и процесс приобретает черты предракового. Так возникает, например, атипическая гиперплазия эндометрия.
Причины и признаки гиперплазии
Основные причины гиперплазии:
Гиперплазия считается естественной реакцией организма на воздействие какого-либо стимула, например, гормона. При устранении провоцирующего фактора постепенно исчезают и симптомы гиперплазии. Этим она отличается от неопластических процессов, лежащих в основе рака и доброкачественных опухолей, которые не реагируют на прекращение действия вредного фактора. Однако патологическая гиперплазия может постепенно трансформироваться в неоплазию.
Симптомы и диагностика гиперплазии
Диагноз этого состояния основан на морфологической характеристике тканей, то есть на обнаружении увеличенного количества клеток при исследовании под микроскопом. Для этого используются разные виды биопсии – мазок, соскоб с поверхности эндотелия, пункция, щипковая, браш-биопсия и так далее. При обнаружении патологических изменений ставится предварительный диагноз заболевания и проводится его дальнейшая диагностика – анализы крови на гормоны, УЗИ органов и другие необходимые исследования.
Наиболее часто встречаются такие клинические формы:
Лечение гиперплазии
Эти морфологические изменения тканей могут привести:
Лечение гиперплазии зависит от того, в каком органе она сформировалась и насколько она выражена. Например, при поражении эндометрия необходима консультация гинеколога, а сама терапия включает назначение лекарственных препаратов, выскабливание при кровотечении или другие хирургические методы.
При гиперплазии щитовидной железы может быть достаточно восстановить поступление йода в организм. Если образовавшийся узел слишком крупный и сдавливает трахею, мешает дыханию и глотанию, его удаляют хирургическим путем.
Гиперплазия простаты лечится с помощью лекарственных средств, а при их неэффективности назначается операция – резекция железы.
Определить, как лечить гиперплазию в каждом индивидуальном случае, может только врач. Народные методы в этом случае будут малоэффективны, а отсутствие своевременной помощи может стать причиной злокачественного перерождения гиперплазированных тканей.
Преимущества клиники для всей семьи «Мама Папа Я»
Сеть семейных клиник «Мама Папа Я» приглашает на обследование и лечение при гиперпластических процессах любой локализации:
Для записи на прием приглашаем позвонить по телефону, указанному на сайте, или заполнить соответствующую заявку.
Рекомендовано к прочтению:
© Сеть семейных клиник
«Мама Папа Я», 2018
ЧИТАТЬ КНИГУ ОНЛАЙН: Общая патологическая анатомия: конспект лекций для вузов
НАСТРОЙКИ.
СОДЕРЖАНИЕ.
СОДЕРЖАНИЕ
С. В. Акчурин, Г. П. Демкин
Общая патологическая анатомия. Конспект лекций для вузов
Лекция 1. Патологическая анатомия
1. Задачи патологической анатомии
2. Объекты исследования и методы патологической анатомии
3. Краткая история развития патанатомии
5. Трупные изменения, их отличия от прижизненных патологических процессов и значение для диагностики болезни
1. Задачи паталогической анатомии
Патологическая анатомия – наука о возникновении и развитии морфологических изменений в больном организме. Она зародилась в эпоху, когда исследование болезненно измененных органов проводилось невооруженным глазом, т. е. тем же методом, каким пользуется анатомия, изучающая строение здорового организма.
Патологическая анатомия – одна из важнейших дисциплин в системе ветеринарного образования, в научной и практической деятельности врача. Она изучает структурные, т. е. материальные основы болезни. Она опирается на данные общей биологии, биохимии, анатомии, гистологии, физиологии и других наук, которые изучают общие закономерности жизни, обмен веществ, строение и функциональные отправления здорового организма человека и животных во взаимодействии его со внешней средой.
Без знания того, какие морфологические изменения в организме животного вызывает болезнь, невозможно правильное представление о ее сущности и механизме развития, диагностике и лечении.
Изучение структурных основ болезни проводится в тесной связи с клиническими ее проявлениями. Клинико-анатомическое направление – отличительная черта отечественной патанатомии.
Изучение структурных основ болезни проводится на разных уровнях:
· организменный уровень позволяет выявить болезнь целостного организма в ее проявлениях, во взаимосвязи всех его органов и систем. С этого уровня начинается изучение больного животного в клиниках, трупа – в секционном зале или скотомогильнике;
· системный уровень изучает какую-либо систему органов и тканей (пищеварительная система и т. д.);
· органный уровень позволяет определять изменения органов и тканей, видимых простым глазом или под микроскопом;
· тканевый и клеточный уровни – это уровни изучения измененных тканей, клеток и межклеточного вещества с помощью микроскопа;
· субклеточный уровень позволяет наблюдать с помощью электронного микроскопа изменения ультраструктуры клеток и межклеточного вещества, которые в большинстве случаев являлись первыми морфологическими проявлениями болезни;
· молекулярный уровень изучения болезни возможен при использовании комплексных методов исследований с привлечением электронной микроскопии, цитохимии, радиоавтографии, иммуногистохимии.
Распознавание морфологических изменений на органном и тканевом уровнях очень трудно в начале болезни, когда эти изменения бывают незначительными. Это связано с тем, что болезнь началась с изменения субклеточных структур.
Эти уровни исследования дают возможность рассматривать структурные и функциональные нарушения в их неразрывном диалектическом единстве.
2. Объекты исследования и методы патологической анатомии
Патологическая анатомия занимается изучением структурных нарушений, возникших на самых начальных стадиях болезни, в ходе ее развития, вплоть до конечных и необратимых состояний или выздоровления. Это морфогенез болезни.
Патологическая анатомия изучает отклонения от обычного течения болезни, осложнения и исходы болезни, обязательно раскрывает причины, этиологию, патогенез.
Изучение этиологии, патогенеза, клиники, морфологии болезни позволяет применить научно- обоснованные меры лечения и профилактики болезни.
Результаты наблюдений в клинике, исследований патофизиологии и патологической анатомии показали, что здоровый организм животного обладает способностью сохранять постоянство состава внутренней среды, устойчивое равновесие в ответ на внешние факторы – гомеостаз.
При болезни гомеостаз нарушается, жизнедеятельность протекает иначе, чем в здоровом организме, что и проявляется характерными для каждой болезни структурными и функциональными нарушениями. Болезнь – это жизнь организма в изменившихся условиях как внешней, так и внутренней среды.
Патологическая анатомия изучает также изменения в организме. Под влиянием лекарств они могут быть положительными и отрицательными, вызывая побочные явления. Это патология терапии.
Итак, патологическая анатомия охватывает большой круг вопросов. Она ставит перед собой задачу дать четкое представление о материальной сущности болезни.
Патологическая анатомия стремится использовать новые, более тонкие структурные уровни и наиболее полную функциональную оценку измененной структуры на равных уровнях ее организации.
Патологическая анатомия получает материал о структурных нарушениях при болезнях с помощью вскрытия трупов, хирургических операций, биопсии и экспериментов. Кроме того, в ветеринарной практике с диагностической или научной целью проводят вынужденный убой животных в разные сроки заболевания, что дает возможность изучить развитие патологических процессов и болезни на различных стадиях. Большая возможность патологоанатомического обследования многочисленных туш и органов представляется на мясокомбинатах при забое животных.
В клинической и патоморфологической практике определенное значение имеют биопсии, т. е. прижизненное взятие кусочков тканей и органов, проводимое с научной и диагностической целью.
Особенно важным для выяснения патогенеза и морфогенеза болезней является воспроизведение их в эксперименте. Экспериментальный метод дает возможность создавать модели болезни для точного и детального их изучения, а также для испытания эффективности лечебных и профилактических препаратов.
Возможности патологической анатомии значительно расширились с применением многочисленных гистологических, гистохимических, авторадиографических, люминисцентных методов и т. д.
Исходя из задач, патологическая анатомия ставится в особое положение: с одной стороны, это теория ветеринарии, которая, раскрывая материальный субстрат болезни, служит клинической практике; с другой – это клиническая морфология для установления диагноза, служащая теории ветеринарии.
3. Краткая история развития патанатомии
Развитие патологической анатомии как науки неразрывно связано со вскрытием трупов человека и животных. Согласно литературным источникам во II столетии н. э. римский врач Гален вскрывал трупы животных, изучая на них анатомию, физиологию, и описал некоторые патолого-анатомические изменения. В Средние века из-за религиозных воззрений вскрытия трупов людей были запрещены, что несколько приостановило развитие патологической анатомии как науки.
В XVI в. в ряде стран Западной Европы врачам вновь было предоставлено право осуществлять вскрытия трупов людей. Данное обстоятельство способствовало дальнейшему совершенствованию знаний в области анатомии и накоплению патолого-анатомических материалов при различных болезнях.
В середине XVIII в. вышла в свет книга итальянского врача Морганьи «О локализации и причинах болезней, выявленных анатомом», где были систематизированы разрозненные патолого-анатомические данные своих предшественников и обобщен собственный опыт. В книге дано описание изменений в органах при различных заболеваниях, что облегчало их диагностику и способствовало пропаганде роли патолого-анатомического исследования в установлении диагноза.
В первой половине XIX в. в патологии господствовало гуморальное направление, сторонники которого видели сущность болезни в изменении крови и соков организма. Считалось, что сначала происходит качественное нарушение крови и соков с последующим отклонением «болезнетворной материи» в органах.
Гипертрофия и гиперплазия
Гипертрофия и гиперплазия мышечных волокон — темы данного обзора. Рассмотрены вопросы гипертрофии и гиперплазии мышечных волокон в ответ на силовые тренировки. Доказана гиперплазия мышечных волокон в ответ на силовые тренировки у животных (птиц). Гиперплазия мышечных волокон у человека в ответ на силовые тренировки не доказана.
Duncan MacDougall Hypertrophy and Hyperplasia / In: Strength and Power in sport. Chapter 13.- P. 252-264.
Дункан МакДоугал
ГИПЕРТРОФИЯ И ГИПЕРПЛАЗИЯ
ВВЕДЕНИЕ
Скелетные мышцы – чрезвычайно динамичные ткани с выдающейся способностью к адаптации, как структурной, так и физиологической, а также к различным формам функциональной перегрузки. Функциональная перегрузка возникает, когда мышце требуется сокращаться более сильно (как в силовой тренировке), или более часто (как в тренировке на выносливость), чем обычно. Эти две формы тренировки вызывают противоположные адаптивные реакции в мышцах. Тренировка на выносливость, как правило, приводит к повышению плотности митохондрий и капилляров и небольшим (или без) изменением размера мышц, в то время как силовые тренировки обычно приводит к увеличению размера мышц (гипертрофии) и их силы. Основное внимание в этой главе будет уделяться факторам, которые способствуют гипертрофии мышц, в ответ на силовые тренировки.
Если Вас интересует гипертрофия и гиперплазия мышц, рекомендую обратить внимание на мою книгу «Гипертрофия скелетных мышц человека«
В теории, увеличение размера мышц может возникнуть в результате увеличения размеров мышечных волокон, их количества (гиперплазия), и / или размеров соединительной ткани в мышцах. Установлено, что силовая тренировка приводит к увеличению площади поперечного сечения мышечных волокон у людей (MacDougall et al. 1979, 1980; McDonagh & Davies 1984; Tesch 1987) и других млекопитающих (Gonyea & Ericson 1976; Timson et al. 1985). Также хорошо известно, что основной вклад в увеличение объема мышц от зачатия до раннего детства является увеличение количества волокон (Goldspink 1974; Mastaglia 1981; Malina 1986). Однако вклад гиперплазии мышечных волокон в гипертрофический ответ скелетных мышц у взрослых остается до настоящего времени спорным. Соединительные ткани вносят незначительный вклад в изменение размеров мышц.
Существуют разные модели тренировки, вызывающие рост мышц. Они включают в себя модели с участием животных (удаление мышц-синергистов (Goldberg et al. 1975; Gollnick et al. 1981) или хроническую подвеску нагрузку на одну из конечностей (Ashmore & Summers 1981)). Однако в этом случае, стимулы для гипертрофии, вероятно, отличаются стимулов, возникающих при силовой тренировке тяжелоатлетов или бодибилдеров (Timson 1990). Альтернативные модели, в которых интактные животные выполняют краткое произвольное (Goldspink & Howells 1974; Gonyea & Ericson 1976) или непроизвольное (Wong & Booth 1988; Tamaki et al. 1992) сокращение ограничены определенных мышцами и имеют очевидные ограничения. В результате, непосредственное применение результатов в таких исследованиях для человека часто бывает трудно. В связи с этим речь в этой главе пойдет о гипертрофии скелетных мышц у взрослых спортсменов (тяжелоатлетах и бодибилдерах).
ГИПЕРТРОФИЯ МЫШЕЧНЫХ ВОЛОКОН В ОТВЕТ НА СИЛОВЫЕ ТРЕНИРОВКИ
Эффектом силовой тренировки является повышение синтеза миофибриллярных белков в мышце (Chesley et al. 1992). Ответ на силовую тренировку достигает максимума через 24 часа, но сохраняется еще 36-48 часов (MacDougall et al. 1995; Phillips et al. 1997). Это увеличение синтеза белка сопровождается непропорционально маленьким увеличением скорости его деградации (Biolo et al. 1995; Phillips et al. 1997), так что баланс смещается в сторону белкового синтеза. Увеличение скорости синтеза белка связано с более эффективной трансляцией иРНК, поскольку она происходит в отсутствие каких-либо изменений в общей РНК или сократительных белков иРНК (Chesley et al. 1992; Welle et al. 1999). При использовании повторного метода силовой тренировки, увеличение синтеза белка проявляется в увеличении, как площади поперечного сечения миофибрилл, так и их количества, без изменения плотности упаковки миофибрилл (рис. 13.1).
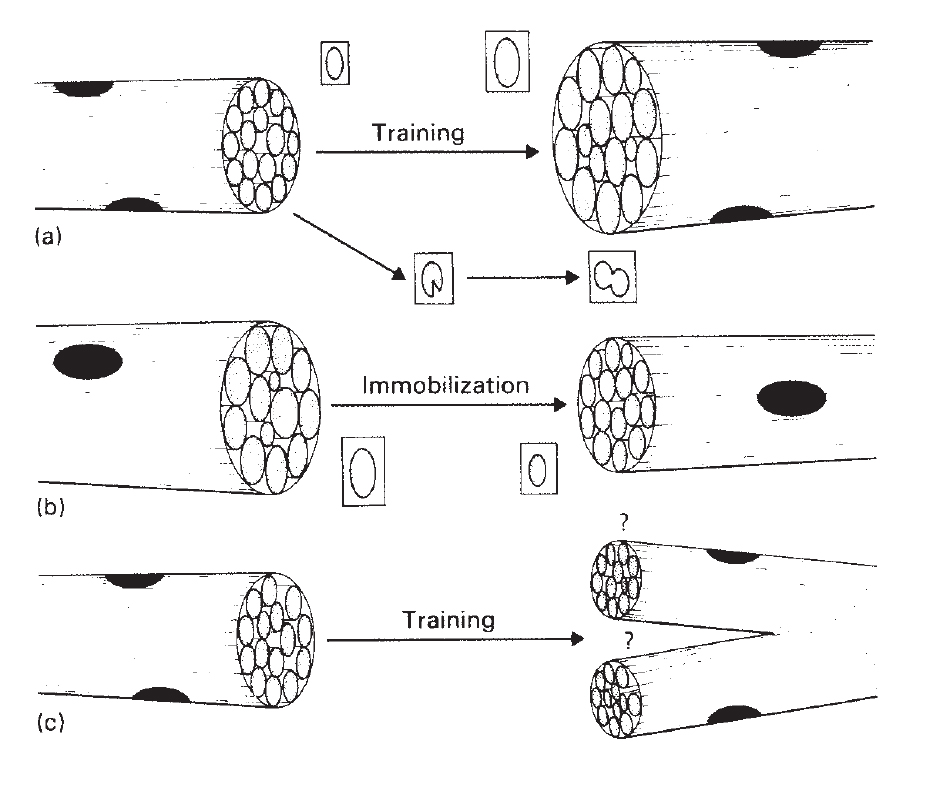
Рис.13.1. Иллюстрация структурных приспособлений, которые вызывают изменения в области мышечного волокна, в ответ на силовые тренировки или иммобилизацию. (а) Во время тренировки поперечное сечение мышц увеличивается (гипертрофия) прямо пропорционально увеличению поперечного сечения миофибрилл и их количества. (b) При иммобилизации, площадь волокон уменьшается (атрофия), в пропорции к уменьшению размера миофибрилл. (c) Вызванное тренировкой расщепление волокон было постулировано, чтобы вызвать гиперплазию у некоторых видов животных, но не имеет места в организме человека (J.D. MacDougall, 1986b).
Актиновые и миозиновые филаменты добавляются на периферии каждой миофибриллы, создавая тем самым более крупные миофибриллы без изменения плотности упаковки филаментов, или пространства между поперечными мостиками (MacDougall 1986b). Несмотря на то, что увеличение площади мышечного волокна пропорционально увеличению площади миофибрилл, очевидно, что должно произойти увеличение количества миофибрилл. Увеличение числа миофибрилл является следствием их продольного «расщепления». Как было показано, это происходит при нормальном постнатальном росте молодых животных (Goldspink 1970, 1974). Это расщепление может быть механическим на уровне А- и I дисков. Когда миофибрилла достигает критического размера и способна генерировать большую силу, мощные силовые напряжения мышцы, как полагают, могут привести к разрыву соединительной ткани в Z-дисках, который передается вдоль миофибриллы и приводит к появлению двух или более «дочерних» миофибрилл такой же длины (Goldspink 1992) (рис. 13.1).
Изменения площади поперечного сечения мышечного волокна
Площадь поперечного сечения мышечных волокон возрастает пропорционально площади поперечного сечения миофибрилл и их количества. Величина этого увеличения значительно варьирует и зависит от ряда факторов, в том числе реагирования человека на тренировку (MacDougall 1986a), интенсивности и продолжительности программы тренировки, уровня подготовки индивидуума до начала тренировки. Результаты исследований, которые были проведены в нашей лаборатории, свидетельствуют о том, что в одних исследованиях после 6 месяцев тренировки у активных молодых мужчин и женщин не было обнаружено достоверных изменений площади поперечного сечения ни одного из типов мышечных волокон в латеральной широкой мышце (Sale et al. 1990). Другие исследования свидетельствовали об увеличении на 33% площади поперечного сечения МВ II типа и 27% I типа в группе нетренированных юношей, которые тренировали трехглавую мышцу плеча в течение 6 месяцев (MacDougall et al. 1979). В исследовании, где 14 пожилых мужчин (60-70 лет), выполняли силовые тренировки в течение 3 месяцев, было обнаружено увеличение на 30% площади поперечного сечения МВ II типа и на 14% в МВ I типа в двуглавой мышце плеча (Brown et al. 1988). В группе элитных бодибилдеров площадь поперечного сечения МВ II типа была примерно на 58% а в МВ I типа на 39% больше, чем у нетренированных мужчин того же возраста (MacDougall et al. 1984).
Изменения площади поперечного сечения мышечных волокон в зависимости от их типов
Силовая тренировка приводит к увеличению площади поперечного сечения всех типов волокон, однако, большинство исследований показывают, что большая гипертрофия наблюдается в мышечных волокнах II типа (Thorstensson 1976; MacDougall et al. 1979; Tesch et al. 1985; Staron et al. 1990). Поскольку все типы мышечных волокон, как считается, активируются при субмаксимальных и максимальных усилиях, большая гипертрофия МВ II типа может отражать большее относительное участие этих высокопороговых ДЕ, по сравнению с обычной жизнью.
Изменение типа мышечного волокна под воздействием тренировки
Если классифицировать мышечные волокна по на основе АТФ-азы миозина (Staron et al. 1990, 1994), или на основе содержания тяжелых цепей миозина (Adams et al. 1993; Carroll et al. 1998; Andersen & Aagaard 2000), очевидно, что силовая тренировка приводит к увеличению в процентном отношении МВ IIA типа и пропорциональному снижению процента МВ IIB типа (или IIX). У человека, однако, такие преобразования в типах мышечных волокон, кажется, ограничиваются преобразованием подтипов МВ II типа и маловероятно, что обычная силовая тренировка влияет на процентное содержание МВ I типа. Этот вывод основывается на исследовании молодых мужчин, выполняющих полугодовую силовую тренировку. Установлено, что процент МВ I типа не изменился (MacDougall et al., 1980), установлено также, что процент МВ I типа в двуглавой и трехглавой мышцах плеча у элитных бодибилдеров был таким же, как и у нетренированных людей, несмотря на 6-8 лет тренировки (MacDougall et al., 1982, 1984) (рис.13.2). Более подробно проблема изменения типов МВ под воздействием тренировки представлена в главе 14 (Tesch & Alkner). Функциональное значение уменьшения процента МВ IIB типа (Baldwin & Haddad, 2001) не очевидны, так как нет никакого «замедления» в свойствах контрактильных волокон после силовой тренировки (Alwey et al., 1989a). Одно из объяснений заключается в том, что это служит для уравновешивания эффекта. Представляется также, что, когда испытуемые прекращают тренироваться, преобразование МВ II типа идет в обратную сторону и пропорция МВ IIB типа достигает прежнего уровня (Andersen & Aagaard 2000).
Другие изменения
Доля интерстициальной соединительной ткани остается достаточно постоянной в широком диапазоне размеров мышц, о чем свидетельствует биопсия двуглавой мышцы плеча у начинающих и элитных бодибилдеров, а также группы контроля. По нашим данным, объем несократительной ткани составляется примерно 13% от общего объема мышцы. На коллаген приходится приблизительно 6% и 7% на остальные ткани (MacDougall et al., 1984). Эти данные показывают, что увеличение размера волокон, вызванное силовыми тренировками, сопровождается пропорциональным увеличением соединительной ткани. Таким образом, в то время как абсолютное количество соединительной ткани увеличивается при использовании силовых тренировок, относительное количество соединительной ткани остается тем же, остается таким же и не может сделать значительный вклад в увеличение размера мышцы.
В отличие от тренировок на выносливость, неясно, сопровождается или нет увеличение площади мышечных волокон, вызванное силовой тренировкой достаточной степенью капилляризации, чтобы сохранить нормальную плотность капилляров в мышцах. Некоторые исследования показали снижение плотности капилляров (Tesch et al., 1984; MacDougall, 1986b), в то время как другие не отметили никаких изменений или отметили даже небольшое увеличение плотности капилляров после силовых тренировок (Green et al., 1999; MacCall et al., 1996). По-видимому, такие различия заключаются в различных программах тренировки.
Гиперплазия скелетных мышечных волокон
Скелетные мышцы млекопитающих развиваются из мезодермы. Повторяющееся митотическое деление дает начало миллионам одноядерных клеток, называемых миобластами. Приблизительно на четвертую неделю беременности, группы миобластов выравниваются и начинают сливаться вместе, чтобы сформировать многоядерные мышечные трубочки, которые в конечном итоге становятся мышечными волокнами. Этот процесс продолжается до рождения и, возможно, в течение нескольких месяцев после рождения. Поскольку расположенные на периферии ядра мышечных трубочек не способны к дальнейшему митотическому делению, считается, что сразу после рождения (или вскоре после этого), количество мышечных волокон остается неизменным (Fischman, 1972; Mastaglia, 1981; Malina, 1986).
Послеродовой рост мышц является результатом увеличения площади мышечных волокон и их длины. Увеличение длины мышц является результатом добавления саркомеров на концах волокон и продолжается до тех пор, пока не прекратится рост костей. Увеличение площади мышечных волокон и их длины также сопровождается пропорциональным увеличением количества миоядер. Эти миоядра, как считается, возникают из клеток-сателлитов (стволовых клеток) (Moss & LeBlond 1971; Goldspink, 1974; Malina, 1986), которые, в свою очередь, также возникают из популяций миобластов, которые не сливаются, чтобы сформировать мышечные трубочки (White & Esser, 1989).
Несколько ранних исследователей сообщали об увеличении количества мышечных волокон во время раннего неонатального роста у нескольких видов животных, таких как крысы (Chiakulus & Pauly, 1965; & Rayne & Crawford, 1975). Для объяснения этой гиперплазии были предложены различные механизмы:
Электронно-микроскопические доказательства при исследовании развития мышц новорожденных крыс показывают, что первые два механизма, вероятно, не имеют места, и увеличение количества мышечных волокон возможно за счет двух других механизмов (Ontell & Dunn 1978; Mastaglia 1981).
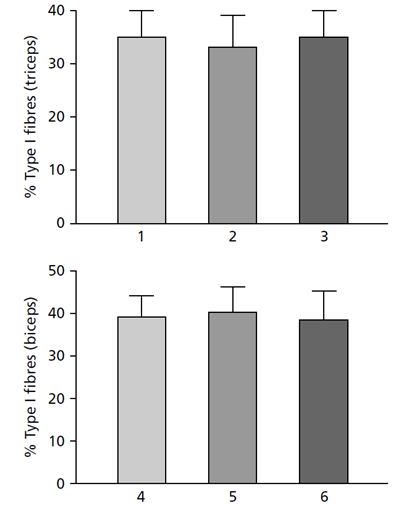
Рис. 13.2 (Сверху) Процентное содержание МВ I типа трехглавой мышцы плеча девяти молодых мужчин: (1) — до, (2) — после 6 месяцев силовых тренировок и (3) — через 6 недель иммобилизации локтевого сустава. Обратите внимание, что нет никаких изменений в типе волокна.
(Снизу) Процентное содержание МВ I типа в двуглавой мышце плеча в группе 13 нетренированных мужчин (4), группе из семи культуристов среднего уровня (5) и группе из пяти элитных культуристов (6). Обратите внимание, что нет никаких различий в типах МВ между группами. Приведены средние значения и стандартное отклонение (MacDougall, 1986a).
Гиперплазия мышц у взрослых?
С первых работ Morpuglo (1897), который обучал собак на беговом колесе, обычно считалось, что количество мышечных волокон в мышцах взрослых млекопитающих не увеличивается, и рост мышц происходит исключительно посредством увеличения объема существующих волокон. В 1970-х годах, однако, в ряде исследований появилось предположение, что компенсационный и индуцированный тренировкой рост мышц у некоторых видов животных был результатом, как гипертрофии существующих волокон, так и добавлением новых волокон (Reitsma 1969; Hall-Craggs,1970; Gonyea et al., 1977;. Sola et al., 1973; Gonyea, 1980).
В 1981 году Gollnick и его коллеги критически отнеслись к последним исследованиям и предположили методологические ошибки, связанные с методом оценки количества мышечных волокон посредством гистологических методов, что привело к предвзятым результатам.
Используя методику, с помощью которой все мышечные волокна были выделены и подсчитаны, эти авторы (Gollnick et al., 1981) пришли к выводу, что у крыс увеличение мышц, вызванное абляцией (удалением) мышц-синергистов при беге на тредмиле может осуществляться посредством только гипертрофии существующих волокон, без добавления новых волокон. Это было подтверждено в последующем исследовании на мышах (Timson et al., 1985). Использование бега, как одной из форм тренировки значительно отличается от силовой тренировки, которая была использована во многих исследованиях, которые сообщили о гиперплазии. Действительно, используя тот же метод подсчета волокон, как у Gollnick et al., было обнаружено значительное (9%) увеличение числа волокон у кошек, после программы силовой тренировки, при выполнении которой животные были обучены выполнять почти максимальные произвольные мышечные сокращения с целью получить пищу в награду (Gonyea et al., 1986). Кроме того, есть также несколько исследований, предполагающих непрямые доказательства гиперплазии МВ после силовых тренировок у кошек (Giddings & Gonyea, 1992) и крыс (Tamaki et al., 1997).
Хорошо известно, что применение хронического удлинения является очень мощной моделью увеличения мышц. Растягивание обычно осуществляется путем навешивания тяжелого груза на одно из крыльев птиц (перепелов или цыплят). Мышцы противоположного крыла в этом случае выступают как контроль. В этих исследованиях установлено, что увеличение мышечной массы после нескольких недель тренировки является результатом, как гипертрофии, так и гиперплазии мышечных волокон (Sola et al., 1973; Alway et al., 1989b, 1990; Антонио & Gonyea 1993a). В одном из исследований было установлено увеличение на 82% количества волокон в ответ на 37 дневное прогрессивное растягивание (Antonio & Gonyea, 1993a). На основании мета-анализа исследований, которые исследовали гиперплазию мышечных волокон у животных, подвергнутых механической нагрузке, Kelly (1996) пришел к выводу, что перегрузки в виде растягивания являются наиболее эффективными, и что гиперплазия чаще встречается у птиц, чем у млекопитающих. Для дальнейшего обсуждения последствий хронического растяжения на гиперплазию мышечных волокон, читатели могут обратиться к обзору Antonio & Gonyea (1993б).
Гиперплазия мышечных волокон у человека
Вопрос о степени гиперплазии мышечных волокон у людей, выполняющих силовые упражнения до настоящего времени остается спорным. Непрямые доказательства основаны на измерении размеров волокон (MacDougall et al. 1982; Tesch & Larsson, 1982) и оценки количества волокон на одну ДЕ (Larsson & Tesch, 1986), которые предполагают, что некоторые бодибилдеры обладают большим количеством МВ, чем нетренированные. В таком случае, однако, следует признать, что большее количество волокон у этих субъектов может быть обусловлено генетически, а не являться результатом силовой тренировки, которая индуцирует гиперплазию. Из-за методологических трудностей в определении количества мышечных волокон в организме человека, решить этот вопрос очень трудно.
Используя метод оценки количества МВ в естественных условиях, мы исследовали двуглавую мышцу плеча 25 молодых мужчин, из которых пять были элитными бодибилдерами, семь – бодибилдерами промежуточного уровня и 13 – нетренированными мужчинами (MacDougall et al., 1984). Количество мышечных волокон определяют посредством определения площади поперечного сечения всей мышцы (посредством компьютерной томографии) и площади мышечного волокна (посредством пункционной биопсии). При этом предполагается, что большинство мышечных волокон в двуглавой мышце плеча начинается в месте начала и заканчивается в месте прикрепления большинства волокон, и измерение площади поперечного сечения мышцы охватывает все волокна. Так как двуглавая мышца плеча у бодибилдеров тренируется для достижения максимальной гипертрофии (площадь двуглавой мышцы плеча у некоторых бодибилдеров в три раза превышает аналогичный показатель у нетренирующихся мужчин), эта мышца особенно подходит для исследования возможной гиперплазии мышечных волокон. Мы предположили, что если силовая тренировка индуцирует увеличение количества волокон, то двуглавая мышца плеча у этих бодибилдеров должна это показать по сравнению с нетренирующимися.
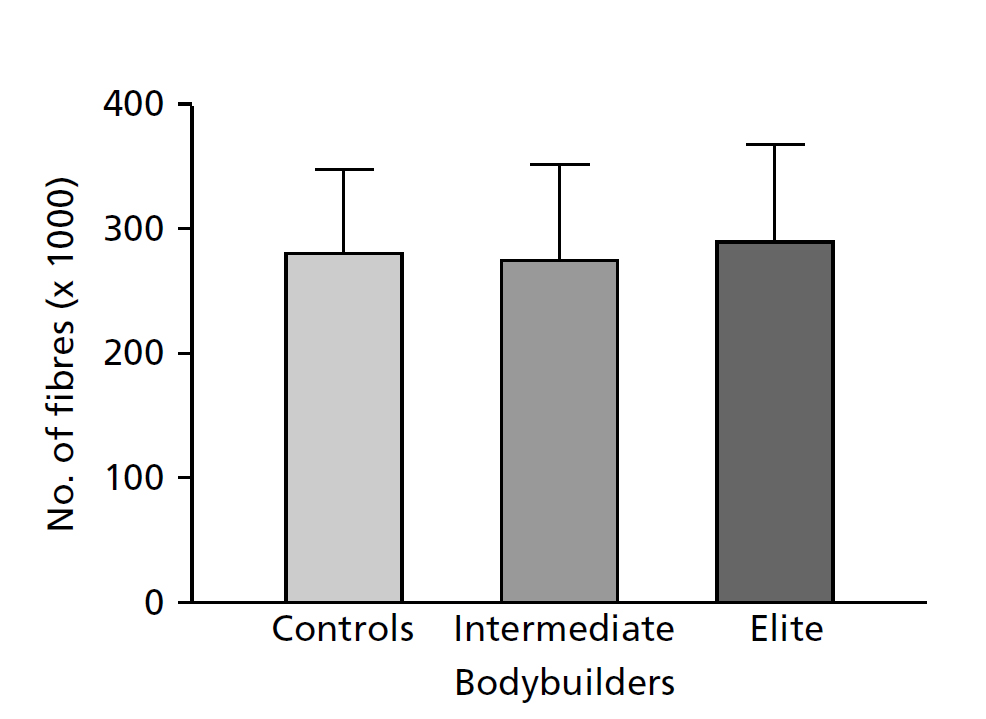
Данные показали, что в то время как общее количество мышечных волокон в двуглавой мышце плеча варьирует в диапазоне от 172000 до 419000 волокон, среднее число волокон было одинаковым для каждой группы (рис. 13.3). Так, обе группы бодибилдеров, которые тренировали свои бицепцы для достижения максимального объема в течение как минимум 6 лет, имели такое же количество волокон, как и нетренированные мужчины. На основании этого мы пришли к выводу, что такая тренировка не приводит к значительному увеличению количества мышечных волокон. Мы также обнаружили, что в каждой группе у субъектов, имеющих самые крупные мышцы, количество волокон было выше средних значений. Таким образом, хотя размер мышц, в первую очередь зависит от размера отдельных волокон, он также зависит от генетически детерминированного количества волокон.
В единственном длительном исследовании гиперплазии на людях, MacCall et al. (1996) не наблюдалось никаких изменений в количестве волокон в двуглавой мышце плеча у молодых мужчин, после 12 недель интенсивной силовой тренировки. В этом исследовании метод оценки количества волокна был таким же, как используемый MacDougall et al. (1984), и его информативность основана на предположении, что средняя площадь волокна в образце биопсии репрезентативна для всей мышцы. Мы рассмотрели точность данного метода при сравнении наших оценок количества волокон в двуглавой мышце плеча одной руки с аналогичным показателем другой руки и пришли к выводу, что стандартная ошибка оценки составляла примерно ±11% (MacDougall et al., 1984). Таким образом, необходимо признать, что этот способ не так точен, как, например, прямой подсчет волокон после расщепления азотной кислотой всей мышцы, и что небольшие изменения в общем количестве волокон может быть не обнаружены.
Рис. 13.3 Количество мышечных волокон в двуглавой мышце плеча у группы, состоящей из 13 нетренированных мужчин, группы из семи бодибилдеров среднего уровня и группы из пяти элитных бодибилдеров. Приведены средние значения и стандартное отклонение (MacDougall, 1986a).
В посмертном исследовании правой и левой передней большеберцовой мышцы у молодых мужчин (правшей), Sjostrom et al. (1991) обнаружили большую площадь поперечного сечения мышц на левой стороне, но не было никакой разницы в площади поперечного сечения мышечных волокон между двумя сторонами. Они пришли к выводу, что больший размер мышц нижней левой ноги был связан с компенсаторной гипертрофией, вызванной долгосрочным асимметричным использованием этой ноги у правшей. Кроме того, они интерпретировали эти данные как указание, что увеличенное мышц было связано с приблизительным увеличением на 9,8% количества волокон (Sjostrom et al., 1991).
Из существующей литературы, таким образом, следует, что у здоровых взрослых людей не встречается чистое увеличение количества волокон в мышцах в ответ силовую тренировку; или, если это имеет место, то очень незначительно. Как же тогда объяснить наличие явных доказательств существования гиперплазии мышечных волокон у некоторых видов животных и ее отсутствие у человека? Одним из возможных объяснений является то, что гиперплазия происходит только в ответ на значительные перегрузки в виде растягивания, что также вызывает удлинение мышц, и что обычных силовых тренировках таких стимулов нет. Рассмотрим обоснование для этого объяснения.
Некоторые исследователи сообщали о небольшом увеличении количества волокон у млекопитающих после силовой тренировки или абляции (удаления) мышц-синергистов (Ho et al., 1980; Gonyea et al., 1986), но большинство из авторов об этом не сообщало (Gollnick et al., 1981; Timson et al., 1985; Snow & Chortkoff 1987; Yarasheski et al., 1990). В отличие от этого, большинство исследователей, которые использовали хроническое растяжение мышц птиц, сообщили о значительном увеличении общего количества волокон (Alway et al., 1989b;. Sola et al., 1973; Antonio & Gonyea, 1993a). Кроме того, увеличение количества волокон связано с величиной растягивания и длительностью стимула (Antonio & Gonyea, 1993a). В отличие от птиц, трудно вызывать длительное растягивание мышц у четвероногих. Таким образом, то, что гиперплазия мышечных волокон проявляется в большей степени у птиц, чем у млекопитающих может быть связана с эффективностью экспериментальной модели, а не в различиях между видами животных.
Сомнительно также, что при силовой тренировке существует большое растягивание мышц. Большинство движений тяжелоатлетов начинаются с длины, соответствующей длине покоя (или чуть больше), с последующим укорочением саркомеров во время концентрической фазы подъема. Хотя некоторое растяжение саркомеров происходит в конце эксцентрического сокращения, структура большинства суставов человека такова, что возможно только умеренное удлинение саркомеров. Исключением является голеностопный сустав, где возможно значительное сгибание и таким образом, растягивание икроножных мышц. В недавнем исследовании (Fowles et al., 2000) мы изучали влияние пассивного растягивания на синтез мышечного белка в камбаловидной мышце. С этой целью использовалось специальное устройство для удержания ног, снабженное тензодатчиками (Sale et al., 1982). Восемь молодых мужчин выполняли в течение приблизительно 30 минут пассивное растяжение икроножной мышцы одной ноги, а другая нога выступала в качестве контроля. Процедура начиналась с максимального сгибания стопы, чтобы исследуемый не испытывал боли и после этого каждые две минуты, величина сгибания увеличивалась до нового максимального значения угла сгибания, который ограничивался способностью переносить боль исследуемым. В среднем, этот протокол тренировки привел к увеличению на 6-7 град угла сгибания по сравнению с первоначальными значениями. Затем измерялась скорость синтеза белков в камбаловидных мышцах обеих ног, путем количественного определения скорости появления L-[1-13C] лейцина в образцах биопсии. Несмотря на вмешательство, никакой разницы в скорости синтеза белков между двумя мышцами не было. Так как величина и длительность растягивания в этом эксперименте значительно превышала то, что бывает во время обычного силовой тренировки, очевидно, что этого не достаточно, чтобы стимулировать синтез белка, так как растягивание очень мало.
Клетки-сателлиты и процесс гипертрофии
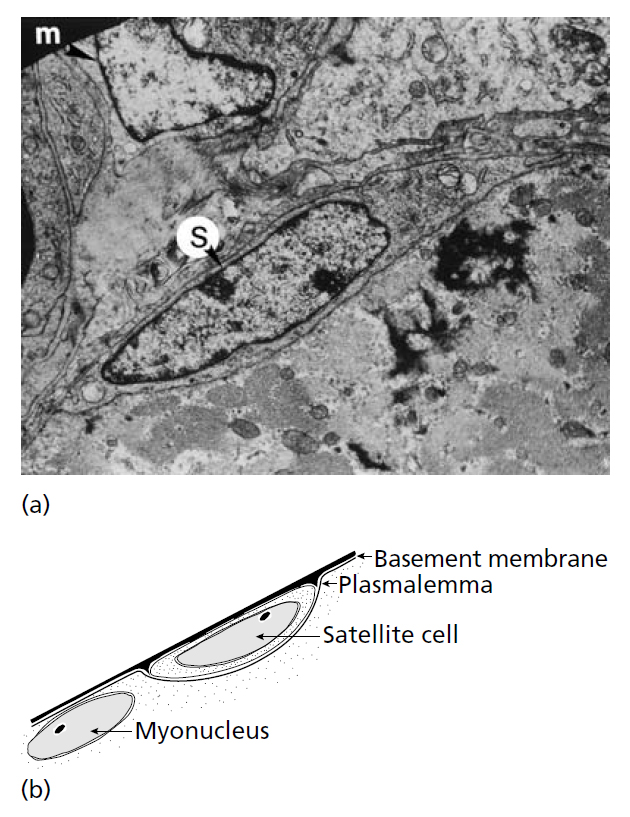
Процесс увеличения количества волокон, индуцированный физической нагрузкой у взрослых животных, предположительно связывали с продольным расщеплением существующих волокон (Hall-Craggs 1970;. Gonyea et al., 1977). Но в настоящее время принято считать, что не этот механизм приводит к гиперплазии (Snow & Chortkoff, 1987), а что новые волокна развиваются из клеток-сателлитов (Кennedy et al., 1988; Antonio & Gonyea 1993a; Kadi & Thornell, 2000). Термин «клетки-сателлиты» был впервые использован Mauro (1961) для описания типа нефункционирующих резервных клеток, которые располагались между базальной мембраной и сарколеммой (рис. 13.4). при использовании светового микроскопа эти клетки выглядят как обычные миоядра, но могут быть идентифицированы посредством электронного микроскопа, так как миоядра лежат под сарколеммой. Считается, что эти клетки возникают из миобластов, которые не сливаются в мышечные трубочки и функциональные волокна во время эмбрионального развития (White & Esser, 1989).
Клетки-сателлиты чаще видны в мышцах молодых животных. С возрастом их количество уменьшается (Schultz 1989; White & Esser, 1989). У здоровых взрослых людей, ядра клеток-сателлитов составляют примерно 2-4% от всех обнаруженных миоядер на электронных микрофотографиях (Schmalbruch & Hellhammer 1976; Roth et al., 2000). Не установлено снижение их количества (Roth et al., 2000) или активности (Hikida et al., 2000) с возрастом. Клетки остаются в состоянии покоя до тех пор, пока гомеостаз мышцы не изменится до определенного порога, после чего они активируются и пролиферуют через митотическое деление.
Клетки-сателлиты являются источником добавления миоядер в мышечных волокнах. Так как под воздействием физической нагрузки происходит увеличение объема мышечных волокон, увеличение количества миоядер позволяет сохранять постоянство миоядерного домена (Kadi & Tornell, 2000). Более того, оказывается, что их активация является необходимой для процесса гипертрофии в первую очередь (Rosenblatt et al., 1994; Phelan & Gonyea 1997), хотя не все исследователи поддерживают эту концепцию (Lou & Always, 1999). Вторая важная функция клеток-сателлитов заключается в их роли в регенерации поврежденных волокон (Bischoff, 1989; Schultz, 1989). При травматическом повреждении, таком как разрыв мышечных волокон, происходит активация клеток-сателлитов на поврежденном волокне. Они активируются, пролифелируют и мигрируют вдоль волокна к месту раны. Затем они проникают в клетку и формируют новые миофибриллы в существующем мышечном волокне, в то время как поврежденные остатки удаляются макрофагами (Chambers & McDermott, 1996). Если повреждение волокна является серьезным, клетки-сателлиты сливаются, чтобы сформировать многоядерную миотубу. Затем миотуба превращается в новое мышечное волокно посредством процесса, подобного тому, какой происходит в период внутриутробного развития и заменяет некротические волокна (Bischoff 1989; Шульц, 1989). Представляется также, что, когда мышечное волокно повреждено, активация клеток-сателлитов ограничивается теми, которые находятся на поврежденном волокне. Клетки-сателлиты неповрежденных волокон не активируются (Schulz et al., 1986). Если это так, и если только одна миотуба появляется вместо некротического волокна, то имеет место процесс замены некротического волокна новым, без увеличения количества волокон.
Рис.13.4. (а) Электронного микрофотография, показывающая клетки-сателлиты в мышце крыла перепела, который был подвергнут перегрузкой посредством растяжения. S – типичная клетка-сателлит, а m указывает на клетку-сателлит соседнего волокна, в стадии миобласта и, вероятно, в процессе миграции (S.E. Alway, West Wirginia University) (b) схематическое изображение типичной клетки-сателлита. Клетку-сателлит можно отличить от других миоядер, потому что она находится за сарколеммой. (A.J. McComas, University McMaster).
Активация клеток-сателлитов с помощью упражнений и тренировки
Заключение
Силовые упражнения стимулируют увеличение синтеза мышечных сократительных белков. При постоянной силовой тренировке происходит увеличение площади поперечного сечения мышечного волокна вследствие увеличения площади поперечного сечения миофибрилл и их количества. Также увеличивается количество соединительной ткани в пропорции увеличения площади мышечных волокон.
Клетки-сателлиты играют важную (и, возможно, существенную) роль в процессе гипертрофии путем поддержания постоянного объема мионуклеарного домена, а также в ремонте или замене мышечных волокон, поврежденных в процессе тренировки. У некоторых видов животных, клетки-сателлиты могут сливаться с образованием дополнительных новых мышечных волокон, так что существует чистое увеличение количества волокон. Однако, имеется мало фактов, свидетельствующих о том, что силовая тренировка человека приводит к увеличению количества мышечных волокон. Поэтому остается сделать вывод, что, новые волокна, которые образуются из клеток-сателлитов, при силовой тренировке у людей заменяют поврежденные некротические волокна, не увеличивая их количества.
References
Adams, G.R., Hather, B.M., Baldwin, K.M. & Dudley, G.A. (1993) Skeletal muscle myosin heavy chain composition and resistance training. Journal of Applied Physiology 74, 911–915.
Alway, S.E., MacDougall, J.D. & Sale, D.G. (1989a) Contractile adaptations in the human triceps surae after isometric exercise. Journal of Applied Physiology 66, 2725–2732.
Alway, S.E., Winchester, P.K., Davis, M.E. & Gonyea, W.J. (1989b) Regionalized adaptations and muscle fiber proliferation in stretch-induced enlargement. Journal of Applied Physiology 66, 771–781.
Alway, S.E., Gonyea, W.J. & Davis, M.E. (1990) Muscle fiber formation and fiber hypertrophy during the onset of stretch-overload. American Journal of Physiology 259, C92–102.
Andersen, J.L. & Aagaard, P. (2000) Myosin heavy chain IIX overshoot in human skeletal muscle. Muscle and Nerve 23, 1095–1104.
Antonio, J. & Gonyea, W.J. (1993a) Progressive stretch overload of skeletal muscle results in hypertrophy before hyperplasia. Journal of Applied Physiology 75, 1263–1271.
Antonio, J. & Gonyea, W.J. (1993b) Skeletal muscle fiber hyperplasia. Medicine and Science in Sports and Exercise 25, 1333–1345.
Appell, H.J., Forsberg, S. & Hollmann, W. (1988) Satellite cell activation in human skeletal muscle after training: evidence for muscle fiber neoformation. International Journal of Sports Medicine 9, 297– 299.
Ashmore, C.R. & Summers, P.J. (1981) Stretch-induced growth in chicken wing muscles: myofibrillar proliferation. American Journal of Physiology 241, C93–C97.
Baldwin, K.M. & Haddad, F. (2001) Effects of different activity and inactivity paradigms on myosin heavy chain gene expression in striated muscle. Journal of Applied Physiology 90, 345–557.
Biolo, G., Maggi, S.P., Williams, B.D., Tipton, K.D. & Wolfe, R.R. (1995) Increased rates of muscle protein turnover and amino acid transport after resistance exercise in humans. American Journal of Physiology 268, E514–E520.
Bischoff, R. (1989) Analysis of muscle regeneration using single myofibers in culture. Medicine and Science in Sports and Exercise 21 (Suppl.), S164–S172.
Brown, A.B., McCartney, N., Moroz, D., Sale, D. & MacDougall, J.D. (1988) Strength training effects in aging. Medicine and Science in Sports and Exercise 20, S80.
Carroll, T.J., Abernethy, P.J., Logan, P.A., Barber, M. & McEniery, M.T. (1998) Resistance training frequency: strength and myosin heavy chain responses to two and three bouts per week. European Journal of Applied Physiology and Occupational Physiology 78, 270–275.
Chambers, R.L. & McDermott, J.C. (1996) Molecular basis of skeletal muscle regeneration. Canadian Journal of Applied Physiology 21, 155–184.
Chesley, A., MacDougall, J.D., Tarnopolsky, M.A., Atkinson, S.A. & Smith, K. (1992) Changes in human muscle protein synthesis after resistance exercise. Journal of Applied Physiology 73, 1383–1388.
Chiakulus, J.J. & Pauly, J.E. (1965) A study of post-natal growth of skeletal muscle in the rat. Anatomical Record 152, 55–62.
Chilibeck, P.D., Syrotuik, D.G. & Bell, G.J. (1999) The effect of strength training on estimates of mitochondrial density and distribution throughout muscle fibres. European Journal of Applied Physiology and Occupational Physiology 80, 604–609.
Darr, K.C. & Schultz, E. (1987) Exercise-induced satellite cell activation in growing and mature skeletal muscle. Journal of Applied Physiology 63, 1816–1821.
Fischmann, D.A. (1972) Development of striated muscle. In: The Structure and Function of Muscle: Structure, Part 1, Vol. 1 (ed. G.H. Bourne), pp. 75–148. Academic Press, New York.
Fowles, J.R., MacDougall, J.D., Tarnopolsky, M.A., Sale, D.G., Roy, B.D. & Yarasheski, K.E. (2000) The effects of acute passive stretch on muscle protein synthesis in humans. Canadian Journal of Applied Physiology 25, 165–180.
Gibala, M.J., MacDougall, J.D., Tarnopolsky, M.A., Stauber, W.T. & Elorriaga, A. (1995) Changes in human skeletal muscle ultrastructure and force production after acute resistance exercise. Journal of Applied Physiology 78, 702–708.
Gibala, M.J., Interisano, S.A., Tarnopolsky, M.A. et al. (2000) Myofibrillar disruption following acute concentric and eccentric resistance exercise in strengthtrained men. Canadian Journal of Physiology and Pharmacology 78, 656–661.
Giddings, C.J., Neaves, W.B. & Gonyea, W.J. (1985) Muscle fiber necrosis and regeneration induced by prolonged weight-lifting exercise in the cat. Anatomical Record 211, 133–141.
Giddings, C.J. & Gonyea, W.J. (1992) Morphological observations supporting muscle fiber hyperplasia following weight-lifting exercise in cats. Anatomical Record 233, 178–195.
Goldberg, A.L., Etlinger, J.D., Goldspink, D.F. & Jablecki, C. (1975) Mechanism of work-induced hypertrophy of skeletal muscle. Medicine and Science in Sports and Exercise 7, 185–198.
Goldspink, G. (1970) The proliferation of myofibrils during muscle fiber growth. Journal of Cell Science 6, 593–603.
Goldspink, G. (1974) Development of muscle. In: Growth of Cells in Vertebrate Tissues (ed. G. Goldspink), pp. 69–99.
Chapman & Hall, London. Goldspink, G. (1992) Cellular and molecular aspects of adaptation in skeletal muscle. In: Strength and Power in Sport (ed. P.V. Komi), pp. 211–229. Blackwell Scientific Publications, Oxford.
Goldspink, G. & Howells, K.F. (1974) Work-induced hypertrophy in exercised normal muscles of different ages and the reversibility of hypertrophy after cessation of exercise. Journal of Physiology 239, 179–193.
Gollnick, P.D., Timson, B.F., Moore, R.L. & Reidy, M. (1981) Muscle enlargement and number of fibers in skeletal muscle of rats. Journal of Applied Physiology 50, 939–943.
Gonyea, W.J. (1980) Role of exercise in inducing increases in skeletal muscle fiber number. Journal of Applied Physiology 48, 421–426.
Gonyea, W.J. & Ericson, G.C. (1976) An experimental model for the study of exercise-induced skeletal muscle hypertrophy. Journal of Applied Physiology 40, 630–633.
Gonyea, W., Ericson, G.C. & Bonde-Peterson, F. (1977) Skeletal muscle fiber splitting induced by weight lifting exercise in cats. Acta Physiologica Scandinavica 99, 105–109.
Gonyea, W.J., Sale, D., Gonyea, Y. & Mikesky, A. (1986) Exercise induced increases in muscle fiber number. European Journal of Applied Physiology 55, 137–141.
Green, H., Goreham, C., Ouyang, J., Ball-Burnett, M. & Ranney, D. (1999) Regulation of fiber size, oxidative potential, and capillarization in human muscle by resistance exercise. American Journal of Physiology 276, R591–R596.
Hall-Craggs, E.C.B. (1970) The longitudinal division of overloaded skeletal muscle fibers. Journal of Anatomy 107, 459–470.
Hikida, R.S., Staron, R.S., Hagerman, F.C. et al. (2000) Effects of high-intensity resistance training on untrained older men. II. Muscle fiber characteristics and nucleo-cytoplasmic relationships. Journals of Gerontology Series A: Biological Sciences and Medical Sciences 55, B347–B354.
Ho, K.W., Roy, R.R., Tweedle, C.D., Heusner, W.W., Van Huss, W.D. & Carrow, R.E. (1980) Skeletal muscle 262 mechanism for adaptation fiber splitting with weight-lifting exercise in rats. American Journal of Anatomy 157, 433–440.
Irintchev, A. & Wernig, A. (1987) Muscle damage and repair in voluntarily running mice: strain and muscle differences. Cell and Tissue Research 249, 509–521.
Jacobs, S.C., Wokke, J.H., Bar, P.R. & Bootsma, A.L. (1995) Satellite cell activation after muscle damage in young and adult rats. Anatomical Record 242, 329– 336.
Kadi, F. & Thornell, L.E. (2000) Concomitant increases in myonuclear and satellite cell content of female trapezius muscle following strength training. Histochemistry and Cell Biology 113, 99–103.
Kadi, F., Eriksson, A., Holmner, S., Butler-Browne, G.S. & Thornell, L.E. (1999) Cellular adaptation of the trapezius muscle in strength-trained athletes. Histochemistry and Cell Biology 111, 189–195.
Kelley, G. (1996) Mechanical overload and skeletal muscle fiber hyperplasia: a meta-analysis. Journal of Applied Physiology 81, 1584–1588.
Kennedy, J.M., Eisenberg, B.R., Reid, S.K., Sweeney, L.J. & Zak, R. (1988) Nascent muscle fiber appearance in overloaded chicken slow-tonic muscle. American Journal of Anatomy 181, 203–215.
Larsson, L. & Tesch, P.A. (1986) Motor unit fiber density in extremely hypertrophied skeletal muscles in man. European Journal of Applied Physiology 55, 130– 136.
Luthi, J.M., Howald, H., Classen, H., Rosler, K., Vock, P. & Hoppeler, H. (1986) Structural changes in skeletal muscle tissue with heavy-resistance exercise. International Journal of Sports Medicine 7, 123–127.
Lowe, D.A. & Alway, S.E. (1999) Stretch-induced myogenin, MyoD, and MRF4 expression and acute hypertrophy in quail slow-tonic muscle are not dependent upon satellite cell proliferation. Cell and Tissue Research 296, 531–539.
McCall, G.E., Byrnes, W.C., Dickinson, A., Pattany, P.M. & Fleck, S.J. (1996) Muscle fiber hypertrophy, hyperplasia, and capillary density in college men after resistance training. Journal of Applied Physiology 81, 2004–2012.
McDonagh, M.J.N. & Davies, C.T.M. (1984) Adaptive response of mammalian muscle to exercise with high loads. European Journal of Applied Physiology 52, 139– 155.
MacDougall, J.D. (1986a) Adaptability of muscle to strength trainingaa cellular approach. In: Biochemistry of Exercise VI, Vol. 16 (ed. B. Saltin), pp. 501– 513. Human Kinetics, Champaign, Illinois.
MacDougall, J.D. (1986b) Morphological changes in human skeletal muscle following strength training and immobilization. In: Human Muscle Power (eds N. L. Jones, N. McCartney & A.L. McComas), pp. 269–288. Human Kinetics, Champaign, Illinois.
MacDougall, J.D., Sale, D.G., Moroz, J.R., Elder, G.C.B., Sutton, J.R. & Howald, H. (1979) Mitochondrial volume density in human skeletal muscle following heavy resistance training. Medicine and Science in Sports 11, 164–166.
MacDougall, J.D., Elder, G.C.B., Sale, D.G., Moroz, J.R. & Sutton, J.R. (1980) Effects of strength training and immobilization on human muscle fibers. European Journal of Applied Physiology 43, 25–34.
MacDougall, J.D., Sale, D.G., Elder, G.C.B. & Sutton, J.R. (1982) Muscle ultrastructural characteristics of elite powerlifters and bodybuilders. European Journal of Applied Physiology 48, 117–126.
MacDougall, J.D., Sale, D.G., Alway, S.E. & Sutton, J.R. (1984) Muscle fiber number in biceps brachii in bodybuilders and control subjects. Journal of Applied Physiology 57, 1399–1403.
MacDougall, J.D., Gibala, M.J., Tarnopolsky, M.A., MacDonald, J.R., Interisano, S.A. & Yarasheski, K.E. (1995) The time course for elevated muscle protein synthesis following heavy resistance exercise. Canadian Journal of Applied Physiology 20, 480–486.
Malina, R.M. (1986) Growth of muscle tissue and muscle mass. In: Human Growth A Comprehensive Treatise, Vol. 2 (eds F. Falkner & J. M. Tanner), pp. 77–99. Plenum Press, New York.
Mastaglia, F.L. (1981) Growth and development of the skeletal muscles. In: Scientific Foundations of Paediatrics (eds J.A. Davis & J. Dobbing), pp. 590–620. Heinemann, London.
Masuda, K., Choi, J.Y., Shimojo, H. & Katsuta, S. (1999) Maintenance of myoglobin concentration in human skeletal muscle after heavy resistance training. European Journal of Applied Physiology and Occupational Physiology 79, 347–352.
Mauro, A. (1961) Satellite cells of skeletal muscle fibers. Journal of Biophysical and Biochemical Cytology 9, 493– 495.
Miller, K.J., Thaloor, D., Matteson, S. & Pavlath, G.K. (2000) Hepatocyte growth factor affects satellite cell activation and differentiation in regenerating skeletal muscle. American Journal of PhysiologyaCell Physiology 278, C174–C181.
Morpurgo, B. (1897) Uberaktivitats-Hypertrophie der Willkurlichen Muskeln. Virchows Archives fur Pathologische Anatomie und Physiologie 15, 522–554.
Moss, F.P. & LeBlond, C.P. (1971) Satellite cells as the source of nuclei in muscles of growing rats. Anatomical Record 170, 421–436.
Ontell, J. & Dunn, R.F. (1978) Neonatal muscle growth: a quantitative study. American Journal of Anatomy 152, 539–556.
Phelan, J.N. & Gonyea, W.J. (1997) Effect of radiation on satellite cell activity and protein expression in overloaded mammalian skeletal muscle. Anatomical Record 247, 179–188.
Phillips, S.M., Tipton, K.D., Aarsland, A., Wolf, S.E. & Wolfe, R.R. (1997) Mixed muscle protein synthesis and breakdown after resistance exercise in humans. American Journal of Physiology 273, E99–E107.
Rayne, J. & Crawford, G.N.C. (1975) Increase in fiber numbers of the rat pterygoid muscles during postnatal growth. Journal of Anatomy 118, 347–357.
Reitsma, W. (1969) Skeletal muscle hypertrophy after heavy exercise in rats with surgically reduced muscle function. American Journal of Physical Medicine 48, 237–259.
Rosenblatt, J.D., Yong, D. & Parry, D.J. (1994) Satellite cell activity is required for hypertrophy of overloaded rat muscle. Muscle and Nerve 17, 608–613. Roth, S.M., Martel, G.F., Ivey, F.M. et al. (2000) Skeletal muscle satellite cell populations in healthy young and older men and women. Anatomical Record 260, 351–358.
Sale, D., Quinlan, J., Marsh, E., McComas, A.J. & Belanger, A.Y. (1982) Influence of joint position on ankle plantarflexion in humans. Journal of Applied Physiology 52, 1636–1642.
Sale, D.G., MacDougall, J.D., Jacobs, I. & Garner, S. (1990) Interaction between concurrent strength and endurance training. Journal of Applied Physiology 68, 260–270.
Schmalbruch, H. & Hellhammer, U. (1976) The number of satellite cells in normal human tissue. Anatomical Record 185, 279–288.
Schultz, E. (1989) Satellite cell behavior during skeletal muscle growth and regeneration. Medicine and Science in Sports and Exercise 21 (Suppl.), S181–S186.
Schultz, E., Jaryszak, D.L., Gibson, M.C. & Albright, D.J. (1986) Absence of exogenous satellite cell contribution to regeneration of frozen skeletal muscle. Journal of Muscle Research and Cell Motility 7, 361–367.
Sjostrom, M., Lexell, J., Eriksson, A. & Taylor, C.C. (1991) Evidence of fibre hyperplasia in human skeletal muscles from healthy young men? A left–right comparison of the fibre number in whole anterior tibialis muscles. European Journal of Applied Physiology and Occupational Physiology 62, 301–304.
Snow, M.H. & Chortkoff, B.S. (1987) Frequency of bifurcated muscle fibers in hypertrophic rat soleus muscle. Muscle and Nerve 10, 312–317.
Sola, O.M., Christensen, D.L. & Martin, A.W. (1973) Hypertrophy and hyperplasia of adult chicken anterior latissimus dorsi muscles following stretch with and without denervation. Experimental Neurology 41, 76–100.
Staron, R.S., Malicky, E.S., Leonardi, M.J., Falkel, J.E., Hagerman, F.C. & Dudley, G.A. (1990) Muscle hypertrophy and fast fiber type conversions in heavy resistance-trained women. European Journal of Applied Physiology and Occupational Physiology 60, 71–79.
Staron, R.S., Karapondo, D.L., Kraemer, W.J. et al. (1994) Skeletal muscle adaptations during early phase of heavy-resistance training in men and women. Journal of Applied Physiology 76, 1247–1255.
Tamaki, T., Uchiyama, S. & Nakano, S. (1992) A weightlifting exercise model for inducing hypertrophy in the hindlimb muscle of rats. Medicine and Science in Sports and Exercise 24, 881–886.
Tamaki, T., Akatsuka, A., Tokunaga, M., Ishige, K., Uchiyama, S. & Shiraishi, T. (1997) Morphological and biochemical evidence of muscle hyperplasia following weight-lifting exercise in rats. American Journal of Physiology 273, C246–C256.