гипергликемия ночью что делать
Гипергликемия и сахарный диабет
Гипергликемия или высокий уровень сахара (глюкозы) крови – это серьезная проблема для людей с сахарным диабетом. Гипергликемия возникает, когда в крови слишком много сахара. У людей с сахарным диабетом могут развиваться два специфических вида гипергликемии:
Если у человека с сахарным диабетом часто или на длительное время возникают периоды гипергликемии, на что указывают высокие показатели гликозилированного гемоглобина HbA1c крови, могут развиться повреждения нервов, кровеносных сосудов и других органов. Гипергликемия также может привести к развитию других более серьезных состояний, включая кетоацидоз, который чаще встречается у людей с сахарным диабетом 1 типа, и гипергликемическую гиперосмолярную некетонемическую кому у людей с сахарным диабетом 2 типа и людей с повышенным риском его развития.
Для того чтобы предотвратить развитие осложнений сахарного диабета очень важно быстро лечить симптомы гипергликемии.
Что приводит к развитию гипергликемии?
Гипергликемию при сахарном диабете могут вызывать:
Каковы симптомы гипергликемии при сахарном диабете?
Если Вы больны сахарным диабетом, Вы должны знать ранние признаки гипергликемии. Если ее не лечить, гипергликемия может развиться в кетоацидоз (если у Вас сахарный диабет 1 типа) или гиперосмолярную кому (если у Вас сахарный диабет 2 типа), которые являются серьезными состояниями, требующими оказания неотложной медицинской помощи.
Ранними признаками гипергликемии при сахарном диабете являются:
Длительно длящаяся гипергликемия при сахарном диабете может привести к развитию:
Как лечится гипергликемия при сахарном диабете?
Если Вы больны сахарным диабетом и у Вас есть любые ранние признаки гипергликемии, не забудьте несколько раз перепроверить свой уровень сахара крови. Перед тем как позвонить своему доктору, Вам стоит записать несколько результатов своего уровня сахара крови. Он или она порекомендует Вам следующее:
Предупреждение: Если у Вас сахарный диабет 1 типа и уровень сахара крови достиг 240мг/дл (13,3ммоль/л), Вы должны проверить свою мочу на присутствие в ней кетоновых тел. Если они есть, НЕЛЬЗЯ выполнять физические упражнения. Если у Вас сахарный диабет 2 типа и концентрация сахара в Вашей крови превысила 300мг/дл (16,6ммоль/л), даже при отсутствии кетоновых тел, НЕ занимайтесь физическими упражнениями.
Если у Вас сахарный диабет 1 типа и уровень сахара в Вашей крови превысил 250мг/дл (13,8ммоль/л), Ваш доктор может захотеть провести анализ Вашей мочи на присутствие в ней кетоновых тел.
Если концентрация глюкозы в Вашей крови через 1-2 часа после приема пищи постоянно находится на уровне выше 180мг/дл (10ммоль/л), или два повторных результата анализа показали уровень выше 300мг/дл (16,6ммоль/л), позвоните своему доктору.
Гипергликемия ночью что делать
Если вы регулярно видите высокий уровень глюкозы крови перед обедом, ужином или перед сном, необходимо внести изменения в привычный ход действий. Рассмотрим возможные причины гипергликемии:

Введение недостаточного количества инсулина в предыдущий раз — распространенная причина высокого уровня глюкозы перед очередным приемом пищи. Оцените дозу инсулина, которую вы использовали: возможно, необходимо ее увеличение. Возможно, у вас изменились коэффициенты — чувствительности и углеводный. При подборе новых коэффициентов лучше всего употреблять одинаковые блюда, в подсчете ХЕ которых вы уверены, в одно и то же время суток. Увеличивая дозу инсулина, делайте это постепенно, чтобы уменьшить риск гипогликемии. При изменении дозы инсулина регулярно измеряйте уровень глюкозы крови и держите средства для купирования гипогликемии под рукой — разложите «быстрые» углеводы везде, где бываете.


Если вы используете инсулин промежуточного действия и у вас высокий уровень глюкозы перед ужином, причиной может быть либо слишком маленькая доза инсулина короткого действия перед обедом, либо недостаточное количество инсулина средней продолжительности действия перед завтраком. Если вы чувствуете, что дело в последнем, рассмотрите вопрос об увеличении дозы препарата. Если вы не знаете, как правильно изменить дозу, обратитесь к лечащему врачу за советом. Рассмотрите также вариант смены инсулина.

Обратите внимание, не был ли высокий уровень глюкозы крови вызван поздним приемом пищи. Если вы пообедали или перекусили позже, чем обычно, это может означать, что введенный инсулин еще не полностью отработал. Перед ужином вы при этом можете обнаружить, что уровень сахара выше, чем предполагалось. Введение дополнительной дозы инсулина на коррекцию гипергликемии может привести к отсроченной гипогликемии, так как эффект двух инъекций суммируется. Если возможно, старайтесь придерживаться одного и того же режима питания. Кроме того, учитывайте время действия препаратов инсулина.

Если вы были менее активны, чем обычно, это может привести к более высокому уровню глюкозы в этот день. Если поддерживать физическую активность ежедневно невозможно, увеличьте дозы одной или нескольких инъекций инсулина в менее активный день.
НОЧНАЯ ИНСУЛИНОТЕРАПИЯ И ЕЕ РОЛЬ В ДОСТИЖЕНИИ КОМПЕНСАЦИИ УГЛЕВОДНОГО ОБМЕНА ПРИ ИНСУЛИННЕЗАВИСИМОМ САХАРНОМ ДИАБЕТЕ
*Пятилетний импакт фактор РИНЦ за 2020 г.
Читайте в новом номере
Современные представления о гипергликемии как о важнейшем звене патогенеза инсулиннезависимого сахарного диабета и факторе, препятствующем достижению компенсации заболевания, диктуют необходимость поддержания нормогликемии натощак.
Х роническая гипергликемия натощак является одним из наиболее ранних и постоянных лабораторных признаков инсулиннезависимого сахарного диабета (ИНСД). Доказательство глюкозотоксичности, приводящей с течением времени к нарушению функции в-клеток, заставило изменить взгляд на гипергликемию как только на маркер сахарного диабета. В настоящее время гипергликемию вообще и натощак в частности рассматривают как важнейшее звено патогенеза ИНСД, фактор риска развития атеросклероза и как самостоятельное явление, препятствующее достижению компенсации данного заболевания. Этот факт диктует необходимость достижения и поддержания нормального или близкого к нему состояния углеводного обмена путем максимальной оптимизации терапевтических мероприятий при ИНСД.
Каким образом поддерживается нормогликемия натощак, каковы причины и последствия тощаковой гипергликемии?
Поддержание нормогликемии натощак осуществляет только печень при помощи равновесия между гликогенолизом и глюконеогенезом. Соответственно для гомеостаза глюкозы натощак требуется достаточное содержание гликогена в гепатоцитах и наличие субстратов для глюконеогенеза. Вырабатывающую при этом глюкозу в основном утилизируют инсулиннезависимые ткани (прежде всего мозг и в незначительной степени – инсулинзависимые (мышцы и жировая ткань). Этот процесс регулируют многие нейрогормональные факторы, а при наличии нормального уровня инсулина глюкоза самостоятельно может регулировать процесс освобождения глюкозы печенью за счет короткосрочных (инсулин, глюкагон, катехоламины) и долгосрочных (соматотропный гормон, глюкокортикоиды, тиреодные гормоны) регуляторов.
Печень чрезвычайно чувствительна к изменениям уровня инсулина и глюкагона, так как эти гормоны секретируются непосредственно в печень и прямым образом регулируют данный процесс. Так, снижение уровня инсулина тут же приводит к медленному повышению продукции глюкозы печенью и длительной гипергликемии. Снижение уровня глюкагона уменьшает продукцию глюкозы печенью и соответственно приводит к восстановлению уровня гликемии. При наличии периферической инсулинорезистентности (ИР), как при ИНСД или висцеральном ожирении, происходят значительные изменения в колебаниях подъемов уровня глюкозы в крови натощак. Островки Лангерганса очень чувствительны к этим изменениям и в норме немедленно отвечают на них повышением продукции инсулина и снижением выработки глюкагона. Это, в свою очередь, должно повышать периферическую утилизацию глюкозы и снижать продукцию глюкозы печенью. Таким образом, при имеющейся ИР гликемия какое-то время остается нормальной, а инсулинорезистентность компенсируется ответной гиперинсулинемией. Однако это не может продолжаться бесконечно, и как только компенсаторная гиперинсулинемия оказывается недостаточной для преодоления имеющейся ИР, гликемия в состоянии натощак резко повышается. Результаты исследования базальной и стимулированной секреции инсулина у больных ИНСД явно указывают на наличие признаков относительного дефицита гормона. Так, в частности, доказан факт недостаточной базальной секреции инсулина, несмотря на наличие гиперинсулинемии по крайней мере в течение первых лет заболевания. Кроме того, тест с острой стимуляцией секреции инсулина указывает на выпадение первой быстрой фазы секреции этого гормона. При этом глубина инсулинсекреторного дефекта прямо коррелирует со степенью гипергликемии натощак. Так, при уровне утренней гликемии ниже порогового базальная инсулинемия и инсулиносекреторный ответ на различные стимулы практически не отличаются от нормы. Однако при наличии гипергликемии натощак стимуляция b- клеток глюкозой в большей и аргинином в меньшей степени тут же выявляет значительные нарушения инсулинового ответа. С клинической точки зрения данное явление означает, что при наличии гипергликемии натощак инсулиносекреторный ответ в-клеток на стимуляцию производными сульфонилмочевины (ПСМ) в течение последующего отрезка времени как минимум окажется недостаточным, а достижение компенсации заболевания будет практически невозможным.
Относительный дефицит инсулина у больных ИНСД, несмотря на ГИ, связывают с нарушением функции b- клеток, обусловленным глюкозотоксичностью. Последняя проявляется в виде снижения способности глюкозы потенцировать инсулиносекреторный ответ b- клеток на нейрогуморальные и прочие (не связанные с глюкозой) стимулы, которые чрезвычайно важны в поддержании базального и постпрандиального уровня инсулинемии.
Не последнюю роль в поддержании гипергликемии натощак при ИНСД играет нарушение секреции глюкагона. Учитывая тот факт, что a- клетки, как и b- клетки, являются глюкозочувствительными, первые с течением времени также теряют нормальную способность отвечать на повышение гликемии снижением продукции глюкагона даже при очень выраженной гипергликемии. Не исключено, что первичный дефект описанного нарушения секреторной способности a- клеток связан с патологическими процессами, происходящими в b- клетках. Кровоток в островках Лангерганса осуществляется от b- клеток к a- клеткам, и вполне возможно, что процессы, приводящие сначала к нарушению секреции инсулина, являются и причиной неспособности а-клеток подавлять секрецию глюкагона.
Независимо от уровня дефекта, приводящего к гипергликемии натощак, можно утверждать, что при ИНСД в любом случае имеется недостаточная секреция инсулина даже при наличии относительной гиперинсулинемии. С течением времени гипергликемия per se, как уже было показано ранее, в силу глюкозотоксичности нарушает секрецию инсулина и, возможно, искажает секрецию глюкагона.
Следующую важную роль относительный дефицит инсулина играет в метаболизме СЖК. Так, адекватное количество инсулина подавляет липолиз и гиперпродукцию СЖК. В исследованиях было четко показано, что в случаях, наибольшей утренней гипергликемии, а следовательно, наименьшей инсулинемии, в крови больных ИНСД выявляется максимальная концентрация СЖК. Введение таким больным высоких доз инсулина приводило к поддержанию нормогликемии и снижению СЖК. Характерно, что уровень СЖК нормализовался на фоне максимальных доз инсулина.
СЖК играют важнейшую роль в развитии инсулинорезистентности и поддержании гипергликемии у больных ИНСД.
Более 20 лет назад Рэндл доказал, что повышение окисления СЖК в мышцах препятствует утилизации и окислению в них глюкозы вследствие воздействия СЖК на различные ферменты гликолиза. В настоящее время доказано, что повышенное окисление СЖК оказывает влияние на все основные внутриклеточные процессы, приводящие к инсулинорезистентности, а именно: снижает транспорт глюкозы внутрь клеток, а также – активность гликогенсинтетазы и пируватдегидрогеназы. Кроме того, избыточное окисление СЖК в печени стимулирует повышенную продукцию глюкозы в ней. Последнее явление было доказано даже у абсолютно здоровых лиц. Так, искусственно созданный избыточный приток СЖК в печень резко стимулировал глюконеогенез (ГНГ). Скорее всего, это связано со способностью Ацетила-СоА, образующегося в процессе окисления СЖК, стимулировать активность аллостерической пируваткарбоксилазы, ключевого фермента ГНГ. Кроме того, Ацетил-СоА снижает активность пируватдегидрогеназы. Результатом последнего действия будет ускорение окисления СЖК в печени и мышцах, и, как следствие, повышенное образование лактата из глюкозы, одного из главных субстратов для ГНГ.
Кроме изложенных эффектов СЖК, следует отметить, что последние оказывают прямое подавляющее действие на связывание и интернализацию инсулина гепатоцитами. Это в свою очередь приводит к снижению синтеза гликогена в печени, усиливает периферическую ГИ и также активизирует ГНГ.
При ИНСД, особенно сопровождающимся висцеральным ожирением, наблюдают повышенный липолиз. Это также связано с избыточным содержанием СЖК, ускорящим процессы их утилизации клетками и окисления липидов, что подавляет естественную способность инсулина ингибировать липолиз. Таким образом, повышенное образование СЖК, обусловленное относительным дефицитом инсулина, препятствует утилизации глюкозы в мышцах и стимулирует ГНК в печени. Совместно эти механизмы ведут к гипергликемии и ИР.
Таким образом, изложенные данные четко демонстрируют важную роль обеспечения нормогликемии в ночные и утренние часы для достижения компенсации углеводного обмена в течение всех суток.
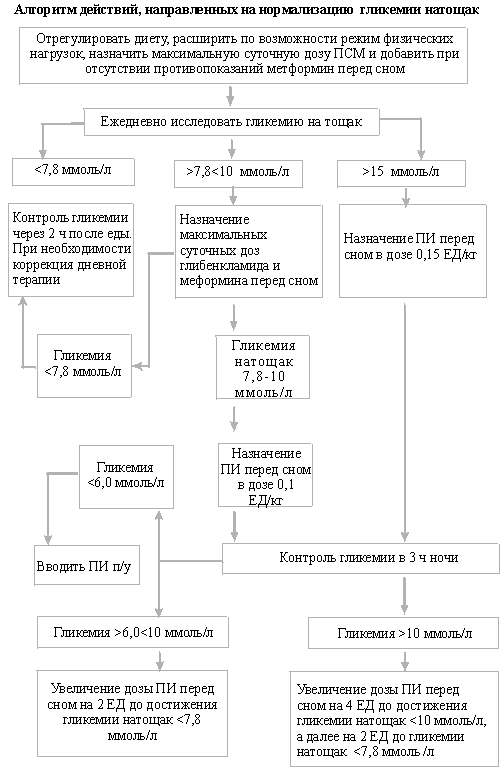
Учитывая значимость нормализации гликемии натощак, нами была поставлена цель разработать оптимальные терапевтические подходы, обеспечивающие удовлетворительный уровень сахара в крови в течение ночи и утром.
Под нашим наблюдением находилось 204 пациента в возрасте от 38 до 72 лет, у которых в соответствии с критериями компенсации, предложенными European NIDDM Policy Group (1993), имела место суб- или декомпенсация сахарного диабета. Так, у всех больных уровень гемоглобина A1c превышал 7,5% (8,6±0,9), а гликемия натощак – 7,8 ммоль/л (9,1±1,1).
Подавляющее большинство больных получали различные ПСМ (92,6%), комбинацию ПСМ и глюкобая (3%) и 4,4% – метформин.
Прежде всего, больные все без исключения были обучены принципам расчета диеты и самоконтроля. Ежедневно вместе с больным производили анализ и коррекцию полученных при самоконтроле данных, которые тщательно сопоставляли с количеством принятой пищи. Проведенные мероприятия позволили достичь у 20,6% больных компенсации сахарного диабета, не меняя лечения вообще. Всем остальным пациентам терапия была изменена следующим образом.
112 (54,9%) пациентов с гликемией натощак, превышающей 10,0 ммоль/л, перед сном в 22 ч был назначен пролонгированный инсулин протафан, монотард, инсуман “Базаль” или хумулин “N” в начальной дозе 0,15 ЕД/кг фактической массы тела. Дозу ПСМ увеличивали до максимальной суточной, или чаще назначали глибенкламид в дозе 15 мг/сут (10 мг + 5 мг). Если у больных лабораторные признаки декомпенсации сахарного диабета сочетались со значительной потерей массы тела, перед основными приемами пищи временно добавляли инсулин короткого действия.
Для исключения ночной гипогликемии, а также для решения вопроса о скорости увеличения дозы пролонгированного инсулина перед сном контролировали гликемию в 3 ч ночи. В том случае, если гликемия оказывалась выше 10 ммоль/л, дозу инсулина перед сном сразу же увеличивали на 4 ЕД, в пределах
6 – 10 ммоль/л — на 2 ЕД. Осуществляли ежедневный контроль гликемии натощак и каждые 2 – 3 дня – в 3 ч ночи. У пациентов, длительно пребывавших в состоянии декомпенсации сахарного диабета, во избежание гипогликемии лавировать дозами инсулина при снижении гликемии натощак ниже 10 ммоль/л следует с осторожностью. У данной категории больных трудно прогнозировать полноценный ответ печени с точки зрения своевременной и адекватной продукции глюкозы в случае недостаточного употребления с пищей углеводов или незначительной физической нагрузки. В том случае, если гликемия в 3 ч ночи оказывалась ниже 6,0 ммоль/л, мы рассматривали вопрос о необходимости перемещения пролонгированного инсулина с 22 ч на более раннее время, например, перед ужином.
Описанные мероприятия в виде постепенного увеличения дозы пролонгированного инсулина перед сном производили до того момента, пока гликемия натощак не оказывалась ниже 7,8 ммоль/л.
Другой группе, состоящей из 50 (24,5%) больных, у которых исходно гликемия натощак находилась в пределах 7,8 – 10 ммоль/л, для подавления ночного ГНГ перед сном добавляли сиофор (метформин) в дозе 500 – 850 мг. Противопоказаниями для назначения сиофора являлись клиренс креатинина менее 50 мл/мин, нарушение функции печени (гепатит, повышение печеночных ферментов), гипоксические состояния любой этиологии, злоупотребление алкоголем, беременность и лактация. 12 (5,9%), пациентов мероприятия оказались недостаточными, а у 8 (3,9%) имелись противопоказания для применения сиофора. Этим больным также, как и пациентам предыдущей группы, перед сном был назначен пролонгированный инсулин в дозе 0,1 ЕД/кг фактической массы тела. Дальнейший контроль гликемии и постепенное изменение дозы инсулина соответствовали описанным ранее.
Такую последовательную тактику увеличения дозы инсулина проводили до того момента, когда гликемия натощак стабильно устанавливалась на уровне ниже 7,8 ммоль/л. Этот уровень гликемии натощак, исключающий декомпенсацию заболевания, мы расценивали как первый важный этап достижения компенсации сахарного диабета. Было доказано, что с одной стороны указанная гликемия уже снижает проявление глюкозотоксичности и способствует нормализации секреции инсулина. С другой стороны, при таком уровне гликемии натощак и в 3 ч ночи практически полностью исключается риск развития гипогликемических эпизодов, особенно в самое опасное ночное время.
Следующим важным этапом лечения было решение вопроса об индивидуальных критериях компенсации заболевания у каждого пациента.
Известно, что одним из критериев компенсации ИНСД является гликемия натощак ниже 6,1 ммоль/л. В то же время широко распространено мнение, что у лиц пожилого возраста критерии компенсации могут быть менее жесткими, учитывая опасность возникновения плохо распознаваемых ими гипогликемий. Однако не вызывает сомнения тот факт, что декомпенсация сахарного диабета у лиц старческого возраста активизирует катаболические процессы, предрасполагает к развитию острых и ускоряет прогрессирование поздних осложнений сахарного диабета. Десятилетнее наблюдение за пожилыми больными, страдающими ИНСД, показало, что при декомпенсации заболевания частота инсультов и сердечно-сосудистых заболеваний резко возрастает независимо от длительности заболевания (М. Uusitupa и соавт., 1993). При этом смертность от описанных причин прогрессивно увеличивается при возрастании уровня гемоглобина A1c c 8,7% до 9,1% (J. Kuusisto;
L. Mykkanen; K. Pyorala и соавт., 1994).
Анализ литературных данных и собственный опыт в достижении компенсации заболевания у больных ИНСД позволяют нам утверждать, что независимо от возраста больного приоритетными позициями при выборе критериев компенсации в каждом конкретном случае являются следующие: сохранный интеллект пациента; наличие у него личных средств самоконтроля; ежедневный контроль гликемии и высокий уровень знаний, позволяющий больному принимать правильное решение на основании полученных им при самоконтроле данных. Если больной прежде всего соответствовал перечисленным критериям, а также у него в анамнезе отсутствовали данные о перенесенном ОНМК и нестабильной стенокардии, мы постепенно переходили к следующей цели терапии — установлению уровня гликемии натощак ниже 6,1 ммоль/л. Пути ее достижения полностью соответствуют выше описанным.
Наблюдение за больными показало, что даже при довольно быстром снижении гликемии с явно высоких цифр до значений ниже 10 ммоль/л, пациенты сразу же отмечали положительную динамику в самочувствии. Интересно, что улучшение самочувствия замечали даже те лица, которые исходно не предъявляли явных жалоб, типичных для декомпенсации сахарного диабета, в связи с неспособностью их распознать или правильно охарактеризовать.
После достижения желаемой гликемии натощак приступали к постоянному контролю и коррекции уровня сахара в крови после еды. Такую последовательную тактику подбора адекватной сахароснижающей терапии мы считали абсолютно безопасной и обоснованной. По мере нормализации тощаковой гликемии на фоне обеспечения необходимой инсулинизации организма, снижения ГНГ и липолиза в ночное время постепенно ликвидировалась глюкозотоксичность и уменьшалась ИР. Это, в свою очередь, способствовало улучшению гликемии в течение всего дня и значительно облегчало достижение компенсации в дальнейшем. Попытки одновременно корригировать все сахароснижающие средства, получаемые больным в течение суток, мы считали необоснованными. С одной стороны, абсолютно очевидна необходимость начального достижения близких к норме цифр гликемии натощак. С другой стороны, стремление контролировать сразу все или несколько гликемических “точек” требует частого и систематического контроля уровня сахара, что отрицательно сказывалось на отношении больного к самому процессу самоконтроля и препятствовало концентрации внимания на достижении хотя бы одной поставленной цели терапии.
Результаты работы позволили создать алгоритм лечебных мероприятий по нормализации гликемии в ночные часы.
Неотложные состояния при сахарном диабете
Неотложные состояния при сахарном диабете (СД) различаются по этиологии и патогенезу.
Выделяют следующие клинико-метаболические варианты острых осложнений в диабетологии:
— диабетический кетоацидоз и кетоацидотическая кома,
— гиперосмолярная кома и гиперосмолярное гипергликемическое состояние,
— молочнокислый ацидоз (лактат-ацидоз),
— гипогликемия и гипогликемическая кома.
ДИАБЕТИЧЕСКИЙ КЕТОАЦИДОЗ И КЕТОАЦИДОТИЧЕСКАЯ КОМА
Диабетический кетоацидоз (ДКА) – это критическое, ургентное состояние при СД, которое развивается вследствие абсолютного дефицита инсулина или выраженной относительной инсулиновой недостаточности, при несвоевременной диагностике и лечении, приводящее к развитию кетоацидотической комы с тяжелыми гормонально-метаболическими нарушениями органов и систем. ДКА, как правило, развивается при декомпенсации СД 1 типа, но вместе с тем редко может развиваться и при СД 2 типа. Это имеет подтверждение в исследованиях отечественных и зарубежных авторов (В. В. Потемкин, 2008, А. М. Мкртумян, 2008).
Причиной ДКА является абсолютный дефицит инсулина. Той или иной выраженности ДКА определяется у большинства пациентов на момент манифестации СД-1 (10—20 % всех случаев ДКА).
У пациента с установленным диагнозом СД-1 ДКА может развиться при прекращении введения инсулина, зачастую самим пациентом (13 % случаев ДКА), на фоне сопутствующих заболеваний, в первую очередь, инфекционных, при отсутствии увеличения дозы инсулина (30-40 %).
До 20 % случаев развития ДКА у молодых пациентов с СД-1 связаны с психологическими проблемами и/или нарушениями пищевого поведения (боязнь прибавки веса, боязнь гипогликемии, подростковые проблемы). Достаточно частой причиной ДКА в ряде стран является отмена инсулина самим пациентом из-за дороговизны препаратов для некоторых слоев населения (табл. 7. 11).
Вследствие нарастания кетонемии появляется тошнота, рвота, анорексия. Дефицит инсулина и повышенная секреция контринсулярных гормонов способствует распаду белков (катаболизм – протеолиз) в печени и образованию из них глюкозы в реакциях глюконеогенеза, а также аммиака, мочевины, что приводит к азотемии. Гипергликемия, гиперкетонемия, гиперазотемия приводят к нарушениям водно-электролитного обмена, повышению осмотического диуреза, выведению натрия, калия, фосфора, хлора. При полиурии вначале преобладает выделение натрия, поскольку он содержится во внеклеточной жидкости, а затем позднее присоединяется выход калия из клеток и повышенное его выделение с мочой. Развивается выраженное обезвоживание организма, уменьшается объём циркулирующей крови.
Таким образом, при кетоацидотической коме происходят глубокие метаболические нарушения, декомпенсация углеводного, липидного, белкового, электролитного обмена.
Токсическое воздействие кетоновых тел на клетки центральной нервной системы, угнетение ферментных систем, снижение утилизации глюкозы клетками мозга, кислородное голодание ведёт к нарушению сознания, развитию кетоацидотической комы.
Развитие ДКА в зависимости от вызвавшей его причины может занимать от нескольких недель до суток. В большинстве случаев ДКА предшествуют симптомы декомпенсации диабета, но иногда они могут не успеть развиться. Клинические симптомы ДКА включают полиурию, полидипсию, похудение, разлитые боли в животе («диабетический псевдоперитонит»), дегидратацию, выраженную слабость, запах ацетона изо рта (или фруктовый запах), постепенное помутнение сознания. Истинная кома при ДКА в последнее время в силу ранней диагностики развивается относительно редко. При физикальном обследовании выявляются признаки обезвоживания, тургора кожи и плотности глазных яблок, тахикардия, гипотония. В далеко зашедших случаях развивается дыхание Куссмауля. Более чем у 25% пациентов с ДКА развивается рвота, которая по цвету может напоминать кофейную гущу.
Базируется на данных клинической картины, указаниях на наличие у пациента СД-1, а также данных лабораторного исследования. Для ДКА характерна гипергликемия (в ряде случаев незначительная), кетонурия, метаболический ацидоз, гиперосмолярность.
Лабораторная диагностика острых осложнений сахарного диабета
Эффективная осмо-лярность, мОсм/кг
При обследовании пациентов с острой декомпенсацией СД необходимо определение уровня гликемии, креатинина и мочевины, электролитов, на основании чего производится расчет эффективной осмолярности. Кроме того, необходима оценка кислотно-основного состояния. Эффективная осмолярность (ЭО) рассчитывается по следующей формуле:
2 X [Na+ (мЭкв/л) + глюкоза (ммоль/л) ].
У большинства пациентов с ДКА определяется лейкоцитоз, выраженность которого пропорциональна уровню кетоновых тел в крови. Уровень натрия, как правило, снижен вследствие осмотического оттока жидкости из интрацеллюлярных пространств в экстрацел-люлярные в ответ на гипергликемию. Реже уровень натрия может быть снижен ложноположительно как следствие выраженной гипертриглицеридемии. Уровень калия сыворотки исходно может быть повышен вследствие его перемещения из экстрацеллюлярных пространств.
Базируется на данных клинической картины, указаниях на наличие у пациента СД-1, а также данных лабораторного исследования. Для ДКА характерна гипергликемия (в ряде случаев незначительная), кетонурия, метаболический ацидоз, гиперосмолярность
Лабораторная диагностика острых осложнений сахарного диабета
Эффективная осмо-лярность, мОсм/кг
У большинства пациентов с ДКА определяется лейкоцитоз, выраженность которого пропорциональна уровню кетоновых тел в крови. Уровень натрия, как правило, снижен вследствие осмотического оттока жидкости из интрацеллюлярных пространств в экстрацел-люлярные в ответ на гипергликемию. Реже уровень натрия может быть снижен ложноположительно как следствие выраженной гипертриглицеридемии. Уровень калия сыворотки исходно может быть повышен вследствие его перемещения из экстрацеллюлярных пространств.
Другие причины потери сознания у пациентов с СД. Дифференциальная диагностика с гиперосмолярной комой, как правило, не вызывает затруднений (развивается у пожилых пациентов с СД-2) и не имеет большого клинического значения, т. к. принципы лечения обоих состояний сходны. При невозможности оперативно выяснить причину потери сознания пациента с СД ему показано введение глюкозы, т. к. гипогликемические состояния встречаются значительно чаще, а быстрая положительная динамика на фоне введения глюкозы сама по себе позволяет выяснить причину потери сознаний.
Лечение
Диабетический кетоацидоз, прекоматозное состояние и кома требуют немедленной госпитализации больного для проведения экстренной медицинской помощи. Необходимо срочное определение гликемии, глюкозурии, кетонемии и кетонурии, кислотно-щелочного равновесия, содержания натрия и калия, креатинина, мочевины, клинического анализа крови и мочи, ЭКГ, неврологическое обследование. На догоспитальном этапе или в приемном отделении после определения гликемии, глюкозурии, ацетонурии начинают внутривенно капельно инфузию 0, 9 % раствора хлорида натрия, при выраженной дегидратации до 1 л/час, инсулин короткого действия 20 ЕД в/м. Дальнейшее лечение осуществляют в реанимационном отделении или в отделении интенсивной терапии. Лечение ДКА легкой степени при сохраненном сознании и отсутствии тяжелой сопутствующей патологии можно проводить в эндокринологическом или терапевтическом отделении. В отделении реанимации и интенсивной терапии необходимо проводить мониторинг лабораторных показателей в целях предупреждения осложнений терапии – гипогликемии, гипокалиемии и гипонатриемии. Предлагаются следующие схемы лабораторного мониторинга:
Исследование глюкозы крови 1 раз в час, до снижения гликемии ниже 14 ммоль/л, затем 1 раз в 3 часа
Контроль ацетона мочи и кетоновых тел – 2 раза в первые 2 суток, затем 1 раз в сутки
Фосфор – только у пациентов при недостаточности питания и хроническом алкоголизме
Остаточный азот, мочевина, креатинин сыворотки – исходно и через 3 дня
Гематокрит, газоанализ и рН – 1-2 раза в сутки до нормализации кислотно-основного состояния Терапия ДКА направлена на коррекцию основных патофизиологических нарушений. Основные компоненты лечебных мероприятий при кетоацидотической коме включают: устранение инсулиновой недостаточности, восстановление электролитного баланса и кислотно-основного равновесия, лечение сопутствующих заболеваний, которые могут быть причиной ДКА.
В настоящее время доказана целесообразность режима малых доз инсулина при лечении кетоацидотической комы, так как при введении больших доз инсулина имеется опасность развития гипогликемии, гипокалиемии, отёка мозга. Введение малых, физиологических доз инсулина проводится одновременно с регидратацией. При ДКА проводится внутривенная (в/в) инсулинотерапия в виде длительных инфузий. Для достижения оптимальных концентраций инсулина в крови необходима непрерывная инфузия малых доз инсулина – 0, 1 ЕД/кг/час, 4-10 ЕД инсулина в час (в среднем 6 ЕД/час). Это позволяет снизить липолиз, кетогенез и продукцию глюкозы печенью, таким образом воздействовать на главные звенья патогенеза ДКА. Начальная доза ИКД составляет 0, 15 ЕД/кг массы тела (в среднем 10-12 ЕД) и вводится в/в болюсно. Необходимую дозу инсулина набирают в инсулиновый шприц, добирают 0, 9 % NaCl до 1 мл вводят очень медленно (2-3 мин). Затем переходят на в/в введение ИКД по 0, 1 ЕД/кг/час (5-8 ЕД/час) с помощью инфузомата (первый вариант). Инфузионнную смесь готовят следующим образом: 50 ЕД ИКД+2 мл 20% раствора альбумина или 1 мл крови пациента для предотвращения сорбции инсулина в системе, и доводят общий объем до 50 мл 0, 9% NaCl. При отсутствии инфузомата используется второй вариант инсулинотерапии. С этой целью инфузионный раствор готовят из расчета 100 ЕД ИКД на каждые 100 мл 0, 9% раствора NaCl, концентрации ИКД будет составлять 1 ЕД/мл. Для предотвращения сорбции инсулина необходимо добавить 4 мл 20% альбумина на 100 мл раствора. Недостатком данного метода является трудность в титровании малых доз инсулина 12 по числу капель или мл смеси, а также возможность перегрузки жидкостью. Если инфузомата нет, более удобен в использовании 3 вариант. ИКД вводят в/в болюсно 1 раз в час шприцем в “резинку” инфузионной системы. Пример: в инсулиновый шприц набирают 6 ЕД ИКД, набирают в шприц 2 мл и добирают до 2 мл 0, 9% раствора NaCl и вводят медленно в течение 2-3 минут. Длительность фармакодинамического эффекта ИКД при этом составляет до 60 минут. Преимуществом этого способа введения является отсутствие сорбции инсулина, не нужно добавлять в раствор альбумин или кровь, а также более точен учет и коррекция введенной дозы ИКД. Внутримышечная (в/м) инсулинотерапия проводится при невозможности в/в доступа, в отсутствии нарушений гемодинамики и при легкой форме ДКА. Доза ИКД примерно 0, 4 ЕД/кг, из них половина вводится в/в, половина – в/м, затем введение ИКД осуществляется по 5-10 ЕД/час. Недостатками введения ИКД в/м является снижение его всасывания при нарушении микроциркуляции (коллапс, прекома, кома) и дискомфорт для больного (24 в/м инъекции в сутки). При этом, если через 2 часа после начала в/м введения ИКД гликемия не снижается, необходимо переходить на в/в введение. Скорость снижения гликемии при лечении ДКА должна быть не более 4 ммоль/час. Более резкое снижение гликемии создает опасность обратного осмотического градиента между внутри- и внеклеточным пространством, осмотического дисбаланса и отека мозга. В первые сутки не следует снижать гликемию ниже 13 ммоль/л. При отсутствии снижения гликемии в первые 2-3 часа следует провести коррекцию дозы инсулина – удвоить следующую дозу ИКД до 0, 2 ЕД/кг и проверить адекватность гидратации. Если снижение гликемии составило около 4 ммоль/л в час или достигнуто снижение гликемии до 14-15 ммоль/л, необходимо уменьшить следующую дозу ИКД вдвое (0, 05 ЕД/кг), примерно 2-4 ЕД/час. При снижении гликемии ниже 4 ммоль/час рекомендуется пропустить следующую дозу ИКД и продолжить ежечасно определять гликемию. После улучшения 13 состояния, стабилизации гемодинамики, уровень гликемии не более 11-12 ммоль/л и рН>7, 3 переходят на п/к введение ИКД каждые 4-6 часов с коррекцией дозы в зависимости от гликемии в сочетании с инсулином продленного действия 1-2 раза в сутки с начальной дозы 10-12 ЕД.
Адекватная регидратация восполняет не только водный и электролитный дефицит, но и приводит к снижению гликемии, улучшает периферическую гемодинамику и почечный кровоток. При исходно нормальном уровне натрия (менее 145 мэкв/л) для регидратации применяется изотонический (0, 9%) раствор хлорида натрия, при гипернатриемии (>150 мэкв/л) используют гипотонический раствор NaCl. Скорость регидратации составляет 1 литр в 1-й час (с учетом жидкости, введенной на догоспитальном этапе), затем по 0, 5 л во 2-й и 3-й час, по 0, 25-0, 5 л в последующие часы. Скорость регидратации корректируется в зависимости от показателей центрального венозного давления и клинической картины. Объем вводимой за час жидкости не должен превышать часовой диурез более чем на 500-1000 мл. Общее количество жидкости, введенной в первые 12 часов терапии, не должно превышать 10% массы тела.
При достижении уровня глюкозы крови 13-14 ммоль/л, переходят на введение 5-10% раствора глюкозы.
Восстановление электролитных нарушений
Важным разделом терапии кетоацитодической комы является коррекция электролитных нарушений. Развитие дефицита калия в организме, снижение его внутриклеточного содержания при кетоацитодической коме обусловлено повышенной экскрецией калия с потом, вследствие осмотического диуреза. Инсулиновая терапия, регидратация, снижение гликемии, уменьшение ацидоза способствуют поступлению калия в клетку вместе с глюкозой, в обмен на ионы водорода. Явления гипокалиемии проявляются обычно через 3-4 часа после начала инсулинотерапии и введения жидкости, при тенденции к нормолизации рН. Развитие гипокалиемии может приводить к тяжелым осложнениям со стороны сердечно-сосудистой системы – тахикардия, снижение АД, нарушения ритма; дыхательной системы, а также атонии желудка, кишечника, мочевого пузыря. Если уровень К+ плазмы неизвестен, в/в инфузию калия начинают не позднее, чем через 2 часа после начала инсулинотерапии, под контролем ЭКГ и диуреза. В/в инфузию калия начинают одновременно с введением инсулина по следующей схеме: