гиперденсивное включение что это такое
Некоторые аспекты диагностики фокальной нодулярной гиперплазии печени (фибронодулярной гиперплазии)
УЗИ сканер HS60
Профессиональные диагностические инструменты. Оценка эластичности тканей, расширенные возможности 3D/4D/5D сканирования, классификатор BI-RADS, опции для экспертных кардиологических исследований.
Еще сравнительно недавно фокальная нодулярная гиперплазия печени (ФНГ) относилась к редким (3%) объемным образованиям печени. Однако, учитывая применение современных методов визуализации, в настоящее время ФНГ занимает 3-е место среди доброкачественных образований печени после гемангиомы и аденомы [8, 10, 14].
Согласно морфологической классификации опухолей печени, ФНГ относится к опухолеподобным процессам и характеризуется гиперплазией печеночной паренхимы, разделенной на узлы фиброзными прослойками в виде звездчатого рубца [14]. Гиперпластические узлы без четких границ переходят в окружающую ткань, не сдавливая ее. Опухоль состоит из гепатоцитов, элементов желчных протоков, купферовских клеток и фиброзной ткани.
ФНГ развивается в любом возрасте, одинаково часто у лиц разного пола. В то же время имеются данные о том, что подобные новообразования чаще диагностируются у женщин (в 82,2% случаев) [10, 17].
Макроскопически очаговая узловая гиперплазия представляет собой мягкоэластичный, четко ограниченный, иногда инкапсулированный узел серовато-коричневого цвета размером от 0,5 до 6 см. Узлы могут быть как одиночными, так и множественными и располагаться в периферических отделах правой (чаще) и левой доли. Иногда узлы заметно выбухают на поверхности печени, в редких случаях они имеют ножку. Узлы имеют дольчатую структуру с наличием фиброзных прослоек, отходящих, как правило, от центрально расположенного рубца.
При микроскопическом исследовании узлов определяют нормальные гепатоциты, содержащие гликоген и формирующие трабекулярные структуры. Местами наблюдается полиморфизм величины и формы зрелых гепатоцитов, они образуют синцитий. В центре печеночной доли, как правило, располагается центральная вена, имеются синусоиды, выстланные купферовскими клетками (звездчатые ретикулоэндотелиоциты). Портальные прослойки сформированы правильно, достаточно деликатны. В зоне звездчатого рубца и по ходу стромы располагаются сосуды. Сосу дис тый компонент весьма разнообразен как по содержанию (венозные, толстостенные артериальные сосуды с миксоматозной дегенерацией среднего слоя), так и по форме (гемангиоматоз). По ходу портальных септ определяются пролиферирующие желчные протоки, единичные мелкие узлы регенерации и лимфоплазмоцитарные инфильтраты. Эти признаки служат основными дифференциально-диагностическими критериями, позволяющими отличить ФНГ от печеночно-клеточной аденомы [17].
Выделяют 2 типа ФНГ: классическая и неклассическая. При классическом типе выделяют все 3 признака: аномальная нодулярная структура, извилистые толстостенные сосуды, гиперплазия желчных протоков. Центральный рубец присутствует в 65% наблюдений. Он всегда содержит измененные сосуды разного калибра: большие извилистые артерии с гипертрофией интимы и медии, крупные и мелкие вены, капилляры. При неклассическом типе отсутствует один из двух признаков (нодулярная структура или измененные сосуды), но гиперплазия протоков есть всегда. Централь ный рубец отсутствует. В свою очередь неклассический тип делится на 3 подтипа: телеангиэктатический (склонный к кровотечениям), аденоматозный и ФНГ с клеточной атипией.
Опухоль в большинстве случаев (66,7-80,8% пациентов) не проявляет себя клинически и может быть случайно обнаружена при проведении ультразвукового исследования (УЗИ) по иному поводу [18]. Специфичные лабораторные симптомы отсутствуют. ФНГ не озлокачествляется и край не редко вызывает осложнения в виде внутрибрюшного кровотечения.
Ультразвуковая картина ФНГ
Так, при УЗИ в В-режиме вид ФНГ неспецифичен и вариабелен. Чаще всего ФНГ печени выглядит как единичное очаговое образование с нечеткими или четкими, ровными или неровными контурами, несколько неоднородное по своей внутренней структуре, без капсулы. В 80% случаев (рис. 1) очаг изоэхогенный или гипоэхогенный [3, 8, 9, 11-14].
а) В-режим. В IV сегменте печени, выходя на контур печени, деформируя его, визуализируется тканевой плотности гипоэхогенное, несколько неоднородное по эхоструктуре образование размерами 50 х 40 мм, неправильной формы, с четкими ровными контурами.
Системный подход — солидные образования почки
Большинство образований почки встречаются в практике, как случайные находки, из которых часть является почечно-клеточная карцинома. Задачей диагностики является дифференцировка доброкачественного и злокачественного образований почки, хотя во многих случаях это не представляется возможным.
В данной статье рассмотрены радиологические находки характерные для доброкачественных и злокачественных образований почки.
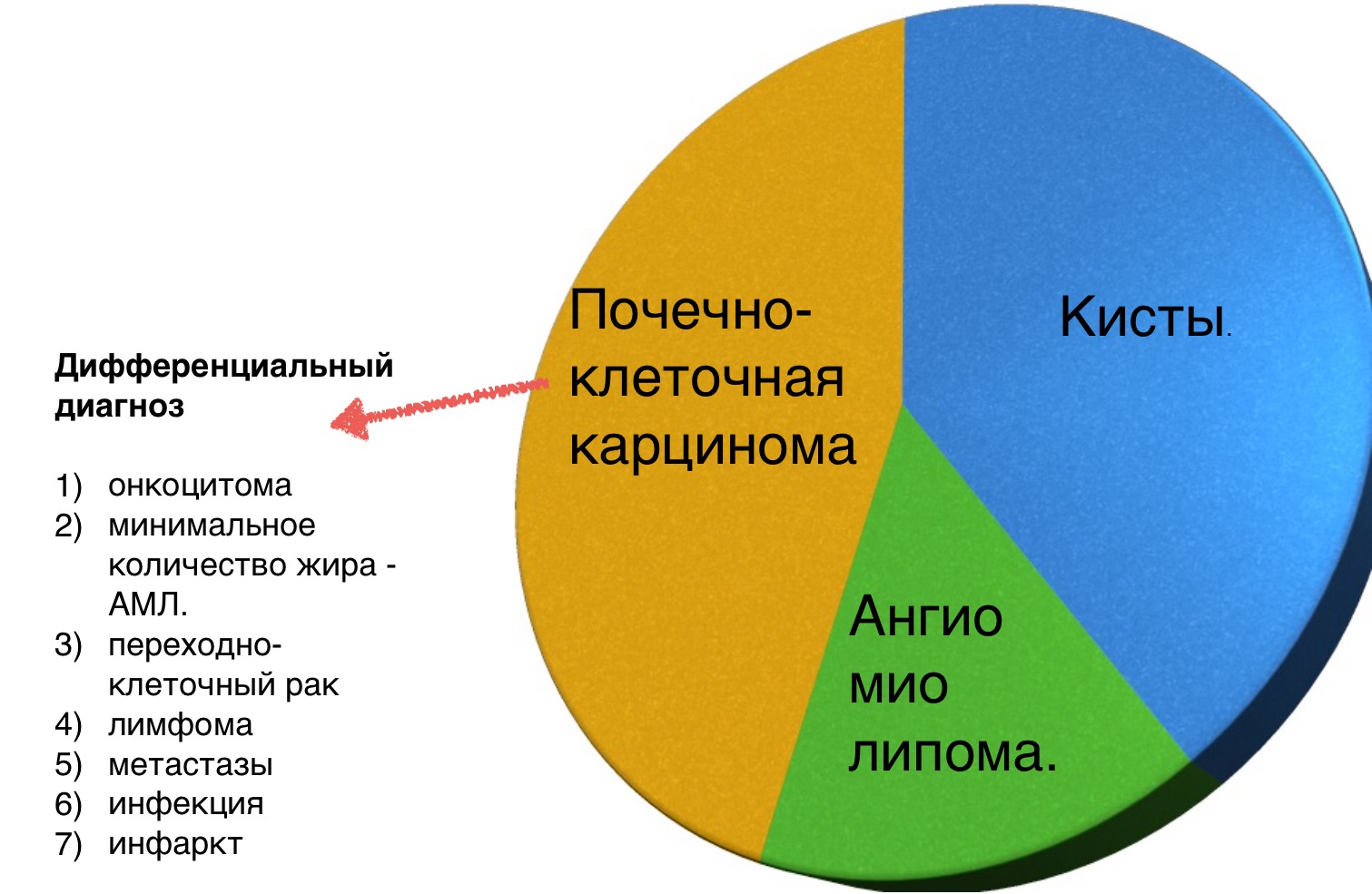
Алгоритм анализа при выявлении образования почки:
Вы еще много раз столкнетесь с тем, что после выполнения данного алгоритма вы не придете к окончательному диагнозу, а на первом месте дифференциального ряда — почечно-клеточная карцинома.
Затем оцените КТ и МРТ-изображения и ответьте на вопрос, что больше соответствует доброкачественному образования почки, а что злокачественному выделив из этой группы признаки низкодифференцируемой опухоли и высокодифференцируемой почечно-клеточной карциномы.
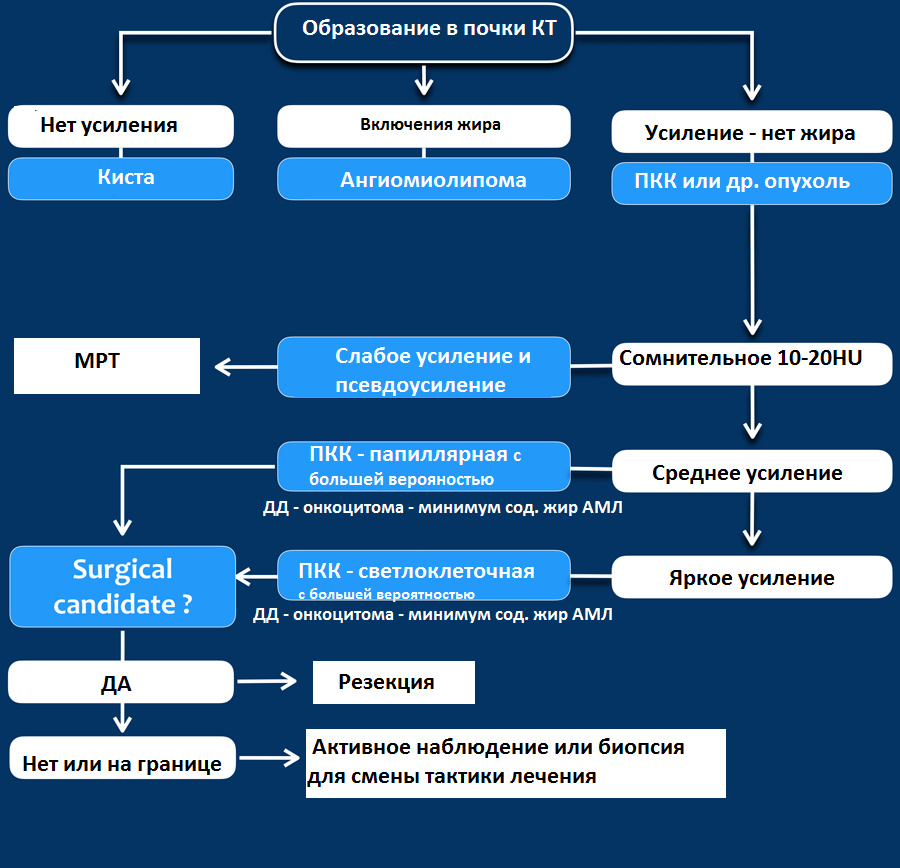
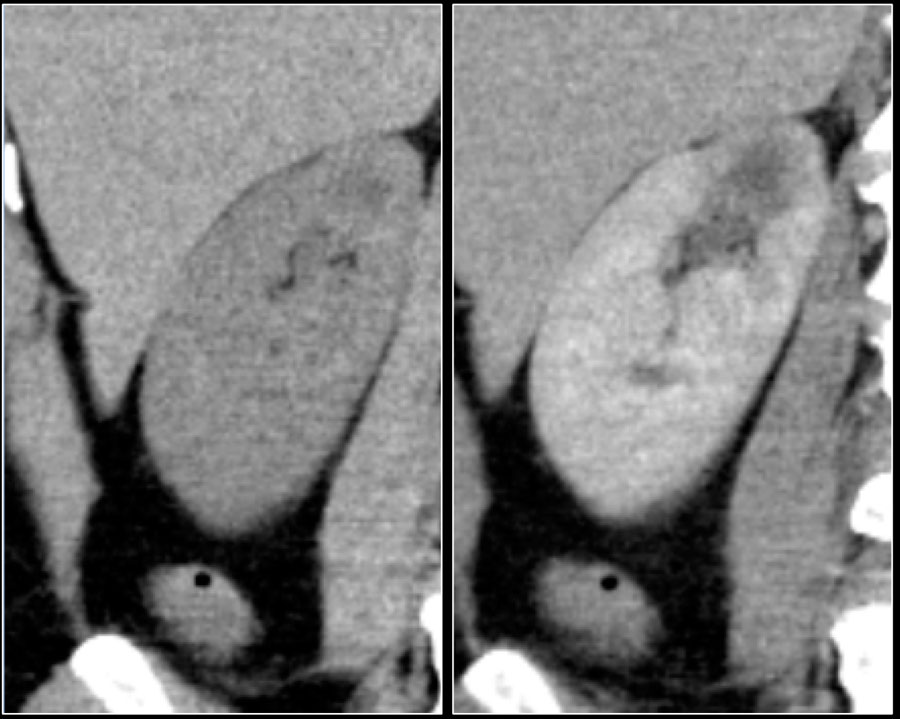
Гиперденсное образование на бесконтрасном КТ.
Образование с плотностью выше 70HU на нативном (бесконтрастном) КТ-изображении является геморрагическая киста. Геморрагические кисты также могут быть с плотностью ниже, чем 70HU, но в данном случае должен осуществлен контроль за образованиями на пост-контрастных изображениях. Если на пост-контрастных изображениях отсутствует контрастное усиление, то, следственно, подтверждается кистозное происхождение образование.
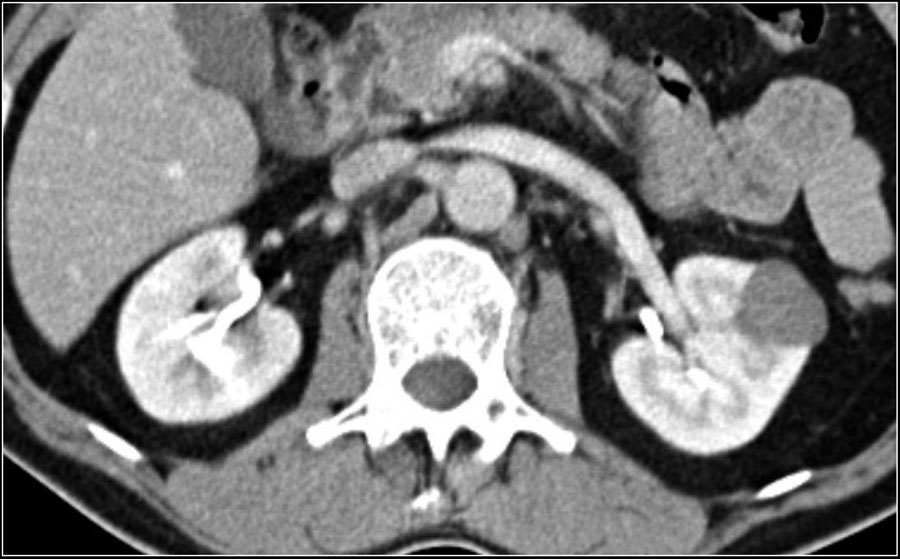
Макроскопическое включение жира в образовании почки плотностью 20HU явный признак ангиомиолипомы. Тонкие срезы лучше при исследовании плотности. К сожалению 5% ангиомиолипом макроскопический жир не содержат. КТ-картина данных ангиомиолипом неотличимо схожа с почечно-клеточной карциномой. Как ни странно, но почечно-клеточная карцинома в некоторых случаях также содержит жир. При включениях жира и кальцификатов в образование почки дифференциальный диагноз должен склонятся в сторону почечно-клеточной карциномы.
Сомнительное усиление на 10-20HU псевдо-усиление в кисте, как результат увеличения жесткости излучения. МРТ в данных случаях является отличным методом в дифференциальном диагнозе. Сомнительное усиление также характерно для папиллярной карциномы почки, для которой характерно слабое усиление и которая менее агрессивная опухоль, чем светлоклеточная карцинома.
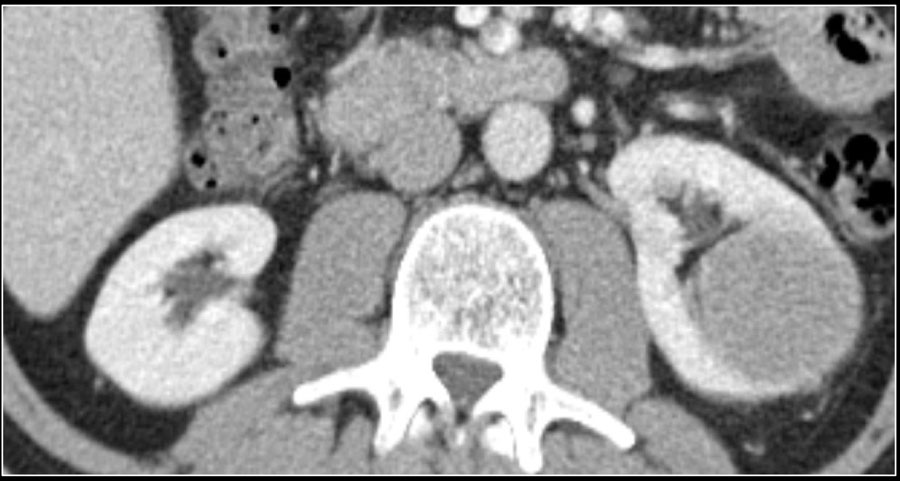
Гомогенное усиление, а также ослабление (> 40 HU) на нативных снимках в большей степени характерны для ангиомиолипомы с малым содержанием жира, хотя почечно-клеточную карциному нельзя также исключать.
Сильное усиление визуализируется при светло-клеточной карциноме, ангиомиолипомах с малым содержанием жира и онкоцитомах. Светло-клеточная карцинома встречается чаще, чем онкоцитома и ангиомиолипома с малым содержанием жира, поэтому диагноз карциномы ставится чаще в особенности в тех случаях, когда образование гетерогенное и больших размеров.
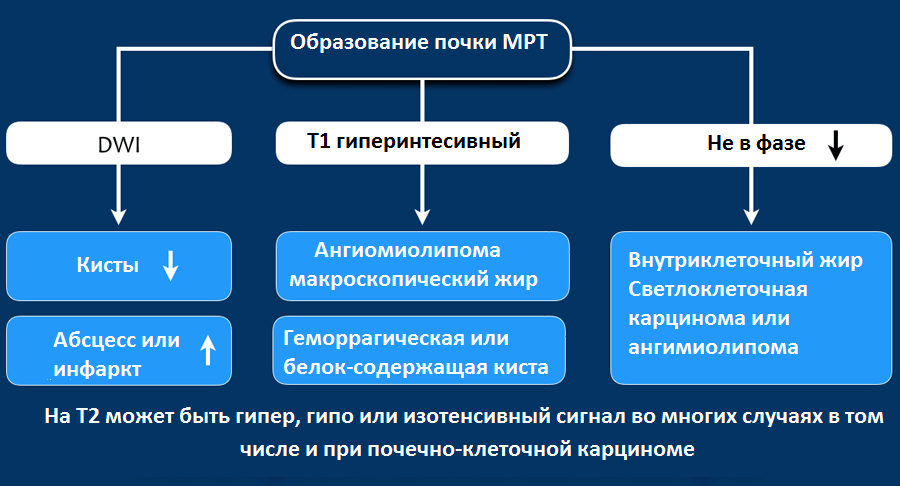
МРТ при образованиях почки
Гиперинтенсивный сигнал на Т1-взвешенных изображениях, как правило, визуализируется при геморрагических кистах или кистах с белковым содержимым, а также при ангимиолипомах, содержащие макроскопический внеклеточный жир.
Если жир внутри клетки, то на Т1-изображениях не будет гиперинтенсивного сигнала, сигнал будет снижаться на out-phase изображениях, что не характерно для ангимиолипомы, а типичнее для светлоклеточной карциномы почки.
На Т2 гипоинтенсивный сигнал характерен в большей степени для папиллярной карциномы почки и в меньшей степени для ангиолипомы с малым содержанием жира.
На Т2 гиперинтенсивный сигнал характерен для светлоклеточной карциномы, но признак не является специфичным, потому как схожие изменения и при онкоцитомах.
По данным МРТ изображений также трудно, как и по данным КТ изображений сказать однозначно о доброкачественности и злокачественности процесса.
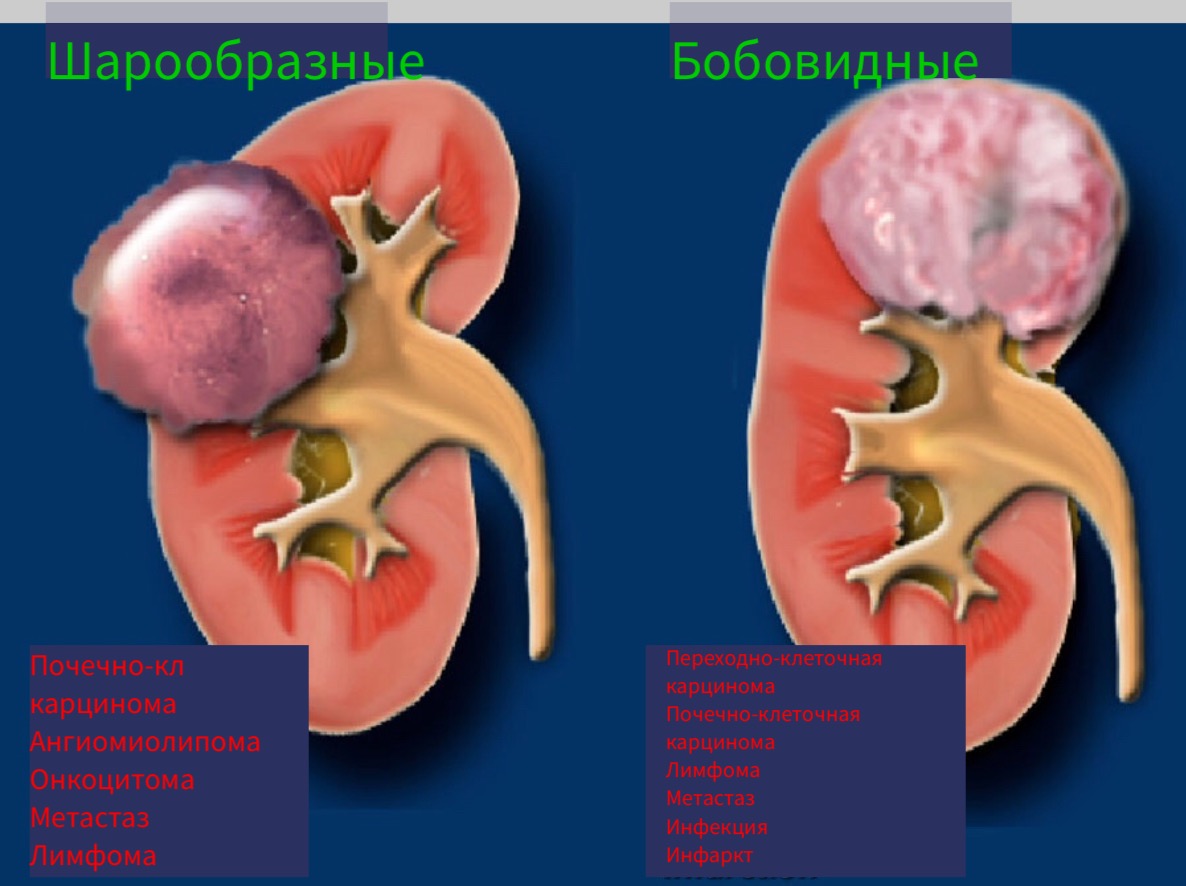
Размер и форма образования.
Шарообразные образования являются наиболее распространёнными образованиями почки. Данные образование чаще обширные деформирующие контур органа. Типичные представители шарообразных образований являются онкоцитома и почечно-клеточная карцинома.
Бобовидные образования не деформируют контур почки и «встроены» в паренхиме органа.
Бобовидные образования более трудно обнаружить и обычно не визуализируются на КТ без контраста.
Обратите внимание, что существует много подводных камней в дифференциальной диагностике шарообразных и бобовидных образований.
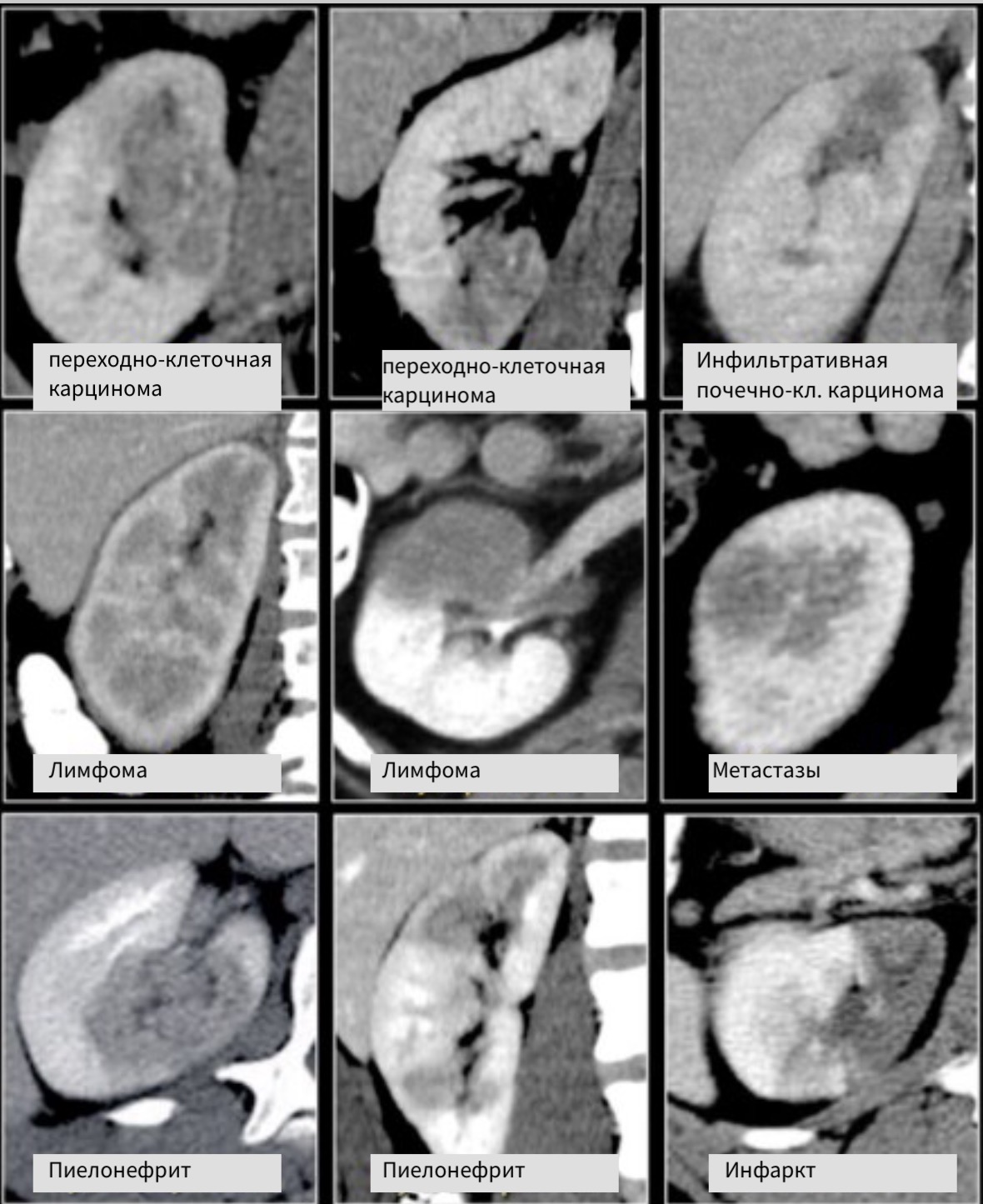
Бобовидные образования.
Радиологические признаки образований бобовидной формы обычно не специфичны. Данное явление заметно если обратить внимание на схожесть образований, представленных на рисунке. Дифференциальный диагноз обычно строят, исходя из клинических данных и, соответственно, данных визуализации.
Инфильтрирующее почку по центру образование у пожилого пациента соответствует переходно-клеточному раку почки. Инфильтрирующее почку по центру образование у молодого пациента с серповидной перегородкой внутри больше соответствует медуллярной карциноме почки. Мультифокальные и билатеральные или диффузные образования почки в сочетании с лимфоаденопатией, а также с вовлечением в патологический процесс других органов характерны для лимфомы.
Мультифокальные и двусторонние поражения почек характерны для злокачественных образований, в частности для метастазирования. У пациентов с клиникой характерной при инфекции, конечно же, в первую очередь нужно подозревать пиелонефрит. Для инфаркта почки характерно клиновидное поражение почки.
Размер образования.
Размер опухоли является наиболее важным показателем злокачественности опухоли вместе с гистологической оценки дифференцировки образования.
Риск возникновения метастазов зависит от размера опухоли.
Если размер опухоли меньше 3 см риск метастазирования незначительна.
Большинство образований почки в размере обычно меньше, чем 4 см. Многие из данных образований низкодифференцированная почечно-клеточная карцинома, безболезненно протекающие злокачественные или доброкачественные образования.
Образования размером от 1 до 2 см, которые удалили хирургически, в 56% доброкачественные образования. 13% образований размером от 6 до 7 см только являются доброкачественные.
Почечно-клеточный рак. Светлоклеточная карцинома почки.
Почечно-клеточная карцинома является типичным шарообразным образованием. Почечно-клеточная карцинома является случайной находкой выявленная у пациентов, обратившихся с жалобами не связанными с патологии мочевыделительной системы.
Пик заболеваемости 60-70 лет. Почечно-клеточная карцинома связана с наследственными синдромами такими, как синдром Хиппель-Линдау, туберозным склерозом и Бирт-Хогг-Дубе.
Самый распространённый подтип почечно-клеточной карциномы является светло-клеточная карцинома почек, затем папиллярная и хромофобная почечно-клеточная карцинома. Медуллярная и кистозных многокамерная почечно-клеточная карцинома встречается крайне редко.
Светло-клеточная карцинома почек составляет 70% случаев рака почек.
Данная опухоль чаще больших размеров и прорастает из почечной коры. Светло-клеточная карцинома является гиперваскулярным образованием с неоднородным содержимым, как следствие некроза, кровоизлияний, кальцинирования или образование внутри кист. В редких случаях почечно-клеточная карцинома содержит внеклеточный жир, соответственно, образование с включением жира и кальцинатов следует рассматривать, как почечно-клеточную карциному.
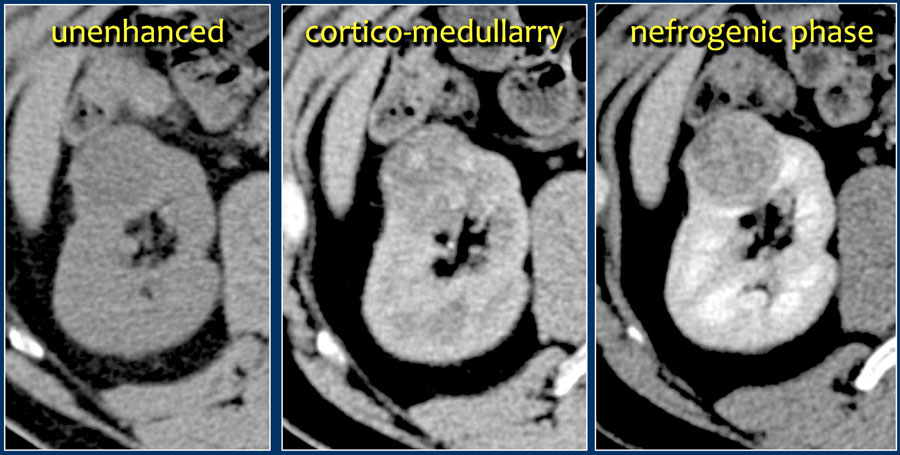
Характерной особенностью светлоклеточной карциномы явлечётся значительное усиление в кортикомедуллярную фазу.
Хотя трудности бывают, когда образование небольших размеров и локализуется в почечной коре, которая также хорошо контрастируется.
Поэтому нефрографическая фаза при образованиях такой локализации и размеров является для оценки наиболее важной так, как паренхима контрастируется гомогеннее и сильнее, чем опухоль, что хорошо заметно на ниже приведённых изображениях.
На МРТ светло-клеточная карцинома визуализируется, как гипоинтенсивное образование на Т1 и гиперинтенсивное на Т2. Как правило, почечно-клеточная карцинома не имеет экстрацеллюлярного жира, что, соответственно, отличает её от ангиомиолипомы. Хотя в 80% случаях светло-клеточной карциномы есть внутриклеточный жир, что приводит к снижению сигнала на Т1 opposed-phase в сравнении с in-phase изображениями. В данных ситуациях не стоит делать вывод о том, что жир внеклеточный, который характерен в большей степени для ангиомиолипомы. Болезнь Фон-Гиппель-Линдау ассоциирована с развитием светло-клеточной карциномы почек, чаще мультифокальной и билатеральной. Пациенты со светло-клеточной карциномой имеет 5-летнюю выживаемость, что является прогнозом хуже, чем у пациентов с папиллярной и хромофобной карциномой.
Порядка 5% всех светло-клеточных карцином имеют инфильтративный характер роста. Несмотря на то, что это лишь небольшая часть от всех почечно-клеточных карцинома, нельзя забывать про них при построении дифференциального ряда бобовидных образований почки с инфильтративным типом роста. Почечно-клеточные карциномы с инфильтративным типом роста являются агрессивными и гиперваскулярными, которые изменяют внутреннюю архитектуру почек, но не наружные контуры, а изменения лоханки схожи с изменениями при переходно-клеточном раке почки.
Папиллярная почечно-клеточная карцинома
Папиллярная почечно-клеточная карцинома встречается в 10-15% случаях от всех случаев почечно-клеточных карцином. Данные образования чаще гомогенные и гиповаскулярные, поэтому схожи с кистами. В отличии от светло-клеточной карциномы при контрастировании разница плотности образования до и после контрастирования составляет всего 10-20HU. Папиллярные почечно-клеточные карциномы больших размеров могут быть гетерогенными, в следствии геморрагий, некрозов и кальцификатов.
На МРТ данные образования на Т1 дают от изо- до гипотенсивный сигнал и на Т2 гипоинтенсивный. Включения макроскопического жира встречается чаще с кальцификатами.
Образования обычно билатеральные и мультифокальные, что в свою очередь намного чаще встречается в сравнении с другими почечно-клеточными карциномами. 5-летняя выживаемость составляет 80-90%.
Хромофобная почечно-клеточная карцинома
5% от почечно-клеточных карцином типа хромофобная ПКК.
Это твердое, резко ограниченное и иногда с дольчатым строением образование.
Данное образование имеют схожее строение с онкоцитомой так, как в центре визуализируется перегородка или паттерн с радиальным строением, поэтому её невозможно отличить от онкоцитомы при визуализации, хотя и при гистологии тоже сложно.
При контрастировании хромофобная почечно-клеточная карцинома чаще однородная и менее интенсивная, чем светло-клеточная почечная карцинома при контрастировании.
Прогноз хромофобной ПКК схожий с прогнозом папиллярной ПКК и равен 5-летней выживаемости в 80-90% случаях.
Синдром Бёрта — Хога — Дьюба (англ. Birt–Hogg–Dubé syndrome) — редко встречающееся аутосомно-доминантное генетическое заболевание, обусловленное мутацией в гене FLCN и проявляющееся развитием доброкачественных опухолей волосяного фолликула (фиброфолликулом), кистами в лёгких и повышенным риском возникновения рака почки (хромофобная почечной карциномы) и рака толстого кишечника.
Стадирование почечно-клеточной карциномы.
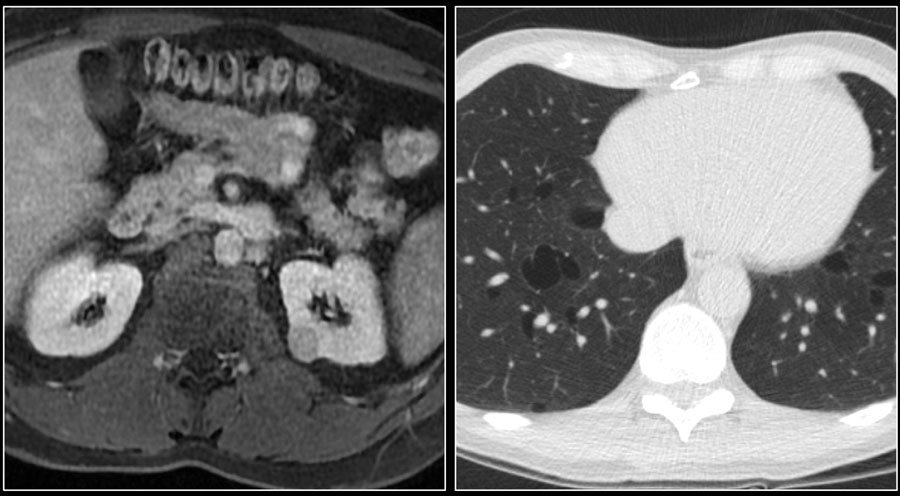
Почечно-клеточная карцинома может распространяться на почечную фасцию и надпочечники, в почечную вену, полую вену.
Для хирурга при планировании операции важно знать, если тромб в нижней полой вене. Это важно в ситуациях, когда тромб поднялся выше диафрагмы, тогда необходимо планирование манипуляций вместе с торакальным хирургом.
Ниже представлен пациент с Т4-стадией почечно-клеточной карциномы.
Образования надпочечников: тактика ведения
Частота выявления новообразований надпочечников постоянно возрастает, их распространенность составляет 1-10%. Хотя в каждом случае необходимо выявить гормональную активность и злокачественный потенциал, большая часть из них представлена гормонально неакти
Abstract. Detection of adrenal neoplasms frequency is increasing constantly, their estimated at 1 to10%. Although in each case it is necessary to identify hormonal activity and malignant potential, most of them are represented by hormone inactive and benign adenomas. Approximately a fifth of the adrenal formations after further verification are hormone-active or carcinomas that require surgical treatment. The main goal of imaging studies in adrenal incidentalomas is the timely detection of malignant tumors; to determine the characteristics of neoplasms, computed tomography, magnetic resonance imaging and, if necessary, a number of radioisotope studies are used. The size of the lesion detected on computed tomograms exceeding 4-6 cm, its uneven edge or heterogeneity of the structure, an attenuation coefficient of 10 Hounsfield units or higher with a non-contrast study, washout of the contrast agent after 10 or 15 minutes by less than 40%, calcification and invasion in the surrounding tissues suggest the malignancy of the adrenal gland lesion, the likelihood of this increases with a combination of these signs. The developed visualization methods and laboratory evaluation allow to assess their morphological structure and functionality with high confidence. The principles of monitoring the growth and hormonal activity of adrenal formations had been currently developed, but the aspects of the long-term dynamic monitoring remain poorly understood. For citation: Morgunov L. Yu. Аdrenal tumors: management tactics // Lechaschy Vrach. 2020; 12 (23): 18-23. DOI: 10.26295/OS.2020.98.90.004
Резюме. Частота выявления новообразований надпочечников постоянно возрастает, их распространенность составляет 1-10%. Хотя в каждом случае необходимо выявить гормональную активность и злокачественный потенциал, большая часть из них представлена гормонально неактивными и доброкачественными аденомами. Примерно пятая часть образований надпочечников после дальнейшей верификации представляет собой гормонально активные или карциномы, требующие оперативного лечения. Основная цель визуализирующих исследований при инциденталомах состоит в своевременном выявлении злокачественных опухолей; для определения характеристик новообразований используют компьютерную томографию, магнитно-резонансную томографию и при необходимости ряд радиоизотопных исследований. Размер выявленного на компьютерных томограммах образования, превышающий 4-6 см, его неровный край или неоднородность структуры, коэффициент ослабления 10 единиц Хаунсфилда или выше при неконтрастном исследовании, вымывание контрастного вещества через 10 или 15 минут менее чем на 40%, кальцификация и инвазия в окружающие ткани предполагают злокачественность поражения надпочечников, вероятность этого повышается при сочетании данных признаков. Разработанные методы визуализации и лабораторная оценка с большой достоверностью позволяют судить об их морфологической структуре и функциональности.
В настоящее время разработаны принципы наблюдения за ростом и гормональной активностью образований надпочечников, однако вопросы длительного динамического наблюдения за ними остаются малоизученными.
Образования надпочечников, случайно обнаруженные при визуальном исследовании, выполненном по причинам, не связанным с их патологией, носят название инциденталом (ИН). Как правило, образования менее 1 см не именуются ИН, и дополнительные диагностические тесты рекомендуются лишь для объемных процессов, превышающих данный размер, при отсутствии клинических симптомов гормональной активности. Быстрое развитие технологий визуализации в последние годы существенно повысило шансы на их обнаружение.
Распространенность ИН составляет от 1% до 8,7% [1] и увеличивается с возрастом, гендерные различия отсутствуют. Например, в стационары Италии ежегодно госпитализируются около 1 450 000 пациентов, у 58 000 из них выявляются ИН [2]. N. Unger (2019) полагает, что распространенность ИН несколько выше – около 3% и увеличивается до 10% у пожилых людей; у 15% пациентов с ИН выявляются признаки их гормональной активности [3]. Хотя данная патология встречается достаточно редко, ее клиническое и экономическое бремя представляется весомым, а вопросы длительного динамического наблюдения пока остаются без ответа.
11-20% выявляемых образований надпочечника являются гормонально активными; с самым высоким риском смертности ассоциированы феохромоцитомы, поэтому их наличие требуется исключить в первую очередь. В 80% случаев в надпочечниках выявляются гормонально неактивные и доброкачественные образования, в то время как распространенность феохромоцитомы составляет от 3,0% до 6,0% адренокортикальной карциномы – от 2,0% до 5,0%. Надпочечник – место метастазирования различных видов рака, встречающихся в 1-2% случаев [4, 5].
Если у пациента ранее выявлялись злокачественные опухоли иной локализации, вероятность того, что ИН окажется метастазом рака, составляет почти 50%. По данным J. T. Lenert с соавт. (2001), адренокортикальная карцинома встречается в 4-5% случаев, но прогноз неблагоприятен из-за частого ее выявления в далеко зашедшей стадии, а ее рецидив является достаточно распространенным явлением. В надпочечник часто метастазирует рак легких, почек, толстой кишки, молочной железы, пищевода, поджелудочной железы, печени или желудка, а сами метастазы нередко бывают двусторонними [6]. Метастатические поражения, как правило, неоднородны по структуре, имеют края неправильной формы и являются двусторонними в 10-15% случаев [7].
Национальное многоцентровое исследование, проведенное по инициативе министерства здравоохранения, труда и социального обеспечения Японии в период с 1999 по 2004 г., включало 3672 случая ИН у 1874 мужчин и 1738 женщин; средний возраст 58,1 ± 13,0 лет. Средний размер ИН составил 3,0 ± 2,0 см; диаметр образований оказался значимо большим у пациентов с верифицированными адренокортикальными карциномами, феохромоцитомами, развернутым синдромом Кушинга, миелолипомами, метастазами рака, кистами и ганглионевромами (p 10 ЕХ) (69%) выполнялась повторная визуализация. 105 врачам первичного звена, чьи пациенты включались в исследование, была разослана стандартизированная анкета, состоящая из 16 вопросов. Большинство специалистов первичного звена полагали, что подавляющей части пациентов с ИН и отсутствием клинической симптоматики не требуется гормональная оценка (71%) или последующее наблюдение (72%). Проведенное исследование демонстрирует необходимость междисциплинарного подхода к наблюдению пациентов с ИН путем взаимодействия между эндокринологами, хирургами и врачами общей практики [38].
Европейское общество эндокринологии (ESE) опубликовало рекомендации по ведению пациентов с ИН (2017), которые полагают возможным воздержаться от повторного гормонального исследования у пациентов с ИН с нормальным уровнем гормонов при первоначальной верификации образования. Рекомендации ESE также полагают нецелесообразным выполнять повторную визуализацию при размерах образования менее 4 см и явных признаках доброкачественности. Однако на сегодняшний день не существует достаточных доказательств, подтверждающих нецелесообразность динамического биохимического и морфологического наблюдения у пациентов с ИН даже при изначально выявленных доброкачественных и гормонально неактивных образованиях надпочечников, поэтому желательно оценивать структурные признаки и уровень гормонов по крайней мере в течение 5 лет [39].
Обобщая рекомендации, предложенные Американской ассоциацией клинических эндокринологов, Американской ассоциацией эндокринных хирургов, Национальным институтом здоровья США, J. M. Lee с соавт. (2017) свидетельствуют о том, что при наличии образования менее 4 см требуется КТ-визуализация через 6 месяцев, не превышающая в дальнейшем 2 лет, а также проведение гормональных тестов – ежегодно в течение 4-5 лет [40].
Клинические рекомендации Российской ассоциации эндокринологов ориентируют на нецелесообразность динамического наблюдения при низкоплотных гормонально неактивных опухолях по данным первичной КТ, в этих случаях также не показан мониторинг гормональной активности. Исключение составляют новые клинические проявления (появление или клиническое прогрессирование артериальной гипертензии, сахарного диабета, ожирения, остеопороза), о чем необходимо предупредить пациента. При неопределенном злокачественном потенциале образования требуется контроль размеров через 3-6 мес, а при увеличении максимального размера опухоли за короткий период на 5 мм или росте объема опухоли на 20% необходимо рассмотреть вопрос об оперативном лечении. При наличии ССК показан ежегодный контроль уровня кортизола и мониторинг коморбидных состояний (артериальной гипертензии, сахарного диабета, ожирения, остеопороза) [41].
Тем не менее круг заболеваний, могущих являться потенциальными предикторами появления гормональной активности ИН, настолько широк, что сводит на нет ограничения к проведению дополнительных визуализирующих и лабораторных исследований в динамике. Так, распространенность артериальной гипертензии среди населения РФ достигает 39,7% [42]. Реальная численность пациентов с СД в РФ составляет не менее 9 млн человек и во всем мире возросла более чем в 2 раза за последние 10 лет [43]. Распространенность ожирения среди россиян с возрастом линейно возрастает у мужчин с 14,3% до 36,3%, а у женщин – с 10,7% до 52,3% [44]. Остеопорозом в России страдают не менее 14 млн человек (10% населения страны), еще у 20 млн граждан России имеет место остеопения [45].
Таким образом, тактика в отношении диагностики, наблюдения и ведения пациентов с новообразованиями надпочечников у разных исследователей практически одинакова. Вопросы лечения пациентов со злокачественными и гормонально активными образованиями решены, но результаты длительного наблюдения за больными с доброкачественными ГНОН пока отсутствуют. Темой для дискуссий остается специальность врача, обеспечивающего дальнейшее наблюдение за пациентом (эндокринолог, врач общей практики, онколог, хирург). Вероятно, создание единого регистра больных с образованиями надпочечников даже в пределах крупного мегаполиса позволит определиться с периодом их наблюдения и тактикой дальнейшего ведения.
Литература/References
Л. Ю. Моргунов, доктор медицинских наук, профессор
ФГАОУ ВО РУДН, Москва, Россия
Образования надпочечников: тактика ведения/ Л. Ю. Моргунов
Для цитирования: Моргунов Л. Ю. Образования надпочечников: тактика ведения // Лечащий Врач. 2020; 12 (23): 18-23. DOI: 10.26295/OS.2020.98.90.004
Теги: новообразования, аденома, карцинома, злокачественная опухоль