гидролиз что это такое понятными словами
Гидролиз
По катиону, по аниону или нет гидролиза?
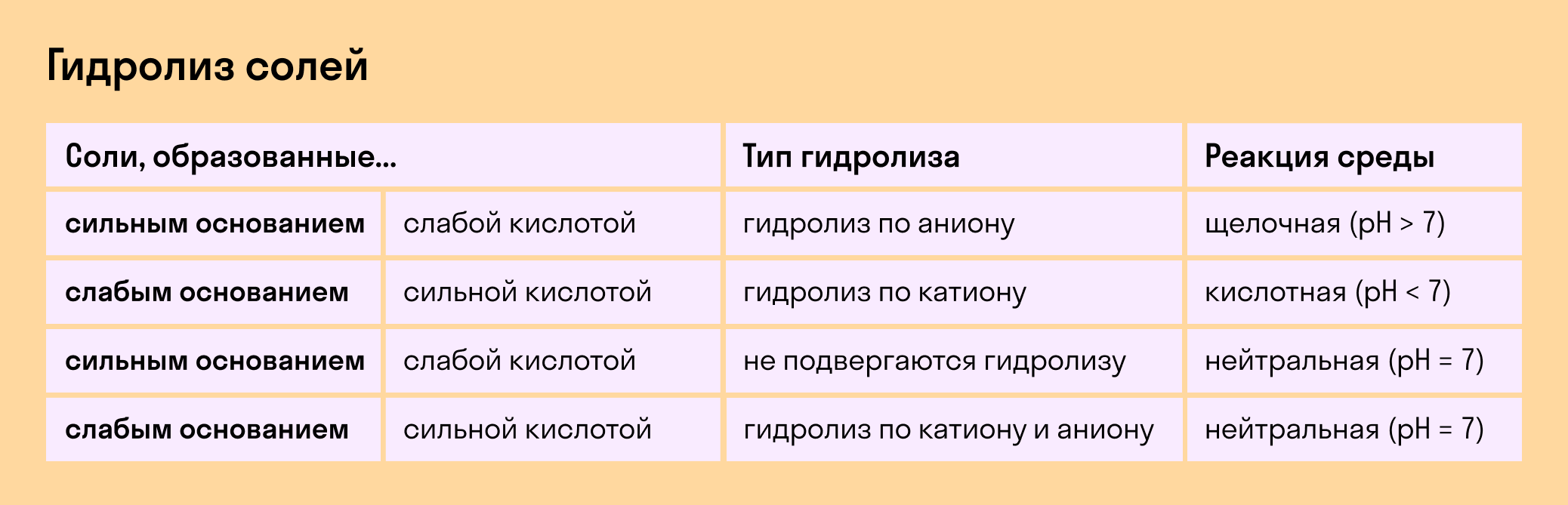
Если в состав соли входит остаток сильного основания и остаток слабой кислоты, то гидролиз идет по аниону. Примеры: K3PO4, NaNO2, Ca(OCl)2, Ba(CH3COO)2, Li2SiO3.
Если соль образована остатком слабого основания и слабой кислоты, то гидролиз идет и по катиону, и по аниону. Примеры: Mg(NO2)2, Al2S3, Cr2(SO3)3, CH3COONH4.
Среда раствора
Среда раствора может быть нейтральной, кислой или щелочной. Определяется типом гидролиза. Некоторые задания могут быть построены так, что, увидев соль, вы должны будете определить ее тип раствора.
Однако замечу, что в дигидрофосфатах, гидросульфитах и гидросульфатах среда всегда кислая из-за особенностей диссоциации. Примеры: NH4H2PO4, LiHSO4. В гидрофосфатах среда щелочная из-за того, что константа диссоциации по третьей ступени меньше, чем константа гидролиза. Примеры: K2HPO4, Na2HPO4.
Попробуйте определить среду раствора для соединений из самостоятельного задания, которое вы только что решили. Ниже будет располагаться решение.
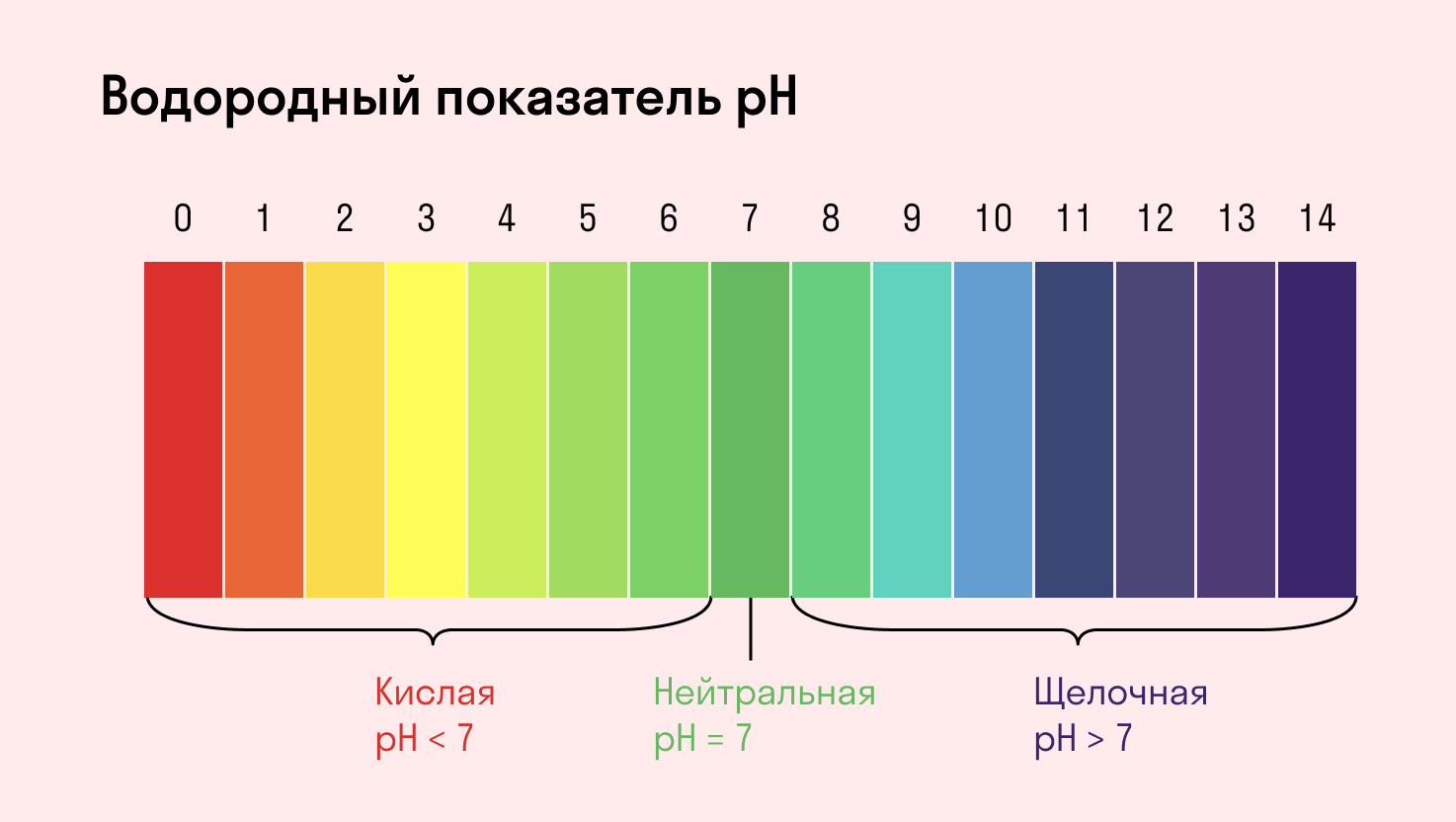
С целью запутать в заданиях часто бывают даны синонимы. Так «среду раствора» могут заменить водородным показателем pH.
Запомните, что кислая среда характеризуется pH 7.
Значение слова «гидролиз»
[От греч. ‛ύδωρ — вода и λύσις — разложение, распад]
Источник (печатная версия): Словарь русского языка: В 4-х т. / РАН, Ин-т лингвистич. исследований; Под ред. А. П. Евгеньевой. — 4-е изд., стер. — М.: Рус. яз.; Полиграфресурсы, 1999; (электронная версия): Фундаментальная электронная библиотека
ГИДРО’ЛИЗ, а, м. [от греч. hydōr — вода и lysis — развязывание] (хим.). Химическое разложение нек-рых веществ действием воды.
Источник: «Толковый словарь русского языка» под редакцией Д. Н. Ушакова (1935-1940); (электронная версия): Фундаментальная электронная библиотека
гидро́лиз
1. хим. один из видов химических реакций сольволиза — реакция обменного разложения между водой и различными химимическими соединениями, способными под действием воды расщепляться на более низкомолекулярные соединения с присоединением элементов воды (Н и ОН) по месту разрыва связей ◆ В присутствии катализатора ― кислоты происходит гидролиз: сахароза расщепляется водой. «Клуб «Юный химик»», 1965 г. // «Химия и жизнь» (цитата из НКРЯ)
Делаем Карту слов лучше вместе

Спасибо! Я стал чуточку лучше понимать мир эмоций.
Вопрос: сума — это что-то нейтральное, положительное или отрицательное?
Синонимы к слову «гидролиз»
Предложения со словом «гидролиз»
Сочетаемость слова «гидролиз»
Понятия, связанные со словом «гидролиз»
Отправить комментарий
Дополнительно
Предложения со словом «гидролиз»
Желатин – это фактически костный клей, продукт гидролиза коллагеновых волокон.
При хранении кочанов выделяется тепло в результате интенсивного процесса гидролиза крахмала.
Ферментативный гидролиз заключается в расщеплении эфирных связей в молекуле триглицерида, и в результате образуются две молекулы жирных кислот и альфа– и бета-диглицериды, разлагаемые впоследствии до бета-моноглицерида.
Гидролиз
Определение гидролиза
| Гидролиз — это процесс взаимодействия сложного химического вещества с водой, итогом которого становится разложение молекул этого вещества. Сам термин происходит от двух греческих слов: hydor, что значит «вода», и lysis, то есть «распад». |
Гидролизации подвержены как органические, так и неорганические вещества: углеводы, белки, оксиды, карбиды, соли и т. д. Например, гидролиз органических соединений напрямую связан с пищеварением — с его помощью происходит распад и усвоение клетками организма жиров, белков, углеводов. Но сейчас мы займемся неорганической химией и рассмотрим гидролизацию на примере солей.
| Гидролиз солей — это реакция взаимодействия ионов соли с Н + и ОН − ионами воды, которая ведет к распаду исходного соединения. В результате такого ионного обмена образуется слабый электролит — кислотный, щелочной или нейтральный. |
Условия гидролиза
Далеко не все соединения распадаются, вступая в реакцию с молекулами воды. Сейчас мы на примере солей рассмотрим, какие вещества подвергаются гидролизу, а какие нет, и от чего это зависит.
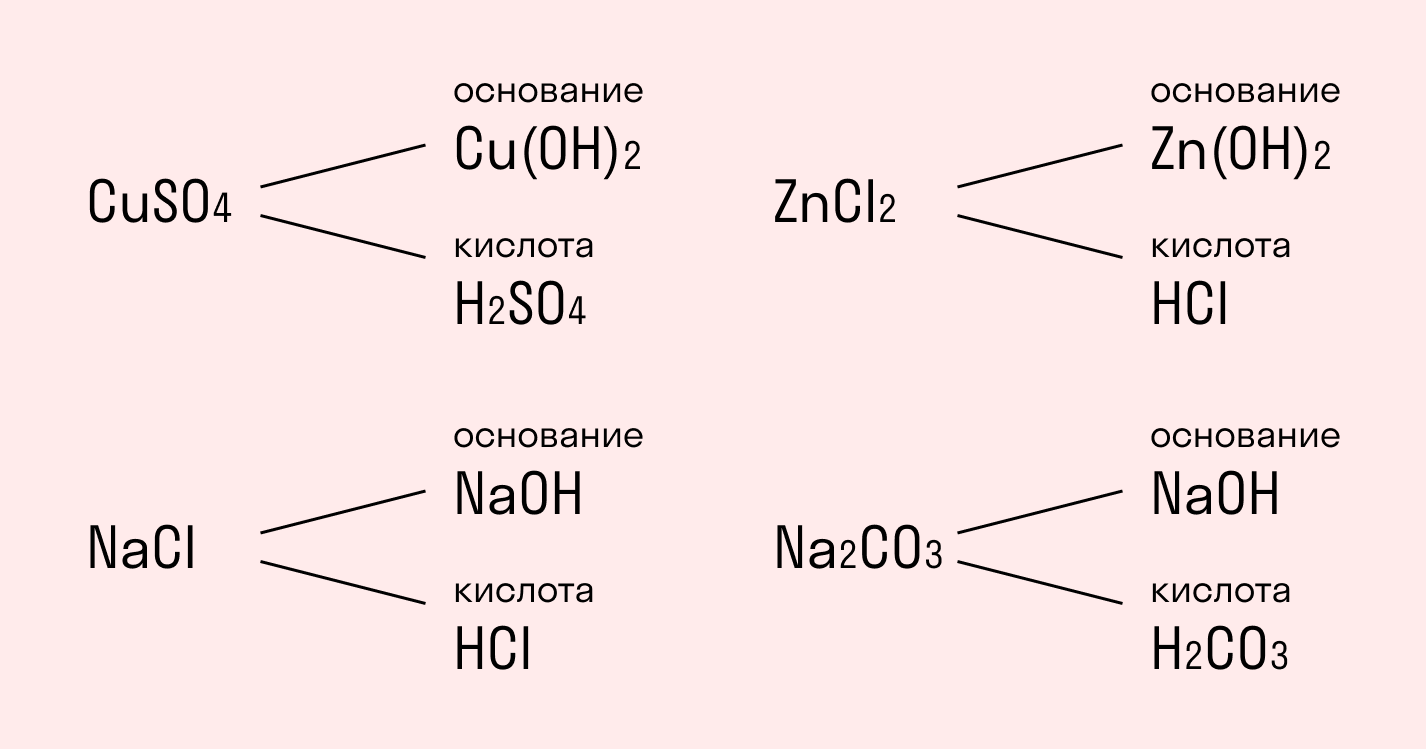
Начнем с того, что любая соль включает основание — амфотерный гидроксид, и кислотный остаток.
сульфат меди CuSO4состоит из основания Cu(ОН)2и кислоты H2SO4;
хлорид натрия NaCl состоит из основания NaOH и кислоты HCl;
хлорид цинка ZnCl2состоит из основания Zn(ОН)2 и кислоты HCI;
карбонат натрия Na2CO3состоит из основания NaOH и кислоты H2CO3.
В зависимости от того, какие соли подвергаются гидролизу — со слабым основанием или слабой кислотой, в итоге может получиться кислая, щелочная или нейтральная среда водного раствора.
А что происходит, если соль состоит из сильного основания и сильного кислотного остатка? Ничего. 🙂 В этом случае ее сильные катионы и анионы не взаимодействуют с ионами воды. Такая соль не распадается, то есть не подвержена гидролизу.
Схема химической реакции гидролиза выглядит так:
XY + HOH ↔ XH + HOY
XH — кислотный остаток;
Индикаторы среды раствора
Для определения среды раствора за считанные секунды используются специальные индикаторы. Самый распространенный из них — лакмусовая бумага, но также популярны фенолфталеин и метиловый оранжевый. В нейтральной среде они не меняют свой цвет, а в кислотной или щелочной — приобретают другую окраску.
Изменение цвета индикатора однозначно говорит о том, что произошла гидролизация. Однако если цвет остался тем же — это не всегда означает отсутствие гидролиза. Среда будет почти нейтральной и в том случае, когда гидролизу подвергается соль со слабым основанием и слабой кислотой. Но об этом поговорим дальше, а пока посмотрите таблицу.
Виды гидролиза
Мы выяснили, что в составе соли может быть слабый ион, который и отвечает за гидролизацию. Он находится в основании, в кислотном остатке или в обоих компонентах, и от этого зависит тип гидролиза.
Соль с сильным основанием и сильной кислотой
Гидролиз отсутствует. Как вы уже знаете, при наличии сильного основания и сильного кислотного остатка соль не распадается при взаимодействии с водой. Так, например, невозможен гидролиз хлорида натрия (NaCl), поскольку в составе этого вещества нет слабых ионов. К таким же не подверженным гидролизации солям относят KClO4, Ba(NO3)2 и т. д.
Среда водного раствора — нейтральная, т. е. pH = 7.
Реакция индикаторов: не меняют свой цвет (лакмус остается фиолетовым, а фенолфталеин — бесцветным).
Соль со слабым основанием и сильной кислотой
Среда водного раствора — кислая, pH меньше 7.
Реакция индикаторов: фенолфталеин остается бесцветным, лакмус и метиловый оранжевый — краснеют.
Соль с сильным основанием и слабой кислотой
Среда водного раствора — щелочная, pH больше 7.
Реакция индикаторов: фенолфталеин становится малиновым, лакмус — синим, а метиловый оранжевый желтеет.
Молекулярное уравнение: KNO2 + H2O ↔ HNO2 + KOH
Ионное уравнение: K + + NO2 − + HOH ↔ HNO2 + K + + OH −
Гидролиз по катиону и аниону. Если у соли оба компонента — слабые, при взаимодействии с водой в реакцию вступает и анион, и катион. При этом катион основания связывает ионы воды OH − а анион кислоты связывает ионы H +
Среда водного раствора: нейтральная, слабокислая или слабощелочная.
Реакция индикаторов: могут не изменить свой цвет.
Цианид аммония NH4CN включает слабое основание NH4OH и слабую кислоту HCN.
Молекулярное уравнение: NH4CN + H2O ↔ NH4OH + HCN
Ионное уравнение: NH4 + + CN − + HOH ↔ NH4OH + HCN
Среда в данном случае будет слабощелочной.
Обобщим все эти сведения в таблице гидролиза солей.
Ступенчатый гидролиз
Любой из видов гидролиза может проходить ступенчато. Так бывает в тех случаях, когда с водой взаимодействует соль с многозарядными катионами и анионами. Сколько ступеней будет включать процесс — зависит от числового заряда иона, отвечающего за гидролиз.
Как определить количество ступеней:
если соль содержит слабую многоосновную кислоту — число ступеней равняется основности этой кислоты;
если соль содержит слабое многокислотное основание — число ступеней определяют по кислотности основания.
Для примера рассмотрим гидролиз карбоната калия K2CO3. У нас есть двухосновная слабая кислота H2CO3, а значит, гидролизация пройдет по аниону в две ступени.
I ступень: K2CO3+HOH ↔ KOH+KHCO3, итогом которой стало получение гидроксида калия (KOH) и кислой соли (KHCO3).
II ступень: K2HCO3+HOH ↔ KOH+H2CO3, в итоге получился тот же гидроксид калия (KOH) и слабая угольная кислота (H2CO3).
Для приблизительных расчетов обычно принимают в учет только результаты первой ступени.
Обратимый и необратимый гидролиз
Химические вещества могут гидролизоваться обратимо или необратимо. В первом случае распадается лишь некоторое количество частиц, а во втором — практически все. Если соль полностью разлагается водой, это необратимый процесс, и его называют полным гидролизом.
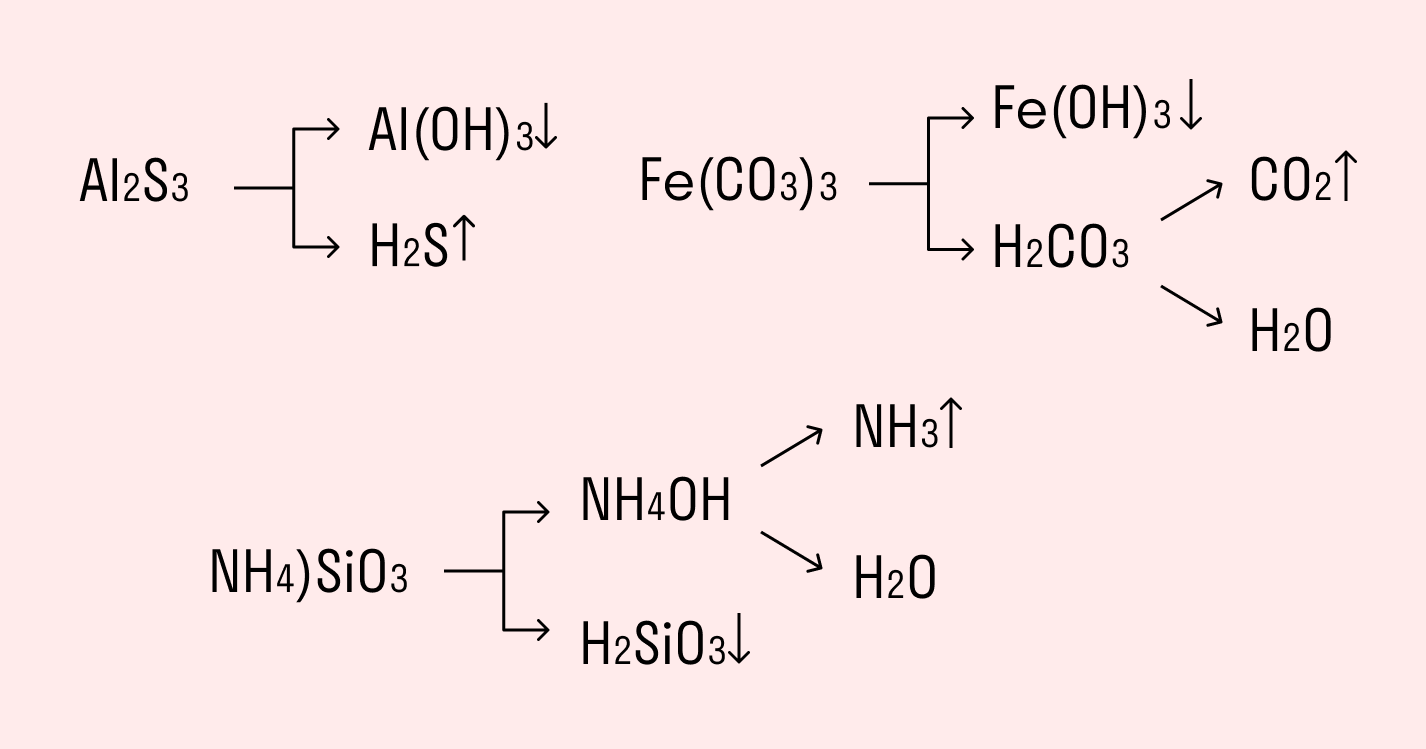
Необратимо гидролизуются соли, в составе которых есть слабые нерастворимые основания и слабые и/или летучие кислоты. Такие соединения могут существовать лишь в сухом виде, их не получить путем смешивания водных растворов других солей.
Например, полному гидролизу подвергается сульфид алюминия:
Как видите, в результате гидролизации образуется гидроксид алюминия и сероводород.
Необратимые реакции при взаимодействии с водой имеют место и в органической химии. В качестве примера рассмотрим полный гидролиз органического вещества — карбида кальция, в результате которого образуется ацетилен:
Степень гидролиза
Взаимодействие соли или другого химического соединения с водой может усиливаться или ослабляться в зависимости от нескольких факторов. Если нужно получить количественное выражение гидролиза, говорят о его степени, которая указывается в процентах.
h — степень гидролиза,
nгидр. — количество гидролизованного вещества,
nобщ. — общее количество растворенного в воде вещества.
На степень гидролизации может повлиять:
температура, при которой происходит процесс;
концентрация водного раствора;
состав участвующих в гидролизе веществ.
Можно усилить гидролиз с помощью воды (просто разбавить полученный раствор) или стимулировать процесс повышением температуры. Более сложным способом будет добавление в раствор такого вещества, которое могло бы связать один из продуктов гидролиза. К соли со слабой кислотой и сильным основанием нужно добавить соль со слабым основанием и сильной кислотой.
Для ослабления гидролиза раствор охлаждают и/или делают более концентрированным. Также можно изменить его состав: если гидролизация идет по катиону — добавляют кислоту, а если по аниону — щелочь.
Итак, мы разобрались, что такое гидролиз солей и каким он бывает. Пора проверить свои знания и ответить на вопросы по материалу.
Вопросы для самопроверки:
Назовите необходимое условие для гидролиза.
Какие типы гидролиза вы знаете?
В каком случае в результате гидролиза может образоваться слабощелочная или слабокислая среда?
По какому типу гидролизуется соль с сильным основанием и слабым кислотным остатком?
При гидролизе соли с сильным основанием и слабой кислотой для ослабления процесса нужно добавить в раствор кислоту или щелочь?
Как воздействует на гидролиз разбавление раствора водой?
Как определяется количество ступеней гидролиза?
Какая среда раствора образуется при гидролизации солей NaF, KCl, FeBr2, Na2PO4? Ответов может быть несколько.
Какие из солей гидролизуются по катиону: Csl, FeSO4, RbNO3, CuSO4, Mn(NO3)2? Ответов может быть несколько.
Какая из солей не подвергается гидролизу: K2HPO4, KNO3, KCN, Ni(NO3)2?
Гидролиз
Гидролиз (греч. hydōr вода + lysis разложение; синоним: гидролитическое расщепление, гидролитическая деструкция)
химическая реакция между каким-либо веществом и водой. При гидролитическом расщеплении солей, которое, как правило, является обратимой реакцией, образуются кислоты и основания. Если при гидролизе солей происходит образование нерастворимого или легколетучего вещества, то реакция идет практически до полного разложения исходного вещества. Органические вещества гидролизуются в присутствии кислот (кислотный гидролиз) или щелочей (щелочной гидролиз).
Гидролитическое расщепление химических связей различных типов играет значительную роль в жизнедеятельности всех живых организмов и катализируется ферментами, называемыми гидролазами (см. Ферменты). Некоторые гидролазы катализируют не только гидролиз сложноэфирных, гликозильных, пептидных, амидных и других связей, но и реакцию переноса отщепленной от субстрата группы на подходящие молекулы-акцепторы, однако и сам Г. можно трактовать как перенос группы атомов на молекулу воды, выступающую в качестве акцептора. Значение гидролаз велико в пищеварении (Пищеварение), обмене белков, углеводов и жиров (см. Азотистый обмен, Углеводный обмен, Жировой обмен). Генетически обусловленная неполноценность ряда гидролаз или их полное отсутствие (в результате чего конкретные реакции Г. в организме не протекают вообще или протекают с меньшей скоростью, а в клетках накапливаются аномально большие количества непревращенных субстратов этих ферментов) могут быть причиной тяжелых наследственных болезней накопления (Болезни накопления). Изменение активности некоторых гидролаз в крови, желудочном и кишечном соке, соке поджелудочной железы и других биологических жидкостях является ценным диагностическим признаком ряда заболеваний. Такие гидролазы, как Трипсин, Химотрипсин, эластолитин, гиалуронидаза (препараты лидаза, ронидаза), рибонуклеаза и дезоксирибонуклеаза (см. Нуклеиновые кислоты), коллагеназа, лизоцим и др., используются в качестве лекарственных средств.
Библиогр.: Ленинджер А. Биохимия, пер. с англ., т. 1, с. 141, 148, М., 1985.
Гидролиз (гидро- (Гидр-) + греч. lysis растворение, распад, разрушение)
реакция разложения вещества с участием воды; в организме Г. является одной из основных реакций обмена жиров, белков, углеводов и нуклеиновых кислот.
Урок №14. Гидролиз
Гидролизу подвергаются как неорганические, так и органические вещества в результате обменной реакции между молекулами воды и вещества. Реакции гидролиза могут протекать как обратимо, так и необратимо.
Примеры гидролиза
Неорганических веществ
CH 3 COONH 4 +H 2 O↔CH 3 COOH+NH 4 OH
Органических веществ
CH 3 COOCH 3 +H 2 O↔CH 3 COOH+CH 3 OH
C 2 H 5 ONa+H 2 O↔C 2 H 5 OH+NaOH
Факторы, влияющие на степень гидролиза
Степень гидролиза зависит от:
природы растворяемого вещества
1). Гидролиз эндотермическая реакция, поэтому повышение температуры усиливает гидролиз.
2). Чем меньше концентрация соли, тем выше степень ее гидролиза. При разбавлении водой равновесие смещается в сторону протекания реакции, т.е. вправо, степень гидролиза возрастает.
3). Повышение концентрации ионов водорода ослабляет гидролиз, в случае гидролиза по катиону. Аналогично, повышение концентрации гидроксид-ионов ослабляет гидролиз, в случае гидролиза по аниону.
4). Добавки посторонних веществ могут влиять на положение равновесия в том случае, когда эти вещества реагируют с одним из участников реакции. Так, при добавлении к раствору сульфата меди
2CuSO 4 + 2H 2 O (CuOH) 2 SO 4 + H 2 SO 4
раствора гидроксида натрия, содержащиеся в нем гидроксид-ионы будут взаимодействовать с ионами водорода. В результате их концентрация уменьшится, и, по принципу Ле Шателье, равновесие в системе сместится вправо, степень гидролиза возрастет. А если к тому же раствору добавить раствор сульфида натрия, то равновесие сместится не вправо, как можно было бы ожидать (взаимное усиление гидролиза) а наоборот, влево, из-за связывания ионов меди в практически нерастворимый сульфид меди.
5). Концентрация соли. Рассмотрение этого фактора приводит к парадоксальному выводу: равновесие в системе смещается вправо, в соответствии с принципом Ле Шателье, но степень гидролиза уменьшается.
Al(NO 3 ) 3
Соль гидролизуется по катиону. Усилить гидролиз этой соли можно, если:
нагреть или разбавить раствор водой;
добавит раствор щёлочи (NaOH);
добавить раствор соли, гидролизующейся по аниону Nа 2 СО 3 ;
Ослабить гидролиз этой соли можно, если:
растворение вести на холоду;
готовить как можно более концентрированный раствор Al(NO 3 ) 3 ;
добавить к раствору кислоту, например HCl
Гидролиз солей многокислотных оснований и многоосновных кислот проходит ступенчато
Например, гидролиз хлорида железа (II) включает две ступени:
FeCl 2 + H 2 O FeOHCl + HCl
Fe(OH)Cl + H 2 O Fe(OH) 2 + HCl
Гидролиз карбоната натрия включает две ступени:
Nа 2 СО 3 + H 2 O NаНСО 3 + NаОН
NаНСО 3 + Н 2 О NаОН + Н 2 СО 3
Гидролиз протекает необратимо, если в результате реакции образуется нерастворимое основание и (или) летучая кислота:
Al 2 S 3 + 6H 2 O =>2Al(OH) 3 ↓+ 3H 2 S↑
2AlCl 3 +3Na 2 S≠Al 2 S 3 +6NaCl
2AlCl 3 +3Na 2 S+6H 2 O=2Al(OH) 3 ↓+6NaCl+3H 2 S↑ (взаимное усиление гидролиза)
Поэтому их получают в безводных средах спеканием или другими способами, например:
2Al+3S = t°C =Al 2 S 3
Необратимый гидролиз
Необратимый гидролиз происходит, если при гидролизе выделяется газ, осадок или вода, т.е. вещества, которые при данных условиях не могут взаимодействовать между собой. Необратимый гидролиз является химической реакцией, т.к. реагирующие вещества взаимодействуют практически полностью.
Гидролиз, в который вступают растворимые соли 2х-валентных металлов (Be 2+ , Co 2+ , Ni 2+ , Zn 2+ , Pb 2+ , Cu 2+ и др.) и растворимые карбонаты/гидрокарбонаты.
При этом образуются нерастворимые основные соли (гидроксокарбонаты):
2MgCl 2 + 2Na 2 CO 3 + H 2 O = Mg 2 (OH) 2 CO 3 + 4NaCl + CO 2
CaCl 2 + Na 2 CO 3 = CaCO 3 + 2NaCl,
2AlCl 3 + 3K 2 S +6H 2 O = 2Al(OH) 3 + 3H 2 S↑ + 6KCl
2CrCl 3 + 3K 2 CO 3 + 3H 2 O = 2Сr(ОН) 3 + 3СO 2 + 6KCl
2AlCl 3 + 3Na 2 SO 3 + 3Н 2 О=2Al(ОН) 3 + 6NaCl + 3SО 2
2AlCl 3 + 3Na 2 S + 3Н 2 О=2Al(ОН) 3 + 6NaCl + 3H 2 S
Соли Fe 3+ при взаимодействии с карбонатами также при смешивании в растворе (взаимном гидролизе) образуют осадок гидроксида и газ:
2FeCl 3 + 3K 2 CO 3 + 3H 2 O = 2Fe(ОН) 3 + 3СO 2 + 6KCl
Обратите внимание: при взаимодействии солей трехвалентного железа с сульфидами реализуется окислительно-восстановительная реакция:
2FeCl 3 + 3K 2 S (изб) = 2FeS + S↓ + 6KCl (при избытке сульфида калия)
При взаимодействии солей трехвалентного железа с сульфитами также реализуется окислительно-восстановительная реакция.
Гидролиз галогенангидридов и тиоангидридов происходит также необратимо. Галогенангидриды разлагаются водой по схеме ионного обмена (H + OH — ) до соответствующих кислот (в случае водного гидролиза) и солей (в случае щелочного гидролиза). Степень окисления центрального элемента и остальных при этом не изменяется!
SO 2 Cl 2 + 2 H 2 O = H 2 SO 4 + 2 HCl,
SOCl 2 + 2 H 2 O = H 2 SO 3 + 2HCl,
PCl 5 + 4 H 2 O = H 3 PO 4 + 5HCl,
CrO 2 Cl 2 + 2H 2 O = H 2 CrO 4 + 2HCl,
PCl 5 + 8NaOH = Na 3 PO 4 + 5NaCl + 4H 2 O,
Галогенангидрид – это соединение, которое получается, если в кислоте ОН-группу заменить на галоген. При гидролизе галогенангидридов кислот образуются соответствующие данным элементам и степеням окисления кислоты и галогеноводородные кислоты.
POCl 3 + 3H 2 O = H 3 PO 4 + 3HCl
Примеры реакций гидролиза
(NH 4 ) 2 CO 3 карбонат аммония – соль, слабой кислоты и слабого основания. Растворима. Гидролизуется по катиону и аниону одновременно. Число ступеней – 2.
1 ступень: (NH 4 ) 2 CO 3 +H 2 O↔NH 4 OH+NH 4 HCO 3
2 ступень: NH 4 HCO 3 +H 2 O↔NH 4 OH+H 2 CO 3
Реакция раствора слабощелочная pH>7, т.к гидроксид аммония более сильный электролит, чем угольная кислота. К д (NH 4 OH)>К д (H 2 CO 3 )
CH 3 COONH 4 ацетат аммония – соль, слабой кислоты и слабого основания. Растворима. Гидролизуется по катиону и аниону одновременно. Число ступеней – 1.
CH 3 COONH 4 +H 2 O↔NH 4 OH+СH 3 COOH
Реакция раствора нейтральная pH=7, т.к К д (CH 3 COOН)=К д (NH 4 OH)
1 ступень: K 2 HPO 4 +H 2 O↔KH 2 PO 4 +KOH
2 ступень: KH 2 PO 4 +H 2 O↔H 3 PO 4 +KOH
Реакция раствора 2 ступени слабокислая pH=6,4, так как процесс диссоциации дигидроортофосфат ионов преобладает над процессом гидролиза, при этом ионы водорода не только нейтрализуют гидроксид-ионы, но и остаются в избытке, что и обуславливает слабокислую реакцию среды.
Задача: Определите среду растворов гидрокарбоната и гидросульфита натрия.
Решение:
1) Рассмотрим процессы в растворе гидрокарбоната натрия. Диссоци а ция этой соли идёт в две ступени, катионы водорода образуются на второй ступени:
Гидролиз гидрокарбоната натрия описывается уравнением:
NaHCO 3 +H 2 O↔H 2 CO 3 +NaOH
Константа гидролиза заметно больше константы диссоциации, поэтому раствор NaHCO 3 имеет щелочную среду.
2) Рассмотрим процессы в растворе гидросульфита натрия. Диссоци а ция этой соли идёт в две ступени, катионы водорода образуются на второй ступени:
Гидролиз гидросульфита натрия описывается уравнением:
NaHSO 3 +H 2 O↔H 2 SO 3 +NaOH
В этом случае константа диссоциации больше константы гидролиза, поэтому раствор NaHSO 3 имеет кислую среду.
Задача: Определить среду раствора соли цианида аммония.
Решение:
NH 4 CN +H 2 O ↔ NH 4 OH+ HCN