гидроксиапатит кальция что это такое
Контурная пластика филлерами на основе гидроксиапатита кальция
Контурная пластика, как один из методов по коррекции возрастных изменений, известна многим людям, которые следят за своим внешним видом. Чтобы не прибегать к использованию пластической хирургии, которая является достаточно болезненной для многих пациентов процедурой, косметологи при помощи филлеров делают так называемые «инъекции красоты».
Классификация
Филлер – гелеобразный препарат, предназначенный для введения под кожу с целью решения эстетических проблем. В современной эстетической косметологии их используется несколько видов.
Биосинтетические филлеры. Их особенностью является то, что в состав препарата входит синтетически созданный компонент, который максимально совместим с человеческим организмом. Примером такого вещества выступает коллаген, не отторгаемый тканями, что сводит риск возникновения аллергических реакций к минимуму. В организме синтетические вещества сохраняются до 3 лет.
Существенным недостатком данной группы филлеров является их высокая плотность, сохраняющаяся на протяжении длительного времени. Это может привести к тому, что введенное под кожу вещество может мигрировать на соседние участки, приводя к образованию неэстетичных неровностей кожного покрова.
Биодеградируемые филлеры – разлагающиеся. В составе большинства таких препаратов содержится гиалуроновая кислота, которая аккумулирует воду, позволяет быстро и без труда разгладить морщины, заставляя клеточные системы обновляться более активно. При этом работа с такими препаратами практически не имеет нежелательных эффектов.
Недостатком филлеров на основе гиалуроновой кислоты можно считать кратковременность их воздействия – препарат выводится из организма спустя несколько месяцев после инъецирования.
Отдельным подвидом косметологи выделили филлеры на основе гидроксиапатита кальция. Данный препарат зарекомендовал себя максимально положительно: отсутствие побочных эффектов, максимальная эффективность наблюдается на протяжении достаточно продолжительного времени (до 2 лет). Это далеко не все свойства, которые сделали данное средство особенно популярным среди пациентов косметических клиник.
Как недостатки таких филлеров специалисты определяют невозможность гидратации, ревитализации, а также неспособность препарата активизировать доступ других веществ в кожный покров.
Механизм действия гидроксиапатита кальция
Препараты на основе гидроксиапатита кальция признаны одними из самых безопасных и эффективных средств для омоложения. Они активно используются в контурной пластике.
Гидроксиапатит кальция – это компонент неорганического происхождения, входящий в состав костных тканей человека. В связи с этим данное вещество отлично усваивается человеческим организмом, не вызывая отторжения и других неприятных последствий.
Филлеры с гидроксиапатитом кальция дают возможность решить такие эстетические проблемы, которые не в состоянии исправить препараты с гиалуроновой кислотой.
Эти инъекционные наполнители включают активно действующее вещество, состоящего из особых микросфер (30%) и водного геля-носителя с оптимальной плотностью (70%). Соотношение этих компонентов зависит от происхождения гидроксиапатита кальция: его получают синтетическим путем или выделяют из определенных морских кораллов.
Попадая под кожный покров, филлер заполняет собой все необходимые полости и пустоты, что обеспечивает моментальный эффект разглаживания морщин. Спустя некоторое время он рассасывается, постепенно поглощаясь тканями. Препарат, оставаясь в коже, стимулирует активную выработку коллагена – белка естественного происхождения, отвечающего за упругость и эластичность тканей.
Коллагеновые волокна, которые формируются в кожном покрове, в свою очередь, способствуют образованию устойчивых структур, выполняющих соединительно-тканную функцию.
После определенного периода микросферы гидроксиапатита кальция постепенно выводятся из организма, а полученные благодаря им новые мышечные ткани сохраняют свою упругость на протяжении достаточно длительного времени. Этим объясняется пролонгированный эффект от таких филлеров: заметный результат наблюдается на протяжении до двух лет, что существенно дольше, чем при использовании гиалуроносодержащих препаратов.
Преимущества
Филлеры с гидроксиапатитом кальция обладают многими замечательными свойствами. Среди них выделяют следующие:
натуральность. Гомогенность и однородность препарата в сочетании с высокими профессиональными качествами врача позволяет пациенту сразу после процедуры выглядеть максимально естественно;
ожидаемый результат. Структура геля предупреждает миграцию препарата по тканям, концентрируясь в выбранном специалистом месте;
длительный эффект. Филлер выводится из организма довольно медленно, при этом микросферы заменяются собственными, сформированными за это время тканями;
безопасность. Препарат биосовместим с человеком, не токсичен, не вызывает аллергических реакций;
легкая и безболезненная процедура введения;
отсутствие реабилитационного периода;
кожа омолаживается и оздоравливается естественным путем.
Показания к использованию
Препараты, содержащие в своем составе гидроксиапатит кальция, косметологи иногда называют носогубными филлерами. Это связано с тем, что они дают максимально положительный результат именно в этой зоне. Однако с помощью таких филлеров корректируют и другие части тела человека:
височная область. Старение – это неизбежный для человека процесс, который сопровождается утратой мягкими тканями лица своего прежнего объема. Это приводит к появлению так называемых теней или впадин в зоне висков. Лифтинговый филлер, в основе которого находится гидроксиапатит кальция, восполняет и корректирует утраченный в этих проблемных местах объем, что подтверждает высокие показатели эффективности препарата;
скулы. Именно они играют одну из основных ролей в эстетическом формировании лица и несут ответственность за восприятие его окружающими людьми. Человек с четко выраженными скулами выглядит молодо и свежо, черты лица приобретают особую утонченность. При помощи препаратов с гидроксиапатитом кальция возможно провести основательную коррекцию данной области лица, восстановить объем и рельефность скул;
область носа. Многие люди недовольны своим носом, и это совершенно не зависит от возраста. Косметологи рекомендуют таким пациентам применить ринопластику без хирургического вмешательства. Филлер в данном случае выполняет роль своеобразного импланта. С его помощью можно сделать нос ровнее, скрыть горбинку, скорректировать кончик и т.д. Коррекция носа филлерами имеет смысл для коррекции незначительных его дефектов. Кардинально изменить форму данного органа, уменьшить его размеры ринопластика с их помощью невозможно;
носогубные складки. Данная зона считается одной из самых проблемных и заметных. С возрастом складки, которые тянутся от краев носа к уголкам губ, становятся глубокими и отчетливыми, что придает лицу угрюмый, грустный вид. Подтянуть их при помощи кремов или используя подтяжку кожи лица практически нереально. В данном случае максимальный эффект показывают филлеры с гидроксиапатитовым наполнителем. Заполняя пустоты в тканях, препарат существенно улучшает рельеф кожи, разглаживает морщины в выбранной области, уменьшает складки на ней до минимального состояния;
«морщины марионетки». Таким термином косметологи называют возрастное опущение уголков губ. Нехватка объема в данной области приводит к возникновению или углублению уже сформированных ранее морщин. Инъекции филлерами в данном случае дают максимально положительный результат, который сохраняет свою эффективность до 2 лет. Выработка собственного коллагена в данной области способствует существенному торможению процесса старения;
нижняя челюсть и подбородок. Возрастные изменения приводят к тому, что со временем кожа лица теряет объем, становится дряблой, обвисает на нижней челюсти, образуя брыли. Векторный лифтинг при помощи инъекций филлерами способен идеально выровнять контур на нижней челюсти, вернуть подбородку прежний, четкий контур. Такая контурная пластика также дает возможность избавиться от второго подбородка;
кисти рук. С приближением старости сухожилия и кровеносные сосуды на тыльной стороне ладоней становятся более заметными, кожа на кистях выглядит дряблой и сухой. Идеальное решение в данном случае – применение инъекций филлерами с гидроксиапатитом кальция. Это единственный препарат, который разрешено использовать для данной зоны.
Порядок инъецирования филлера
В современной косметологии использование филлеров – один из самых безопасных, эффективных и быстрых методов решения эстетических и медицинских проблем. Контурную пластику с использованием данных препаратов может проводить исключительно специалист, который прошел обучение по специальной программе, и обладает сертификатом, дающий ему право применять данное средство в практике. Именно такие работают в Центре эстетической косметологии «VIRTUSCLINIC».
В среднем продолжительность процедуры составляет 30 минут и проводится под местной аппликационной анестезией. Врач очищает лицевую поверхность, и определяет зоны введения препарата, оставляя там разметки в виде точек. Некоторые специалисты выполняют фото до процедуры и после нее.
Косметолог демонстрирует пациенту препарат в целостной упаковке, с обязательным указанием его срока годности и дозировки. Филлер вводят при помощи очень тонкой иглы подкожно в намеченной ранее зоне. Метод и способы введения препарата специалист выбирает самостоятельно, с учетом всех особенностей процедуры и пациента.
Сеанс заканчивается проведением легкого массажа, который помогает равномерно распределить филлер под кожей.
Эффект от процедуры заметен сразу после ее проведения, однако максимальный результат проявляется, как правило, через 10–14 дней.
Побочные действия препарата
Несмотря на то что гидроксиапатит кальция толерантен человеческому организму и побочных эффектов не вызывает, в некоторых случаях его использование может привести к нежелательным последствиям. Среди них выделяют следующие:
появление в местах инъекций белых полосок. Такая проблема возникает по причине недостаточно глубокого введения препарата под кожу;
на поверхности кожи могут возникнуть неровности, комки и гематомы. Такой результат будет в случае, если филлер был введен в непредназначенные для этого места (например, в носослезную борозду, в области губ и т.п.);
эффект Тиндаля, который заключается в неестественной бледности кожи в зоне введения препарата. Это связано с чрезмерно поверхностным его инъецированием;
в редких случаях у пациентов после процедуры наблюдается отечность, формирование гранулем, инфицирование.
Следует отметить, что наличие осложнений связано исключительно с квалификацией специалиста, соблюдением им всех правил и техник введения препарата, точного определения его количества, обеспечения максимального гигиенического ухода и т.п. Поэтому к вопросу выбора исполнителя необходимо подойти со всей ответственностью, поскольку от этого зависит не только окончательный результат процедуры, но и возможные нежелательные явления.
Высококвалифицированные специалисты Центра эстетической косметологии «VIRTUSCLINIC» прошли специальное обучение, что дает им возможность проводить самые сложные процедуры, требующие специальных знаний и навыков.
Все препараты, которые используют в клинике, сертифицированы, что подтверждает их качество и безопасность. Процедуры проводятся с максимальным комфортом для пациентов и обязательным учетом специалистами всех их пожеланий.
Врачи-косметологи «VIRTUSCLINIC» с радостью помогут вам вернуть прежнюю красоту и уверенность в себе.
Как укрепить зубную эмаль
Эмаль — это внешняя твёрдая оболочка видимой части зубов. Она защищает их от ежедневного механического и химического воздействия. В этой статье рассказываем, что нужно знать об укреплении эмали.
Деминерализация эмали
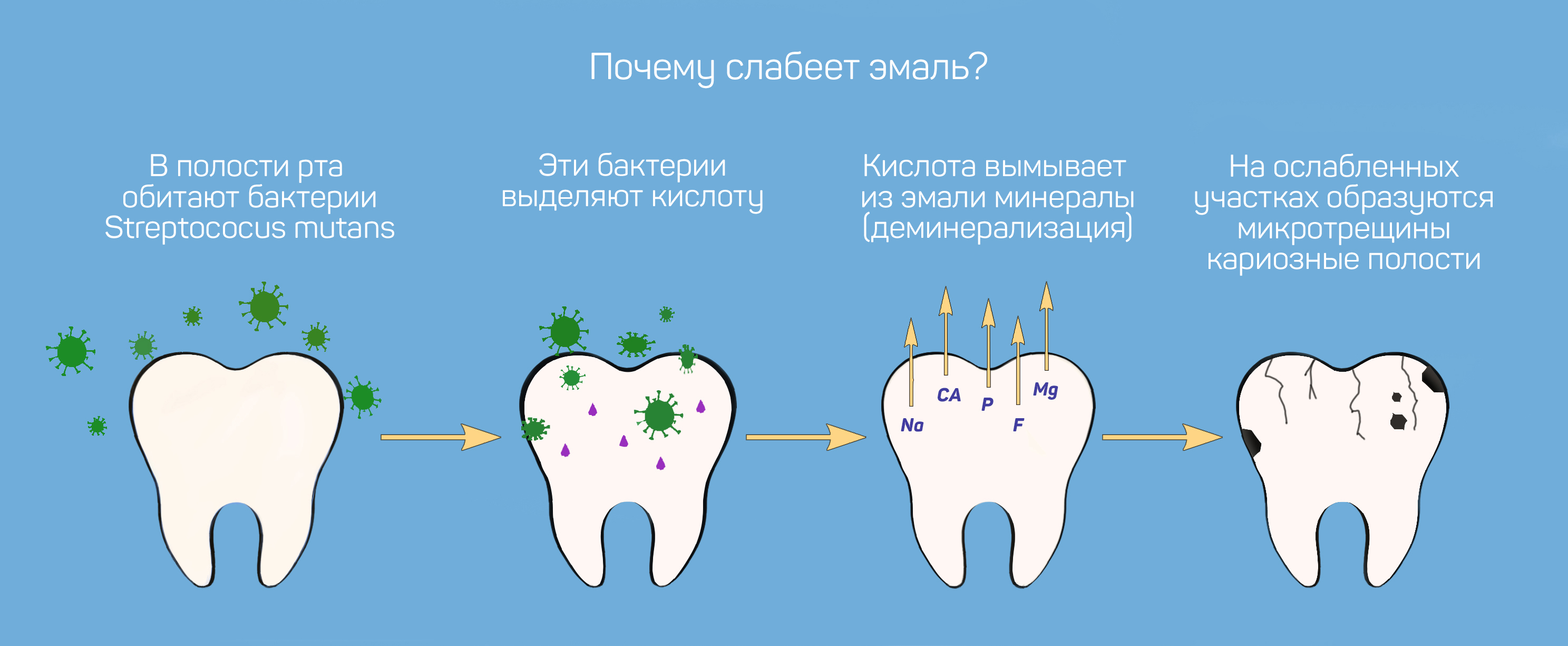
Эмаль на 97% состоит из кристаллов гидроксиапатита, небольшого количества воды (2–3%) и органических веществ (1–2%). В течение жизни она может изнашиваться и разрушаться по различным причинам.
Деминерализация — процесс, при котором эмаль теряет полезные минералы (в первую очередь кальций), от которых зависит её целостность и прочность.
У деминерализации есть две основных причины.
Вначале изменения состояния эмали не заметны, но, если не удалять налёт вовремя, появляются белёсые пятна (ранняя стадия кариеса), а затем — полноценный кариес. Дальше — только к стоматологу.
На стадии белого пятна кариес ещё можно предотвратить. Для этого нужно насытить эмаль минералами, которые повысят устойчивость к кислотам. Укрепить эмаль можно как дома, так и в кабинете стоматолога.
Показания к укреплению эмали
Как укрепить зубную эмаль
Фторирование
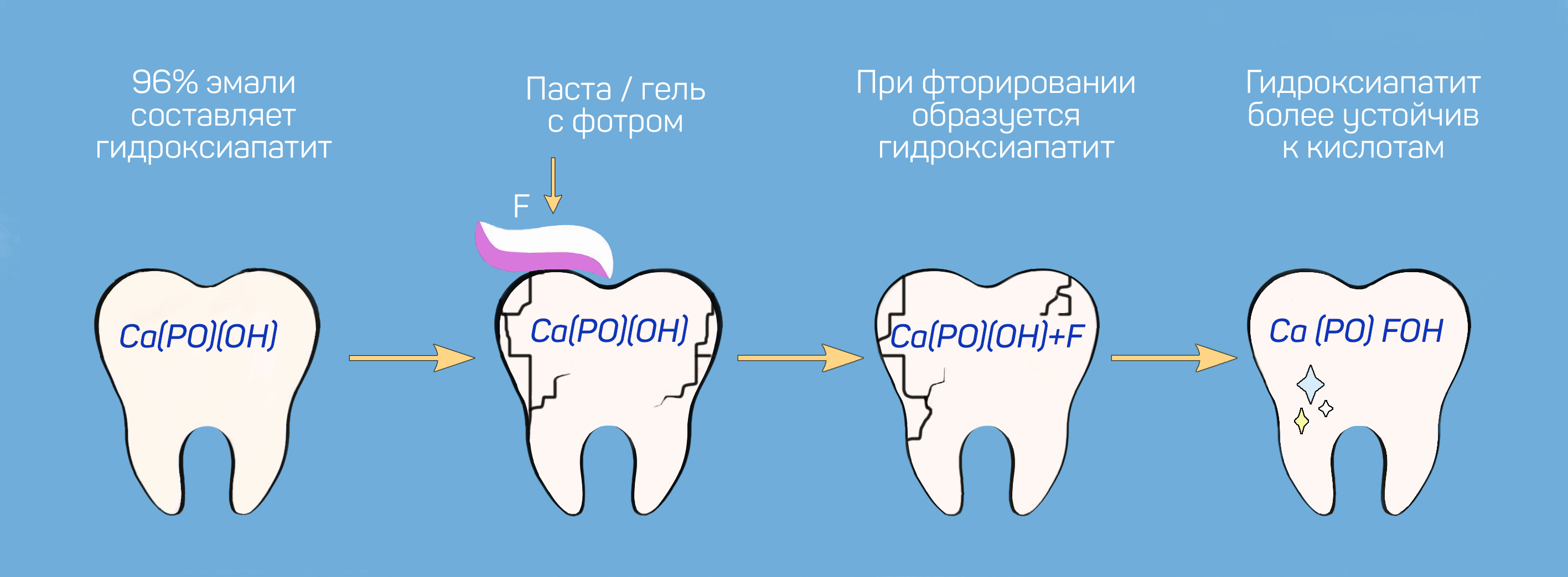
Фторирование — самый распространённый и единственный доказанно эффективный способ укрепления эмали. Он заключается в нанесении на поверхность зубов фторсодержащих составов.
Проникая в зубную эмаль, фтор ускоряет усвоение кальция и фосфора, укрепляя и восстанавливая поверхность зуба. Происходит это так: молекулы фтора соединяются с гидроксиапатитом, образуя гидроксифторапатит — минерал, устойчивый к действию кислот.
Для домашнего ухода и профилактики кариеса можно использовать зубные пасты с фтором. Самыми эффективными считаются составы с фторидом натрия и аминофторидами. Чем выше содержание фтора, тем сильнее реминерализирующее свойство пасты и защита от кариеса.
Концентрацию фтора в зубной пасте измеряют в ppm или процентах. Если на тюбике написано, что она содержит 900 ppm фтора, значит, в килограмме пасты будет 900 мг этого элемента.
Зубные пасты с фтором
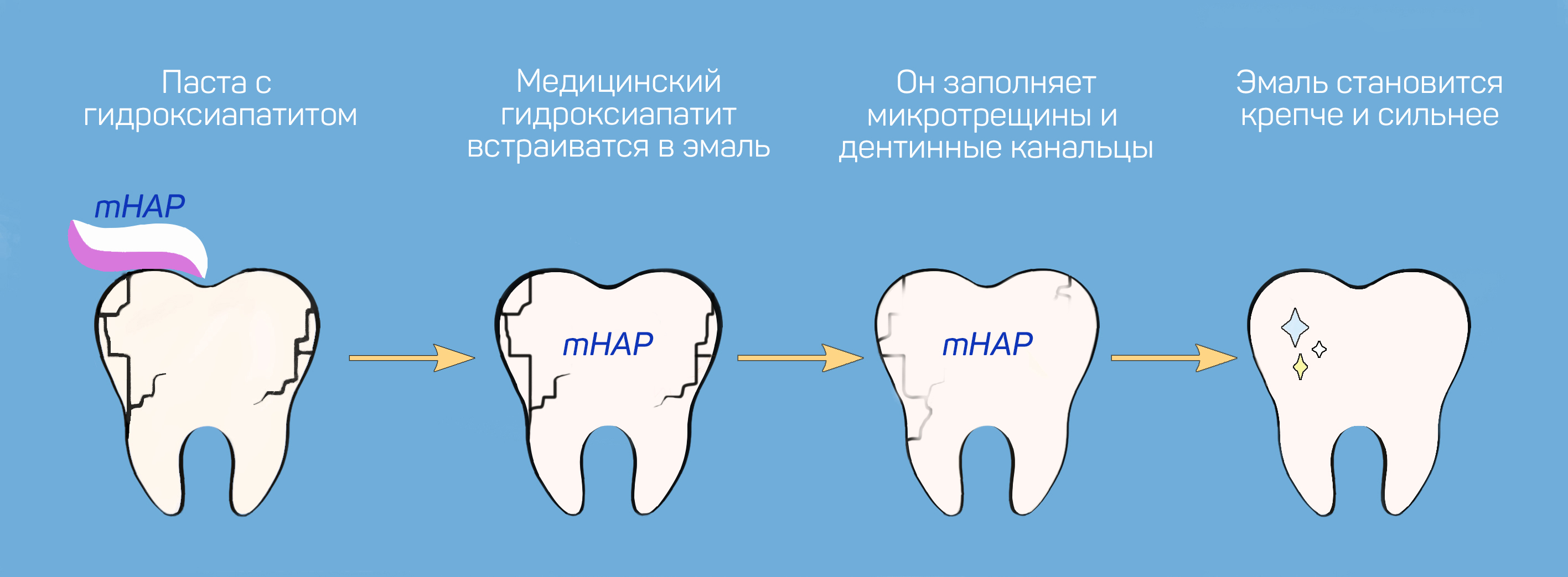
Наногидроксиапатит
Медицинский наногидроксиапатит по составу не отличается от натурального. Благодаря этому он легко встраивается в кристаллическую решётку эмали и решает следующие задачи.
Зубные пасты с гидроксиапатитом
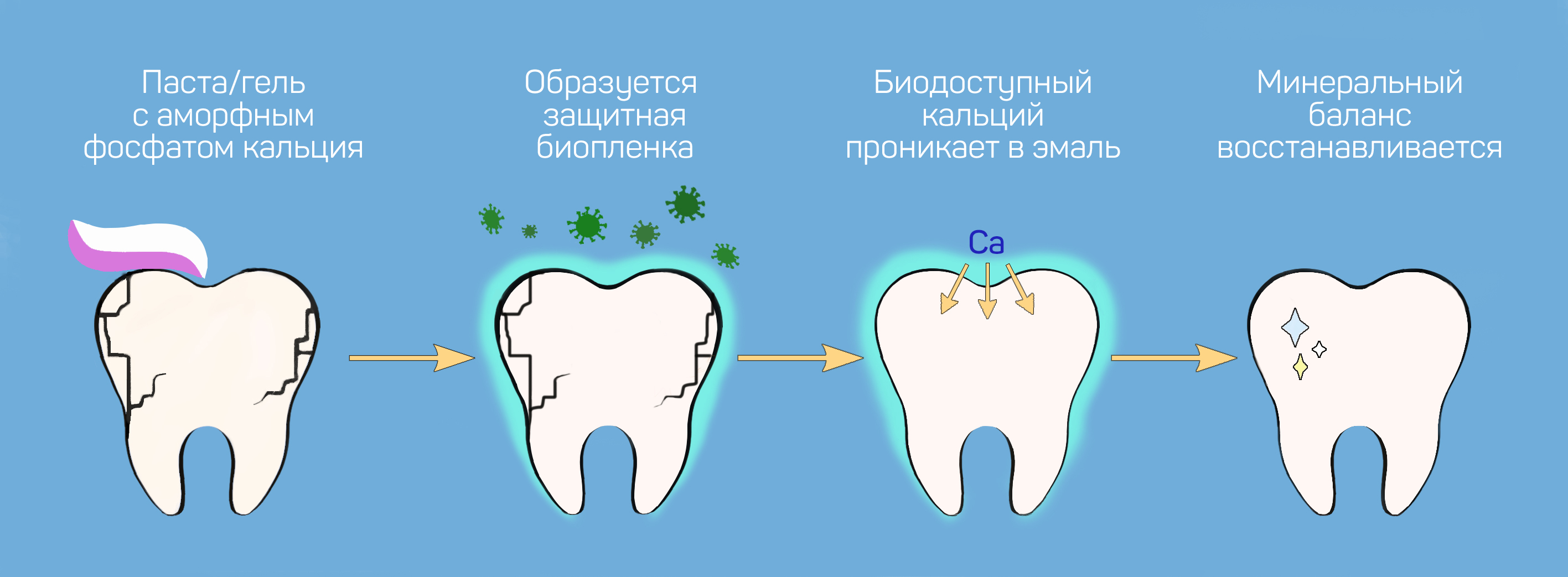
Аморфный фосфат кальция
При контакте со слюной и гидроксиапатитом этот элемент образует на поверхности зубов особую биоплёнку, которая:
Важно!
Так как активное вещество получают из казеина коровьего молока, этот способ укрепления эмали не подойдёт людям с аллергией на молочный белок.
Гели и зубные пасты с аморфным фосфатом кальция
Теобромин
Это самый молодой, инновационный способ укрепления эмали с помощью экстракта какао-бобов. Теобромин стимулирует образование собственных кристаллов гидроксиапатита в эмали. Пасты с теобромином выпускает марка Theodent.
Перечисленные выше средства можно использовать дома для профилактики и лечения незначительных проблем полости рта.
Детские зубные пасты для укрепления эмали
Фтор — важный компонент в уходе за детскими зубами. Однако при частом проглатывании пасты фтор накапливается в организме и может вызвать неприятные последствия.
От паст для взрослых детскую пасту для укрепления эмали отличает концентрация фторидов (химических соединений фтора).
Для малышей лучше приобрести пасту без фтора, детям постарше — с небольшим его содержанием (до 500 ppm), а лучше с его органической формой (аминофторид, олафлур).
Витамины для зубной эмали
Кальций — основной элемент костной системы. Однако организм его усваивает не полностью: необходимо дополнять кальций витаминами D и E.
Кальция гидроксиапатит и микросфокусированный ультразвук для подтяжки кожи: результаты исследования
В настоящем исследовании мы оценивали клиническую эффективность и переносимость методов для коррекции возрастных изменений кожи лица, шеи и зоны декольте, а также удовлетворенность пациентов. Кроме того, были изучены патогистоморфологические характеристики для установления совместимости данной комбинации.
Методы исследования
Дизайн
Рандомизированное, сравнительное клиническое исследование с обработкой разных зон разными методами (split-face) и проведением иммуногистохимического анализа.
Выборка
Девятнадцать здоровых женщин-добровольцев от 35 до 45 лет с индексом массы тела (ИМТ) Рисунок 1. Области обработки MFU-V
Введение препарата и обработка микросфокусированным ультразвуком проводились под местной анестезией. Крем наносился на 30–45 минут до начала лечения. Место введения препарата дезинфицировалось 0,05% раствором хлоргексидина диглюконата. Филлер вводился по методу профессора Юцковской.
Суть метода
Препарат вводился в виде раствора (разведение 0,9 % хлоридом натрия; соотношение 1:2, на 3 мл препарата 6 мл хлорида натрия) подкожно на границе дермы и гиподермы в линейно-ретроградной технике вдоль линий Лангера от периферии к центру и сверху вниз. Иглу вводили на всю длину (28G × 19 мм) со скосом вверх под минимальным углом к поверхности кожи.
Данные экспертной оценки и измерение ощущений пациентов
Изменение объема в области под подбородком и шейно-нижнечелюстного угла
Проводилось во время визитов D01, M08 и M12. С помощью сканера делались мгновенные снимки с коррекцией на микродвижения пациенток. Последующие расчеты выполняли с использованием программы PhoenixCAS. Изменение объема варьировалось от 0,4 до 24,1 см 9-13 или от 0 до 8 градусов; негативное изменение наблюдалось только у одной пациентки, у которой объем под подбородком увеличился на 3,9 см 9-13 (14 градусов).
Оценка независимыми экспертами на основе Шкалы оценки эстетического результата компании Merz (Merz Aesthetics Scales ™ )
Возрастные изменения оценивались следующим образом: морщины марионетки 2,47 ± 0,8, контур линии подбородка 2,2 ± 0,7 и шея 2,1 ± 0,7 баллов. Через 15 месяцев эти показатели изменились следующим образом: 1,8 ± 0,7, 1,89 ± 0,56 и 1,7 ± 0,6 баллов, соответственно. Таким образом, выявлено уменьшение выраженности возрастных изменений во всех обработанных областях по сравнению с исходным уровнем по оценке исследователя.
Субъективное ощущение интенсивности боли пациенток
Удовлетворенность результатами лечения по всем обработанным областям по шкале GAIS увеличилась к 5 этапу исследования (таблица 1)
Таблица 1. Результаты удовлетворенности пациентов по шкале GAIS
| Этап 2 | Этап 5 | |
|---|---|---|
| Исследователь | ||
| Левая сторона | 1,30 ± 0,58 | 3,00 ± 0,80 |
| Правая сторона | 2,00 ± 0,57 | 2,78 ± 0,80 |
| Пациент | ||
| Левая сторона | 1,68 ± 0,90 | 2,47 ± 1,00 |
| Правая сторона | 1,70 ± 0,90 | 2,40 ± 1,00 |
Данные сравнительной морфологической оценки изменений кожи с передней стенки живота
Результаты
Мы показали, что после комбинированной обработки (введение разведенного CaHA и воздействие MFU-V) наблюдалось значительное увеличение большинства индикаторов профилеративной и синтетической активности клеток.
Полученные результаты также согласуются с данными гистологического исследования, полученными при ведении клинического случая, описанного Casabona G и соавт. 9-13 : обработка MFU-V не привела к изменению гистологических характеристик или эффективности CaHA; напротив, она помогла усилить образование новых волокон коллагена и эластина и улучшить их качество.
Гидроксилапатит — самый главный из фосфатов кальция
Гидроксилапатит — самый главный из фосфатов кальция
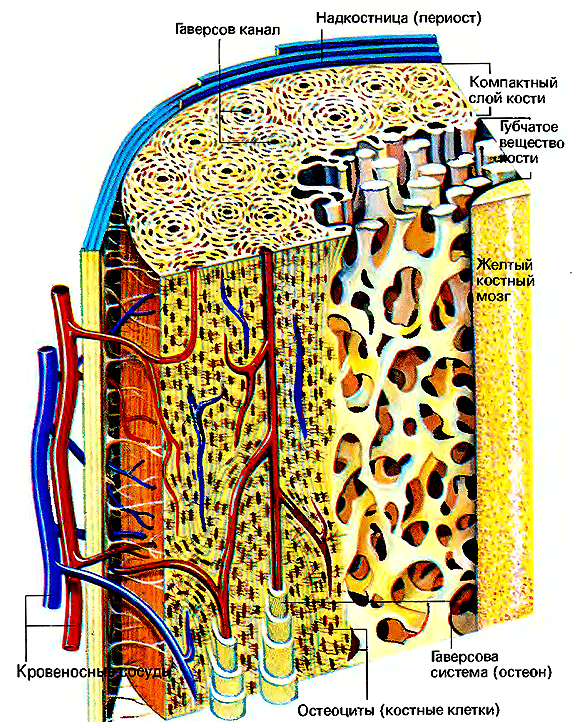
Схематичное изображение трубчатой кости. Разумеется, человеку пока не под силу искусственно создать нечто подобное, но ведь можно заставить сам организм ускорить естественный рост такой ткани!
Автор
Редакторы
Статья на конкурс «био/мол/текст»: Заболевания, связанные с повышенной скоростью деградации костной ткани у пожилых людей, все острее ощущаются населением. Во многом это связано с увеличением продолжительности жизни вообще и состариванием так называемого «золотого миллиарда». Новые материалы на основе фосфатов кальция, пригодные для имплантации больным остеопорозом, могут частично решить эту проблему.
Конкурс «био/мол/текст»-2013
Эта статья представлена на конкурс научно-популярных работ «био/мол/текст»-2013 в номинации «Лучший обзор».
Спонсор конкурса — дальновидная компания Thermo Fisher Scientific. Спонсор приза зрительских симпатий — фирма Helicon.
Современная наука ставит одной из главных своих целей продление длительности человеческой жизни. Разрабатываются новые методы лечения заболеваний, облегчается жизнь стариков, многие болезни, считавшиеся неизлечимыми ранее, практически полностью побеждены человечеством. Однако некоторые возрастные изменения заложены в организм генетически, и обычными методами с ними бороться практически невозможно.
Заболевания костной ткани занимают одну из первых строчек в рейтинге наиболее часто встречающихся у пожилых людей проблем. С возрастом нарастает потеря массы кости. Особенно от этого страдают женщины — из-за более активного вымывания из организма катионов кальция, служащего основой нашего скелета. Потеря массы костной ткани может достигать 40% у женщин старше 70 лет [1]!
Это заболевание называется остеопорозом. Пораженные им кости становятся хрупкими, с трудом справляясь с возложенной на них нагрузкой. В случае перелома срастаться такая кость будет значительно дольше, чем здоровая. Как уже упоминалось выше, главной причиной таких изменений является постепенное вымывание кальция из организма. На протяжении всей жизни у нас в организме происходят два равновесных процесса: непрерывное образование новой костной ткани и резорбция (растворение) старой. К старости равновесие смещается в сторону резорбции, и новая ткань просто не успевает занять место растворенной. А избыток катионов кальция, являющегося основным продуктом этого процесса, выводится из организма естественным путем.
Что же представляет собой человеческая кость? На рисунке 1 схематически изображено строение кости человека. Основа состоит из композита (материала, составленного из других материалов и обладающего свойствами, отличными от свойств «родителей»), представляющего собой кристаллы нестехиометрического гидроксилапатита с химической формулой:
и длинных цепочек белка коллагена [2]. Этот композит представляет собой пространственную матрицу, заполненную остеобластами, остеокластами, макрофагами, сетью капилляров и прочим, но в рамках этой статьи мы подробнее строение кости рассматривать не будем.
Рисунок 1. Строение трубчатой кости. Хорошо видно, что кость состоит из последовательных слоев: внешнего — надкостницы, — затем идет компактное вещество кости, губчатое вещество кости и желтый костный мозг.
Существуют различные способы сымитировать костную ткань с помощью различных материалов. Для этого используются керамические, металлические, пластиковые и даже стеклянные протезы, но все они далеки от идеала. Полноценной такую замену назвать нельзя. Одна из проблем, к примеру, — различие прочности настоящей и искусственной кости. Если материал слишком прочный, то нагрузка, которой подвергается эта часть скелета, начинает распределяться неравномерно. Наиболее прочная часть «забирает» львиную долю нагрузки, и на стыке протеза и настоящей кости возникает избыточное разрушение костной ткани. Поэтому искусственная кость должна как можно точнее соответствовать заменяемой части скелета по механическим свойствам.
Очевидно, что материал не должен быть токсичным и вызывать отмирание окружающей протез ткани. Но многие материалы, даже не являясь токсичными для человека, начинают при попадании в организм покрываться соединительной тканью. Так организм изолирует чужеродный объект. По толщине такой капсулы, называемой так же шрамом, судят о биосовместимости материала. В идеале искусственный материал должен срастаться с организмом и не оставлять никаких следов. Такой материал называют биоактивным. Примером может служить стеклянный материал BIOGLASS [3]. Служит такое «стекло» и для крепления имплантов из других материалов, и как самостоятельный биоактивный материал для имитации кости. Применяется он главным образом в стоматологии. При попадании импланта в среду организма клетки костной ткани «прорастают» в его поверхностный слой, прочно связывая имплант с костью. Для увеличения числа таких связей и, следовательно, прочности соединения необходимо увеличивать площадь поверхности материала. Чем он более пористый, тем прочнее связывается кость с искусственным элементом [4].
Таким образом, полная замена кости на искусственный материал нежелательна. Наиболее предпочтительным путем к регенерации костной ткани на сегодняшний день стала замена поврежденной части ткани на биоактивный протез, который срастется с окружающими тканями, затем ускорит естественную регенерацию и постепенно растворится без следа, оставив на костном дефекте новую ткань.
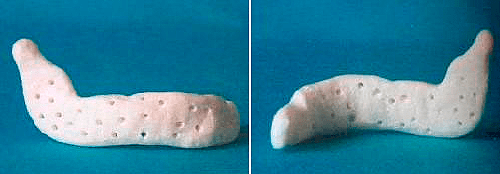
Рисунок 2. Индивидуальный протез фрагмента нижней челюсти для больного саркомой нижней челюсти. Протез изготовлен из полимера и гидроксилапатита.
Традиционно в ортопедии для этих целей применяется гидроксилапатит. Стехиометрически гидроксилапатит (далее для краткости мы будем называть его ГАП) наиболее приближен по составу к минеральной составляющей кости (по сравнению с другими фосфатами кальция). Его формула:
Далее в статье мы расскажем, в чем преимущества и недостатки этого материала по сравнению с другими.
Что собой представляет гидроксилапатит?
Долгое время считалось, что гидроксилапатит Ca10(PO4)6(OH)2 — идеальный в плане биосовместимости материал для восстановления поврежденных костей и зубов. Первая документированная попытка использовать ГАП в качестве остеозамещающего материала относится к 1920-м годам. Однако успешное применение ГАП в указанных целях совершилось только через 60 лет. Гидроксилапатит прекрасно совместим с мускульной тканью и кожным покровом; после имплантации он может напрямую срастаться с костной тканью в организме. Высокая биосовместимость гидроксилапатита объясняется кристаллохимическим подобием искусственного материала костному «минералу» позвоночных.
Название минерала происходит от греческого «апатао» — обманываю, поскольку красиво окрашенные природные разновидности апатитов часто путали с бериллами и турмалином. Несмотря на очень широкий спектр окраски природных апатитов, вызванных различными примесями, низкая твердость (он является эталоном значения 5 по 10-балльной шкале Мооса) не позволяет рассматривать его как полудрагоценный поделочный камень.
Известно, что костный минерал содержит в заметном количестве (
8% по массе) карбонат-ионы; существует также природный минерал сходного состава — даллит. Считается, что карбонат-ионы могут занимать две разные позиции в структуре ГАП, замещая гидроксил и/или фосфат-ионы с образованием карбонатгидроксилапатита (КГАП) А- и Б-типа, соответственно. Апатит биологического происхождения относится к Б-типу. Замещение фосфат-ионов карбонат-ионами приводит к уменьшению размеров кристаллов и степени кристалличности ГАП, а это сильно затрудняет исследование природных биоминералов. Увеличение доли карбонат-ионов в составе гидроксилапатита вызывает закономерные изменения в равновесной форме кристалла. Игольчатые кристаллы «сплющиваются» до пластин, которые очень похожи на кристаллиты существующего в организме апатита [5]. Таким образом, внесением в синтезируемый минерал небольшой доли карбонат-ионов можно получить материал, аналогичный биогенному и по химическому составу, и геометрически.
Как используется гидроксилапатит?
Существуют различные методы синтеза гидроксилапатита. Их можно условно разделить на высоко- и низкотемпературные. Высокотемпературные методы не представляют для нас большого интереса, так как полученные таким образом материалы практически не биоактивны. Низкотемпературные методы можно разделить на две большие группы: гидролиз (в том числе так называемые гидротермальные методы синтеза) и осаждение из раствора. Интересен так же комбинированный метод так называемого золь–гель синтеза. В нем сухой остаток геля подвергается разложению при относительно невысокой температуре 400–700 °С (по сравнению с высокотемпературным синтезом). Материалы, полученные таким образом, представляют собой твердую, пористую керамику, по химическому составу и физическим свойствам напоминающую минерал кости.
Как реагирует организм на кальций-фосфатную керамику?
Биоактивность — комплексная характеристика совместимых с организмом материалов, учитывающая, помимо воздействия на биологические процессы роста и дифференциации клеток, также:
Среди требований, которые предъявляются к биоактивным материалам, применяемым в медицинской практике для восстановления целостности костной ткани, на первом месте стоят относительно высокая скорость растворения (порядка десятков мкм в год) — так называемая биорезорбируемость. Активную роль в биохимических реакциях, протекающих на границе раздела кость/имплантат с участием клеток специфических для процесса остеосинтеза, играет поверхность. Говоря о скорости резорбции материала, находящегося в межтканевой жидкости, принято сравнивать новые материалы с уже используемыми в медицине — керамикой на основе гидроксилапатита или β-трикальцийфосфата. Крупнокристаллическая керамика на основе ГАП резорбируется медленно, так что включения искусственного материала можно обнаружить в кости и через много лет. Керамика, полученная с использованием β-Ca3(PO4)2, растворяется столь быстро, что растущая кость не успевает заполнить образующиеся полости. Скорость растворения материала зависит от множества факторов: площади поверхности, строения, состава, дефектности материала. Эти характеристики определяют отклик организма на инородный имплантат. Биоактивные материалы характеризуются быстрым срастанием с костной тканью через образование промежуточного слоя ГАП, образующегося двумя возможными путями:
Важная процедура оценки биоактивности подразумевает тестирование in vivo. Это дорого и долго, а также сопряжено с риском. Однако ведется активная разработка методик, позволяющих уже на раннем этапе доклинических испытаний ранжировать материалы по степени биоактивности в ходе относительно простых экспериментов in vitro, моделирующих процессы в организме человека — растворение материала и осаждение ГАП на поверхности материала из растворов, подобных жидкостям организма.
Исследование биоактивности материалов проводят с использованием раствора, имитирующего ионный состав межтканевой жидкости человека. Компактные образцы исследуемого материала помещают в раствор на несколько суток при 37 °С. Процесс осаждения карбонатгидроксилапатита из модельного раствора на поверхность материала контролируют методами рентгенофазового анализа, ИК-спектроскопии и растровой электронной микроскопии.
Существует необходимость регулировать биорезорбируемость искусственных материалов, в зависимости от их назначения. Такая возможность существует благодаря различию свойств материалов с разным составом. Чтобы сделать образец более резорбируемым, нужно увеличить долю карбонат- и силикат-ионов в кристаллической решетке материала.
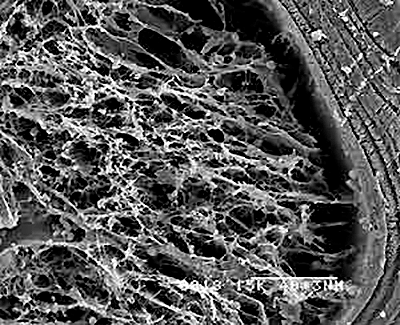
Рисунок 3. Ажурный слой частично резорбированной керамики. Снимок со сканирующего электронного микроскопа. Здесь изображен фрагмент материала, подвергнутый растворению в модельном растворе in vitro. Справа можно увидеть, каким был материал до начала резорбции.
Наилучшую биоактивность в таких исследованиях проявляет кремнийсодержащий материал. На его поверхности образуются силанольные (—SiOH) группы, активно участвуя в минерализации внешнего слоя имплантата. Такой материал интенсивно обменивается ионами с раствором: силанольные группы прочно связывают ионы кальция, способствуя формированию слоя аморфного фосфата кальция на поверхности, расслоение и кристаллизация которого приводит к образованию ажурного слоя, состоящего из частиц ГАП размером
10 нм (рис. 3). Различия в толщине такого слоя могут служить мерой биоактивности материала: чем он толще, тем проще кость будет встраивать этот материал в свою структуру.
Еще одним из важнейших свойств современных имплантационных материалов является остеоиндуктивность — способность поддерживать жизнедеятельность остеобластов и стимулировать эктопическое (вне кости) образование костной ткани de novo. Это важнейшее свойство для искусственных имплантов. Дело в том, что для инициации костеобразования вокруг импланта необходимо микроокружение частицами живой кости. Вновь образующаяся кость постепенно срастается с окружающими имплантированными частицами, «перескакивая» с одной на другую.
Считается, что наиболее активным с точки зрения остеосинтеза является аморфная модификация гидроксилапатита. Однако в достаточной степени кристалличный ГАП с размерами кристаллитов, приближающимися к размерам кристалла в костной ткани (20–40 нм 3 ), может показывать результаты на порядок выше аморфных цементов, использующихся в настоящее время [6].
Биоинертные материалы никак не влияют на процесс остеосинтеза. На поверхности изготовленных из них имплантатов происходит образование фиброзной ткани, препятствующей образованию связи имплантата с костью. Существует значительная вероятность отторжения таких материалов организмом, часто сопровождающегося воспалительными процессами. Тем не менее, полностью отказаться от этих материалов пока нельзя, поскольку они дешевы и легки в обработке. Основные проблемы, которые решаются при проектировании имплантатов из биоинертных материалов, — приближение упругих характеристик имплантата к характеристикам кости, а также снижение скорости коррозионных процессов.
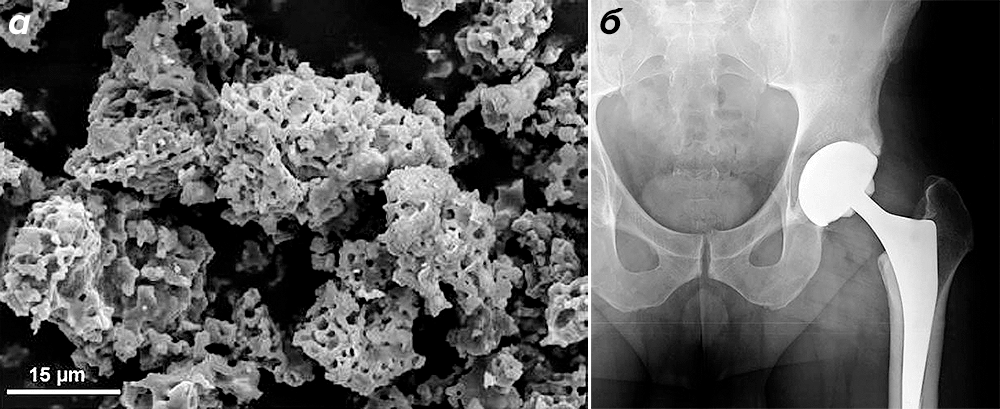
В отличие от биоинертных синтетических материалов на основе полимеров и металлов, керамика на основе фосфатов кальция биосовместима и биоактивна, а значит, является наиболее перспективным материалом для костных имплантатов. Главным ее недостатком является хрупкость. Пока что наилучшим выходом является применение композитов из покрытых кальцийфосфатной керамикой металлов или полимеров (рис. 4). Они хорошо обеспечивают интеграцию материала в костную ткань, не позволяя образовываться фиброзной ткани вокруг биоинертного металла. Со временем протез очень прочно срастется с окружающей костью, которая заменит слой ГАПа. Процент отказа таких протезов значительно ниже, чем у металлических и пластиковых аналогов.
Рисунок 4. Покрытие из биоактивной керамики на протезе тазобедренного сустава. а — Пористая структура керамического покрытия. б — Рентгеновский снимок протеза, имплантированного на место тазоберенного сустава. Сам протез изготовлен из титана и полимеров.
Как придать ГАПу новые свойства?
Не все свойства, необходимые для протезирования, заложены в гидроксилапатит природой. Однако какие-то терапевтические эффекты к материалам можно добавить, усложняя состав композита дополнительными веществами. Однако это не очень удобно, так как усложнит клинические испытания, да и разрабатывать такой материал значительно труднее. Но можно добиться прогресса и получить уникальные свойства, незначительно модифицируя состав и вводя в решетку гидроксилапатита примеси других катионов и анионов. Изменяя состав керамики, можно варьировать ее прочность, размер и форму кристаллитов, скорость растворения и множество других параметров.
Модифицировать кальций-фосфатную керамику можно введением множества компонентов. Возможности для выбора такого модификатора (легирующего компонента) довольно широки: в зависимости от размеров замещаемого иона можно менять состав как на доли, так и на десятки процентов. Например, малые концентрации ионов кремния активируют регенерацию костной ткани, играя роль антигена для соответствующих клеток.
Интересны, например, биологические свойства катионов лантаноидов [7]. Применение ионов лантаноидов в пероральных препаратах ограничено их низкой способностью проходить сквозь стенки желудка и кишечника. Для улучшения доступности катионов лантаноидов можно использовать липофильные оболочки комплексов. Вещества, способные проникать сквозь клеточные мембраны, называются ионофорами. (Подробнее о них можно прочитать в статье «Неизвестные пептиды: „теневая“ система биорегуляции» [8].) Такая оболочка позволит им проникать сквозь мембрану клетки. Этот метод доставки ионов в остеобласты может стать принципиально новым подходом к лечению целого ряда заболеваний кости.
Благодаря высокому сродству к фосфатам лантаноиды прочно связываются в структуре минералов, составляющих основу костной ткани, не нарушая при этом их структуру. Лантаноиды способны даже замещать кальций в костях, параллельно подавляя развитие клеток, отвечающих за разрыв и резорбцию костной ткани. Эта способность «подражать» функциям ионов кальция позволяет рассматривать лантаноиды в качестве компонента для терапии заболеваний кости.
Частичный обмен катионов кальция на катионы лантаноидов открывает широкие перспективы для целого ряда различных материалов на основе фосфатов кальция. С помощью лантаноидов можно влиять на физические свойства получаемой керамики, регулировать скорость резорбции и даже использовать этот материал как препарат для лечения остеопороза.
На практике ГАП используют в виде цемента или пористых вкладок для заполнения трещин, каверн и других дефектов в ортопедии и челюстно-лицевой хирургии. В виде пленки его наносят на протезы из других материалов (чаще всего металлических или полимерных) для снижения риска отторжения и лучшей фиксации за счет образования новых тканей вокруг протеза. Как правило, это протезы тазобедренного сустава и различные зубные протезы.
Разумеется, искусственно синтезированный гидроксилапатит далек от идеала, и в качестве материала для имплантации при создании полноценных протезов крупных костей или суставов его пока использовать нельзя. Но использование его замечательных свойств, таких как сравнительно простое регулирование состава и морфологии кристаллитов, биоактивность и способность ускорять естественную регенерацию, позволяет делать на его основе препараты для исправления и профилактики костных дефектов уже сейчас. А это значит, что в обозримом будущем мы сможем значительно упростить лечение остеопороза, ускорить излечение переломов, а, возможно, даже и возвращать утраченные конечности с помощью искусственных костей.