гидратация мочевого пузыря что это такое
Гидродистензия мочевого пузыря
Гидродистензия мочевого пузыря часто выполняется для постановки диагноза интерстициального цистита.
Гидродистензия — это метод увеличения мочевого пузыря с помощью жидкости. Жидкость (солевой раствор или раствор глицина) вводится в мочевой пузырь под довольно высоким давлением (80-100 см. вод. ст.). Когда жидкость выпускается наружу из мочевого пузыря, у пациентов с интерстициальным циститом обычно появляется небольшое кровотечение из ткани мочевого пузыря в местах, называемых «гломеруляциями». Процедура обычно проводится под общей или спинальной анестезией, потому что многие пациенты могут не выдержать чувство дискомфорта в мочевом пузыре. Чувство дискомфорта возникает непосредственно при проведении цистоскопа в мочевой пузырь.
При анестезии мочевого пузыря можно определить, какое давление выдерживает мочевой пузырь, какова его емкость. У большинства пациентов с интерстициальным циститом это обычно нижняя граница нормы (меньше, чем 800 куб. см).
Биопсия мочевого пузыря может быть взята при цистоскопии из наиболее измененных участков стенки мочевого пузыря. Кусочек ткани, который берут при биопсии, размером такой как эта буква «О». При необходимости берется несколько образцов ткани. Обычно биопсию оценивают на наличие воспаления и/или рака.
У 30% пациентов гидродистензия может быть также использована с целью лечения, для некоторого облегчения симптомов. Как правило, гидродистензия используется не очень часто из-за низкого процента эффективности, инвазивности процедуры, рецидивирования симптомов у большинства пациентов.
Что ожидать перед процедурой гидродистензии
•Пациенту может быть назначена медицинская санация и специальные лабораторные исследования, необходимые для процедуры гидродистензии.
•Если есть проблемы с сердцем, необходимо дополнительно обратиться к своему кардиологу для устранения проблем. Это может повлечь за собой дополнительные исследования, такие как эхокардиография или радиологический стрессовый тест.
•Все дополнительные исследования должны быть назначены в соответствии с первичным физикальным обследованием или кардиологическим анамнезом. Каждый пациент, который имеет протезированный клапан сердца или любую причину для антибактериальной терапии, должен сказать об этом хирургу и анестезиологу.
•Аспирин, мотрин, ибупрофен, адвил, алка-зельцер, витамин Е, тиклид, кумадин, ловенокс, целебрекс, вольтарен, виокс, плавикс и некоторые другие препараты для лечения артрита могут быть причиной кровотечения и должны быть отменены за неделю до операции.
•Нельзя ничего есть и пить после полуночи перед процедурой гидродистензии. Также, нельзя употреблять конфеты и жвачку после полуночи.
Чего ожидать после процедуры гидродистензии
Пробуждение пациента происходит в палате восстановления. У пациента может возникнуть неудержимое желание помочиться, т. к. манипуляции в мочевом пузыре вызывают раздражение, инициирующее это ощущение. Мочевой пузырь опорожняется сразу после процедуры. Медицинская сестра может предложить пациенту подкладное судно или мочеприемник, если будет необходимо, однако мочи может выделиться не много.
Некоторым пациентам (примерно 1 из 10) временно устанавливают катетер в мочевой пузырь, он удаляется в палате восстановления или на следующий день. Это делается с различными целями, обычно это безопасная процедура.
Обезболивающие препараты могут избавить пациента от дискомфорта, вызываемого процедурой гидродистензии. Тип и количество лекарства определяется для каждого конкретного пациента индивидуально.
В течение нескольких дней после гидродистензии пациенту назначаются пероральные антибактериальные препараты для предупреждения развития инфекции мочевых путей.
В первое время и первые несколько дней при мочеиспускании может быть небольшое жжение. Потом это чувство пройдет или может несколько уменьшиться при употреблении большого количества жидкости.
Возможно присутствие крови в моче. Это нормально и обычно проходит в течение нескольких последующих дней. Гематурия (наличие крови в моче) обычно умеренная и может уменьшиться при увеличением потребления жидкости и ограничении физической активности в течении нескольких дней. Если гематурия продолжится или будет увеличиваться, необходимо связаться со своим лечащим врачом. Пациенты иногда видят маленькие темные включения в моче. Это может свидетельствовать об отделении корочек из области гидродистензии — не стоит переживать по поводу этого.
Неотложное и частое мочеиспускание наряду с тазовой болью или дискомфортом, возникшие вследствие процедуры, могут продлиться несколько недель, и в последствии они постепенно уменьшаются. После нескольких недель около 30% пациентов отмечают уменьшение симптомов. Улучшение состояния может продлиться от нескольких недель до года и более. Среднее время улучшения симптоматики (когда это происходит) около 3 месяцев.
Преимущества гидродистензии
Основное преимущество гидродистензии заключается в том, что она помогает установить диагноз интерстициального цистита. Диагноз интерстициального цистита устанавливается на основании совокупности истории болезни, физикального обследования и других исследований совместно с этой процедурой. Кроме помощи в диагностике интерстициального цистита, гидродистензия помогает определить прогноз. Например, выявление при гидродистензии маленькой емкости мочевого пузыря предполагает худший прогноз, чем у пациентов с большей емкостью мочевого пузыря. После гидродистензии примерно у 30% пациентов происходит временное улучшение симптомов, связанных с интерстициальным циститом.
Осложнения гидродистензии
•Инфекция и инфекционные осложнения — для профилактики обычно проводится внутривенная антибиотикотерапия в течение процедуры и /или пероральная антибиотикотерапия в течение нескольких дней после процедуры.
•Кровотечение — гидродистензия при интерстициальном цистите обычно является причиной кровотечения из поверхности мочевого пузыря. Поэтому моча может быть слегка окрашенной кровью. Изредка могут выходить небольшие сгустки крови. Это может наблюдаться в течение нескольких дней и, периодически, в течение следующих нескольких недель. Если кровотечение прогрессирующе увеличивается, необходимо позвонить лечащему врачу немедленно.
•Перфорация мочевого пузыря — это крайне редкое осложнение, которое обычно случается при сильно пораженном мочевом пузыре. В этом случае для ускорения заживления в мочевой пузырь устанавливается уретральный катетер на 7-10 дней. Очень редко при перфорации мочевого пузыря необходимо «открытое» оперативное вмешательство.
•Некроз мочевого пузыря — некроз означает, что отмирает стенка мочевого пузыря, вероятно, из-за потери ее кровоснабжения (подобно «сердечному приступу»). Это чрезвычайно редкое осложнение, описано всего три случая в мировой литературе.
Альтернатива гидродистензии
•«Инъекции анестетика» — чтобы определить источник тазовой боли, анестетик вводится в мочевой пузырь. Если боль уменьшается, ее источник, вероятнее всего, — мочевой пузырь. Нежелательные эффекты — кратковременная задержка мочи и, редко, кратковременное усиление боли, когда анестезирующий препарат перестает действовать.
•Тест калиевой чувствительности — при введении раствора калия хлорида в мочевой пузырь симптомы интерстициального цистита (неотложное, учащенное мочеиспускание, боль) могут быть вызваны в амбулаторных условиях. На практике эта процедура выполняется крайне редко, потому что она может вызвать существенный дискомфорт у пациентов.
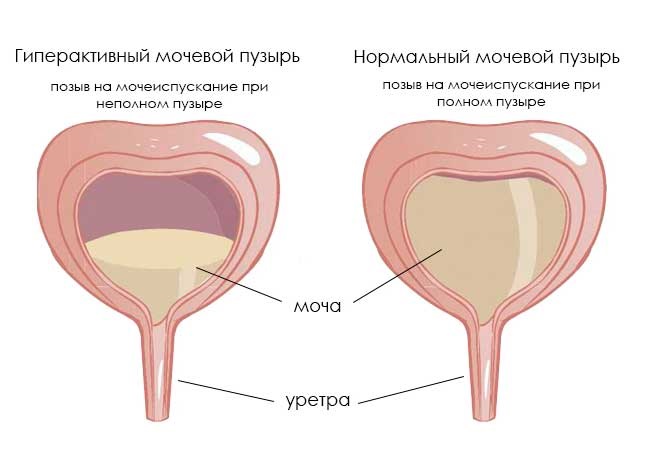
Гиперактивный мочевой пузырь: как справиться с деликатной проблемой
Гиперактивный мочевой пузырь (гиперрефлекторный, ГАМП или ГМП) – форма нейрогенного мочевого пузыря (НМП), при котором у человека появляются проблемы с произвольным сознательным контролем мочеиспускания. Эта форма НМП встречается чаще, чем гипорефлекторная. Основной симптом – частое мочеиспускание, которое может сопровождаться увеличением объема мочи. ГАМП – серьезная проблема, поскольку по распространенности сравним с гипертонией, хроническим бронхитом, астмой и заболеваниями сердца.
Из-за чего может развиться гиперактивный мочевой пузырь
Гиперактивный мочевой пузырь у женщин встречается чаще, чем у мужчин – 60% против 40%. Основной причиной выступают нарушения в работе нервной системы, вызванные:
Еще ГАМП развивается на фоне сахарного диабета, отравления организма алкоголем или химическими веществами. Также расстройство может быть врожденным из-за аномалий в строении мочевыделительного канала.
У мужчин ГАМП может вызывать аденома простаты, из-за которой сужается мочеиспускательный канал. У женщин синдром гиперактивного мочевого пузыря имеет факторы риска, которые увеличивают вероятность столкнуться с таким заболеваниям. В список таких факторов включают:
Еще с ГАМП можно столкнуться в период климакса, когда организму недостает гормонов эстрогенов. Чувствительность детрузора (его сокращение приводит к мочеиспусканию) может повышаться при заместительной гормонотерапии при раке молочной железы. Не меньшее значение в развитии ГАМП имеют стрессовые ситуации и вредные условия труда.
Признаки гиперактивного мочевого пузыря
Нейрогенный гиперактивный мочевой пузырь проявляется в частом мочеиспускании (поллакиурии), причем малыми порциями при незаполненном пузыре. На его фоне может наблюдаться полиурия – увеличенное количество мочи, свыше 1800-2000 мл при норме 1000-1500 мл. В ряде случаев за сутки может выделяться более 3 л мочи. Причем желание помочиться может вызывать звук льющейся воды.
Еще при ГМП возможно недержание мочи, иногда возникающее даже от любого напряжения брюшных мышц. Чаще всего это ургентное недержание, при котором резко появляется желание помочиться, после чего происходит непроизвольное выделение мочи. Другой характерный признак – ноктурия. Это необходимость просыпаться ночью для мочеиспускания более 1-2 раз. Ноктурия, поллакиурия и полиурия могут возникать как одновременно, так и изолировано.
Нередко ГМП сопровождается симптомами, которые указывают на расстройство вегетативной нервной системы. К таким признакам относятся повышение артериального давления и гипергидроз (усиленное потоотделение). Еще ГАМП влияет на социализацию. Человек постоянно боится не успеть в туалет, переживает из-за неприятного запаха. Из-за произвольного выделения мочи может развиваться экзема или мочевой дерматит.
Как лечат ГАМП
Лечение гиперактивного мочевого пузыря у мужчин и женщин производится по одним и тем же принципам. Но терапия не имеет единой схемы. Она носит, в основном, паллиативный характер, т. е. проводится для улучшения качества жизни пациента. Можно сказать одно – лечение гиперактивного мочевого пузыря всегда сложное и комплексное. К основным методам относятся:
В самых сложных случаях, когда не помогают режим и лекарства, прибегают к малоинвазивным операциям. Но решение об их проведении принимает врач. При ГАМП необходимо обратиться к урологу. В Государственном центре урологии вы можете получить квалифицированную медицинскую помощь в рамках ОМС. Для этого вам необходимо записаться на прием к урологу, воспользовавшись формой на сайте или нашим контактным номером.
Лечение функциональных нарушений опорожнения мочевого пузыря
Лечение больных с функциональными нарушениями опорожнения мочевого пузыря является насущной проблемой нейроурологии. Это связано с тем, что до настоящего времени не разработано эффективных и этиопатогенетически обоснованных методов лечения таких больных
Лечение больных с функциональными нарушениями опорожнения мочевого пузыря является насущной проблемой нейроурологии. Это связано с тем, что до настоящего времени не разработано эффективных и этиопатогенетически обоснованных методов лечения таких больных.
Выделяют нейрогенные, миогенные (миопатии) и психогенные (неврозы, шизофрения, истерия и др.) факторы, лежащие в основе функциональных нарушений опорожнения мочевого пузыря. Нейрогенные нарушения и повреждения — основная причина таких нарушений. В отсутствие причины функциональных нарушений опорожнения мочевого пузыря следует думать об идиопатических формах заболевания.
Согласно классификации Международного общества по удержанию мочи, функциональные нарушения опорожнения мочевого пузыря — это результат недостаточной функции мочевого пузыря, гиперактивности уретры или следствие комплексного воздействия обоих нарушений [1]. Недостаточная функция мочевого пузыря возникает вследствие снижения или отсутствия сократительной способности детрузора (арефлексия), которые встречаются при локализации повреждения или неврологического поражения в области фронтальных долей и моста головного мозга, сакрального отдела спинного мозга, при повреждении волокон конского хвоста, тазового сплетения и нервов мочевого пузыря, а также при рассеянном склерозе. Гиперактивность уретры — это следствие наружной детрузорно-сфинктерной диссинергии (ДСД) или нерасслабляющегося (спастического) поперечно-полосатого (п/п) сфинктера уретры, также может проявиться как вариант синдрома Фоулера у женщин. При этом наружная ДСД наблюдается при супрасакральном уровне поражения спинного мозга.
В литературе имеются лишь единичные сообщения о распространенности функциональных нарушений опорожнения мочевого пузыря. Так, P. Klarskov и соавт., оценивая обращаемость в лечебные учреждения Копенгагена, выявили, что ненейрогенные формы нарушения опорожнения мочевого пузыря встречаются в среднем у 7 женщин на 100 000 населения [2]. По данным T. Tammela и соавт., после оперативных вмешательств на органах брюшной полости нарушения опорожнения мочевого пузыря встречаются у 2,9 % пациентов, а после проктологических операций — у 25% больных [3]. Многие авторы считают данную проблему особенно значимой у неврологических больных.
Клиническим проявлением снижения сократительной способности детрузора и нерасслабляющегося п/п сфинктера уретры являются симптомы нарушения опорожнения мочевого пузыря, к которым относятся затрудненное мочеиспускание тонкой, вялой струей, прерывистое мочеиспускание, необходимость прилагать усилия и натуживаться, чтобы начать мочеиспускание, ощущение неполного опорожнения мочевого пузыря.
При отсутствии сократительной способности детрузора в сочетании с паралитическим состоянием п/п сфинктера уретры больные опорожняют мочевой пузырь, искусственно увеличивая внутрибрюшное давление, что клинически проявляется мочеиспусканием слабой струей мочи. При отсутствии сократительной способности детрузора в сочетании со спастическим состоянием наружного сфинктера уретры в большинстве случаев самостоятельное мочеиспускание невозможно и отмечается хроническая задержка мочи.
Нерасслабляющийся п/п сфинктер уретры приводит к инфравезикальной обструкции с симптомами нарушения опорожнения мочевого пузыря.
Клинические проявления наружной ДСД (непроизвольное сокращение п/п сфинктера уретры во время мочеиспускания или непроизвольного сокращения детрузора) включают два вида симптомов, а именно: нарушения опорожнения и накопления мочи в мочевом пузыре. Последние включают учащенное и ургентное мочеиспускание нередко в сочетании с ургентным недержанием мочи и никтурией. Для наружной ДСД характерно неполное опорожнение мочевого пузыря и развитие пузырно-мочеточникового рефлюкса.
Таким образом, различные формы нарушения опорожнения мочевого пузыря могут иметь во многом сходную клиническую картину. В связи с этим правильная и своевременная диагностика функциональных нарушений опорожнения мочевого пузыря является залогом успешного лечения.
Диагностика функциональных нарушений опорожнения мочевого пузыря складывается из сбора жалоб и анамнеза, урологического и неврологического обследования, а также дополнительных методов обследования, среди которых основное место занимает уродинамическое исследование. На начальном этапе обследования обязательна оценка симптомов нижних мочевых путей на основании вопросника I-PSS (Internanional Prostate Symptom Score). Вопросник I-PSS был предложен для оценки нарушений акта мочеиспускания вследствие заболеваний предстательной железы, однако в настоящее время он с успехом применяется и в случаях проявления симптомов заболеваний нижних мочевых путей, вызванных различными факторами, в том числе и неврологического характера.
Для уточнения поведения детрузора и его сфинктеров в фазу опорожнения мочевого пузыря наиболее информативным методом исследования больных является комплексное уродинамическое исследование.
Уродинамическими признаками наружной ДСД, характерной для надкрестцовой локализации патологического процесса, особенно в шейном отделе спинного мозга, являются регистрируемые с помощью электромиографии во время мочеиспускания «всплески» сократительной активности п/п сфинктера уретры и мышц тазового дна. Сокращение мышц тазового дна затрудняет или полностью прерывает поток мочи. Для нерасслабляющегося сфинктера уретры характерно отсутствие снижения электромиографической активности п/п сфинктера уретры во время мочеиспускания. Снижение или отсутствие сократительной способности детрузора уродинамически проявляется отсутствием плавного повышения детрузорного давления в ходе цистометрии или отсутствием позыва к акту мочеиспускания.
Следует подчеркнуть, что только уродинамическое обследование дает возможность достоверно установить форму нарушения функции нижних мочевых путей, приводящих к нарушению опорожнения мочевого пузыря, и во многом определить выбор метода лечения.
Ультразвуковое исследование почек и мочевого пузыря, также как и экскреторная урография, позволяет уточнить анатомическое состояние верхних мочевых путей и количество остаточной мочи в мочевом пузыре. По количеству остаточной мочи в мочевом пузыре после акта мочеиспускания (в норме до 50 мл) можно косвенно судить о функциональном состоянии детрузора и наличии инфравезикальной обструкции.
В таблице перечислены методы лечения больных с функциональными нарушениями опорожнения мочевого пузыря, из которых только медикаментозная терапия и дорзальная ризотомия с электростимуляцией передних корешков могут действительно считаться методами лечения, тогда как другие скорее являются способами опорожнения мочевого пузыря. При этом даже медикаментозная терапия во многом является симптоматическим методом лечения. Несмотря на это, назначение лекарственных средств представляет собой первый этап лечения больных с функциональными нарушениями опорожнения мочевого пузыря. Выбор медикаментов зависит от вида нарушения функции нижних мочевых путей. Так, в случае нарушения сократительной способности детрузора применяют антихолинэстеразные средства и М-холиномиметики, а при гиперактивности уретры — центральные миорелаксанты и α-блокаторы.
У 22 больных со сниженной сократительной способностью детрузора использовали дистигмина бромид (убретид) в дозе 5 мг через день за 30 мин до завтрака в течение 2 мес. При этом через каждые 2 нед делали 7-дневный перерыв в приеме препарата. Механизм действия дистигмина бромида заключается в блокировании ацетилхолинэстеразы, что сопровождается увеличением концентрации ацетилхолина в синаптической щели и соответственно приводит к облегчению передачи нервного импульса.
У всех больных терапевтический эффект развивался в первую неделю приема препарата и выражался в снижении среднего балла I-PSS c 15,9 до 11,3, а количества остаточной мочи — с 82,6 до 54,3 мл. Субъективно пациенты отмечали усиление ощущения позыва и облегчение начала акта мочеиспускания.
Следует отметить, что до настоящего времени остается открытым вопрос о продолжительности лечения антихолинэстеразными средствами. По нашим данным, у 82% больных в разные сроки после окончания 2-месячного курса лечения отмечалось возобновление симптомов, потребовавшее повторного назначения препарата.
К сожалению, мы не накопили собственного опыта применения бетанехола у больных со сниженной сократительной способностью детрузора, так как данный препарат не зарегистрирован для клинического применения в нашей стране и соответственно отсутствует в аптечной сети. Механизм действия бетанехола аналогичен действию ацетилхолина на гладкие миоциты. Данные других авторов показывают, что бетанехол может применяться при лечении больных с легкой степенью нарушения сократительной способности детрузора [4, 5].
α1-адреноблокатор доксазозин (кардура) использовали в ходе лечения 30 больных с гиперактивностью уретры, в том числе 14 пациентов с наружной ДСД и 16 с нарушением произвольного расслабления п/п сфинктера уретры. Доксазозин назначали в дозе 2 мг/сут на ночь.
Через 6 мес средний балл по шкале I-PSS у больных с наружной ДСД снизился с 22,6 до 11,4, количество остаточной мочи уменьшилось с 92,6 до 32,4 мл, а максимальная скорость потока мочи увеличилась с 12,4 до 16,0 мл/сек.
Кроме того, через 6 мес у больных с нарушением произвольного расслабления п/п сфинктера уретры средний балл I-PSS снизился с 14,6 до 11,2, количество остаточной мочи — с 73,5 до 46,2 мл, а максимальная скорость потока мочи увеличилась с 15,7 до 18,4 мл/сек.
Баклофен и тизанидин (сирдалуд) являются центральными миорелаксантами. Они снижают возбуждение моторных нейронов и интернейронов и могут ингибировать передачу нервного импульса в спинном мозге, уменьшая спастичность п/п мышц. По нашим данным, после применения баклофена в дозе 20 мг/сут и тизанидина в дозе 4 мг/сут не было выявлено существенной динамики субъективных и объективных симптомов как у больных с наружной ДСД, так и у пациентов с нарушением расслабления п/п сфинктера уретры. Выраженная слабость мускулатуры конечностей на фоне приема этих препаратов не позволяет увеличивать дозу препаратов, что существенно ограничивает их применение в клинической практике.
Следует отметить, что медикаментозная терапия эффективна у больных с начальными и легкими формами нарушения опорожнения мочевого пузыря. Тем не менее ее целесообразно использовать в качестве первого этапа лечения. В случае недостаточной эффективности медикаментозной терапии необходимо искать новые пути решения проблемы адекватного опорожнения мочевого пузыря.
Предложенная Lapides и соавт. в 80-е гг. прошлого столетия интермиттирующая аутокатетеризация мочевого пузыря до настоящего времени остается одним из основных методов опорожнения мочевого пузыря [6]. Однако этот метод имеет ряд осложнений, к которым относятся инфекции нижних мочевых путей, стриктуры уретры и, самое главное, значительное снижение качества жизни. При невозможности выполнения (неврологические больные с тетраплегией, больные с ожирением) или отказе пациента от аутокатетеризации, у лиц с наружной ДСД и нерасслабляющимся сфинктером уретры, а также со сниженной сократительной способностью детрузора для адекватного опорожнения мочевого пузыря применяют в последние годы имплантацию специальных стентов (производства фирм Balton, Mentor, МедCил) и инъекции ботулинического токсина в зону п/п сфинктера уретры.
 |
| Рисунок 1. Временный уретральный стент |
Временные уретральные стенты имеют форму цилиндра, выполненного из проволочной спирали толщиной 1,1 мм, изготовлены они на основе полимолочной и полигликоликовой кислот с различным периодом разрушения (от 3 до 9 мес) посредством гидролиза (рис. 1). Механические свойства и время разрушения временных стентов зависят от степени поляризации, места и формы зоны имплантации.
Мы имеем опыт применения временных уретральных стентов у семи мужчин с наружной ДСД и у четырех пациентов, у которых отсутствовала сократительная способность детрузора. Временный уретральный стент устанавливали при уретроцистоскопии таким образом, чтобы он «шинировал» как простатический, так и мембранозный отделы уретры. Такое положение стента обеспечивает адекватное опорожнение мочевого пузыря.
У всех больных отмечалось восстановление самостоятельного мочеиспускания сразу после имплантации уретрального стента. Пациенты с наружной ДСД осуществляли мочеиспускание по позыву, а больные с отсутствием сократительной способности детрузора с интервалом 4 ч (6 раз в сутки) с использованием приема Креда. По данным ультразвукового сканирования, через 10 нед после установки стента у больных с наружной ДСД не отмечалось остаточной мочи, а у больных с отсутствием сократительной способности детрузора среднее количество остаточной мочи составило 48 мл и зависело от адекватности выполнения приема Креда. Очень важно, что у больных с наружной ДСД было выявлено снижение максимального детрузорного давления во время мочеиспускания в среднем с 72 до 35 см вод. ст. (профилактика развития пузырно-мочеточникового рефлюкса).
Мы считаем, что временные уретральные стенты обеспечивают адекватное опорожнение мочевого пузыря и показаны тем больным с нарушением опорожнения мочевого пузыря, которым не может быть выполнена интермиттирующая катетеризация мочевого пузыря или которые воздерживаются от нее по различным причинам. Временные стенты могут являться методом отбора больных для установки постоянных (металлических) стентов.
В последние годы в литературе появились сообщения об успешном использовании ботулинического токсина у больных с функциональными нарушениями опорожнения мочевого пузыря. В нашей клинике ботулинический токсин применялся у 16 больных с нарушением опорожнения мочевого пузыря, в том числе у девяти с наружной ДСД, у трех с нерасслабляющимся п/п сфинктером уретры и у четырех с нарушением сократительной способности детрузора. Мы использовали ботулинический токсин типа А фармацевтической фирмы Allergan. Коммерческое название препарата — ботокс (Botox), он представляет собой лиофилизированный порошок белого цвета в вакуумных стеклянных флаконах объемом 10 мл, закрытых резиновой пробкой и герметичным алюминиевым затвором. В одном флаконе содержится 100 ЕД ботулинического токсина типа А.
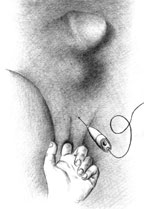 |
| Рисунок 2. Введение ботулинического токсина у мужчин |
Механизм действия ботокса заключается в блокировании выброса ацетилхолина из пресинаптической мембраны в нервно-мышечном синапсе. Фармакологическим эффектом этого процесса является стойкая хемоденервация, а клиническим проявлением — расслабление мышечных структур.
Согласно рекомендациям фирмы-производителя, лиофилизированный порошок разводили 8 мл стерильного 0,9% раствора натрия хлорида без консервантов (1 мл полученного раствора содержит 12,5 ЕД ботокса). Использовали трансперинеальную методику введения препарата. У мужчин под контролем указательного пальца, введенного в прямую кишку, специальную иглу с изоляционным покрытием вводили в точку, находящуюся на 2 см латеральнее и выше анального отверстия (рис. 2). У женщин иглу под контролем указательного пальца, введенного во влагалище, вводили в точку на 1 см латеральнее и выше наружного отверстия уретры на глубину 1,5–2,0 см (рис. 3). Во всех случаях положение иглы контролировали электромиографически по характерному звуку динамика электромиографа. В каждую точку вводили по 50 ЕД ботокса.
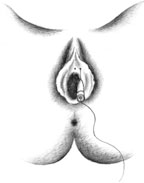 |
| Рисунок 3. Введение ботулинического токсина у женщин |
У всех больных через 10 дней после введения ботулинического токсина исчезла остаточная моча и было отмечено увеличение максимальной скорости потока мочи. Важно, что хемоденервация сфинктера уретры после инъекции ботокса у всех пациентов с нерасслабляющимся п/п сфинктером и наружной ДСД приводила к снижению детрузорного давления, а у больных с нарушением сократительной способности детрузора — к снижению максимального абдоминального давления, вызывающего выделение мочи из наружного отверстия уретры. Это наблюдение представляется крайне важным в отношении профилактики развития пузырно-мочеточникового рефлюкса и сохранения функциональной способности почек. Только у одного больного клинический эффект после инъекции ботокса продолжал сохраняться на протяжении 16 мес, остальным пациентам потребовались повторные инъекции препарата с периодичностью 3–8 мес.
В отдельных случаях, при выраженной инвалидизации больных с нарушением опорожнения мочевого пузыря, используют трансуретральную инцизию или резекцию наружного сфинктера уретры, дренируют мочевой пузырь постоянным уретральным катетером или выполняют цистостомию.
Таким образом, нарушение опорожнения мочевого пузыря может быть следствием различных форм дисфункции нижних мочевых путей. Требуются проведение комплексного уродинамического обследования для уточнения функционального состояния мочевого пузыря и его сфинктеров и выбор адекватного метода опорожнения мочевого пузыря. Отсутствие высокоэффективных и универсальных способов лечения больных с функциональными нарушениями опорожнения мочевого пузыря диктует необходимость поиска новых методов терапии таких больных.
Г. Г. Кривобородов, доктор медицинских наук
М. Е. Школьников, кандидат медицинских наук
РГМУ, Москва