гетерозиготная форма мутации что это значит
Гетерозиготная форма мутации что это значит
При гетерозиготном наследовании гены происходят от двух родительских клеток для размножения и присутствуют у животных, людей и растений. Существует несколько примеров гетерозиготных генов, включая полное доминирование, совместное доминирование и гетерозиготные мутации.
Что такое гетерозиготные гены?
Во всех диплоидных организмах, которые содержат два набора хромосом, термин гетерозиготный означает, что индивидуум, образованный из двух родительских клеток, имеет два разных аллеля для одного специфического признака. Хромосомы содержат аллели в качестве специфического признака ДНК или гена. Вы наследуете аллели от обоих родителей, в случае людей, половину от своей матери и половину от своего отца.
То же самое происходит у животных и растений. Клетки содержат наборы из двух гомологичных хромосом, что означает, что наборы появляются в одинаковом положении для одного и того же признака на каждой паре хромосом. Гомологичные хромосомы имеют одинаковую генетическую структуру, но аллели могут различаться, чтобы определить, какие признаки выражены в клетке.
Что такое гетерозиготная черта?
Какие доминантные и рецессивные черты?
Когда два аллеля отличаются по своим соответствующим хромосомам от каждого родителя, они могут иметь доминантные или рецессивные гены или признаки. Доминирующей чертой является та, которую вы можете увидеть или заметить, например, внешний вид, или это может быть черта, вызывающая привычку, например, грызть ногти. Гетерозиготный рецессивный признак в этом случае маскируется гетерозиготным доминантным признаком, поэтому он не будет рассматриваться как доминирующий признак. В случае, когда доминанта полностью маскирует рецессивную черту, это называется полным доминированием.
Что такое неполное доминирование?
Что такое совместное доминирование?
В случае совместного доминирования в генетике оба гетерозиготных аллеля полностью экспрессируются в фенотипе от обоих родителей. Это можно увидеть, изучив группы крови потомства. Если один из родителей имеет группу крови A, а другой родитель имеет группу крови B, ребенок будет иметь группу крови с доминированием AB. В этом случае каждый из двух различных типов крови полностью выражен и одинаково выражен, чтобы быть доминантным.
Что такое гомозиготный?
Гомозиготный по сути является противоположностью гетерозиготного. У человека с гомозиготным признаком есть аллели, которые очень похожи друг на друга. Гомозиготы производят только гомозиготное потомство. Потомство может быть гомозиготным доминантным, выраженным как RR, или они могут быть гомозиготным рецессивным, выраженным как rr для признака.
Гомозиготные особи могут не иметь как рецессивных, так и доминантных признаков, выраженных как Rr. Как гетерозиготное, так и гомозиготное потомство могут родиться от гетерозиготы. В этом случае у потомства могут быть доминантные и рецессивные аллели, которые выражаются в полной доминантности, неполной доминантности или даже совладении.
Что такое дигибридный крест в генетике?
Поколение F2, которое присутствует, когда растения самоопыляются, является вторым поколением, и все растения имеют вариации формы и цвета семян. В этом примере около 9/16 растений имеют желтые семена с морщинистой формой. Приблизительно 3/16 получают зеленый цвет в качестве цвета семени и округлый как форму. Приблизительно 3/16 получают семена желтого цвета и морщинистой формы, а оставшиеся 1/16 получают семена зеленого цвета с морщинистой формой. В результате поколение F2 демонстрирует четыре фенотипа и девять генотипов.
Что такое моногибридный крест в генетике?
Что такое гетерозиготные мутации?
Генетические мутации могут происходить в хромосомах, которые постоянно изменяют последовательность ДНК, поэтому она отличается от последовательности у большинства других людей. Мутации могут быть такими же большими, как сегмент хромосом с несколькими генами, или такими же маленькими, как одна пара аллелей. В мутации наследственности, мутация наследуется и остается с человеком в каждой клетке своего тела на протяжении всей своей жизни.
Мутации происходят, когда яйцеклетка и сперматозоид объединяются, и оплодотворенная яйцеклетка получает ДНК от обоих родителей, у которых полученная ДНК имеет генетическую мутацию. В диплоидных организмах мутация, происходящая только в одном аллеле гена, является гетерозиготной мутацией.
Генные мутации и влияние на здоровье и развитие
Каждая клетка в организме человека зависит от тысяч белков, которые должны появляться в нужных областях, чтобы выполнять свою работу и способствовать здоровому развитию. Мутация гена может помешать правильному функционированию одного или нескольких белков, а также вызвать нарушение функционирования белка или его отсутствие в клетке. Эти вещи, которые совпадают с генетическими мутациями, могут нарушить нормальное развитие или вызвать заболевание в организме. Это часто называют генетическим заболеванием.
В случае серьезных генетических мутаций эмбрион может даже не выжить достаточно долго, чтобы достичь рождения. Это происходит с генами, которые необходимы для развития. Очень серьезные генные мутации будут несовместимы с жизнью, поэтому эмбрион не доживет до рождения.
Гены не вызывают заболевания, но генетическое нарушение может привести к тому, что ген не сможет функционировать должным образом. Если кто-то говорит, что у человека плохие гены, это на самом деле случай дефектного или мутировавшего гена.
Каковы различные типы генных мутаций?
Ваша последовательность ДНК может быть изменена семью различными способами, что приведет к мутации гена.
Мутации вставки изменяют количество оснований ДНК, потому что они добавляют дополнительный кусок ДНК, который не принадлежит. Это может привести к неправильной работе белка гена.
Мутации удаления являются противоположностью мутации вставки, поскольку есть часть ДНК, которая удаляется. Делеции могут быть небольшими, если затронуты только несколько пар оснований, или они могут быть большими, когда весь ген или соседние гены удалены.
Мутации смены кадров происходят, когда рамка считывания гена изменяется из-за потери или добавления изменений в основе ДНК. Рамки считывания содержат группы из трех оснований с каждым кодом для одной аминокислоты. Мутация сдвига кадров смещает группы из трех и изменяет коды аминокислот. Белок в результате этого действия обычно нефункциональный.
Повторите мутации расширения, когда нуклеотиды повторяются несколько раз подряд. Это в основном увеличивает количество повторений короткой ДНК.
Что такое сложный гетерозигот?
Составная гетерозигота возникает, когда есть два мутантных аллеля, по одному от каждого родителя, в парах генов в одном и том же месте. Оба аллеля имеют генетические мутации, но каждый аллель в паре имеет разные мутации. Это называется сложным гетерозиготом или генетическим соединением, которое включает обе пары аллелей в одной области хромосомы.
Каковы некоторые примеры окраски у собак?
Доминирующие признаки выражены заглавными буквами, а рецессивные признаки выражены строчными буквами для генотипа. Например, собака с генотипом BB имеет два доминантных аллеля, и она будет экспрессировать только B, так как оба являются доминантными. Собака с Bb в качестве генотипа будет экспрессировать B, так как B является доминантным, а b рецессивным. Генотип bb, причем оба являются рецессивными, будет единственным генотипом, который выражает цвет b.
Новая генетика (геномика) в профилактике осложнений беременности
Особенностью многих вариантных генов является то, что они могут долгое время никак себя не проявлять. Патологические симптомы могут возникнуть при дополнительных условиях (особенности питания, беременность, прием лекарств, образ жизни и т. д.). Выяснение этих дополнительных условий помогает эффективно предотвращать развитие заболеваний и их осложнений у носителей вариантных генов.
Тромбофилия как фактор риска осложнений беременности
Тромбофилией называется склонность к развитию тромбов (кровяных сгустков). Тромбофилия может быть угрожающим жизни состоянием, если тромб запирает кровоток. Тромбофилия может быть наследственным нарушением, но может быть связана и с внешними причинами, такими как хирургические операции, ожирение, беременность, использование гормональных контрацептивов, антифосфолипидный синдром, повышение уровня гомоцистеина или долгий период неподвижности. Врачи подозревают наличие тромбофилии у пациентов, имевших тромбозы в прошлом, или у родственников которых были случаи тромбозов, инсультов, инфарктов в молодом возрасте (до 40 — 50 лет). Однако у многих людей с тромбофилией нет никаких симптомов, или эти симптомы проходят незамеченными, поскольку тенденция к тромбофилии недостаточно сильно выражена. Исследования последних лет показали, что наличие тромбофилии сопряжено с повышенным риском развития осложнений беременности (привычное невынашивание, плацентарная недостаточность, задержка роста плода, поздний токсикоз (гестоз)). К числу генных маркеров наследственных тромбофилий относятся мутация метилентетрагидрофолатредуктазы, лейденская мутация и мутация гена протромбина G20210A.
Исследования последних лет показали, что у пациенток с привычным невынашиванием беременности часто обнаруживаются один или несколько генетических маркеров тромбофилии. Например, в одном из исследований было обнаружено наличие лейденской мутации у 19% пациенток с невынашиванием беременности, тогда как в контрольной группе лейденская мутация была обнаружена только у 4% женщин.
Мутация метилентетрагидрофолат-редуктазы
фермента с нарушениями обмена гомоцистеина. Примерно в те же годы было показано, что повышение уровня гомоцистеина является независимым фактором риска развития сосудистых осложнений. Начались попытки выяснения генетической природы дефицита MTHFR. Клонирование гена MTHFR в 1993 г. стало основой для определения мутаций, связанных с различными степенями дефицита данного фермента.
Фолатный цикл
Фермент 5,10-метилентетрагидрофолат-редуктаза относится к группе флавопротеинов и состоит из двух одинаковых субъединиц с молекулярной массой около 70 кДа. MTHFR является ключевым ферментом фолатного цикла. Фолат и фолиевая кислота (синтетический витамин, отсутсвующий в естественных продуктах) являются двумя формами семейства веществ, связанных с птероилглютаминовой кислотой (ПтеГлу). Эта кислота является сложной молекулой, состоящей из птероидной кислоты и одного (моноглютаматы) или нескольких (до 9, полиглютаматы) остатков глютаминовой кислоты (см. рис. 1). Пища, особенно свежая зелень, печень, дрожжи и некоторые фрукты в основном содержат восстановленные полиглютаматы, которые должны быть гидролизованы с помощью фермента птероилполиглютамат-гидролазы до моноглютамата, чтобы они могли быть абсорбированы в проксимальном отделе тонкого кишечника. После всасывания фолат-моноглютамат быстро восстанавливается до тетрагидрофолата, поскольку только восстановленные формы фолата обладают биологической активностью. После метилирования фолаты поступают в кровь в виде 5-метилтетрагидрофолата. Кроме пищи, постоянное поступление 5-метилтетрагидрофолата обеспечивается кишечно-печеночным циклом: птерил-моноглютамат всасывается из кишечника и поступает в печень, где он восстанавливается и метилируется до 5-метилтетрагидрофолата. Образовавшийся 5-метилтетрагидрофолат выделяется с желчью в кишечник, где он затем всасывается и разносится с кровью по всему организму.
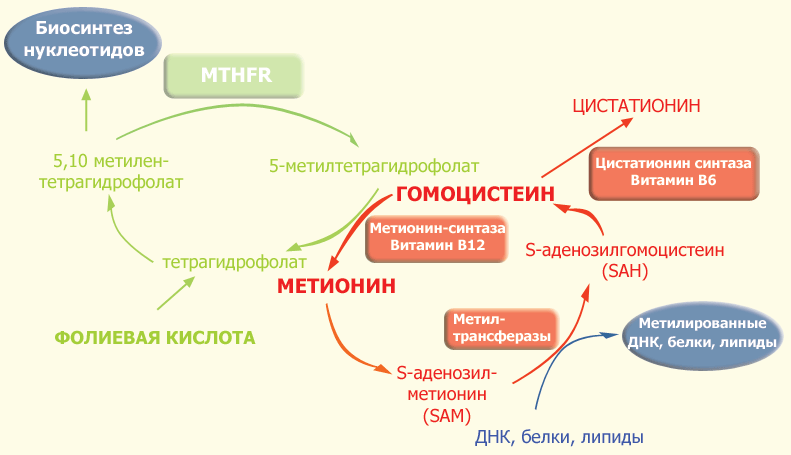 |
| Рис. 1. Фолатный цикл и цикл метионина. |
В ткани поступление 5-метилтетрагидрофолата внутрь клетки происходит с помощью эндоцитоза при участии специфических фолатных рецепторов. Описаны три изоформы фолатных рецепторов. Внутри клетки 5-метилтетрагидрофолат служит донором метильных групп и основным источником тетрагидрофолата. Последний выступает в качестве акцептора большого числа моноуглеродных групп, превращаясь в разные виды фолатов, служащих в свою очередь специфическими коферментами в целом ряде внутриклеточных реакций. К ним относятся 5-формилтетрагидрофолат (фолиниевая кислота, лейковорин), 10-формилтетрагидрофолат и 5,10-метилентетрагидрофолат.
Одной из реакций, требующих наличия 5,10-метилентетрагидрофолата и 5-метилтетрагидрофолата, является синтез метионина из гомоцистеина (путь реметилирования в обмене гомоцистеина). В этой реакции MTHFR играет ключевую роль, восстанавливая 5,10-метилентетрагидрофолат до 5-метилтетрагидрофолата, являясь таким образом катализатором единственной внутри клетки реакции образования 5-метилтетрагидрофолата. Хотя в сыворотке и других тканевых жидкостях обнаруживаются разные формы фолатов, главной формой фолата в плазме является 5-метилтетрагидрофолат, несущий на себе метильную группу, необходимую для превращения гомоцистеина в метионин. В этой реации метильная группа вначале переносится на коб(I)аламин (форма витамина B12), превращая его в метилкобаламин, который затем отдает метильную группу гомоцистеину, образуя метионин с помощью фермента метионин-синтазы. Однако в некоторых случаях коб(I)аламин может окисляться в коб(II)аламин, что приводит к подавлению метионин-синтазы. Для поддержания активности фермента необходимо восстановительное метилирование с помощью фермента метионин-синтаза-редуктазы.
Поскольку кобаламин (витамин B12) служит акцептором метильной группы 5-метилтетрагидрофолата, дефицит этого витамина приводит к «ловушке для фолата». Это тупиковый путь метаболизма, поскольку метилтетрагидрофолат не может при этом восстанавливаться до тетрагидрофолата и возвращаться в фолатный пул. Неспособность регенирировать метионин приводит к истощению запаса метионина и выбросу в кровь избытка гомоцистеина.
Мутация Лейдена
Лейденовская мутация – это изменение одного или двух (гетеро-, гомозигота) участков в гене, кодирующем активность V фактора свертывания крови, проакцелерина. В результате F5 становится устойчивым к воздействию протеина С – естественного антикоагулянта, нарушаются противотромботические механизмы крови и организм находится в постоянной тромботической готовности.
Мутация Лейдена – самая распространенная причина наследственной склонности к тромбозам, инфарктам, инсультам и акушерским осложнениям у людей европеоидной расы. Патология названа в честь города Лейден (Голландия), где впервые был описан механизм ее возникновения.
Почему вы узнали о мутации Leiden только сейчас
Нечувствительность к протеину С сразу у нескольких членов одной семьи впервые выявлена шведским ученым Б. Дальбеком в 1993, а детально описана голландским профессором Р. Бертиной в 1994 году. Открытие внесло коррективы в диагностику нарушений гемостаза и акушерских осложнений – теперь любой случай тромбоза или патологии беременности в анамнезе врачи связывают с возможной тромбофилией. Согласно данным последних исследований, полиморфизм гена F5 – главная причина генетической тромбофилии у 5-8% населения Земли. Его распространенность варьируется в зависимости от региона: достигает 15% у жителей Греции, Швеции, Ливана и практически не встречается в Африке, Азии, Гренландии и отдельных районах Северной Америки.
Что такое фактор V
F5, проакцелерин, фактор Лейдена – это молекула белка, В-глобулин, которая образуется в печени человека, циркулирует в крови и участвует в каскаде свертывания.
Благодаря F5 фактор 10 прикрепляется к тромбоциту и активирует протромбин. Также проакцелерин играет важную роль в инактивации комплекса протромбиназы: в норме молекула фактора V разрушается протеином С, после чего протромбиназный комплекс распадается.
Как мутация Лейдена влияет на тромбообразование
При Leiden-мутации в клетке ДНК, кодирующей фактор 5, происходит замена белка-нуклеотида гуанина на аденин в позиции 1691 (G1691A). Изменяется порядок аминокислот в составе «готового» F5 – в 506 положении глутамин сменяет аргинин.
В результате повреждается одно из 3 мест расщепления фактора V, и он теряет чувствительность к воздействию естественного антикоагулянта, протеина С. Действие F5 длится дольше обычного, из-за чего кровь становится излишне вязкой. Нарушается система комплекса протромбиназы, высвобождается больше тромбина и возрастает риск тромбоза.
Вероятность тромбоэмболического события увеличивается с возрастом и при сочетании Лейденовской с мутациями других генов гемостаза – протромбина, протеинов С и S. В развитии тромбозов у носителей полиморфизма фактора V играет роль и ряд других факторов: беременность, прием гормонов, климактерический период, травмы, инфекционные болезни, хирургические операции.
Когда надо сдать анализ на мутацию Лейдена
| Ситуативный случай | Разъяснение |
|---|---|
| Планирование беременности | Полиморфизм F5 является причиной синдрома потери плода, тяжелых форм гестоза, случаев отслойки плаценты и ВЗР. Риск акушерских осложнений у носительниц, в зависимости от формы мутации, при беременности возрастает в 7-80 раз. |
| Прием пероральных контрацептивов, ЗГТ при климаксе | Препараты гормонов повышают уровень гомоцистеина в крови и провоцируют хроническое внутрисосудистое свертывание, что при наличии генетической предрасположенности может закончиться тромбоэмболией. |
| Рецидивирующие тромбозы у пациентов младше 50 лет | Идиопатические (причина которых не установлена), рецидивирующие, тромбозы с необычной локализацией (церебральных, брыжеечных артерий и вен) – признак того, что вы являетесь носителем тромбофилии и нуждаетесь в антикоагулянтной терапии. |
| Отягощенный семейный анамнез | Важно проследить, были ли тромбоэмболические осложнения, инфаркты, инсульты у родителей, дедушек, бабушек, братьев и сестер, поскольку Лейденовская мутация наследуется по аутосомно-доминантному типу и диагностируется у всех близких родственников. |
| Плановое хирургическое вмешательство | После любого повреждения сосудов – травмы, в ходе хирургической операции из клеток высвобождается тканевый тромбопластин, фактор III, активирующий систему свертывания крови. При отсутствии реакции между фактором 5 и протеином С, что характерно для Лейденской мутации, это служит предпосылкой для образования тромбов в венозной системе. |
Признаки и симптомы
Полиморфизм фактора 5 Leiden – генетически детерминированное заболевание. Патология присутствует у человека с рождения, но дает о себе знать только в зрелом возрасте или под воздействием «провоцирующих» факторов – травмы, длительной иммобилизации во время болезни или после операции, при наступлении беременности. До этого момента клинические проявления носительства мутации обычно отсутствуют.
Лейденская мутация – самое значимое нарушение гемостаза, приводящее организм в предтромботическое состояние. При подозрении на тромбофилию анализ на фактор V является приоритетным. В зоне особого риска находятся пациентки с рецидивирующими тромбозами и невынашиванием беременности.
Почему мутация Лейдена опасна для беременных женщин
Во время беременности в организме включается адаптивный механизм: физиологическая гиперкоагуляция, которая нарастает с каждым триместром и достигает максимума в момент родов. Так срабатывает «программа защиты» от массивной кровопотери после родоразрешения.
Но для носительницы полиморфизма гена F5 этот процесс становится патологическим и может привести к тяжелым осложнениям. Уже доказано, что мутация Лейдена – главная причина:
75% случаев невынашивания беременности, синдромов потери плода; 90% случаев ПОНРП, преждевременной отслойки плаценты; 75% случаев резкого подъема уровня артериального давления и поздних токсикозов, а также внутриутробной задержки роста плода, самопроизвольного аборта на сроках как до 12, так и до 20 недель беременности, неудач ЭКО, преждевременных родов, синдрома системного воспалительного ответа. Акушерские осложнения можно предупредить, если на этапе планирования, и даже во время беременности обратиться к квалифицированному врачу гемостазиологу, который назначит поддерживающую антикоагулянтную терапию.
Полиморфизм гена фактора V: лечится или нет
«Поправить» дефектный ген в молекуле ДНК невозможно, но гемостазиологи предлагают, как вариант, предупредить осложнения тромбофилии профилактическими мерами. Медикаментозная терапия при мутации Лейдена назначается, исходя из прогнозируемого по результатам анализа риска тромбозов:
Обследование и сопровождение пациентов с мутацией Лейдена проводят в МЖЦ на Таганской – профильной клинике под руководством Татьяны Владимировны Кузнецовой, профессоров Александра Давидовича Макацария и Виктории Омаровны Бицадзе. На базе нашей Научной лаборатории патологии гемостаза вы сможете сдать анализ на мутацию в гене FV Leiden, который позволит определить риск тромбофилии и подобрать оптимальную противотромботическую терапию.
акушер-гинеколог, гемостазиолог, профессор, доктор медицинских наук, эксперт международного уровня по проблемам тромбозов и нарушений свертывания крови
Бомба замедленного действия: чем опасно носительство мутаций у будущих родителей
Когда тест на беременность показывает заветные две полоски – это очень радостное и волнительное событие. Будущие родители готовятся к тому, что с появлением малыша их жизнь заиграет новыми красками. К сожалению, не для всех пар эти мечты воплощаются в реальность. Иногда счастье сменяется болью утраты из-за того, что беременность прерывается по непонятным причинам.
Пары, пережившие такие события, часто начинают винить себя. Женщина перебирает в памяти события из своей жизни, пытается понять, что она делала неправильно, где совершила роковую ошибку, из-за которой всё это произошло. На самом деле чаще всего никто не виноват. Одна из возможных причин прерываний беременности и рождения детей с тяжелыми заболеваниями – наследственность. Генетические мутации коварны. Некоторые из них передаются по аутосомно-рецессивному типу. Катастрофа происходит, когда в клетках организма встречаются две «неправильные» копии гена. Оба родителя могут оказаться носителями. Каждый из них здоров, потому что один ген функционирует нормально. Но есть 25% вероятность, что ребенок получит оба дефектных гена. Это высокий риск.
Еще существуют наследственные заболевания, сцепленные с полом. Тут тоже довольно сложный механизм наследования. Например, если дефектный ген находится в «женской» X-хромосоме, то носительницами могут быть только женщины, а их сыновья в 50% случаев рождаются больными, в остальных 50% случаев они здоровы и не являются носителями.
Проблема в том, что такие «неправильные» гены обычно сложно выявить. У носителей нет симптомов, и они не догадываются о рисках для потомства. Зачастую это вскрывается только после нескольких прервавшихся беременностей или рождения ребенка с тяжелым заболеванием.
Случаи из нашей практики
В 2019 году в Репробанк обратилась пара, у которой было несколько потерь беременности и безуспешных попыток ЭКО. Эти люди очень хотели завести ребенка, они прошли обследование, и после тщательного обследования врач-генетик заподозрил в паре носительство одного из генетических заболеваний, относящихся к группе митохондриальной патологии.
Генетический анализ показал, что оба партнера являются носителями мутации в гене SCO2. Эта мутация связана с тяжелым заболеванием – фатальной инфантильной митохондриальной миопатией. Эта патология вызвана нарушением функции митохондрий – «клеточных электростанций», она проявляется в виде почечной недостаточности, поражения сердечной мышцы (кардиомиопатии), выраженных дыхательных нарушений, снижения мышечного тонуса, слабости, повышенного уровня молочной кислоты в крови (лактат-ацидоз).
Другая пара обратилась к нам по поводу замершей беременности на девятом месяце. Это одно из самых страшных осложнений беременности, которого сильнее всего боятся будущие мамы. Развитие плода останавливается, и он погибает. В случае с данной парой генетический анализ показал, что оба родителя являются носителями мутации, связанной со спинальной мышечной атрофией (СМА). Это наследственное заболевание может передаваться в том числе по аутосомно-рецессивному типу и характеризуется гибелью нервных клеток, ответственных за движения. Тяжелее всего протекает младенческий тип СМА: у таких детей с рождения нарушено дыхание, они не могут нормально сосать грудь, глотать, держать головку, сидеть.
Еще одна мутация, носители которой обращались в Репробанк, была связана с наследственным поликистозом почек. При этой патологии у детей примерно 90% ткани почек замещается кистами, развивается прогрессирующая почечная недостаточность. У этой пары в анамнезе было 4 потери ребенка.
Донорские половые клетки – одно из возможных решений
Для родителей, которые являются носителями одинаковых мутаций, связанных с тяжелыми наследственными заболеваниями, есть несколько решений. Вот что об этом говорит врач-генетик Александра Борисовна Тюрина:
«У партнеров, которые являются носителями мутаций в одном и том же гене, ответственном за редкую наследственную патологию, очень высок риск родить больного ребенка. Вариантов у таких семей несколько: сделать ЭКО с поиском семейной мутации у эмбриона, обследовать плод во время беременности, сделать выбор в пользу донорского материала, выбрать усыновление или отказ от деторождения вовсе. Это так называемые «reproductive options». Этот термин можно перевести как репродуктивный выбор или репродуктивные варианты. У каждого из этих вариантов есть как преимущества, так и недостатки, но нет плохого или хорошего решения. Каждая семья, столкнувшаяся с редким наследственным заболеванием, делает приемлемый для себя выбор. Репробанк помогает подобрать подходящего донора для каждой конкретной семьи и минимизировать риск рождения ребенка с наследственным заболеванием, если пара выберет этот путь».
Паре из нашего первого примера – носителям мутации SCO2 – было предложено воспользоваться донорскими половыми клетками. Для первой беременности наши специалисты оплодотворили яйцеклетку женщины донорской спермой, а для второй беременности сперматозоиды ее партнера использовали для оплодотворения донорской яйцеклетки. Оба донора были дополнительно проверены на носительство данной мутации. Теперь эта пара растит двух здоровых малышей.
«Наши стандарты отбора доноров – одни из самых строгих в мире. Донором Репробанка становится только 1 из 300 кандидатов. Мы стремимся снизить до минимума риски возникновения генетических заболеваний. В дополнение к необходимым, согласно №107н (803н) приказу, обследованиям все наши доноры обязательно проходят генетический скрининг. Многим из них проведено полноэкзомное секвенироване экзома — исследование (прочтение) всей кодирующей белок части генома.
Как итог, около 40% доноров мы отсеиваем по причине носительства того или иного частого или очень серьезного наследственного заболевания (а в некоторых случаях и нескольких одновременно). Для данной пары мы подобрали доноров спермы и яйцеклеток, не имеющих мутации в гене SCO2».
Автандил Чоговадзе, руководитель Репробанка.
Также мы могли бы предложить этой паре воспользоваться технологией предимплантационного генетического тестирования на моногенную патологию (ПГТ-М). Этот метод помог бы получить совместные эмбрионы у супругов, протестировать их и отобрать на перенос только те, что здоровы или являются здоровыми носителями. К сожалению, у этой технологии есть ряд ограничений: высокая себестоимость, значительное время для реализации. Поэтому наши пациенты отказались от этого варианта.
Все три наших примера иллюстрируют огромную роль генетических исследований при подготовке к беременности. Всем парам, планирующим завести ребенка, стоит проконсультироваться с клиническим генетиком вне зависимости от возраста, состояния здоровья и семейной истории. Это может помочь избежать трагедии в будущем.
Все доноры половых клеток в Репробанке проходят тщательное обследование, в том числе генетический скрининг. В нашем каталоге нет носителей опасных мутаций. Тем не менее, если вы решили использовать донорский материал, вам стоит пройти генетическое обследование.


