гены ighv не подвергались соматической гипермутации что это значит
Гены ighv не подвергались соматической гипермутации что это значит
Многочисленные исследования показывают, что разные варианты хронического лимфолейкоза заметно отличаются по течению и прогнозу.
То, что мутационный статус IgVH-генов при хроническом лимфолейкозе (ХЛЛ) отражает наиболее существенные биологические особенности заболевания, подтверждается тем обстоятельством, что именно мутационный статус оказался наиболее значимым прогностическим фактором течения хронического лимфолейкоза и реакции на терапию.
Проведенный несколькими исследовательскими группами анализ выживаемости больных с различным мутационным статусом показал, что при отсутствии мутаций медиана выживаемости при современной терапии колеблется от 79 до 119 мес, в то время как при их наличии нередко составляет 200—300 мес, а некоторые больные этой группы никогда не нуждаются в лечении. В наблюдении из Англии 144 больных в начальной стадии (стадия А по Binet) были прослежены в течение 27 лет.
Все больные с отсутствием мутаций IgVH-генов умерли в течение первых 12 лет болезни. Из 27 больных с мутациями IgVH-генов за 27 лет от хронического лимфолейкоза умерли только двое. Медиана выживаемости больных в группе без мутаций IgVH равнялась 109 мес, в группе с мутациями — 293 мес. Французская группа, сопоставив мутационный статус, клиническую стадийность и выживаемость 145 больных, установила, что при начале наблюдения в стадии А медиана выживаемости в группе с отсутствием мутаций составила 97 мес, в то время как не была достигнута за 12 лет наблюдения в группе с мутациями (р = 0,0017), а время до прогрессирования в более продвинутую стадию составило соответственно 42 и 156 мес.
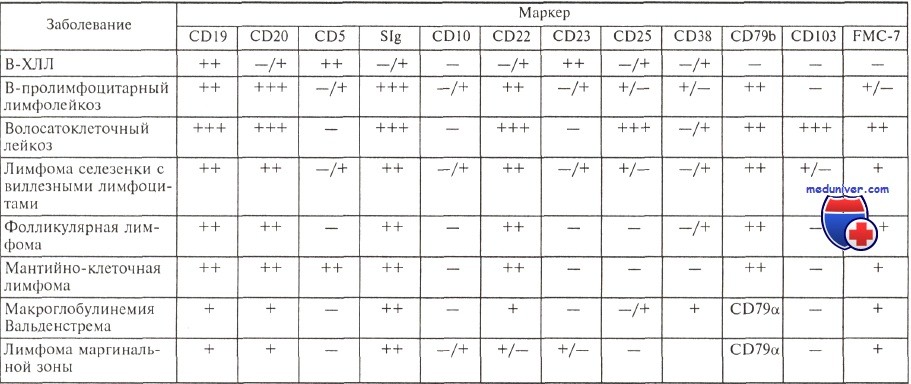
Иммунофенотип опухолевых клеток при различных лимфопролиферативных заболеваниях
Статистически значимая разница в выживаемости сохранялась и в стадиях В и С: в группе с отсутствием мутаций она равнялась 78 мес, в группе с мутациями — 120 мес (р = 0,002).
Из этого положения существует исключение. Показано, что в случаях функционирования у больного IgVH-генов, относящихся к семейству VH3-21, как правило, имеются соматические мутации IgVH-генов, однако прогноз соответствует прогнозу у больных без мутаций этих генов. Обнаружено, что у большинства больных ХЛЛ с мутировавшими IgVH-генами длина теломер в лимфоцитах значительно больше, чем у больных без мутаций этих генов.
Если оценивать не только мутационный статус IgVH-генов, но и гена BCL-6, больных хроническим лимфолейкозом (ХЛЛ) можно разделить на 3 группы: имеющих мутации IgVH и BCL-6, не имеющих мутаций вообще и имеющих мутации lgVH, но не имеющие мутаций гена BCL-6. Разделив на указанные 3 группы 200 больных в стадии А и сопоставив время от начала заболевания до необходимости в лечении, Е. Sarsotti и соавт. получили наилучшие показатели в группе с мутациями IgVn, но без мутаций BCL-6.
В этой группе у всех больных отмечалось стабильное состояние, и за 10-летний срок наблюдения только одному из 34 больных потребовалось лечение. Эти показатели принципиально отличались от показателей в группе без мутаций IgVH и BCL-6. За время наблюдения 38 % больных потребовалось лечение с медианой времени от начала заболевания до необходимости в терапии 44 мес. Эти показатели оказались близкими к показателям в группе с мутациями IgVH и BCL-6: 32 % больных этой группы потребовалось лечение с медианой от начала заболевания до необходимости в лечении 55 мес. Авторы, однако, не делают вывода о неблагоприятной прогностической роли мутаций BCL-6, указывая, что в этой группе у некоторых больных были неблагоприятные хромосомные аберрации.
Изолированный анализ показал отсутствие прогностической значимости мутаций BCL-6.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Клинические последствия генных мутаций при хроническом лимфоцитарном лейкозе
Хроническая лимфоцитарная лейкемия (ХЛЛ) является молекулярно-неоднородным заболеванием, которое выявлено в результате недавних геномных исследований. Среди генетических поражений, которые являются рецидивирующими в ХЛЛ, в клинической практике для определения лечебных решений доступны несколько клинически подтвержденных прогностических маркеров, таких как мутации ТР53 и удаление 17 р. Недавно в CLL были идентифицированы несколько новых молекулярных маркеров. Хотя эти мутации еще не получили квалификацию прогностических факторов для лечения потливости, они показали, что обещают уточнить прогностическую стратификацию пациентов. Внедрение целевых препаратов изменяет генетику CLL и раскрывает приобретение ранее неожиданных лекарственно-устойчивых мутаций в генах сигнальных путей. Ультра-глубокое секвенирование следующего поколения позволило достичь глубоких уровней разрешения генетического портрета CLL, обеспечивая точное определение его субклональной генетической архитектуры. Этот подход показал, что небольшие субклоны, содержащие лекарственно-устойчивые мутации, предвосхищают развитие фенотипа хемореактивных веществ. Здесь мы рассмотрим недавние достижения в определении геномического ландшафта CLL и продолжающиеся исследования, чтобы охарактеризовать клинические последствия старых и новых молекулярных повреждений в установлении как традиционной химиоиммунотерапии, так и целевых препаратов.
Хроническая лимфоцитарная лейкемия (ХЛЛ) — это злокачественная злокачественная опухоль В-клеток, характеризующаяся накоплением зрелых лимфоцитов CD5 + / CD19 + / CD23 + со слабой поверхностной экспрессией моноклонального иммуноглобулина (Müller-Hermelink et al, 2008). Клинический ход ХЛЛ варьируется от очень ленивого состояния с почти нормальной продолжительностью жизни до быстрого прогрессирования, приводящего к ранней смерти. Бессимптомные пациенты управляются часами и ждут развития симптомов, которые возникают в результате цитопении, аденопатии или спленомегалии, как об этом говорится в Международном семинаре 2008 года по ХЛЛ (Hallek et al, 2008).
Широкий спектр эффективных вариантов доступен, когда требуется лечение, хотя болезнь по-прежнему остается неизлечимой. Комбинированная химио-иммунотерапия флударабином, циклофосфамидом и ритуксимабом (FCR) является наиболее эффективным режимом для молодых и пригодных пациентов, так как дает отличные долгосрочные результаты. Поскольку CLL часто поражает пожилых людей, были успешно применены более терпимые терапевтические подходы, такие как химиоиммунотерапия, сочетающая хлорамбуцил с анти-CD20-антителом (ритуксимаб, obinutuzumab, aatumumab) и схемы на основе бендамустина (Ghia and Hallek, 2014). Совсем недавно терапия, нацеленная на сигнальный путь B-cell-receptor (BCR), такой как ibrutinib и idelalisib, показала высокую частоту ответа и переносимость (Byrd et al, 2014).
Патогенез CLL можно рассматривать как сотрудничество между микроэкологическими механизмами и опухолевой генетикой. Геном хронического лимфоцитарного лейкоза (CLL) несет молекулярные повреждения
20 несинонимических мутаций и
5 валовых структурных аномалий Puente et al, 2015). В отличие от других вялых лимфопролиферативных В-клеточных нарушений, когда один преобладающий ген молекулярно изменен практически во всех случаях, ХЛЛ имеет гетерогенный генетический профиль, и до сих пор не было выявлено никаких унифицированных повреждений. Периодические сбалансированные транслокации, которые обычно встречаются во многих типах зрелых опухолей В-клеток, крайне редки в ХЛЛ, ограничиваясь транслокацией t (14; 18), включающей гены BCL2 в
2% невыбранных случаев (Cavazzini et al, 2008). Немногие молекулярные изменения повторяются с частотой> 5% в CLL, тогда как большое количество биологически и клинически нехарактеризованных генов мутируется на более низких частотах (Landau et al., 2015; Puente et al, 2015). Наиболее рекуррентные молекулярные поражения CLL указывают на дерегулирование клеточных программ, имеющих клиническое значение, а именно: (i) апоптоз; (ii) ответ на повреждение ДНК; и (iii) сигнализация соты (рисунок 1). Хотя патогенные последствия генетических повреждений ХЛЛ в большинстве случаев не были полностью охарактеризованы, их полезность в качестве прогностических биомаркеров (т.е. биомаркеров, которые предоставляют информацию о вероятном исходе ХЛЛ) или предсказательных биомаркеров (т.е. биомаркеров, которые предоставляют информацию о вероятной выгоде от специфическая обработка ХЛЛ) в определенной степени исследовано.
Исключение 13q14 является наиболее частым генетическим поражением CLL, происходящим в 50-60% случаев. Минимальная удаленная область на 13q14 содержит микроРНК miR15A и miR16A (Calin et al, 2002). В нормальных клетках miR15A и miR16A ингибируют экспрессию множественных генов, включая BCL2, циклины CCND1 и CCND3 и циклинзависимую киназу 6 (CDK6) (Klein et al, 2010). Удаление miR15A и miR16A отменяет этот ингибирующий эффект, способствует конститутивной выживаемости и циклированию опухолевых В-клеток и вызывает CLL в моделях мыши. В соответствующей фракции (
TP53 для центрального регулятора пути ответа на повреждение ДНК и, когда он функционирует, вызывает апоптоз CLL-клеток в ответ на химиотерапию. TP53 может быть нарушен в CLL делециями, мутациями или комбинацией обоих. Мутации представляют собой наиболее частую форму инактивации ТР53 в ХЛЛ и часто (
70% случаев) сопровождаются потерей второго аллеля через делецию 17 р13 (Rossi et al, 2009). Частота мутаций, лишенных 17p13 делеции, варьируется в зависимости от разных исследований в зависимости от когорты пациентов и используемой методологии, но в целом она составляет
30% всех дефектов TP53, тогда как единственная делеция 17p13 с отсутствием мутации TP53 реже (
Клиническая значимость аномалий ТР53 в ХЛЛ тесно связана с плохим прогнозом, отмеченным этим генетическим поражением, и его тесной связью с хемореактивностью, о чем свидетельствует ряд наблюдательных исследований и перспективных исследований, проведенных как в эпоху химиотерапии, так и в иммунохимиотерапии. Среди недавно диагностированных ХЛЛ у пациентов, страдающих от расстройств ТР53, самый худший результат, при этом средняя выживаемость (ОС) составляет 3-5 лет (
30% случаев живы в 10 лет, что составляет примерно 70% выживаемость по сравнению с общей популяцией) (Rossi et al, 2013). Однако в ситуациях без указания лечения отклонения TP53 не должны подвергаться регулярному тестированию, так как они могут превратить стратегию «смотреть и ждать» в «часовую и тревожную» ситуацию для пациента без каких-либо непосредственных терапевтических последствий. Действительно, важно подчеркнуть, что существует небольшая подгруппа пациентов с делецией 17p13 (и в основном мутированными генами IGHV), которые могут проявлять стабильное заболевание в течение многих лет без указаний на лечение.
Всесторонняя характеристика реорганизации генов иммуноглобулина у пациентов с хроническим лимфоцитарным лейкозом
Предыдущие исследования предложили географическую картину перегруппировки иммуноглобулина при хронической лимфоцитарной лейкемии (ХЛЛ), которая может быть получена в результате генетического фона или экологического антигена. Однако характеристики перегруппировок Ig у населения с юга Франции еще не установлены. Здесь мы изучали репертуар и мутационную модель CLL B-cell в южно-французской когорте пациентов, используя собственный протокол для цельного секвенирования перегруппированных генов тяжелой цепи иммуноглобулина. Описанное предвзятое использование переменных, разнообразия и присоединения генов между мутантными и не мутировавшимися группами было обнаружено у нашего населения. Однако, частота различных генов больше соответствует тем, которые наблюдаются у средиземноморских пациентов. Мы обнаружили, что третья длина комплементарно определяющей области (CDR) была выше в не мутированных последовательностях из-за смещения в разнообразии и объединении использования генов, а не из-за разнообразия N. Мутации, обнаруженные в CLL, следовали особенностям канонического механизма соматической гипермутации: предпочтение нацеливания на индуцированные активацией цитидиндезаминазы и полимеры полимеразы, смещение изменения базы для переходов и более замещающих мутаций, происходящих в CDR, чем в каркасных областях. Удивительно, что локализация активированных активацией мотиваций цитидина дезаминазы на переменный ген показала предпочтение каркасным областям. Изучение характеристик в возрасте диагноза не показало разницы в клинических исходах, но показало тенденцию к увеличению замещения и мутаций перекрестной трансверсии и более длинной третьей длины CDR у пожилых пациентов.
Хроническая лимфоцитарная лейкемия (ХЛЛ) является наиболее распространенной лейкемией, затрагивающей взрослых в западных странах. Клинический результат ХЛЛ очень варьируется: от пациентов, имеющих агрессивную злокачественность, к другим, у которых наблюдается медленное прогрессирующее заболевание. Определение соматического мутационного статуса перестроенных генов IGHV иммуноглобулина стало сильным прогностическим фактором для стратификации пациентов в клинических испытаниях 4. В частности, пациенты с 2% или более мутациями на генах IGHV (так называемые «мутированные») имеют лучший прогноз, чем пациенты с менее чем 2% мутациями (так называемые «не мутированные»).
Преднамеренное использование генов IGHV описано в клетках CLL с предпочтением к генам IGHV1, IGHV3 и IGHV4, но с другим перераспределением между мутантными и не мутированными группами 5. В частности, сегмент IGHV1-69 был связан с не мутированным статусом, тогда как сегменты IGHV3-23 и IGHV4-34 были обнаружены у пациентов с мутированным статусом [5,8,9]. Среди генов IGHD IGHD3 и, в частности, IGHD3-3 были в значительной степени перепредставлены и связаны с не мутированным статусом [2,5,8,9]. Что касается генов IGHJ, IGHJ4 предпочтительно применяли в мутантной группе, тогда как IGHJ6 в основном находили в не мутированной группе [2,5,7-9]. Кроме того, сравнение нескольких исследований, проведенных в разных географических регионах, привело к наблюдению различий в частотах гена IGH [8,10].
Предыдущие исследования показали, что третий комплементарно определяющий регион (CDR3) был более длинным в не мутированной группе, чем в мутантной группе [5,8,9,11]. Более короткий CDR3 наблюдался при перегруппировке с использованием семейства IGHV3 по сравнению с другими семействами IGHV [5]. Учитывая наиболее часто используемые гены IGHV, средний размер CDR3 в B-клеточном рецепторе (BCR), содержащий ген IGHV1-69, был длиннее, чем для других сегментов IGHV [8,12,13]. Значительный более длительный CDR3 наблюдался в BCR, включая ген IGHJ6, по сравнению с IGHJ3 и IGHJ4 [8,11,13,14]. Более того, Stamatopoulos et al. продемонстрировал, что гены IGH были перегруппированы неслучайным образом и показали существование стереотипов BCR [11].
Изучение мутационной картины в гене IGHV у пациентов с ХЛЛ показало характеристики соматической гипермутации (SHM), в том числе меньшую замену (R) мутаций в каркасе (FR) по сравнению с CDR генов IGHV, избыток переходов над трансверсионами и мутации, нацеленные на конкретные нуклеотидов или нуклеотидных мотивов, специфичных для AID (RGYW) и полимераз (WA) [8,15,16].
Изучая ген IGHV3-21, Ghia et al. предложил географическую схему перегруппировки Ig в ХЛЛ [10] с разницей между средиземноморским и скандинавским популяциями. Целью этого исследования было определить характеристики перегруппировок Ig у нашей популяции с юга Франции и сравнить их с ранее опубликованными данными. Используя собственный мультиплексный протокол с праймерами IGHV-Leader для эффективной амплификации и последовательности всего гена IGHV, мы проанализировали предвзятое использование генов IGHV, IGHD и IGHJ. Кроме того, мы сравнили длину CDR3 между мутантными и не мутированными группами и проанализировали вклад каждого компонента CDR3. Мы также сосредоточились на изменениях нуклеотидов у пациентов с мутированным геном IGHV, чтобы оценить, совместима ли мутационная картина с SHM. С этой целью мы проанализировали смещение переходных процессов, соотношение молчащих и замещающих мутаций и локализацию мотивов RGYW и WA. Наконец, в отсутствие предыдущего исследования мы определили, существуют ли различия в использовании IGHV, IGHD или IGHJ, длина CDR3, накопление мутаций и характеристики мутаций в клетках CLL, связанных с возрастом диагностики.
Семьдесят четыре пациента с ХЛЛ наблюдались в университетской больнице Монпелье в период с 1997 по 2011 год. Для исследования в соответствии с возрастом в возрасте до трех лет эмпирически определялись три категории. Геномные ДНК экстрагировали с использованием QIAmp DNA Blood Mini Kit (Qiagen®, Courtaboeuf, France) в соответствии с протоколом поставщика. Пациенты подписали письменное согласие на анализ.
Было проведено сравнение двух протоколов для оценки клональной картины каждого пациента. В первом протоколе, называемом «IGHV-Leader», использовалась смесь из 5′-праймеров, специфичных для каждой лидерной последовательности, расположенной на 150 б.п. выше по потоку от IGHV-области IGHV1 до IGHV6 вместе с 3′-BIOMED-консенсусным праймером JH-FAM (в списке в таблице 1). Другой, называемый «BIOMED2-FR1», использовал смесь 5 ‘FR1-праймеров и консенсус JH-FAM, как описано в протоколе BIOMED2 [17].
Семейство IGHV-Leader и консенсусные праймеры JH
Для процедуры IGHV-Leader амплификацию перегруппировки VDJ проводили в 25 мкл конечного объема в соответствии с протоколом изготовителя (Multiplex PCR kit, Qiagen®). Двадцать семь циклов амплификации выполняли при следующих условиях: 30 сек. при 95 ° С, 90 сек. при 57 ° С, 90 сек. при 72 ° С с начальной стадией денатурации / активации при 95 ° С в течение 15 мин. и конечный шаг расширения при 72 ° С в течение 10 мин.
Для стандартизованного протокола мультиплексирования BIOMED-2 ПЦР выполняли, как описано ранее [17], в конечном объеме 50 мкл.
Два микролитра продукта ПЦР выполнялись на секвенсоре.
Для обоих протоколов продукты ПЦР были очищены в соответствии с протоколом изготовителя (QIAQuick MinElute PCR Purification Kit, Qiagen®). Затем шесть реакций ПЦР проводили с каждым из шести семейных специфических праймеров (для протокола IGHV-Leader) или праймеров FR1 (для протокола BIOMED2-FR1) в сочетании с антисмысловым праймером JH. Условия ПЦР были идентичны условиям ПЦР мультиплексирования. Для каждой ПЦР контроль проводили на 2,5% агарозном геле.
После первого этапа очистки с использованием набора ExoSAP-IT® (GE Healthcare, Velizy-Villacoublay, Франция) в соответствии с протоколом поставщика продукты ПЦР секвенировали в обоих направлениях с использованием соответствующих смысловых и антисмысловых праймеров. Каждая смесь амплификации включала: 0,1 мкМ праймеров (IGHV-Leader, FR1 или JH); 2 мкл крупного красителя Master Mix 10 × (Big Dye Terminator v3.1 Набор для секвенирования цикла, Applied Biosystem®, Saint Aubin, Франция); 4 мкл буфера 5 × qsp 15 мкл. Эту смесь добавляли к 6 мкл продуктов ПЦР. Данную ПЦР проводили в течение 25 циклов (10 с при 96 ° С, 5 с при 50 ° С и 4 мин при 60 ° С). Затем продукты ПЦР очищали на пластине Sephadex® (GE HealthCare) и запускали в Sequencer Applied Biosystem® 3130XL.
Последовательности, полученные из смысловых и антисмысловых праймеров, были сначала выровнены, а затем проанализированы в двух базах данных: инструмент IMGT / V-QUEST (международная информационная система ImMunoGeneTics, депутат Лефранк, Университет Монпелье, CNRS, Франция; http://www.imgt.org / IMGT_vquest /) и программное обеспечение IgBLAST (Национальный центр биотехнологической информации, Национальные институты здравоохранения, Bethesda, MD, США; http://www.ncbi.nlm.nih.gov/igblast/). Результаты были представлены после формата IMGT. Мы рассматривали только продуктивные последовательности.
Чтобы проанализировать мутации в гене IGHV, мы использовали инструмент IMGT / V-QUEST. Регионы CDR и FR были такими же, как определено IMGT-V-QUEST. Процент гомологии рассчитывали путем подсчета количества нуклеотидных различий между 5′-концом FR1 и 3′-концом FR3 последовательности VH. Мы рассматривали как мутированную последовательность гена IGHV, представляющую более 2% изменений последовательности по сравнению с опубликованной последовательностью зародышевой линии. Пациенты с процентом мутаций более 2% были включены в мутированную группу [18]. В мутированных последовательностях формула Лоссоса использовалась для определения наличия выбора антигена [19]. Последовательности также анализировали на длину CDR3, мотивы CDR3, мотивы RGWY и WA и локализацию мутаций с использованием инструмента IMGT / V-QUEST.
Чтобы вычислить вероятность того, что мутация, происходящая в модах AID (RGWY / WRCY) или полимераз (WA / TW), была не из-за опасности, мы оценили ожидаемую частоту этих мотивов и сравнили ее с наблюдаемой частотой. Ожидаемая частота мутаций, нацеленных на RGYW / WRCY или WA / TW, была получена путем оценки ожидаемого количества мутаций, расположенных в мотиве RGYW / WRCY или WA / TW, если мутация была случайной и с учетом длины мотива и количество каждого мотива в данной последовательности IGHV. Наблюдаемая частота мутаций, расположенных в интересующих мотивах, была рассчитана с учетом количества мутаций, расположенных в мотивах и общего числа нуклеотидов.
Гены ighv не подвергались соматической гипермутации что это значит
В последние годы благодаря использованию новых биологических технологий сделан определенный шаг вперед в понимании патогенеза хронического лимфолейкоза (ХЛЛ), хотя многие моменты остаются неясными. В возникновении заболевания, как и при других лимфоидных опухолях, основную роль, по всей вероятности, играют длительная антигенная стимуляция и генетические нарушения.
Первый вопрос, возникающий при изучении опухоли, — из каких нормальных клеток она возникла.
Морфология лимфоцитов при хроническом лимфолейкозе (ХЛЛ) соответствует нормальным зрелым В-лимфоцитам, а их иммунофенотип — иммунофенотипу клеток зоны мантии вторичного фолликула лимфатического узла: сочетание экспрессии CD5 и слабой экспрессии поверхностных моноклональных иммуноглобулинов — IgM, нередко одновременно с IgD и очень редко с экспрессией IgG или IgA.
Нормальные CD5+-лимфоциты обнаруживают еще у новорожденных, они участвуют в независимом от Т-лимфоцитов иммунном ответе — продукции полиреактивных низкоаффинных антител, главным образом антител к собственным антигенам и полисахаридным микробным антигенам. Данные изучения аминокислотной последовательности вариабельного района Н- и L-цепей иммуноглобулинов этих лимфоцитов свидетельствуют о том, что нормальные CD5-позитивные В-лимфоциты не имеют признаков соматических гипермутаций или обнаруживают лишь очень небольшое число мутаций генов, кодирующих образование вариабельных районов иммуноглобулинов (генов IgV). Это также соответствует представлениям об их участии в независимом от Т-лимфоцитов иммунном ответе. У взрослых таких лимфоцитов значительно меньше, чем у новорожденных.
Они составляют примерно 10 % лимфоцитов костного мозга и около 30 % лимфоцитов лимфатических узлов и сосредоточены в зоне мантии вторичных фолликулов. На основании этих данных до последнего времени принималось без сомнений, что хронический лимфолейкоз развивается из клеток мантии вторичного фолликула лимфатического узла. Затем было показано, что клетки маргинальной зоны лимфатических узлов и селезенки человека имеют все черты лимфоцитов при В-ХЛЛ, кроме экспрессии CD5, которая, однако, может появляться после активации этих клеток. Кроме того, клетки маргинальной зоны также участвуют в выработке аутореактивных антител. Есть мнение, что, возможно, именно клетки маргинальной зоны служат источником развития хронического лимфолейкоза.
Сравнение интенсивности экспрессии различных антигенов на поверхности В-лимфоцитов при хроническом лимфолейкозе показало, что лимфоциты с признаками мутаций IgVH-генов интенсивно энспрессируют антигены CD71, CD62L, CD39, на поверхности клеток без признаков таких мутаций высока плотность экспрессированных антигенов CD38, CD69, CD40, HLA-DR.
Корреляция между мутационным статусом генов IgV и экспрессией CD38 обнаружена еще в конце 90-х годов. Оказалось, что CD38 экспрессирован на поверхности лимфоцитов в большинстве случаев ХЛЛ без признаков мутаций IgVHн-генов и отсутствует на большинстве лимфоцитов, имеющих признаки таких мутаций. CD38 является трансмембранным гликопротеином, экспрессированным на многих пролиферирующих гемопоэтических клетках. В недавно вышедших работах показано, что молекула CD38, обладающая энзиматической активностью и катализирующая обмен никотинамидов в лимфоцитах и поступление кальция, при ХЛЛ играет роль рецептора, проводящего сигнал пролиферации и дифференцировки клеток.
Кроме того, CD38 функционирует как молекула адгезии, обеспечивая связь клеток, на которых она экспрессирована, с эндотелиальными клетками. Все эти данные доказывают участие молекулы CD38 в пролиферации патологических лимфоцитов при ХЛЛ. P. Ghia и соавт. показали, что в тех случаях, когда у одного и того же больного имеются популяции CD38-позитивных и CD38-негативных клеток, CD38-позитивные лимфоциты статистически значимо чаще и в большем количестве обнаруживаются в костном мозге, чем в крови. Это согласуется с частым началом прогрессирования или рецидива заболевания с увеличения лимфоцитарной инфильтрации костного мозга.
Известно, что в клонах лимфоцитов с различным мутационным статусом активны разные гены, кодирующие Н-цепи иммуноглобулинов. Всего существует более 200 таких генов (IgVH-гены), однако идентифицированы как функционально активные (кодирующие образование белка) только 44 гена. Эти гены разделены на 6 семейств — от VH1 до VH6.
Все авторы, исследовавшие мутационный статус при ХЛЛ, указывают, что при хроническом лимфолейкозе без признаков соматических мутаций IgVH-генов чаще других функционируют гены 1-го семейства — VH1-69, в случаях с мутациями IgVH-генов — либо гены VH4-34, либо VH3-21. В Японии при обследовании 101 больного установили, что преобладающими по частоте функционирования являются гены семейства VH4 даже в группе без мутаций IgVH-генов. При исследовании 33 больных только у одного из 12 с отсутствием мутаций обнаружили функционирование генов VH1-69, в то время как в сообщениях из других стран функционирование этих генов выявили в 20— 30 % случаев.
В семье с несколькими больными хроническим лимфолейкозом преобладающими оказались гены семейства VH3 как в случаях с мутациями, так и без них. Пока неясно, отражает ли эта находка особенность семейных случаев вообще или присуща только этой семье.
Мутационный статус не меняется на протяжении болезни пациента.
С помощью ДНК-микрочипов было показано, что профиль экспрессируемых генов при хроническом лимфолейкозе независимо от мутационного статуса резко отличается от профиля экспрессируемых генов при других В-клеточных лимфомах и генов, экспрессируемых нормальными В-лимфоцитами. Обнаружено, что при хроническом лимфолейкозе с различным мутационным статусом имеется разница в экспрессии примерно 200 генов из изученных 14 000. Оказалось, что экспрессия тирозинкиназы Zap-70 в 93 % случаев совпадает с мутационным статусом, она достоверно чаще экспрессирована в лимфоцитах больных с отсутствием мутаций IgVH-генов.
Причины различной экспрессии Zap-70 у больных хроническим лимфолейкозом (ХЛЛ) с различным мутационным статусом лимфоцитов неясны. Zap-70 экспрессирована в нормальных Т-лимфоцитах и натуральных киллерах. В Т-лимфоцитах Zap-70 фосфорилируется и проявляет тирозинкиназную активность при передаче Т-клеткам сигнала активации через Т-клеточный рецептор. Роль Zap-70 в В-лимфоцитах пока неясна. Недавно в одной из работ показано, что при хроническом лимфолейкозе имеется корреляция между экспрессией Zap-70 в Т- и В-лимфоцитах: экспрессия Zap-70 в Т-лимфоцитах больных ХЛЛ оказалась значительно более выраженной, чем ее экспрессия в Т-лимфоцитах здоровых доноров (р = 0,001). Добавление фитогемагглютинина к культуре вызвало увеличение экспрессии Zap70 как в Т-, так и в В-лимфоцитах. Это позволяет высказать предположение, что первичная активация Т-лимфоцитов индуцирует экспрессию Zap-70 В-лимфоцитами.
Иммунофенотип опухолевых клеток при различных лимфопролиферативных заболеваниях
Если эти данные будут подтверждены, роль Т-клеток в патогенезе одного из вариантов ХЛЛ станет более очевидной.
В 2005 г. появились работы, в которых показано, что, помимо различий в экспрессии Zap-70, патологические лимфоциты при хроническом лимфолейкозе (ХЛЛ) различаются по экспрессии других белков. Оказалось, что лимфоциты с различным мутационным статусом достоверно различаются по наличию или отсутствию экспрессии липопротеинлипазы (LPL) и металлопротеиназы ADAM29.
Липопротеинлипаза играет центральную роль в метаболизме и транспорте липидов низкой плотности. Мутации гена, кодирующего ее образование, приводят к дислипидемии и развитию атеросклероза. LPL экспрессирована на клетках жировых тканей, сердечной мышцы, скелетных мышц, тканях молочной железы в периоде лактации. Она не эксперссируется нормальными В- и Т-лимфоцитами. Металлопротеиназа ADAM29 относится к семейству трансмембранных белков, регулирующих взаимодействие клеток друг с другом и с окружающими тканями. Она также не экспрессируется нормальными лимфоцитами. Причины экспрессии этих протеаз частью В-лимфоцитов при хроническом лимфолейкозе неизвестны.
Оказалось, что общая и безрецидивная выживаемость больных различаются в зависимости от наличия или отсутствия экспрессии LPL. Сопоставление экспрессии LPL и мутационного статуса показало, что в 84 % экспрессия LPL обнаруживается у больных с отсутствием мутаций IgVH-генов, а отсутствие экспрессии LPL — у больных с мутациями этих генов. Одновременное определение экспрессии LPL и ADAM29 позволило получить еще более близкое совпадение с мутационным статусом. Отношение LPL/ADAM29 более 1 в 90 % случаев совпадало с отсутствием мутаций IgVH-генов, менее 1 — с их наличием. Это показывает, что мутационный статус обусловливает профиль экспрессируемых на клеточной мембране белков, определение которых может использоваться вместо трудоемкого определения мутационного статуса.
Таким образом, к настоящему времени известно, что между двумя вариантами хронического лимфолейкоза имеются существенные биологические отличия. Тем не менее пока нет данных, позволяющих судить о том, одинаковые или разные по своему происхождению лимфоциты являются субстратом развития хронического лимфолейкоза при этих вариантах. Это могут быть одинаковые клетки, но малигнизация могла произойти на разных уровнях их дифференцировки, однако малигнизироваться могли и лимфоциты разных подгрупп. В последнее время все чаще высказывается предположение, что при обоих вариантах хронического лимфолейкоза малигнизируются клетки маргинальной зоны, экспрессирующие на своей поверхности IgM и небольшое количество IgD. Лабораторные исследования показывают, что эти клетки реагируют на антиген без участия Т-лимфоцитов.
Обычно лимфоциты, пролиферирующие в результате Т-независимой антигенной стимуляции, имеют немутировавшие IgVH-гены, однако имеются доказательства, что клетки маргинальной зоны могут проходить циклы соматических гипермутаций вне терминального центра. Эта гипотеза хорошо согласуется с похожим генным профилем обоих вариантов хронического лимфолейкоза.
Известно, что примерно у трети больных хроническим лимфолейкозом имеются мутации гена BCL-6, одного из регуляторов клеточного цикла. Мутации BCL-6 происходят в терминальном центре. Они обнаружены только в лимфоцитах, имеющих мутации IgVH-генов, что заставляет предполагать единый механизм их возникновения в терминальном центре вторичного фолликула лимфатического узла. В то же время мутации BCL-6 обнаружены только у трети больных с мутациями IgVH-генов, поэтому возможно, что в части лимфоцитов соматические гипермутации происходят вне терминального центра.
Таким образом, пока нет данных, позволяющих с полной уверенностью говорить о том, какая популяция нормальных лимфоцитов является источником развития хронического лимфолейкоза. С несомненностью доказано существование двух вариантов заболевания, однако неизвестно, почему при одном из них после встречи с антигеном в лимфоцитах не произошли гипермутации IgVH-генов и какова в этом роль В-клеточного рецептора.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021