геномное редактирование что это такое
Редактирование генома. Величайшее благо или абсолютное зло?
У человечества есть несколько ”ящиков Пандоры”, которые лучше не открывать. Если даже желание или необходимость его открыть все же появились, то делать это надо с максимальной осторожностью. Одним из таких ящиков является генная инженерия и редактирование генома. Кажется, что в этой истории все красиво. Мы можем получить лекарство от всех болезней, можем стать супер людьми, можем получить потомство, которое будет в десятки раз лучше нас, и многое другое. Можем даже избавить себя от необходимости искать элексир бессмертия, просто немного подправив гены еще до рождения. Можно подумать, что это дивный мир, которого мы достойны, но не спешите радоваться, ведь как в известной присказке, мы можем получить ”мир, который мы заслужили”. Естественно, в плохом смысле. Открывая этот ящик, мы можем сделать так, что уже никогда не станем прежними, но где гарантии, что новые ”мы” действительно будем лучше и не приведем сами себя к закату человечества?
Редактирование генома — это изменение всего.
Генная инженерия
Сейчас все большее количество правительств разных стран готовится к тому, чтобы разрешить эксперименты по редактированию генома на эмбрионах человека. Некоторые страны уже даже разрешили это, например, Великобритания.
Справедливости ради, пока мы не говорим о полностью готовом человеке с измененными генами, но все к этому идет. Вы же понимаете? Пока Великобритания разрешает ставить эксперименты только над эмбрионами, выращенными в лабораторных условиях. При этом они обязательно должны быть уничтожены через 14 дней после начала эксперимента. То есть формально нам это ничем не угрожает. Вопрос только в том, для чего это нужно тому, кто это разрешил. Явно не из любопытства. Что-то подсказывает, что как и многие передовые разработки, сначала это будет применяться в военных целях, ведь именно так можно получить универсального солдата. Он не будет хотеть есть или пить. Он не будет уставать или бояться взрывов. Небольшая корректировка генов и супер-солдат готов.
Жизнь на Земле могла появиться в результате гибрида молекул ДНК и РНК
Может не надо это трогать?
Но может все же что-то положительное в этом есть и можно дать шанс ученым доказать, что они не зря открывали инструменты редактирования? Какие преимущества редактирование генов может принести человеку?
Защита от вирусов на уровне ДНК
В основе редактирования генов и понимания того, зачем это вообще нужно, стояли исследования бактерий, которые показали, как они вырабатывали защиту от бактериофагов. Ученых особенно интересовало, как эта защита влияет на цепочки ДНК и при этом переносится на новые поколения бактерий.
Название бактериофагов происходит от древнегреческого ”пожираю”. Название не случайно, ведь это вирусы, которые избирательно поражают клетки бактерий и архей. Также бактерия служит местом размножения вируса. Бактериофаг состоит из белковой оболочки и генетического материала. Общая численность бактериофагов в природе примерно равна общей численности бактерий. Бактериофаги оказывают больше влияние на эволюцию бактерий.
Более того, определенные признаки изменения генов нашли изначально у бактерии кишечной палочки. Ученые заметили определенные повторяющиеся фрагменты, которые были разделены спейсерами, но тогда объяснить этого не смогли. Позже подобную структуру-кассету нашли и у других представителей прокариот. Тогда им и дали сокращенное название CRISPR (Clustered Regularly Interspaced Short Palindromic Repeats). В переводе на русский это может звучать, как КППРРГ (короткие палиндромные повторы, регулярно расположенные группами). Такое сокращение выглядит просто ужасно и проще пользоваться емким словом CRISPR.
Позже выяснилось, что те самые спейсеры очень похожи на куски ДНК вирусов-бактериофагов и являются частью защитного механизма бактерий, выработанного в ходе эволюции. Ученые предложили механизм, при котором белок Cas, ассоциированный с CRISPR, позволяет находить чужеродную ДНК, когда вирус попадает в клетку бактерии. Если ДНК вируса соответствует информации, которая есть у бактерии, то в этом случае чужая ДНК разрезается и заражение предотвращается.
Бактериофаги не просто живут за счет бактерий, но и размножаются в них.
Ученые провели ряд экспериментов, в ходе которых меняли геном бактерий и наблюдали, как на них воздействуют другие бактериофаги. Результаты доказали, что механизм работает именно так, как они думали. Также они подтвердили, что когда бактерия сталкивается с новым для себя вирусом, она может вырезать часть его ДНК и вставлять их в свою CRISPR-кассету. После чего эти ”записи” передаются потомкам.
Как можно редактировать геном
Ученые предлагали несколько способов редактирования генов. В частности можно было создавать определенные искусственные последовательности, которые могли бы узнавать определенные участки ДНК. В результате белок Cas9 вносил бы разрезы точно в те места, в которых это требовалось. Параллельно с разработкой такого метода было доказано, что внесение изменений подобным образом возможно не только на уровне бактерий, но и в клетках других организмов.
Что такое тест ДНК, как его делают и для чего он нужен?
Есть и другие способы редактирования генома. Например, с помощью искусственных ферментов, которых не существует в природе, но которые способны расщеплять цепочку ДНК. Их еще называют цинковыми пальцами. Все из-за того, что этот белковый модуль включает в себя один или несколько ионов цинка.
Редактировать гены возможно, но это сложно.
Такой способ требовал сложного подхода и долгой подготовки. Для каждого разреза в определенных участках генома надо было синтезировать специфичный белок. Кроме того, подобный способ редактирования часто приводил к ошибкам, так как разрезы часто происходили не в тех местах, где было нужно. Это лишний раз доказывает то, что вероятность ошибки очень высока, а неточности на начальных этапах могут привести к тому, что сбои будут идти, как снежный ком.
Редактирование генома CRISPR
Система CRISPR-Cas с точки зрения редактирование генома более простая и надежная. Главное только правильно синтезировать то, что укажет, в каком месте надо совершить разрез ДНК. Дальше запустится механизм восстановления и все сделается практически само собой. Тем более, если сделать много таких разрезов, то можно запрограммировать нужные изменения достаточно крупного участка ДНК.
Можно даже убирать целые участки ДНК, если это потребуется. При этом, на место удаленных фрагментов будут встроены те участки, которые будут нужны генетикам. Это позволит редактировать ”сломанные” последовательности, которые приводят к тяжелым заболеваниям. В теории надо будет просто заменить нужный фрагмент и все должно стать нормально.
Сами понимаете, что первым вопросом будет ”а можно ли встроить нужную часть кода?” Конечно, со временем и это станет возможно. Вот тогда и могут начать получаться целые новые народы. Но, скорее всего, дело ограничится небольшой группой узких специалистов, вроде людей, которые смогут выдержать полеты к другим планетам, или солдат, которые не будут уставать. Люди найдут, как извлечь из этого выгоду. Особенно правительства и инвесторы, которые вкладывают в разработки огромные деньги. И далеко не все из них делают это, чтобы избавить человечество от болезней. Увы, но реальность такова.
Применение генной инженерии в промышленности
Более того, можно смело говорить о том, что генное модифицирование уже применяется на практике для достижения определенных результатов. Я говорю о генно-модифицированных организмах — ГМО.
Самым простым примером, как для понимания преимуществ метода, так и для самих генетиков является создание модифицированных кисломолочных бактерий. Дело в том, что когда на производстве вирусы бактериофаги попадают в закваску, они уничтожают культуру полезных микроорганизмов. В итоге это приводит к тому, что партия оказывается испорченной, а производитель несет огромные убытки. Именно поэтому устойчивые к бактериофагам микроорганизмы решают массу проблем.
Если бактериофаги попадают на производство, пропадают просто огромные объемы продукции.
Ретровирусные инфекции
Относительно недавно я уже рассказывал о том, как мы все являемся носителями ретровирусов или, как их еще называют, реликтовых вирусов. В том числе к ним относится и ВИЧ, который миллионы лет назад встроил свой геном в наши ДНК и мы продолжаем передавать его из поколения в поколение.
В журнале Scientific Reports даже была опубликована работа, которая показывает, как при помощи CRISPR-Cas9 можно избавиться от этого наследства и даже ликвидировать возможность повторного встраивания вируса в ДНК.
Китайские ученые даже проводили эксперименты в этом направлении и обеспечили рождение двух генно-модифицированных человек. Ими стали девочки близнецы, один из родителей которых был ВИЧ-положительным. В итоге, они родились с устойчивым иммунитетом к вирусу. Проблема в том, что эксперимент был за гранью законности, но в целом все получилось.
Найдено живое ДНК динозавра. Возможно ли это?
Также в другой работе, опубликованной в Nature Biotechnology, доказывается, что при помощи модифицированного белка Cas9 можно отключать гены, которые мешают нормальному перерождению клеток и приводят к злокачественным образованиям. То есть потенциально это может стать долгожданным лекарством от рака. Вот только не привело бы такое вмешательство к тому, что воспроизводство новых клеток станет еще хуже.
Стоит ли запретить генетические исследования
Конечно, сейчас нельзя говорить о том, что уже завтра мы рискуем получить нежелательные последствия редактирования генома. Во-первых, исследования еще только ведутся и чего-то действительно серьезного не сделали. Во-вторых, даже когда начнется массовое применение технологий на людях, понять истинные последствия можно будет только через несколько поколений. К сожалению, такое положение дел может расслабить некоторых ученых, ведь по сути у них не будет никакой ответственности. Впрочем, это вряд ли, но вероятность этого все равно есть.
Главное не вестись на кажущуюся легкость редактирования генов. Неизвестно, во что потом это выльется.
Пока ученые с осторожность прогнозируют вероятность внесения таких изменений в геном человека, которые сделают из него кого-то другого, но в перспективе это все равно возможно. Если даже в этом не поможет CRISPR, найдется другой способ, но он будет.
Тут уже можно поднимать вопросы этичности того, что одни люди изначально будут от рождения лучше других. Кроме этого, возникают вопросы, насколько это корректно — вмешиваться в геном человека без его ведома. Может быть, когда из модифицированного появится человек, который отличается от остальных, он сам будет не рад этому. Одно дело, когда у него от природы определенный цвет волос, разрез глаз и форма ушей, а другое — когда за него кто-то решил, каким он должен быть. Вот еще одна дилемма будущего. А решать, стоит ли запрещать редактирование генома, вам. Каждый имеет свое мнение, которым можно и нужно поделиться в нашем Telegram-чате.
Редактирование людей: как и зачем ученые проводят операции с геномом
Каждый из живых организмов на Земле носит в клетках наследственный материал своих предков. Эти данные называются геномами, и они нужны непосредственно для создания и поддержания деятельности организма. Генная инженерия работает над изменениями в наследственной информации. Рассказываем, что происходит с редактированием геномов прямо сейчас.
Читайте «Хайтек» в
Применение генной инженерии в научных исследованиях
Для изучения функции того или иного гена может быть применён нокаут гена. Так называется техника удаления одного или большего количества генов, что позволяет исследовать последствия подобной мутации.
Для нокаута синтезируют такой же ген или его фрагмент, измененный так, чтобы продукт гена потерял свою функцию. Основные методы реализации: цинковый палец, морфолино и TALEN.
Для получения нокаутных мышей полученную генно-инженерную конструкцию вводят в эмбриональные стволовые клетки, где конструкция подвергается соматической рекомбинации и замещает нормальный ген, а измененные клетки имплантируют в бластоцисту суррогатной матери. У плодовой мушки дрозофилы мутации инициируют в большой популяции, в которой затем ищут потомство с нужной мутацией. Сходным способом получают нокаут у растений и микроорганизмов.
Логичным дополнением нокаута является искусственная экспрессия, то есть добавление в организм гена, которого у него ранее не было. Этот способ генной инженерии также можно использовать для исследования функции генов. В сущности процесс введения дополнительных генов таков же, как и при нокауте, но существующие гены не замещаются и не повреждаются.
Используется, когда задачей является изучение локализации продукта гена. Одним из способов мечения является замещение нормального гена на слитый с репортерным элементом, например, с геном зеленого флуоресцентного белка GFP. Этот белок, флуоресцирующий в голубом свете, используется для визуализации продукта генной модификации.
Хотя такая техника удобна и полезна, её побочными следствиями может быть частичная или полная потеря функции исследуемого белка. Более изощрённым, хотя и не столь удобным методом является добавление к изучаемому белку не столь больших олигопептидов, которые могут быть обнаружены с помощью специфических антител.
В таких экспериментах задачей является изучение условий экспрессии гена. Особенности экспрессии зависят прежде всего от небольшого участка ДНК, расположенного перед кодирующей областью, который называется промотор и служит для связывания факторов транскрипции.
Этот участок вводят в организм, поставив после него вместо собственного гена репортерный, например, GFP или фермента, катализирующего легко обнаруживаемую реакцию. Кроме того, что функционирование промотора в тех или иных тканях в тот или иной момент становится хорошо заметным, такие эксперименты позволяют исследовать структуру промотора, убирая или добавляя к нему фрагменты ДНК, а также искусственно усиливать его функции.
Зачем нужна генная инженерия человека
В применении к человеку генная инженерия могла бы применяться для лечения наследственных болезней. Однако, технически, есть существенная разница между лечением самого пациента и изменением генома его потомков.
Задача изменения генома взрослого человека несколько сложнее, чем выведение новых генноинженерных пород животных, поскольку в данном случае требуется изменить геном многочисленных клеток уже сформировавшегося организма, а не одной лишь яйцеклетки-зародыша. Для этого предлагается использовать вирусные частицы в качестве вектора.
Вирусные частицы способны проникать в значительный процент клеток взрослого человека, встраивая в них свою наследственную информацию; возможно контролируемое размножение вирусных частиц в организме. При этом для уменьшения побочных эффектов учёные стараются избегать внедрения генноинженерных ДНК в клетки половых органов, тем самым избегая воздействия на будущих потомков пациента.
Также стоит отметить значительную критику этой технологии в СМИ: разработка генноинженерных вирусов воспринимается многими как угроза для всего человечества.
С помощью генотерапии в будущем возможно изменение генома человека. В настоящее время эффективные методы изменения генома человека находятся на стадии разработки и испытаний на приматах.
Долгое время генетическая инженерия обезьян сталкивалась с серьёзными трудностями, однако в 2009 году эксперименты увенчались успехом: в журнале Nature появилась публикация об успешном применении генноинженерных вирусных векторов для излечения взрослого самца обезьяны от дальтонизма. В этом же году дал потомство первый генетически модифицированный примат (выращенный из модифицированной яйцеклетки) — обыкновенная игрунка ( Callithrix jacchus).
Хотя и в небольшом масштабе, генная инженерия уже используется для того, чтобы дать шанс забеременеть женщинам с некоторыми разновидностями бесплодия. Для этого используют яйцеклетки здоровой женщины. Ребёнок в результате наследует генотип от одного отца и двух матерей.
Однако возможность внесения более значительных изменений в геном человека сталкивается с рядом серьёзных этических проблем. В 2016 в США группа учёных получила одобрение на клинические испытания метода лечения рака с помощью собственных иммунных клеток пациента, подвергаемых генной модификации с применением технологии CRISPR/Cas9.
В конце 2018 года в Китае родились двое детей, геном которых был искусственно изменён (выключен ген CCR5) на стадии эмбриона методом CRISPR/Cas9, в рамках исследований, проводимых с 2016 года по борьбе с ВИЧ. Один из родителей (отец) был ВИЧ-инфицированным, а дети, по заявлению, родились здоровыми.
Поскольку эксперимент был несанкционированным (до этого все подобные эксперименты на человеческом эмбрионе разрешались только на ранних стадиях развития с последующим уничтожением экспериментального материала, то есть без имплантации эмбриона в матку и рождением детей), ответственный за него учёный не предоставил доказательств своим заявлениям, которые были сделаны на международной конференции по редактированию генома.
В конце января 2019 года властями Китая были официально подтверждены факты проведения данного эксперимента. Тем временем учёному было запрещено заниматься научной деятельностью и он был арестован.
Как редактируют человеческий геном?
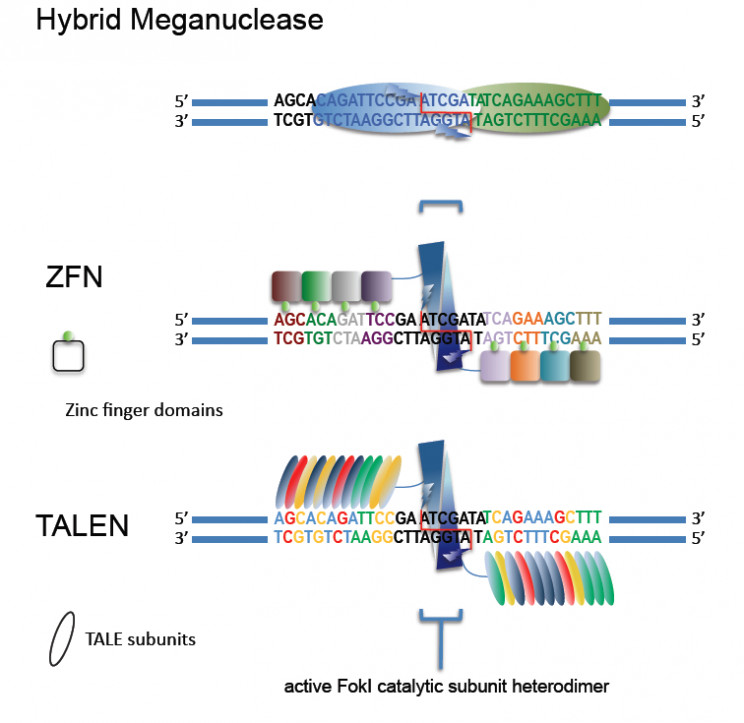
«Цинковые пальцы» встречаются и в составе человеческих белков. Благодаря этому методу можно сконструировать цепь ZFN так, что она будет узнавать определённый участок ДНК. Это дает возможность точечного воздействия на заданные участки в составе сложных геномов.
Домены «цинковые пальцы» встречаются в составе человеческих факторов транскрипции – белков, регулирующих процесс синтеза РНК с матрицей ДНК. При создании искусственных нуклеаз можно сконструировать цепочку из «цинковых пальцев» так, что она будет узнавать определенный участок ДНК.
Если такая цепочка будет достаточно длинной, она может распознавать относительно протяженные последовательности ДНК, состоящие из ряда тринуклеотидных фрагментов. Это означает реальную возможность точечного воздействия на заданные участки в составе больших сложных геномов.
Однако у метода «цинковых пальцев» обнаружились и серьезные недостатки: во-первых, это не вполне строгое распознавание тринуклеотидных повторов, что приводит к заметному числу расщеплений ДНК в «нецелевых» участках.
Во-вторых, метод оказался весьма трудозатратным и дорогостоящим, поскольку для каждой последовательности ДНК необходимо создать свою оптимизированную белковую структуру zinc-finger нуклеазы. Поэтому система «цинковые пальцы» широкого распространения не получила.
В 2011 году журнал Nature Methods назвал систему TALEN (Transcription Activator-like Effector Nucleases) «методом года» благодаря широкому спектру возможных применений в разных областях фундаментальной и прикладной науки.
TALEN — один из способов направленного внесения разрыва в ДНК с последующим его «залечиванием» — для выключения генов у мышей. Сразу после них эту технологию применили для внесения в мышиный геном мутации, приводящей к развитию одного из наследственных синдромов. Авторам метода моделирования генетически обусловленных болезней удалось не только «испортить» мышиный геном, но и исправить его обратно.
Метод обеспечивает точное воздействие на заданные участки ДНК и может быть использован практически в любой современной молекулярно-биологической лаборатории.
В основе этой системы — особые участки бактериальной ДНК — CRISPR (Clustered Regularly Interspaced Short Palindromic Repeats, или короткие палиндромные кластерные повторы). Разделяют эти повторы спейсеры — короткие фрагменты чужеродной ДНК. Последние встраиваются в геном после того, как ДНК рекомбинирует с её геномом.
Примеры редактирования человека
Заболевание 44-летнего жителя Аризоны Брайана Мадо проявилось еще в раннем детстве. Оно неизлечимо и наследуют его в основном мужчины. Мукополисахаридоз II типа — это метаболическое расстройство: у людей с ним есть мутация в гене, ответственном за производство фермента, который участвует в расщеплении сложных углеводов. В итоге они накапливаются в клетках и вызывают многочисленные патологии органов.
Мужчина решил принять участие в клиническом испытании нового метода — генной терапии. Это лишь первая фаза исследования, а всего до регистрации терапии (то есть до разрешения применять этот метод для всех больных с синдромом Хантера) их должно быть три.
Метод, который использовали в случае Брайана Мадо, позволяет редактировать геном прямо в теле человека — и при этом достаточно точно попадать в конкретный участок ДНК. Редактирование происходит с помощью так называемых «цинковых пальцев».
Китайский исследователь Хэ Цзянькуй отредактировал геномы человеческих эмбрионов перед процедурой искусственного оплодотворения, в результате чего на свет появились двое детей с измененной ДНК.
С помощью системы CRISPR/Cas9 исследователь отредактировал геномы эмбрионов семи пар во время репродуктивного лечения. В результате одной из беременностей от здоровой матери и ВИЧ-инфицированного отца родились две девочки-двойняшки с измененной ДНК. Хэ Цзянькуй пояснил, что удалил у детей ген CCR5, благодаря чему они получили пожизненный иммунитет к ВИЧ.
Для восстановления зрения можно использовать оптогенетические технологии, с помощью которых работой нейронов можно управлять с помощью светочувствительных белков бактерий и вспышек лазера.
Руководствуясь этой идеей, биологи создали вирус, который может проникать в ганглионарные нейроны. Эти нервные клетки отвечают за передачу сигналов из сетчатки в мозг человека. Попавший в ганглионарный нейрос вирус заставляет его производить подобные сигнальные молекулы. Однако эта процедура не возвращает зрение сама по себе, так как белки бактерий реагируют на свет не так, как палочки и колбочки сетчатки.
Чтобы решить эту проблему, профессор Базельского университета Ботонд Роска и профессор Питтсбургского университета Хосе Сахель создали специальные очки, которые преобразуют поступающие в них изображение в понятный мозгу формат и стимулируют ганглионарные клетки вспышками лазера. В результате пациент может видеть силуэты крупных предметов и объектов и совершать другие сложные действия
Все, что вам нужно знать о редактировании генома
Редактировать гены еще предстоит, когда-нибудь этот медицинский инструмент будут использовать для лечения широкого спектра дегенеративных заболеваний.
Каждая клетка тела человека содержит около 3 миллиардов пар оснований кода ДНК. Всего несколько мелких ошибок в этом коде могут наградить кого-то изнурительным заболеванием. Молекулярный биолог Эрик Олсен описал это как ошибку в написании одного слова в стопке из тысячи библий, и из-за этой крошечной опечатки ребенок может оказаться в инвалидном кресле на всю жизнь.
Исследователи уже определили ошибки в ДНК как причину почти 7000 заболеваний. К счастью, растущий мир редактирования генома может стать «средством проверки орфографии», необходимым для обнаружения и, в конечном итоге, устранения этих проблем.
Это невероятно мощный инструмент с огромным потенциалом в области медицины. В простейшей форме это способ внести определенные изменения в ДНК организма. Это похоже на редактирование кода в компьютерной программе.
Есть причина, по которой вокруг редактирования генов много шумихи. Оно потенциально может быть использовано для лечения основных дегенеративных заболеваний и исправления простых генетических состояний, таких как мышечная дистрофия. Возможно, скоро оно будет применено для выращивания новых человеческих органов у свиней, борьбы с постоянным спросом на трансплантации органов и потенциально перевернуть человеческое воспроизводство с ног на голову.
Генная инженерия в реальном мире ставит некоторые очень интересные этические вопросы. Сегодня мы собираемся взглянуть на историю редактирования генома, новые методы, такие как CRISPR, а также альтернативные варианты, а также рассмотрим некоторые этические вопросы, которые в настоящее время беспокоят этот медицинский инструмент.
Что такое редактирование генома?
Таблица сконструированных нуклеаз. Соответствующие цвета обозначают образцы распознавания ДНК. Источник: Фарзад Джамшиди / Викимедиа
Для редактирования ДНК используется множество различных методов и технологий. Тем не менее, большинство этих технологий обычно действуют как функции «вырезания» и «вставки» на вашем компьютере, позволяя ученым изменять ДНК в определенном месте генома организмов. Хотя большая часть ажиотажа вокруг редактирования генов сосредоточена вокруг его способности создавать людей, основное применение редактирования генома до сих пор находилось на растениях и некоторых животных в лабораторных условиях.
Можно ли исправить молекулярные ошибки?
Как только в 1940-х годах было осознано, что ДНК отвечает за наследственность, и в 1950-х годах была выяснена структура молекулы ДНК, исследователи поняли, что ошибки в этом генетическом коде ответственны за многие болезни и наследственные состояния.
Последовавший за этим вопрос был очевиден. Можно ли исправить эти ошибки? Этот вопрос привел к появлению генной инженерии в 1970-х годах, когда новый генетический код был введен в ДНК организмов. Однако изначально эта технология не позволяла целенаправленно вводить новый материал.
Гомологичная рекомбинация
Одним из первых примеров нацеливания генов на определенные участки в геноме организма была гомологичная рекомбинация. Этот метод включает в себя создание своего рода шаблона, который соответствует целевой последовательности генома, и полагается на нормальные клеточные процессы для вставки этого шаблона в правильное место. Метод был успешно использован для введения генетических модификаций мышам с использованием эмбриональных стволовых клеток.
Условный таргетинг
Другой ранний метод использовал условное нацеливание с использованием ферментов, называемых сайт-специфическими рекомбиназами (SSR). Он позволил выключить или включить гены только в определенных клетках и в конечном итоге помог исследователям вызвать рекомбинацию при определенных условиях, выключая гены или экспрессируя их в определенное время или на определенных этапах развития.
Процесс генной инженерии
Мегануклеазы
Нуклеазы «цинковые пальцы»
В 1990-х годах ученые использовали «цинко-пальчатые нуклеазы» (zinc-fingered nucleases) для улучшения существующих методов редактирования генов. Эти синтетические белки используются для нацеливания на гены и состоят из ДНК-разрезающих эндонуклеазных доменов, слитых с доменами цинковых пальцев, сконструированных для связывания определенной последовательности ДНК. Их можно использовать для добавления или удаления участков разреза в геномах клеток. Хотя этот метод был значительно улучшен, вероятность успеха по-прежнему составляет всего около 10 процентов. Более того, разработка этого метода редактирования генов требует больших затрат и времени.
Эффекторные нуклеазы, подобные активатору транскрипции (TALEN)
Эффекторные нуклеазы, подобные активатору транскрипции (TALEN), имеют некоторое сходство с нуклеазами «цинковый палец». Разработанные в 2009 году, TALEN созданы из белков, встречающихся в природе, и способны связываться со специфическими последовательностями ДНК. И хотя их эффективность и действенность параллельны ZFN, их гораздо проще спроектировать.
Кластерные короткие палиндромные повторы с регулярными промежутками (CRISPR)
Хотя ZFN и TALEN действительно предлагают эффективное редактирование генома, одним из недостатков является то, что их разработка требует много времени и средств. И процесс создания белков подвержен ошибкам. CRISPR является настолько революционным в области редактирования генов, потому что предлагает ученым более быстрый и простой способ редактирования генома, «требующий небольшой сборки». CRISPR / Cas9 уже был в поле зрения исследователей в 1990-х годах, но его потенциал был реализован только в последние годы.
CRISPR может распознавать определенные последовательности генома и вырезать их, часто используя белок Cas9
Технология CRISPR основана на защитном механизме, который бактерии используют для борьбы с вирусами. Вирусы атакуют клетки, используя собственный механизм клеток для создания своих копий. В конце концов, клетки лопаются, и копии вируса попадают в организм, заражая новые клетки. Однако у бактерий появился способ сопротивляться, разрезая ДНК вируса. Если бактерии переживают вирусную атаку, они копируют части ДНК этого вируса и включают их в свои собственные геномы. Эти копии используются как фотографии, чтобы бактерии могли идентифицировать вредоносные вирусы.
Чтобы отслеживать эту коллекцию «снимков» и держать их отдельно от собственной ДНК бактерий, повторяющиеся последовательности молекул размещаются вокруг каждой последовательности, взятой из вируса. Когда бактерия сталкивается с вирусом с последовательностью в его коллекции, бактерии посылают фермент, чтобы разрезать и уничтожить все, что соответствует генетическому снимку. CRISPR позволяет ученым использовать аналогичный подход, часто используя белок Cas9 для вырезания и замены определенных последовательностей генов.
Технология CRISPR позволяет ученым быстро и эффективно изменять практически любой ген любого растения или животного с небольшими затратами. Исследователи уже использовали эту технику для коррекции генетических заболеваний у животных, выращивания сельскохозяйственных культур, более устойчивых к определенному климату, изменения органов свиньи для облегчения трансплантации человеку, стерилизации комаров для предотвращения болезней и увеличения мышечной массы гончих.
Ученые также могут использовать CRISPR для создания коротких шаблонов РНК, которые соответствуют целевой последовательности в геноме, что делает процесс редактирования намного проще, эффективнее, дешевле и быстрее. CRISPR в настоящее время используется для разработки методов лечения ВИЧ, мышечной дистрофии Дюшенна, некоторых типов слепоты и болезни Лайма, и это лишь некоторые из них.
Редактирование генов может быть использовано для решения широкого круга проблем, если технология достигнет зрелости
Существует множество распространенных проблем, которые потенциально можно решить с помощью редактирования генов.
Когда-нибудь исследователи смогут избавиться от малярии у комаров. Исследователи уже создали москитов, устойчивых к малярии, удалив определенный сегмент ДНК комаров. Нейродегенеративные заболевания, такие как болезнь Альцгеймера и Паркинсона, потенциально могут уйти в прошлое. Ученые уже работают над платформами на основе CRISPR, чтобы идентифицировать гены, контролирующие клеточные процессы, которые приводят к нейродегенеративным заболеваниям. В 2017 году исследователи использовали CRISPR, чтобы отключить способность вируса ВИЧ к репликации, удалив вирус ВИЧ из инфицированных клеток.
В 2016 году пациент с раком легких в Китае стал первым человеком, которому сделали инъекцию клеток, модифицированных с помощью CRISPR. Исследователи использовали CRISPR, чтобы отключить ген, который раковые клетки используют для деления и размножения. Исследователи надеются, что без гена раковые клетки не будут размножаться.
Можно ли в конечном итоге редактировать людей? Приведет ли это к генетической дискриминации?
Да и нет. Дизайнерские младенцы, кажется, ведут разговор при обсуждении CRISPR. Этические вопросы типа: «Можно ли использовать генную терапию на эмбрионе, если невозможно получить разрешение эмбриона на лечение?» или «Что, если генная терапия слишком дорога и только богатые люди могут получить к ней доступ и позволить себе?» лежат в основе забот большинства людей.
Что, если люди будут использовать эти инструменты для улучшения спортивных способностей или роста ребенка, а не для лечения болезней?
Приведет ли это к генетической дискриминации? Хотя исследователи все еще обсуждают аргументы за и против, редактирование генов у людей уже началось.
США, Китай и Великобритания одобрили редактирование генов у людей только в исследовательских целях.
Нам еще предстоит долгий путь, прежде чем мы будем гулять с мутантами