генно инженерная векторная вакцина что это значит
Виды вакцин от COVID-19: какую выбрать
Оглавление
Сегодня поставить прививку от можно с использованием нескольких препаратов. Какие виды вакцин от ковида применяются в нашей стране? Чем они отличаются друг от друга? Какие прививки ставят в других странах? Давайте разберемся в этих вопросах.
Российские типы вакцин от ковида
В нашей стране в настоящий момент используются исключительно отечественные препараты.
Они разделяются на несколько групп:
Рассмотрим все вакцины от коронавируса более внимательно, определим их виды и отличия.
«Спутник V» (от Исследовательского центра имени )
Препарат создан на основе аденовируса (вируса, вызывающего ОРВИ) человека. Для разработки вакцины вирус лишили гена размножения. Благодаря этому он стал так называемым вектором (транспортным средством для доставки груза в клетки организма). В качестве груза в данном конкретном случае выступает генетический материал заболевания, против которого и работает препарат. Поступая в клетку, груз стимулирует выработку антител.
Важно! После введения первой дозы препарата организм человека от заражения еще не защищен. Это обусловлено тем, что антитела вырабатываются постепенно. Максимальный их уровень обеспечивается примерно через 2–3 недели после постановки второй прививки.
Иммунитет после вакцинации сохраняется примерно 2 года. При этом важно понимать, что антитела в крови присутствуют определенное количество времени, которое во многом зависит от индивидуальных особенностей пациента. В настоящий момент говорят о том, что хватает их примерно на год. При этом клеточный иммунитет сохраняется. Он защищает организм и после исчезновения антител.
«Спутник Лайт» (однокомпонентный вариант вакцины «Спутник V»)
Этот препарат отличается от исходного тем, что достаточно введения одной его дозы.
«ЭпиВакКорона» (от Центра «Вектор»)
Данная вакцина разработана на основе искусственно созданных фрагментов белков вируса. Благодаря этому она дает минимальное количество побочных эффектов. К основным относят возможную болезненность в месте инъекции и незначительное повышение температуры тела на короткое время. При этом и эффективность препарата является более низкой, чем у вакцины «Спутник V». Для повышения данного показателя проводится двукратная вакцинация с интервалом в 2–3 недели. На формирование иммунитета уходит около 30 дней. Ревакцинация по предварительным оценкам требуется примерно через 6–9 месяцев.
Разработчики уверяют, что препарат может обеспечить защиту организма от различных штаммов коронавируса. Но существует и другое мнение. Некоторые специалисты утверждают, что вакцина уязвима при мутациях вируса.
Иностранные виды вакцин от коронавируса
К ним относят: Pfizer/BioNTech и Moderna. Вирусные белки для производства препаратов синтезируются непосредственно в организме человека. Матричная РНК представляет собой своеобразную инструкцию. Прочитав ее, клетка начинает самостоятельно вырабатывать закодированный белок (фрагмент коронавируса). Препараты Pfizer/BioNTech и Moderna сегодня применяются для вакцинации в Великобритании, Израиле, странах Евросоюза, на Украине, в США и в других государствах. Прививки демонстрируют хорошую защиту от тяжелого течения заболевания. Это обусловлено тем, что вакцины проникают вглубь клеток, что имитирует инфицирование и приводит к формированию полноценного иммунитета. Недостатком препаратов является их недостаточная изученность.
Таким средством является вакцина AstraZeneca. Изготовлена она по принципу препарата «Спутник V». В качестве вектора в AstraZeneca выступает модифицированный вирус шимпанзе. Эффективность этой вакцины составляет 79%. При этом препарат на 100% защищает от тяжелого течения вирусной инфекции. Он используется в странах Евросоюза.
К ним относят Sinopharm и Sinovac.
Основными крупными поставщиками вакцин стали биофармацевтические компании из Китая. Они разработали препараты по принципу российского препарата «КовиВак». Вакцинация Sinopharm и Sinovac проводится не только в КНР, но и в Турции, ОАЭ, Чили, Аргентине и ряде других стран. Во время третьей фазы исследований определена общая эффективность препаратов, которая варьируется от 50% до 84%. При этом от тяжелого течения заболевания средства защищают на 100%.
Сравнение российских препаратов
Для правильного выбора прививки от коронавируса нужно сравнить между собой представленные препараты. Мы провели такое сравнение и оформили его в виде таблицы для вашего удобства.
| «Спутник V» | «Спутник Лайт» | «Кови Вак» | «Эпи Вак Корона» | |
|---|---|---|---|---|
| Срок формирования иммунитета (в днях) | 42 | 28 | Исследуется | 35-40 |
| Формирование антител (в процентах от вакцинированных) | У 98% | Почти у 97% | Исследуется | Более чем у 82% |
| Эффективность | Более 91% (в том числе для пациентов старше 65 лет) | Почти 80% | На стадии исследований | В настоящий момент не установлена |
Побочные эффекты вакцин
Необходимо сразу уточнить, что все побочные эффекты легкого и умеренного типов являются вариантом нормы.
В некоторых случаях также возможно развитие диареи.
После введения препарата пациент на 20–30 минут остается в медицинском учреждении. Это необходимо по причине риска развития аллергической реакции.
Преимущества обращения в МЕДСИ
Вирусолог Чумаков объясняет, что такое живые, мертвые, мРНК, векторные, белковые и пептидные вакцины

Мировая эпидемия ускорила развитие вакцин примерно так же, как мировая война ускорила развитие военной техники. Еще совсем недавно выбор был невелик: вакцины бывали живые и мертвые. Мертвые — из убитого формалином вируса, живые — из вируса аттенуированного, то есть такого, который хитро выращивали в лаборатории до той поры, пока он не потерял способность вызывать болезнь, но сохранил способность стимулировать иммунитет.
Минус живых вакцин в первую очередь в том, что они могли «одичать». Плюс — в том, что они задействовали все разновидности иммунитета, имеющиеся у человека. Константин Чумаков особо подчеркивает, что живые вакцины умеют задействовать неспецифический иммунитет, то есть тот вид иммунитета, который не связан с выработкой специфических к данной болезни антител, а преследует цель уничтожить любого агрессора, вторгшегося в организм.
Вирусолог-вакцинолог Константин Михайлович Чумаков. Фото: соцсети
Организм, грубо говоря, может существовать в нормальном режиме, а может — в защитном: немедленно начинает вырабатываться интерферон, запускаются каскады, приводящие к производству противовирусных белков, а в клетках начинает разрушаться любая РНК, что вирусная, что своя.
Такой неспецифический иммунитет можно сравнить с кнопкой, которую нажимает кассир в банке, чтобы защититься от грабителей.
Немедленно на окнах падают решетки, включается сигнализация, вся деятельность банка останавливается. Вдолгую в таком режиме банк не просуществует, но от грабителей — пока не подоспеют полицейские (специализирующиеся на борьбе с ними антитела) — защитится.
Эти исследования неспецифического иммунитета в свое время проводила известный советский вирусолог Мария Ворошилова, супруга Михаила Чумакова и мать Константина. В 1970-е годы во время сезонной эпидемии гриппа она прививала живой вакциной от полиомиелита рабочих Горьковского автозавода, и та давала защиту 75% — выше, чем вакцина от собственно гриппа. Константин Чумаков и первооткрыватель ВИЧ проф. Роберт Галло предлагали использовать эти свойства живых вакцин для временной защиты от ковида.
Советский вирусолог, член-корреспондент Академии наук СССР, основатель и первый директор Института полиомиелита и вирусных энцефалитов АН СССР Михаил Петрович Чумаков. Фото: Лев Портер / ТАСС
Новые вакцины
В ходе эпидемии в совершенно ударные сроки — меньше года — были созданы, испытаны и запущены в производство два совершенно новых типа вакцин: мРНК-вакцины и вакцины векторные.
Вместо того чтобы доставлять в клетку антиген — т.е. тот белок, к которому вырабатываются антитела, оба этих типа вакцин доставляют в клетку инструкцию по сборке антигена силами самой клетки. Это изящный прием биологического джиу-джитсу. Клетка что умеет делать? Синтезировать белок. Ну пусть и пашет.
В случае мРНК-вакцин это делается с помощью мРНК, потому что мРНК — это и есть инструкция организму по синтезу того или иного белка.
Двумя самыми известными такими вакцинами стали Pfizer-BioNTech (они получили на разработку вакцины 375 млн евро от правительства Германии и на 2 млрд долл. предзаказов от правительства США) и Moderna (1,53 млрд долл. от Operation Warp Speed).
В случае векторных вакцин информация в клетку доставляется с помощью вектора — т.е. репликативно дефектного вируса, вируса-евнуха, в которого вставлен «лишний» кусочек ДНК, содержащий инструкцию по сборке антигена, в данном случае знаменитого S-белка коронавируса. При этом у самого вируса вырублен ген, без которого он не может размножаться. «Этот дефектный вирус может расти только в специальных культурах, в которых этот вырубленный ген экспрессируется», — говорит Константин Чумаков.
Векторные вакцины — это китайская CanSino, наш «Спутник», Оксфордская вакцина и Johnson&Johnson (который вот только что получил разрешение на применение в ЮАР). Все они в качестве вируса-евнуха используют аденовирус — то, что вызывает обычную простуду. Merck (неудачно) пытался использовать вирус кори, еще одна компания использовала вирус везикулярного стоматита.
Плюсы мРНК-вакцин колоссальны.
Первое: они задействуют почти все уровни иммунитета, от антител до Т-киллеров (существовали опасения, что они будут задействовать только антитела).
Второе: для производства мРНК-вакцин не надо выращивать в реакторах вирус, ни живой (и поэтому опасный), ни дефектный (и поэтому довольно сложно размножающийся). мРНК-вакцины могут быть быстро произведены в огромных количествах. Один только Pfizer обещает произвести в 2021 г. невообразимые 2 млрд доз.
Третье. Если вирус мутирует, и прежние антитела не будут на него действовать, то мРНК-вакцину перестроить под новый штамм так же легко, как проапгрейдить компьютер, поменяв карту памяти. Для этого не надо новых долгих трех фаз испытаний. Для этого просто в лаборатории нужно переписать несколько букв в инструкции по сборке, а эффективность быстро проверить в опытах на животных, которые покажут, работает вакцина или нет.
И, наконец, четвертое:
в отличие от векторных (аденовирусных) вакцин, мРНК-вакцины можно вводить неограниченное число раз.
Увы, с векторными вакцинами этот фокус не проходит. Человек, привитый аденовирусной вакциной, получает иммунитет не только к спайк-белку, но и к самому аденовирусу. Если его снова привить той же вакциной, то «местные копы» просто не пустят аденовирус в клетку.
Из этого вытекает вторая неприятная особенность векторных вакцин: если вы уже болели данным типом аденовируса, у вас может не сформироваться сильный иммунитет. Создатели «Спутника» попытались обойти проблему, использовав два разных и редких аденовируса.
Создатели Оксфордской вакцины использовали аденовирус шимпанзе.
Плюсы векторных вакцин по сравнению с мРНК-вакцинами в первую очередь в том, что пока они гораздо дешевле. Минус: производить их гораздо сложнее, особенно если учесть, что растить надо не абы какой вирус, а вирус-евнух. «Спутник», по слухам, испытывает особенно большие проблемы с размножением своего второго компонента.
Проблемы с производством испытывает и «Астра-Зенека», производящая Оксфордскую вакцину. Векторные и мРНК-вакцины — бесспорные победители этой гонки, и обидно понимать, что технология мРНК была известна уже добрых десять лет, но не шла в ход, чтобы абы чего не вышло.
Ведь эти технологии могут использовать в первую очередь даже не для лечения ковида, а, скажем, для лечения рака. Ведь что такое мРНК? Способ доставки в клетку инструкций о синтезе того или иного белка. А теперь представьте себе, что вы доставляете в клетку информацию о синтезе белка, который запускает процесс умирания этой клетки? А эта клетка — раковая.
Белковые вакцины
Есть, однако, и бесспорные лузеры, и первыми из этих лузеров пока кажутся белковые вакцины.
Житель Израиля возле пункта вакцинации. Фото: Anadolu Agency / Getty Images
Здесь вообще следует сделать отступление и напомнить, что Евросоюз — по сравнению с Израилем, Великобританией и США — в деле вакцинации населения позорно провалился. Темпы вакцинации во всех странах ЕС крайне незавидные, потому что страны ЕС делегировали закупку и распределение вакцин Еврокомиссии, а Еврокомиссия, как это обычно бывает с надгосударственной бюрократией, ошиблась везде, где можно.
Одной из самых крупных ошибок Еврокомиссии и кипрского психолога Стеллы Кириакидис, которая 1 декабря 2019 года была назначена на совершенно на тот момент пустую бюрократическую должность комиссара здравоохранения, — стала закупка 300 млн доз вакцины от GlaxoSmithKlein/Sanofi.
Вакцина Sanofi получила от ЕС умопомрачительные 2,1 млрд долл., но недавно объявили о неудачных испытаниях: для людей свыше 60 лет она оказалась попросту не очень эффективна.
Как устроена вакцина Sanofi? Это — белковая вакцина.
Как мы уже говорили, в случае векторной вакцины или мРНК-вакцины в организм вводится инструкция по сборке белка. В случае белковой вакцины в организм вводится сам белок — не весь вирус, живой или мертвый, а только белок, к которому организм и вырабатывает антитела. В данном случае, конечно, вводится знаменитый S-белок коронавируса.
Первые вакцины такого рода появились в конце прошлого века, и это были вакцины от гриппа. Делаются они в реакторе. Встраивают в какой-то крупный вирус (обычно это бакуловирус) ген, который надо экспрессировать, заражают этим вирусом клеточную культуру, а потом очищают белок.
«Двадцать лет назад все радовались такому чистому белку, — говорит Константин Чумаков, — но мне, честно говоря, кажется, что это прошлый век. Мне больше нравятся вакцины живые, или полуживые, или мРНКовые. Вы вводите вакцину, организм синтезирует белок сам, и это сопровождается целым оркестром защитных реакций. А когда вы вводите чистенький белок — это, как правило, менее эффективно».
Грубо говоря: если вы вводите в организм мРНК или вектор, то организм играет общую тревогу. В обороне оказываются задействованы все виды войск: антитела, Т-киллеры.
Организм поднимает танки, самолеты и силы ПВО. А белковая вакцина — это вакцина, которая из всех сил обороны задействует только ОМОН.
Белковые вакцины — очень слабые раздражители, и для того, чтобы организм вообще узнал, что в него попало что-то нехорошее, к этим вакцинам часто требуется добавить адьювант, то есть вещество, которое само по себе не вызывает иммунитета, но вызывает воспаление. Классический адьювант — соли алюминия.
Согласимся — вакцина, которой организм даже не заметит, если вы его дополнительно не расцарапаете, доверия не внушает. К тому же, как напоминает Константин Чумаков, большинство вакцинологов считают, что адьювант повышает риск аутоиммунной реакции. В 1976 году во время пандемии гриппа сделали вакцину с адьювантом — и в результате получили много случаев синдрома Гийяма-Барре.
Суммируя: более мягкие белковые вакцины оказались более сложными в проектировании, чем мРНК и аденовирусные. Они по определению должны давать худший иммунитет. Eсли есть выбор, этим лучше не прививаться. Иммунитет будет слабый, а шансы на осложнения могут возрасти.
Пептидные вакцины
Про белковые вакцины я не случайно так подробно говорю, потому что белковых вакцин от коронавируса еще нет, а вот вакцина новосибирского «Вектора» уже есть. И это даже не белковая вакцина — это пептидная вакцина. И пептидная вакцина — простите уж нахрапистое обобщение дилетанта — представляется сооружением еще более сомнительным, чем вакцина белковая.
Если Sanofi и Novavax пытаются сделать целый большой белок, то пептидная вакцина устроена так: она берет кусочки белка (по научному — «эпитопы»). «Это старая и довольно очевидная идея, — говорит Чумаков, — иммунизировать не всем белком, а только кусочком, который важен».
Однако к практическому воплощению этой идеи Константин Чумаков относится скептически. «Это было последним писком моды в 1980-е годы, но сейчас серьезные вакционологи об этом подходе перестали думать, — говорит он, — хотя у них может быть узкое применение в специальных случаях. А пока их единственное преимущество в том, что они, скорее всего, будут безопасны, но с другой стороны — не слишком эффективны».
Почему «массовая вакцинация» в России так и не началась, а другие страны опережают нас на порядок: исследование «Новой»
На Западе есть несколько маленьких стартапов, которые заявили о том, что работают над пептидной вакциной против ковида. Это Valo Teurapeutics, Generex, Vaxil Bio и пр. Но ни один из них близко не является финалистом гонки и не вошел в призеры Operation Warp Speed.
Поскольку официальным данным об испытаниях вакцин в России доверия нет (мы, к сожалению, его попросту не заслужили), то люди, участвовавшие в России в испытаниях вакцин, сами делали тесты на антитела и делились данными в Telegram, что было, строго говоря, плохо, потому что тем самым эти люди расслеплялись и официальные испытания проваливали.
Тем не менее из групп в Telegram было ясно, что «Спутник» работает (потом это стало ясно и из статьи в Lancet), а вот антител к ковиду после векторовской вакцины не находили.
В «Векторе» на это отвечали, что их эпитопы — такие, которые вызывают не антитела, а Т-клеточный ответ, который измерить куда сложней, чем антитела. «Однако неизвестно, достаточно ли одного Т-клеточного иммунитета для защиты от ковида», — говорит Константин Чумаков. Короче, у «Вектора» такая особая вакцина, что иммунный ответ на нее проверить сложно, но «Вектор» уверяет, что он есть.
А что от вакцины «Вектора» нет побочки — святая правда. От физраствора тоже побочки нет.
Мертвые вакцины
Тут читатель спросит — а куда же делись мертвые вакцины? Вакцины по старинным рецептам, традиционные, как бабушкино варенье? Самая надежная, простая и могучая кувалда, которая имеется против вирусов в арсенале человечества уже без малого век? На Западе среди финалистов Operation Warp Speed их просто нет. Однако мертвую вакцину сделал Китай (Sinovac), и мертвую вакцину вот-вот выпустит институт им. Михаила Чумакова.
Пустые пузырьки из под вакцины Sinovac после вакцинации в Индонезии. Фото: ЕРА
Почему про мертвые вакцины забыли на Западе? (Почему пока нет живых — понятно. Аттенуировать вирус в лаборатории — долгий процесс и большое искусство.)
Ответов, судя по всему, три.
Первый — о котором Константин Чумаков говорит, несколько даже стесняясь, — заключается в том, что ученым интересно делать что-то новое, а шить варежки, как бабушка, неинтересно. И грантов под это больших не получишь.
Второй заключается в том, что для того, чтобы изготовить много мертвой вакцины, нужно, прежде всего, наработать много живого вируса (который потом надо убить). Вирус патогенный, работать с ним опасно. Вовсе не всякий биологический стартап, который без проблем варит у себя в пробирке мРНК, будет связываться с живым патогенным вирусом, для которого нужны лаборатории высокой степени защиты. (Собственно, именно поэтому в России мертвую вакцину предлагает институт им. Чумакова, который собаку съел на размножении патогенных вирусов и у которого подобные мощности есть.)
И, наконец, третье обстоятельство заключается в том, что старая добрая бабушкина варежка (мертвая вакцина) в данном случае не очень хорошо шьется. Почему? Все дело в свойствах S-белка, того самого, с помощью которого коронавирус проникает в клетку.
Напомню, что этот белок — отмычка. И у него есть две конфигурации (конформации, как говорят вирусологи). До того как он пролез в клетку — и после.
Видели когда-нибудь «бешеный огурец», который, созревая, стреляет семенами? Вот примерно то же самое происходит и с S-белком: когда он прикрепляется к рецептору, через который забирается в клетку (вообще-то этот рецептор нужен для регулирования кровяного давления), он сворачивается совсем другим способом.
Пептидная цепочка остается одна и та же, но форма у нее разная, и на нее вырабатываются разные антитела. «Если антитела вырабатываются на ту конформацию, которую S-белок имеет до проникновения в клетку (pre-fusion), то все в порядке, — говорит Константин Чумаков. — А если пост-фьюжн — то такие антитела не только не помогут против инфекции, но, чего доброго, еще сами помогут затащить белок в клетку». (И тогда это будет т.н. АЗУИ – антителозависимое усиление инфекции, самый страшный кошмар вирусологов.)
И вот когда вирус готовится при помощи формалиновой обработки — то S-белок может свернуться. Именно такая печальная история произошла в 1960-х годах с мертвой вакциной от RSV — респираторно-синцитиального вируса.
«Эти белки очень похожие и у коронавируса, и у RSV, и у вируса гриппа. Они нужны для того, чтобы вирус проник в клетку. Прикоснувшись к ней, они быстро сворачиваются, раздвигают клеточную мембрану и позволяют вирусу пролезть внутрь. А если белок свернется в процессе изготовления вакцины, то такая вакцина работать не будет. Поэтому, чтобы S-белок не сворачивался, в мРНК-вакцинах специально поставили два пролина (одна из аминокислот, из которых сделан любой белок. — Ю. Л. ). А в живом вирусе этого сделать нельзя. Эти два пролина являются шарниром, который не позволяет S-белку свернуться, без этого он не может проникнуть в клетку, — говорит Константин Чумаков. — Но если убитую вакцину сделать правильно — то у нее есть все шансы на успех».
„ нет худа без добра, и в результате эпидемии те биотехнологические решения, внедрение которых человечество откладывало десятки лет, за год стали мейнстримом.
Будем надеяться, что США и Евросоюз с такой же скоростью начнут одобрять лекарства против рака.
Ключ к уничтожению противника
Как работают вакцины против COVID-19? Какие самые эффективные, какие безопасные? Чем прививаться? Объясняет микробиолог Константин Северинов
И второе: колитесь, колитесь и колитесь. Риск от вакцины и риск от ковида попросту несопоставимы, а боязнь прививок нельзя объяснить ничем, кроме вопиющей безграмотности. Как гласит жестокая фотожаба: «Те, кто считает, что вакцина от ковида изменит их ДНК, должны рассматривать это как шанс».
Что такое ДНК-вакцины и с чем их едят?
Автор
Редактор
ДНК-вакцины относятся к типу принципиально новых биологических препаратов. С их разработкой связывают большие надежды на повышение эффективности профилактики не только заболеваний бактериальной, вирусной и паразитарной природы, но и аллергических, аутоиммунных и даже онкологических болезней. Более двадцати лет назад возникла идея использовать гены возбудителей заболеваний для активации защитных механизмов. Конструкция ДНК-вакцин гениально проста: главные компоненты в ней — вектор и целевой иммуноген. Но, несмотря на это, ДНК-вакцины не стоят на страже нашего здоровья: их не вводят пациентам в поликлиниках, они не продаются в аптеках.
Более сотни лет прошло с введения Л. Пастером термина «вакцина» (лат. vacca — корова) и более двух сотен — с легендарных экспериментов Э. Дженнера по прививанию коровьей оспы ребенку с целью предупреждения развития опасного человеческого варианта болезни. Принцип защитного действия введенных в организм ослабленных инфекционных агентов или их частей научным языком объяснили уже в XX веке: безопасный чужеродный антиген учит иммунную систему в дальнейшем быстро распознавать и уничтожать активного и опасного возбудителя с точно такими же антигенами*. Процесс часто сравнивают с раздачей фоторобота преступника сотрудникам полиции.
* — Хронологию разработки вакцин, информацию о влиянии вакцинации на характер эпидемий и численность человечества, доводы адептов движения антивакцинации и ответы на множество животрепещущих вопросов относительно целесообразности, пользы и вреда прививок можно найти в статье «Вакцины в вопросах и ответах» [1]. — Ред.
За 200 лет форма и содержание прививок претерпели существенные изменения: Дженнер инфицировал царапины содержимым оспинных пустул, Пастер облагородил процедуру, вводя ослабленных агентов шприцем, затем научились создавать вакцины из убитых и даже растерзанных возбудителей (сплит- и субъединичные вакцины), недавно начали использовать рекомбинантные вакцины, содержащие один или несколько антигенов (обычно белковых), синтезированных генно-инженерным путем. И вот в двери ВОЗ робко стучится новый плод, порожденный слиянием науки с фарминдустрией, — вакцина из нуклеиновых кислот [2].
Начало ДНК-вакцинологии связывают с работами Д. Танга (1992 г.), в которых была показана способность плазмидной ДНК, экспрессирующей гормон роста человека, индуцировать выработку антител.
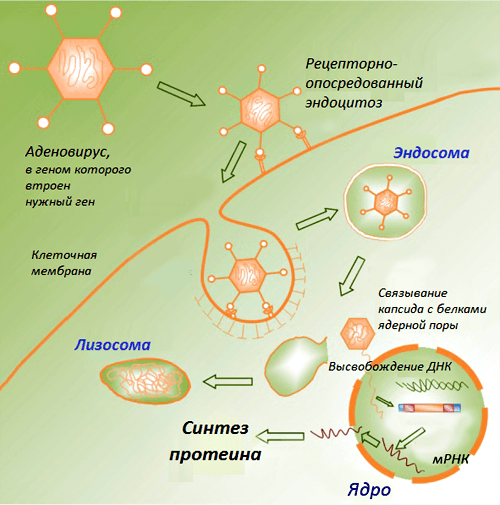
В классическом варианте такие вакцины состоят из плазмидных ДНК, содержащих гены возбудителей инфекционных заболеваний (целевые гены, или иммуногены). Продукты данных генов способны вызывать развитие защитных реакций организма, выступая в этом случае в роли антигенов. Доставку ДНК в макроорганизм первоначально осуществляли в комплексе с катионными липидами, однако эффект от введения препарата чистой нуклеиновой кислоты оказался более выраженным. Введенная в организм ДНК проникает в клеточное ядро, превращая клетку в завод по производству вакцины. Такая ДНК длительное время существует вне хромосом без репликации, транскрибируется за счет ферментов хозяйской клетки и экспрессирует соответствующие гены, продукты которых вызывают формирование иммунитета (рис. 1).
Рисунок 1. Схематическое изображение процессов в клетке после проникновения ДНК-вакцины. Рисунок из «Википедии».
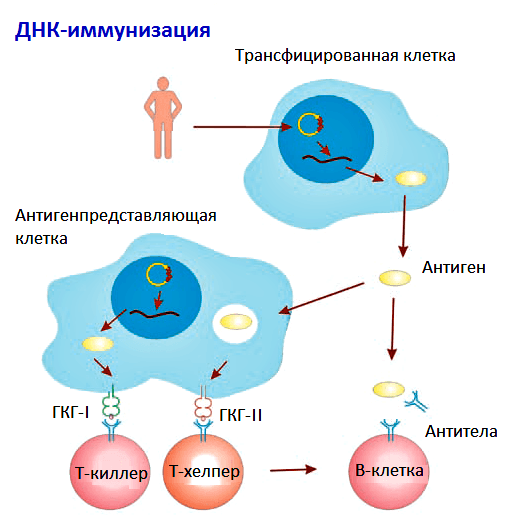
ДНК-вакцины сохраняются в организме 3–4 недели. За это время они успевают индуцировать Т- и В-клеточный иммунитет (рис. 2). Однако, несмотря на кажущуюся простоту, многие механизмы развития иммунного ответа на ДНК-вакцины остаются малоизученными [3].
Рисунок 2. Схема развития иммунного ответа на ДНК-вакцину. Рисунок из «Википедии».
Более чем 20-летняя эволюция ДНК-вакцин продолжается и сегодня. Прогресс в дизайне кодирующих антигены нуклеотидных последовательностей, в оптимизации состава (в том числе включение молекулярных адъювантов), в совершенствовании форм и физических методов доставки позволил второму поколению ДНК-вакцин преодолеть такие проблемы первого поколения, как низкий уровень трансфекции и недостаточная иммуногенность.
Сейчас разработки в области генетических вакцин проводятся во многих странах мира. В настоящее время сконструированы экспериментальные ДНК-вакцины для профилактики инфекционных заболеваний паразитарной (шистосомоз, лейшманиоз), бактериальной (хламидиоз, сибирская язва, микоплазмозы) и вирусной (бешенство, лихорадки Западного Нила и Эбола) природы. На разных стадиях доклинических и клинических испытаний находятся генетические вакцины против вирусов гриппа, гепатитов А и В, герпеса, кори, геморрагических лихорадок, ВИЧ, собачьей чумы, ящура, папилломавирусов, цитомегаловирусов. Столь интенсивное развитие данного направления вакцинологии, вероятно, уже в ближайшей перспективе обеспечит реальный выход в виде эффективных и безопасных вакцинных препаратов, рекомендованных для применения в здравоохранении и ветеринарии.
Чем же ДНК-вакцины хороши?
Но. всё хорошее имеет свои недостатки
Конструкция ДНК-вакцин
Для получения ДНК-вакцин ген, кодирующий продукцию иммуногенного белка, необходимо встроить в вектор, роль которого выполняют бактериальная плазмида или вирус [4]. Вектор не должен реплицироваться в клетках макроорганизма, поэтому может содержать только прокариотические сайты инициации репликации.
Для создания ДНК-вакцин используются хорошо изученные плазмиды грамотрицательных бактерий (в основном E. coli), в частности многокопийная pUC19 или pBR322 и их производные. Разработаны специальные векторы для ДНК-вакцин — pcDNA3 и pcDNA3.1 (Invitrogen), которые содержат цитомегаловирусный (ЦМВ) промотор и сигнал полиаденилирования гена гормона роста быка. Также к коммерчески доступным плазмидам, которые чаще всего используются в качестве векторов для ДНК-вакцин, относятся: pVAX1 (Invitrogen), pCI, VR1012 DNA, pJW4303, pVAC1-mcs и pVAC2-mcs (InvivoGen). Последние две применяются для усиления гуморального иммунного ответа и содержат антигены к поверхностным структурам мышечных клеток [5].
Из числа вирусных векторов, обеспечивающих более высокий уровень экспрессии целевого антигена, чаще всего используются: дефектный по репликации аденовирус серотипа 5 (AD5), ортопоксвирусы и модифицированные вирусы осповакцины, альфавирусы. Аденовирусный вектор обладает высокой эффективностью трансфекции — до 100 %, в него можно включать до 8 т.п.н. ДНК. Отрицательный момент — синтез собственных белков, способных индуцировать иммунный ответ. Самые используемые осповакцинные модификации — Ankara (MVA) и New York Vaccinia strain (NYVAC). Первая получена в результате 56-кратного пассирования вируса в куриных эмбриональных фибробластах. В геноме NYVAC удалено 18 открытых рамок считывания, ассоциированных с диапазоном хозяев и вирулентностью. В каждый из перечисленных векторов можно встроить до 50 т.п.н. ДНК [6].
Элементы конструктора
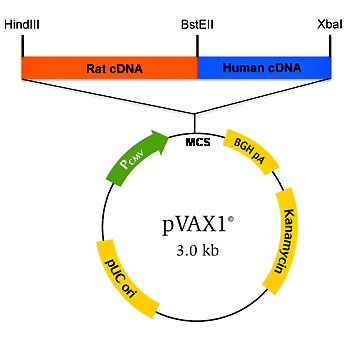
Рисунок 3. Конструкция ДНК-вакцины на основе вектора pVAX1 с химерным геном (Rat cDNA, Human cDNA). Pcmv — цитомегаловирусный промотор; MCS — сайт для множественного клонирования генов; BGH pA — терминатор с сигналом полиаденилирования гена гормона роста быка; Kanamycin — ген устойчивости к канамицину; pUC ori — участок начала репликации плазмид группы pUC; HindIII, BstEII, XbaI — сайты рестрикции. Рисунок из [5].
Чтобы пригодиться для создания ДНК-вакцин, каждый уважающий себя вектор должен содержать необходимые конструкционные элементы (рис. 3).
Службы доставки
Способам введения ДНК-вакцин в организм уделяется не меньше внимания, чем созданию самих конструкций, так как от этого зависит успех иммунизации в целом. Поэтому разработаны различные, порой весьма хитроумные, методы доставки таких вакцин в организм.
Самый простой — это парентеральный способ введения, который заключается в инъекции ДНК-вакцин в солевом растворе (внутримышечно, внутрикожно). При этом бόльшая часть ДНК поступает в межклеточное пространство и только потом включается в клетки.
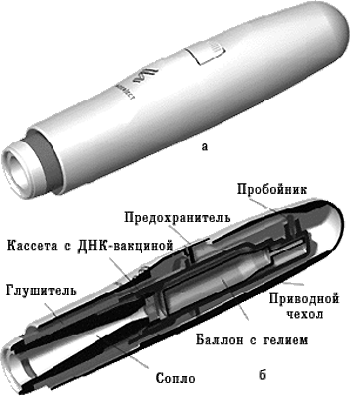
Использование генного пистолета. Для этого ДНК фиксируют на микроскопических золотых гранулах (около 1–2 мкм), а затем с помощью устройства, приводимого в действие сжатым гелием, гранулы «выстреливают» непосредственно внутрь клеток (рис. 4). Для данного способа доставки требуется значительно меньшее количество вводимого материала, чем для внутримышечной инъекции. Так, для инъекции мышам нужно 10-100 мкг препарата, а с использованием генного пистолета достаточно 0,1-1 мкг.
Электропорация — техника, которая с использованием электрических импульсов позволяет формировать поры в клеточной мембране и доставлять ДНК непосредственно в клетки.
Микроконтейнеры из полиматериалов. Московские ученые, например, создали пористую микросферу из карбоната кальция, покрытую несколькими слоями полисахаридов, в которую упаковывается молекула ДНК. Если микросферы в полимерной оболочке поместить в подкисленный раствор, карбонат кальция внутри растворится и уйдет через полимерную мембрану. Внутри останется только ДНК, подлежащая транспортировке. Подобных микроконтейнеров для доставки ДНК разработано не так много. Есть зарубежные аналоги, в которых оболочка капсулы выполнена из полимолочной кислоты. На их основе создают вакцины против гепатита и даже СПИДа. Средний диаметр микрокапсул для доставки ДНК-вакцин всего 1–2 микрона. Такие микрокапсулы можно ввести подкожно или даже в кровь. Если в микрочастицу вместе с ДНК или лекарством поместить фермент, расщепляющий оболочку капсулы изнутри, то высвобождением лекарства можно управлять: чем меньше фермента, тем медленнее рушится оболочка.
Липосомные носители обеспечивают высокую эффективность доставки при внутривенном введении, при этом экспрессия целевых генов значительно возрастает, так как осуществляется во многих органах, и особенно в селезенке.
ДНК-вакцины можно вводить перорально с использованием бактериальных носителей. Для этих целей применяются, например, модифицированные бактерии Shigella flexneri с делецией в гене asd. Мутантные бактерии растут in vitro на среде с диаминопимелиновой кислотой и, проникая в эукариотические клетки, не размножаются в них, так как отсутствует упомянутая кислота, а продуцируют закодированные в плазмиде антигены [6]. Для перорального введения создан вектор на основе ослабленного штамма Salmonella, который способен к самоуничтожению в организме через определенный период времени после выполнения иммунизационных задач. Для этого бактерию модифицировали таким образом, что ее выживание стало зависеть от наличия искусственных сахаров, не встречающихся в условиях организма. После того как в клетках, зараженных генно-инженерным штаммом Salmonella, заканчивается запас специфического сахара, поставляемого вместе с вакциной, бактерии не способны сохранить целостность своих клеточных стенок, что приводит к их гибели [11].
Была предложена оригинальная система доставки ДНК с помощью «теней» — неживых клеток грамотрицательных бактерий, лишенных цитоплазматического содержимого, но сохраняющих морфологию и антигенные структуры, включая адгезивные факторы. «Тени» обладают тропностью к антигенпрезентирующим клеткам макроорганизма и адъювантными свойствами, усиливающими иммунный ответ. Кроме того, в лиофильно-высушенном состоянии препараты «теней» хранятся при комнатной температуре неопределенно долгое время, а их производство дешево [6].
Разработана технология доставки ДНК-вакцин с использованием бактериофагов [12]. В данном случае вакцинная ДНК встраивается в геном вектора-бактериофага, которым затем иммунизируют макроорганизм [13].
Нужно учитывать, что разные методы доставки ДНК-вакцин в организм обеспечивают развитие различных клеточных реакций, при этом важные иммунологические пути могут быть стимулированы или, наоборот, не задействованы в ходе развития защитного ответа. Способы и места введения ДНК-вакцин варьируют для разных видов организмов. Например, уши свиньи — отличное место для инъекций, а вот введение препарата в уши овец или коров неэффективно.
Помощники генетических вакцин
Для усиления иммунного ответа, вызванного ДНК-вакцинами, совместно с ними вводят различные адъюванты, например, плазмиды, кодирующие синтез цитокинов, гранулоцитарно-макрофагального колониестимулирующего фактора и других костимуляторных молекул (B7.1 (CD80), B7.2 (CD86) и CD40) [14].
Для ДНК-вакцины против ВИЧ создана конструкция, которая обеспечивает получение более высокого титра антител и его сохранность в течение более длительного времени по сравнению с обычной ДНК-вакциной. Эта молекулярная вирусоподобная конструкция представляет собой частицы диаметром 25-30 нм, содержащие в центре полинуклеотидный комплекс — рекомбинантную плазмиду pGEX-2T-TBI с генами инфекционного агента ВИЧ-1 или двухцепочечную РНК, которая является стимулятором неспецифической резистентности организма. На поверхности конструкции располагаются гибридные белки, содержащие эпитопы ВИЧ-1 и фермент (например, глутатион-S-трансферазу или галактозидазу). Связь между полинуклеотидным комплексом и гибридными белками осуществляется посредством конъюгата: спермидин (для связи конъюгата с полинуклеотидным комплексом) — полиглюкин — субстрат для фермента (например, глутатион или галактопиранозид; для аффинной сорбции гибридных белков на конструкцию).
Современное состояние ДНК-вакцинологии
В настоящее время в разработке находится около 420 ДНК-вакцин против заболеваний различной этиологии как человека, так и животных.
Бόльшая часть разрабатываемых противоинфекционных терапевтических ДНК-вакцин нацелена на ВИЧ-1. Существенные успехи достигнуты в активной иммунизации против вируса папилломы человека. Некоторые вакцины находятся на стадии клинических испытаний и, возможно, в скором времени будут введены в обязательную практику. Так, американская компания Inovio, специализирующаяся на разработке ДНК-вакцин, создала препарат против цервикальной дисплазии VGX-3100, который проходит вторую фазу клинических испытаний. В 2013 г. VGX-3100 удостоилась награды «Лучшая терапевтическая вакцина» на Всемирном конгрессе по вакцинам. В I или IIа фазах клинических испытаний находятся: вакцины против гепатита С, цервикального рака, рака головы и шеи, СПИДа, гриппа. Компанией Inovio также ведется активная разработка вакцин против лихорадки Эбола* и рака простаты.
* — О более привычном, но не менее перспективном методе борьбы с вирусом Эбола — с помощью «коктейля» из моноклональных антител — читайте в статье «Вирус Эбола и макак-резус: получено новое эффективное лекарство» [15]. — Ред.
Разработке способов вакцинотерапии онкологических заболеваний при помощи рекомбинантных ДНК большое внимание уделяют и другие организации. Хорошую эффективность показала ДНК-вакцина против лейкемии, созданная в Саутгемптонском университете (но вводимая с помощью электропоратора всё той же Inovio). Вакцина направлена на подавление в организме активности гена WT1 (Wilms tumor gene). Именно повышенная активность этого гена отмечается в опухолевых клетках различных видов. В ходе I фазы клинических испытаний у пациентов наблюдалось развитие иммунного ответа, в том числе активация Т-киллеров и выработка антител; была также доказана безопасность новой вакцины. Испытания перешли в фазу II, однако из-за проблем с финансированием организаторы пока не могут увеличить число участников [16].
Животные нуждаются в такой же защите, как и люди. В связи с этим для ветеринарии разрабатываются ДНК-вакцины против бычьего и лошадиного герпесвирусов, собачьего вируса чумы, вируса классической свиной лихорадки, кроличьей папилломы, ящура, вируса инфекционного гемопоэтического некроза, вируса гриппа, вируса японского энцефалита, вируса бешенства, вируса везикулярного стоматита и т.д. [13]. Много ДНК-вакцин создается для борьбы с вирусными, бактериальными и эукариотическими патогенами рыб [17].
Активно разрабатываются ДНК-вакцины для повышения иммунитета птиц. Многокомпонентные ДНК-вакцины могут сократить количество прививок, необходимых во время короткой жизни птиц и позволят избежать риска увеличения вирулентности некоторых патогенов. В случае птицеводства проблема связана с тем, что вакцины вводятся в амниотическую жидкость яиц, которая обладает ДНКазной активностью, поэтому свойства ДНК-вакцины могут ухудшиться. Заключение ДНК в катионные липосомы, скорее всего, поможет решить эту проблему.
Из множества разработанных ДНК-вакцин на сегодняшний день лицензировано всего несколько, причем повезло в этом плане только животным (табл. 1).