генетические ножницы что это такое
«Генетические ножницы». За что присуждена Нобелевская премия по химии
«Они получили все возможные на лице Земли премии»
«Генетические ножницы» — очень молодая работа. Сама система CRISPR/Cas-9 известна давно, но ее использование для прицельного разрезания генома и введения в него нужных участков Шарпантье и Дудна разработали и описали всего восемь лет назад. Однако за это время технология завоевала и лаборатории, и стартапы, и промышленность, и медицину. И успела, хотя и без участия ее создательниц, всегда подчеркнуто осторожных и сдержанных, поставить мир перед этической дилеммой улучшения человека.
На момент открытия Шарпантье — француженка — работала в Швеции в Университете Умео. Следует также отметить, что это не ситуация параллельного открытия: лауреатки плотно сотрудничали, хотя Дудна работала и работает в десятки часовых поясов от Европы в Университете Калифорнии в Беркли.
«Эту премию никак нельзя назвать неожиданной. Лауреатки уже получили все возможные на лице Земли премии, поэтому логично было предположить, что они получат и эту. Однако Нобелевская премия — очень старая, уважаемая и особенная. Никто не воспринимает ее получение как что-то само собой разумеющееся. Я не говорил сегодня с профессором Дудна, однако профессор Шарпантье была по-настоящему счастлива и тронута», — сказал председатель Нобелевского комитета по химии Клос Густафссон, отвечая на вопрос, ожидали ли победительницы присуждения премии.
Агентство Clarivate Analytics, каждый год оглашающее «лауреатов цитирования» — самых влиятельных ученых, «предсказало» им Нобелевскую премию еще в 2015 году. Таков был резонанс, вызванный их работами всего за три года (кстати, в том же году были названы в кандидатах на нобелевку прошлогодние лауреаты-химики — создатели литий-ионных аккумуляторов Джон Гуденаф и Стэнли Уиттингэм).
Довершает картину то, что лауреатки, по нобелевским меркам, чрезвычайно молоды — Дудна 56 лет, Шарпантье — 51 год. Подводя итог: уже несколько лет было совершенно ясно, что их «нобелевка» — вопрос времени. Только какого? Гуденафу пришлось ждать до 97 лет, а создательницам «генетических ножниц», к счастью, повезло куда больше.
Ножницы из бактерий
«Генетические ножницы» не созданы человеком с нуля — они подсмотрены в природе. CRISPR-системы изучаются порядка 20 лет — это часть очень необычно работающего иммунитета бактерий. Поскольку бактерии — это целые клетки, они могут также болеть вирусами, как и мы, клетки нашего организма.
Такие вирусы называются бактериофагами, а вот «лечатся» — вернее, приобретают иммунитет, — бактерии очень необычно. Они «запоминают врага» внутри себя. Короткие фрагменты ДНК бактериофага (длиной 30 пар нуклеотидов) встраиваются в специальный участок бактериальной хромосомы (это и есть CRISPR-локус). Клетки с модифицированным таким образом геномом (и их «дети» — геном наследуем) становятся устойчивыми к повторному заражению бактериофагом. Впоследствии бактерия «сверяет» геномы подбирающихся к ней вирусов с тем, что есть в ее «базе данных» и при совпадении носитель опознанной ДНК уничтожается.
Этот механизм очень интересен с точки зрения фундаментальной науки, однако среди его применений еще 10 лет назад рассматривался только мир бактерий — как бы получше убивать ненужных и защищать нужных микробов. Гениальной была идея увидеть в этом явлении не объект изучения, а потенциальный метод — ведь бактерия умудряется очень точно разрезать свой геном, вставить в него участок, а затем сшить.
Именно так посмотрели на вопрос Дудна и Шарпантье. Они собрали систему из ферментов, которые точно прицеливаются в определенную точки ДНК и разрезают ее. Так можно избирательно удалять участок генома или заменять его на нужный вам. Этот метод — CRISPR/Cas9 — не первый метод генетической модификации, но революционный. Старые методы не позволяли добиться точности «прицеливания» и были дорогие и сложные.
А вот генетические ножницы оказались очень точны и доступны. Теперь с их помощью в лабораториях создают модели для исследований лекарств, ученые в сфере сельского хозяйства экспериментируют с новыми сельхозкультурами, а медики — пытаются разработать надежные терапии генетических заболеваний. Это последнее применение, конечно, самое известное и спорное (хотя далеко не самое массовое, как исследовательский инструмент CRISPR/Cas9 куда популярнее).
Хотя китайский ученый Хэ Цзянькуй и обеспечил два года назад появление на свет двух ГМ-детей, устойчивых к ВИЧ, эта работа не встретила понимания и в научном сообществе, ни в обществе. Вкратце проблема в следующем: что годится для лабораторных исследований, далеко не всегда годится для больниц и жизни.
Ученым-химикам предстоит доработать метод до 100-процентной надежности, а обществу вместе с учеными-этиками и философами — понять, готовы ли мы к нему и на каких условиях. Конечно, редактирование генома человека не остановить, но его правила и нормы пишутся у нас на глазах, и сегодняшние лауреаты неизменно призывают к осторожности и широкому общественному диалогу в этих вопросах.
Кругом наши
Нобелевскую премию могут получить не более трех человек, но работают над «нобелевской» тематикой всегда гораздо большее число ученых в разных уголках Земли. Так, в исследованиях CRISPR/Cas9 серьезен вклад российской научной школы.
«Активную роль в истории CRISPR сыграли наши соотечественники, работающие за рубежом — Евгений Кунин, Александр Болотин, и, наконец, Виргис Шикшнис, выпускник МГУ, защитивший кандидатскую под руководством Карела Мартинека. Виргис и показал, что CRISPR-Cas9 работает как единая ферментная система, реконструировав его в другом организме. Виргис, будучи химиком-энзимологом также продемонстрировал, что эта система может быть реконструирована и может расщеплять ДНК «в пробирке». Независимо от Виргиса, Шарпантье и Дудна пришли к таким же выводам, что фермент можно использовать для коррекции генов и провели реконструкцию», — рассказал профессор Университета Северной Каролины в Чапел-Хилл Александр Кабанов, выпускник химфака МГУ и президент Ассоциации русскоязычных ученых в США RASA-America
Виргис Шикшнис в 2018 году разделил премию Кавли с Дудна и Шарпантье.
Люди с молекулярными ножницами

«Мы создаём мутантов»
Нариман Баттулин, заведующий лабораторией генетики развития. Институт цитологии и генетики Сибирского отделения РАН
Как вы решили стать учёным?
Какими исследованиями занимается ваша лаборатория?
Почему для работы вы выбрали метод молекулярных ножниц?
Любая модификация генома связана с разрезанием ДНК. Необходим соответствующий инструмент. С 1970-х годов для этого используют ферменты рестриктазы. Но в больших геномах типа человеческого их очень сложно нацелить в определённое место, а значит, рестриктазы просто искрошат весь геном. Учёным нужен был механизм, который не просто разрезает ДНК, но и делает этот разрез в конкретном месте. Прежние системы были очень громоздкие, сложные и дорогие. CRISPR/Cas9 обходится почти в 10 раз дешевле.
Когда технология CRISPR/Cas9 окончательно созреет, в каком проекте вы бы хотели её применить?
Ваша любимая научная шутка?
Как работают молекулярные ножницы
От зубастого цыплёнка к воскрешению динозавров
Дмитрий Карпов, старший научный сотрудник лаборатории регуляции внутриклеточного протеолиза. Институт молекулярной биологии им. В.А. Энгельгардта РАН
Как вы решили стать учёным?
Летом между 6-м и 7-м классом, пока одноклассники отдыхали, я готовился к первой в своей жизни школьной олимпиаде по биологии. Учитель разрешал пользоваться всем, что можно было найти в биологическом классе: плакатами, муляжами, коллекциями насекомых. Был в классе и микроскоп. Когда я устал рассматривать готовые препараты для микроскопа, в голову пришла необычная мысль. Я приготовил препарат на основе воды из-под цветочного горшка. В этой капле я с изумлением обнаружил микроскопическую живность! Этот день полностью перевернул моё представление о мире, и именно тогда мне захотелось изучать клеточную биологию.
Какими исследованиями занимается ваша лаборатория?
Мы изучаем внутриклеточные механизмы разрушения белков. Они нужны, чтобы клетка могла избавиться от повреждённых или мутировавших белков. Если эти механизмы сломаются, могут начатьcя проблемы: развиваются, например, нейродегенеративные заболевания вроде болезни Альцгеймера, появляются злокачественные образования.
Почему для работы вы выбрали метод молекулярных ножниц?
Эта технология удобна по сравнению с предшествующими. Необходимо определиться только с последовательностью направляющей РНК, которая нацеливает редактор в нужное место генома. Кроме того, метод позволяет работать одновременно с несколькими мишенями: можно легко удалить часть гена, ген целиком или несколько генов.
Когда технология CRISPR/Cas9 окончательно созреет, в каком проекте вы бы хотели её применить?
Ни у одной из современных птиц, кроме этого трансгенного цыплёнка, зубов нет.
Ваша любимая научная шутка?
Как починить генетическую поломку
Татьяна Егорова, научный сотрудник лаборатории моделирования и терапии наследственных заболеваний. Институт биологии гена РАН
Как вы решили стать учёным?
Какими исследованиями занимается ваша лаборатория?
Почему для работы вы выбрали метод молекулярных ножниц?
Когда технология CRISPR / Cas9 окончательно созреет, в каком проекте вы бы хотели её применить?
Ваша любимая научная шутка?
Просто о сложном: CRISPR/Cas
«Даже у таких мерзавцев есть ангел-хранитель. Ангел с золотыми волосами присматривает за ними» (Плохой, он же — Ангельские глазки, фильм «Хороший, плохой, злой»).
Авторы
Редакторы
Конкурс «био/мол/текст»-2016

В конкурсе участвовала только инфографика!
Текст написала Ольга Волкова.
Генеральным спонсором конкурса, согласно нашему краудфандингу, стал предприниматель Константин Синюшин, за что ему огромный человеческий респект!
Спонсором приза зрительских симпатий выступила фирма «Атлас».
Спонсор публикации этой статьи — Дмитрий Геннадиевич Калашников.
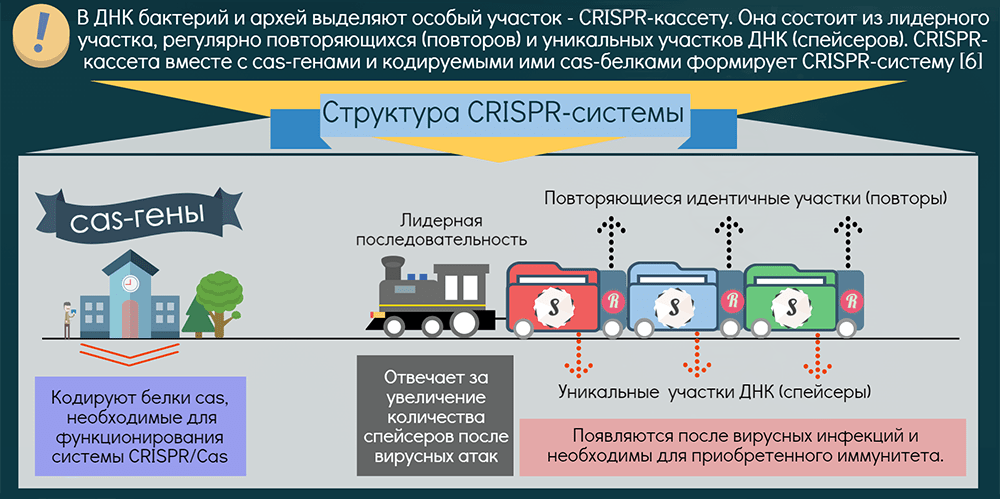
Как устроена иммунная система прокариот?
Системы CRISPR-Cas обнаружены почти у всех известных архей и половины бактерий. Чаще они находятся на хромосоме, реже — в составе фагов (вирусов бактерий) и других мобильных генетических элементов. Эти системы состоят из двух основных блоков: CRISPR-кассеты и прилегающего к ней кластера генов cas. Кассета — это блок прямых почти палиндромных («зеркальных», взаимокомплементарных последовательностей, способных складываться в шпильки) повторов размером 24–48 пар нуклеотидов. Эти повторы перемежаются спейсерами — уникальными вставками примерно такой же длины. Спейсеры идентичны различным участкам фагов и других мобильных элементов, когда-либо проникавших в эту клетку или ее предков. Число повторов в разных системах варьирует от единиц до сотен.
Таким образом, CRISPR можно считать коллекцией разделенных повторами «фотографий» нарушителей клеточных границ. Составляется эта коллекция простым заимствованием их кусочков, а чтобы противостоять новой инвазии этих же молекулярных агентов, коллекция должна регулярно «просматриваться» и обновляться. Для этой функции нужна лидерная последовательность, предшествующая череде повторов. Она богата «легкоплавкими» АТ-пáрами и содержит промотор, контролирующий транскрипцию CRISPR-кассеты («просмотр коллекции»).
К чему это приводит, можно узнать из конкурсной статьи о бактериофагах и вечной гонке вооружений в фаговом и бактериальном мирах: «Пожиратели бактерий: убийцы в роли спасителей» [11]. Кстати, там много интересных авторских электронных изображений фагов.
Для решения инженерных задач больше всего подходит система II типа, относящаяся ко II классу, — она самая простая. Именно ее эффекторный белок называется Cas9 — то самое обозначение, что фигурирует в современных системах редактирования генома.
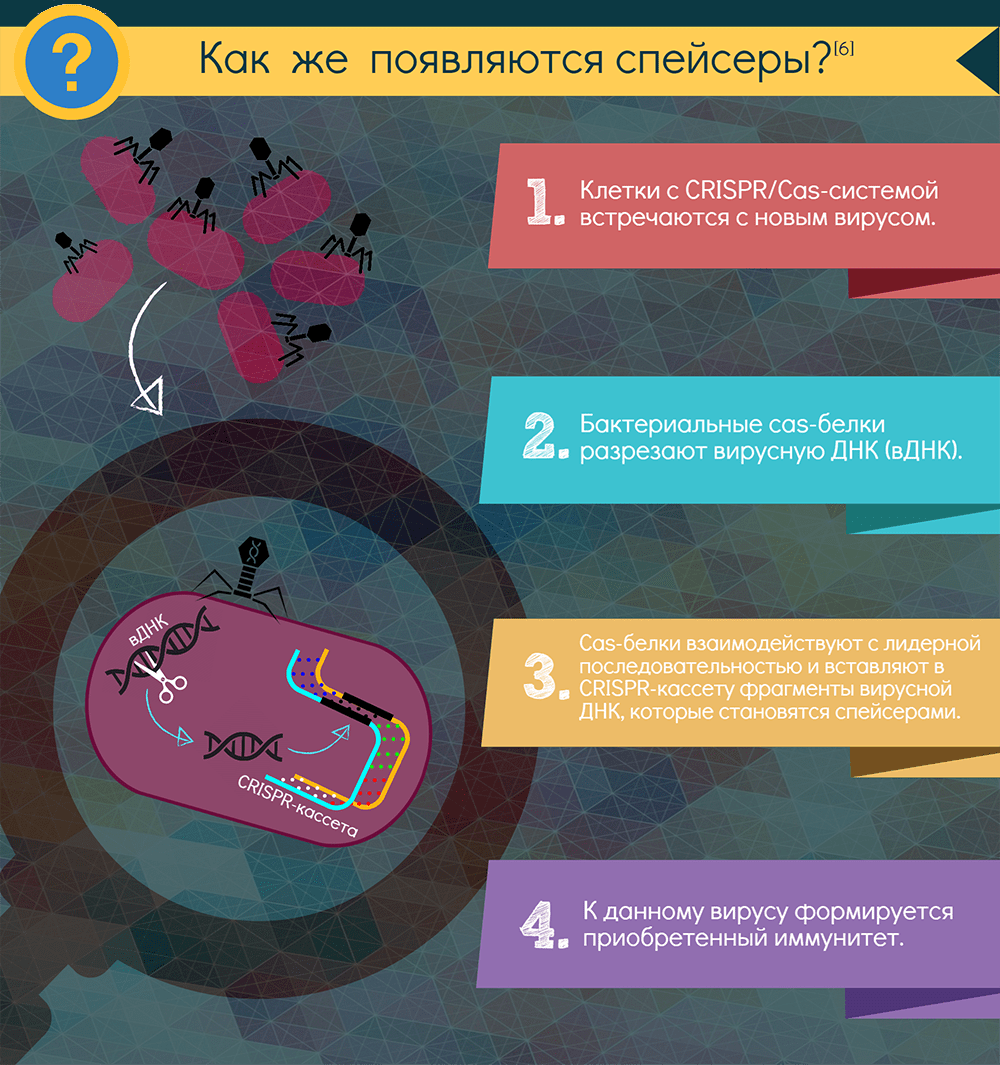
Как формируется CRISPR-опосредованный иммунитет?
Если в бактерию или архею, снабженную CRISPR-системой, проникает вирус, включается адаптационный функциональный модуль системы: специфические Cas-белки — у всех систем это как минимум Cas1 и Cas2 — вырезают из чужака понравившиеся фрагменты. Подобрать протоспейсер в некоторых случаях помогает и эффекторный белок. Белки выбирают участки рядом с особой последовательностью PAM (protospacer adjacent motif) — всего несколько нуклеотидов, но неодинаковых для разных CRISPR-систем. Затем эти же адаптационные белки встраивают фрагмент в CRISPR-кассету, всегда с одной стороны — у лидерной последовательности. Так образуется новый спейсер, а заодно с ним — и новый повтор. Весь этот процесс называют адаптацией, или приобретением, а по сути это — запоминание врага. Информацию обо всех запомнившихся врагах получает при делениях всё потомство клетки.
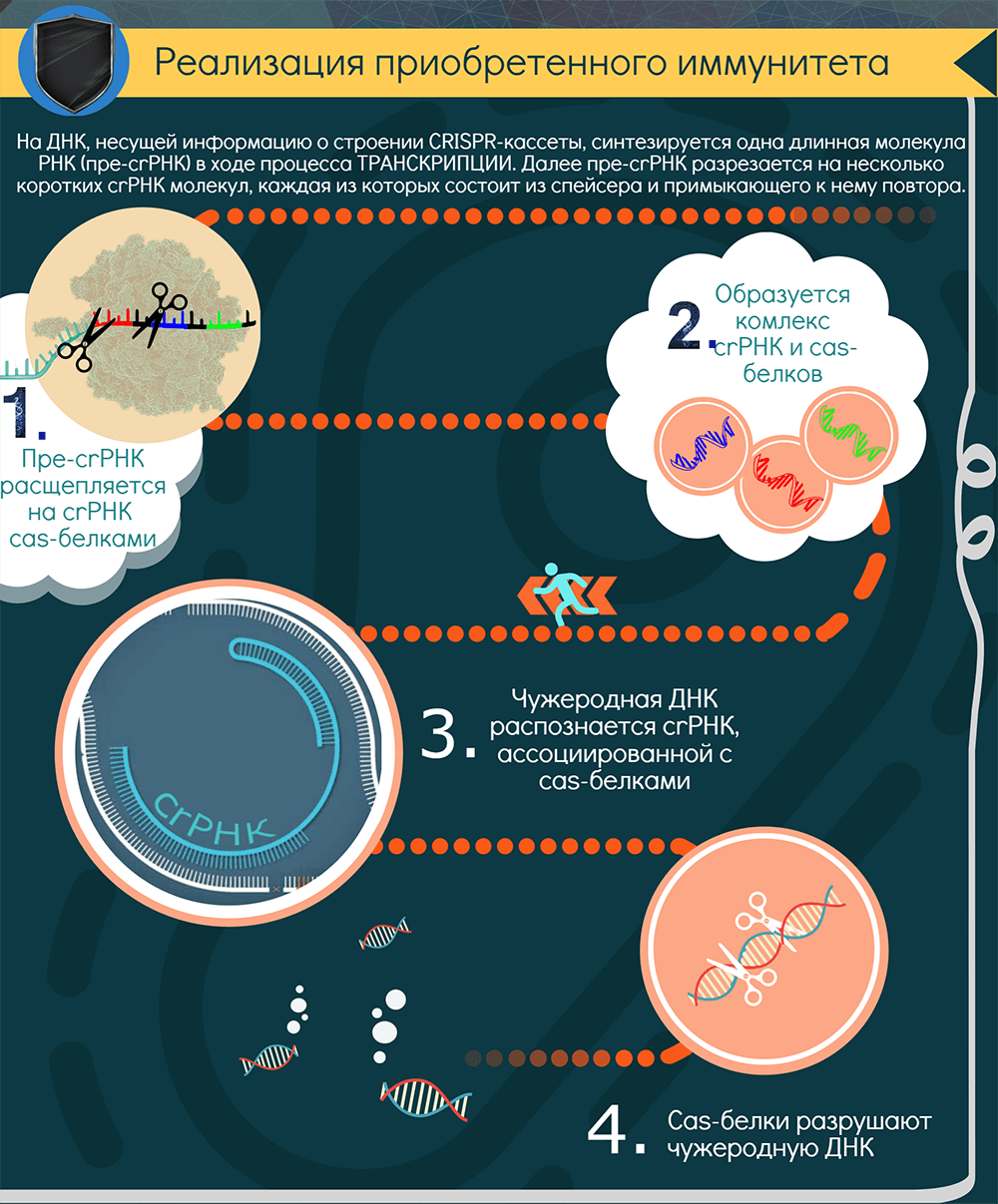
Как реализуется CRISPR-опосредованный иммунитет?
Для поиска повторно вторгающихся агентов CRISPR-кассета должна экспрессироваться. В результате ее транскрипции образуется длинная молекула РНК — pre-crРНК. С помощью РНКазы III и, как правило, Cas-белков транскрипт нарезается по повторам на отдельные crРНК — молекулы, содержащие один спейсер и кусочки окружающих его повторов (один из них длиннее). В системах II типа для этого процесса, называемого созреванием, необходим еще один участник — tracrРНК (trans-activating CRISPR RNA), которая закодирована рядом с cas-кластером [12].
Далее у систем I класса crРНК взаимодействует с комплексом Cas-белков, а у систем II класса crРНК либо дуплексы tracrРНК-crРНК связываются с одним белком-эффектором, например Cas9. Так образуется интерференционный функциональный модуль — рабочая иммунная единица, состоящая из направляющей РНК и эффекторного белка (или комплекса). Совокупность таких единиц «сканирует» клетку в поисках интервентов.
При обнаружении комплементарной crРНК последовательности, то есть протоспейсера, модуль «слипается» с ней и определяет, не помечена ли она как «своя», клеточная. Если нет, и если к ней прилегает тот самый PAM, то эффекторный белок, который представляет собой эндонуклеазу, разрезает обе цепи ДНК в строго определенных местах. Весь процесс называется интерференцией. В особом случае, у системы VI типа, происходит РНК-интерференция, потому что эффекторный белок является рибонуклеазой и разрушает РНК. Так или иначе, атакованные фаги или плазмиды выводятся из строя. Ну и появляется лишняя возможность «наворовать» новые спейсеры.
Какие проблемы могут возникнуть при реализации иммунного ответа? Не исключено, что по мере удаления от лидерной последовательности, то есть от CRISPR-промотора, шансы спейсера транскрибироваться и созреть уменьшаются. Кроме того, есть мнение, что удаленные спейсеры со временем могут накапливать мутации, препятствующие эффективной интерференции с мишенью, или вовсе удаляться. Но раз адаптация новых спейсеров происходит вблизи промотора, удаленные спейсеры представляют собой фото агентов, давно не нападавших на эту клеточную линию, и в постоянной боеготовности по отношению к ним клетка не нуждается. Настоящей же проблемой могут стать даже однонуклеотидные мутации мишени. В общем, комплементарность в этом деле превыше всего.
А не приручить ли нам чужой иммунитет?
Детально изучив принципы работы стрептококковой системы CRISPR-Cas9 (II тип), ученые подумали: а почему бы не попробовать с ее помощью корректировать геномы других организмов? Появились новые надежды относительно лечения генетических (и не только) заболеваний человека, ведь этот способ редактирования in vivo мог оказаться эффективнее уже вовсю тестируемых в то время нуклеаз ZFN и TALEN [13].
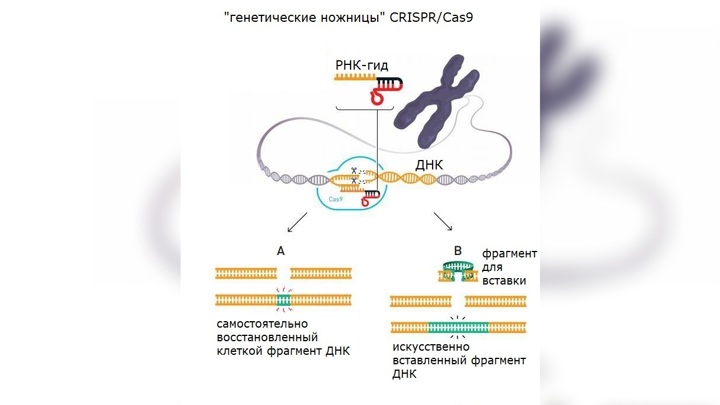
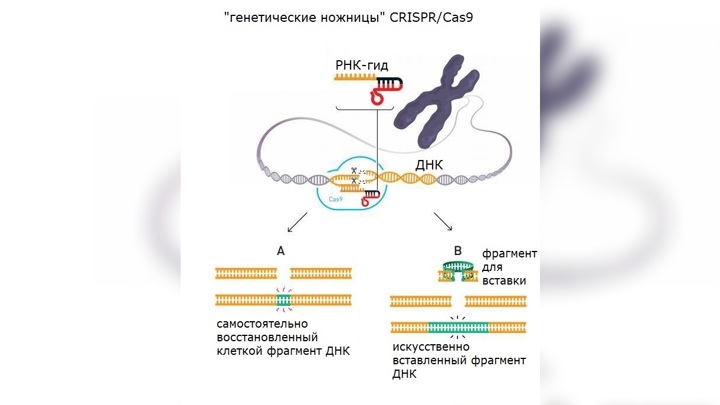
Получилась простая и, что немаловажно, дешевая двухкомпонентная система: ген cas9 и CRISPR-кассета транскрибируются в клеточном ядре выбранного организма, CRISPR-транскрипт нарезается на отдельные sgРНК, которые объединяются с белками Cas9 и ищут цель. Когда sgРНК находит комплементарный участок в геноме организма, Cas9 разрезает «натупо» обе цепи ДНК. Всё, работа CRISPR-системы на этом окончена. Теперь эстафета передается репарационным системам самогό организма. Они решают, как лучше залатать разрез: то ли просто сшить куски (это будет негомологичное соединение концов, NHEJ), то ли, если есть подходящая матрица с флангами, комплементарными участкам ДНК с двух сторон от разрыва, поставить «заплатку» (это будет гомологичная рекомбинация). Так вот, первый вариант выгоден, если нужно что-то вырезать, второй — если нужно что-то вставить или заменить дефектный участок ДНК на нормальный, который просто вводят на подходящем векторе. Иногда используют гомологию с парной хромосомой, если на ней нужный локус не дефектный.
Разумеется, технология пока не лишена недостатков. Cas9, например, может проявлять нецелевую активность, «закрывая глаза» на мелкие несоответствия между sgРНК и мишенью. По словам К. Северинова, основная проблема — это биоинформатическое предсказание мишеней, поскольку, помимо наличия участка PAM, необходимо учитывать массу факторов, включая состояние хроматина. Кроме того, сценарий, по которому пойдет репарация разреза, не всегда соответствует желаемому, поэтому сейчас активно ищут факторы, влияющие на выбор этого сценария клеткой. Помимо оптимизации CRISPR-Cas9 и механизмов ее доставки в нужные клетки, ведется апробирование других типов CRISPR-систем [14].
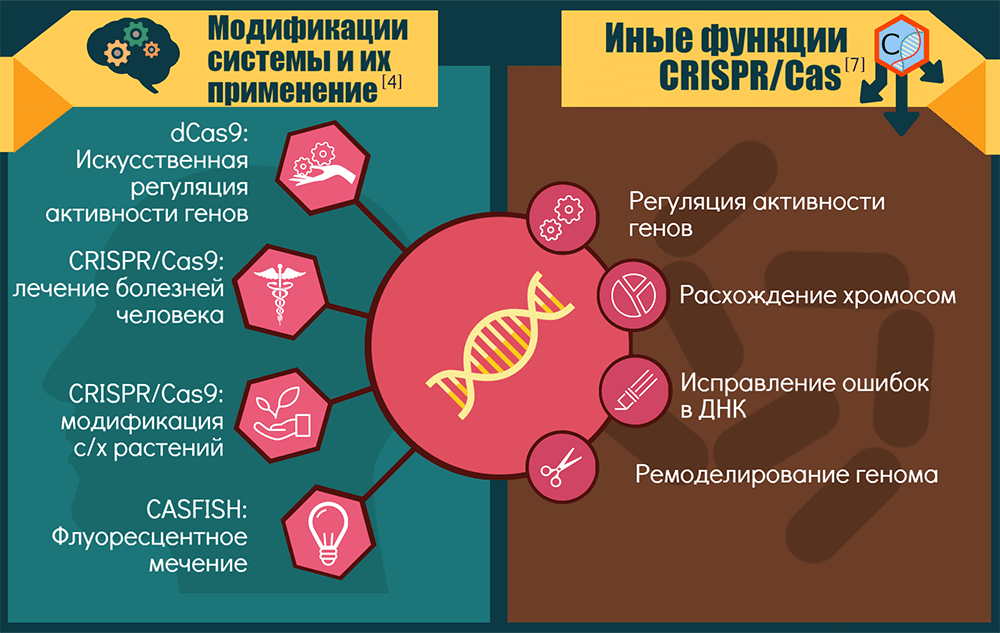
Спектр применений CRISPR-Cas9 и ее модификаций
Точки приложения CRISPR-технологии можно условно объединить в три крупные группы: «CRISPR — для исследований», «CRISPR — для биотехнологий» и «CRISPR — для терапии».
1. «CRISPR — для исследований». Технология позволяет изучать роль конкретных генов в процессах развития и жизнедеятельности организмов. Как вариант — устанавливать роль генов и их перестроек в возникновении и прогрессировании генетических болезней и рака: этот инструмент позволяет создавать прекрасные модельные системы [15].
Если Cas9 лишают одного нуклеазного домена, то белок становится никазой (nCas9) — режет только одну цепь ДНК, — а если лишают сразу двух, то белок становится инактивированным, или «мертвым» (dead, dCas9). Такой белок ничего не режет, зато систему CRISPR-dCas9 можно использовать для репрессии целых наборов генов или как платформу для конструирования более сложных регуляторных и модифицирующих комплексов. Например, если к ней привязать активирующий домен, то экспрессия целевых генов активируется. Для эпигенетической модификации нужных зон достаточно добавить модифицирующий домен. А пометив dCas9 флюоресцентными белками [16], можно визуализировать разные области хромосом. Ясно, что регуляторные возможности системы будут востребованы и в медицине. Кроме того, разные варианты CRISPR-Cas открывают новые возможности для скрининга мишеней лекарств [1].
2. «CRISPR — для биотехнологий». Здесь речь идет о применении CRISPR-Cas9 как минимум для трех целей:
3. «CRISPR — для терапии». Здесь пределов для фантазии, кажется, и вовсе нет. Если говорить о наследственных заболеваниях, то CRISPR-Cas9 в культурах клеток или животных моделях уже «примерили» для серповидноклеточной анемии и β-талассемии, M2DS-синдрома и миодистрофии Дюшенна, муковисцидоза (исправили мутантный CFTR-локус в кишечных стволовых клетках человека) и тирозинемии, катаракты (у мышей устранили доминантную мутацию в гене Crygc) и пигментного ретинита. Вообще, болезни глаз сейчас в центре внимания, потому что в глаза генетические конструкции легко доставлять [14].
Преимущества коррекции генома в зародышевой линии (как совокупности любых генеративных клеток, связывающих друг с другом поколения организмов) и стволовых клетках очевидны, но даже изменения, вносимые в соматические клетки уже развитых органов, дают эффект. Особенно если речь идет о борьбе с болезнями печени и мышц. О результатах терапевтического применения CRISPR-Cas9 в разных типах клеток рассказывает свежий обзор [21].
Отдельное перспективное направление — борьба с хроническими вирусными заболеваниями типа гепатитов и ВИЧ-инфекции. Если возбудитель сохраняется в организме в виде провируса (вирусной ДНК, встроенной в клеточный геном), то его можно просто вырезать. Именно так и поступил коллектив биологов из США, избавив лимфоциты человека от ВИЧ (об этом сообщили сразу две «биомолекулярные» статьи: «Битва века: CRISPR VS ВИЧ» [22] и «CRISPR/Cas9 как помощник в борьбе с ВИЧ» [23]). Правда, ВИЧ — объект крайне изменчивый, и с ним еще придется поломать копья.
Можно помечтать, что в терапии опухолей найдут применение варианты недавно описанной CRISPR-системы VI типа — той, что уничтожает только РНК, причем, как оказалось, любую клеточную РНК без разбора: запустить такую систему в раковую клетку — это как наслать на нее проклятье [14].
CRISPR-Cas — это не только иммунитет
Оказывается, для бактерий и их эволюции эта система значит намного больше.
Неканонические активности CRISPR-систем или их отдельных компонентов возникали как побочные продукты их иммунной функции либо как самостоятельно отбираемые признаки. Скорее всего, CRISPR-кассеты и Cas-белки когда-то работали порознь, причем исходная задача последних состояла в регуляции экспрессии генов и репарации ДНК [7]. Современные компоненты CRISPR-Cas замечены:
Инфографика выполнена совместно с Павлом Чирковым, магистром факультета политологии Санкт-Петербургского государственного университета. Одним файлом ее можно скачать здесь.
Встреча в кафе, изменившая жизнь человечества, или Как изобретали генетические ножницы
Изначально исследовательницы искали новые антибиотики, а обнаружили то, что изменило молекулярную биологию и медицину на многие годы вперёд.
Иллюстрация Niklas Elmehed/Nobel Media.
В 2011 году ни Эммануэль Шарпантье, ни Дженнифер Дудна не догадывались, что их первая встреча в кафе в Пуэрто-Рико изменит их жизнь.
Иллюстрация Niklas Elmehed/Nobel Media.
Многие говорят, что Шарпантье всегда ищет неожиданные решения. Сама же она цитирует Луи Пастера: «Удача сопутствует подготовленному уму».
Фото Wikimedia Commons.
Схема редактирования ДНК при помощи CRISPR/Cas9.
Иллюстрация Niklas Elmehed/Nobel Media.
Нобелевская премия по химии 2020 года присуждена двум женщинам-учёным Эммануэль Шарпантье из Института Макса Планка в Германии и Дженнифер Дудна из Университета Калифорнии в Беркли, США.
Официальная формулировка Нобелевского комитета «за развитие методики редактирования генома» (за переписывание кода жизни, как выразился ведущий церемонии Йёран Ханссон).
Биохимики и клеточные биологи теперь могут легко исследовать функции различных генов и их возможную роль в прогрессировании заболеваний. Селекционеры теперь могут не тратить долгие годы на выработку растениями или животными нужных черт, а могут сразу наделить представителей флоры и фауны специфическими характеристиками, такими как способность выдерживать засуху в более тёплом климате и нашествие насекомых-вредителей. В медицине редактор генов CRISPR/Cas9 используется для разработки новых методов лечения рака и в исследованиях, направленных на лечение ранее неизлечимых наследственных заболеваний.
Изначально Эммануэль Шарпантье исследовала иммунную систему бактерий рода стрептококков. Данные патогены очень распространены и часто заражают людей. Исследовательница надеялась отыскать новую форму антибиотиков для борьбы с этими микробами.
В 2002 году, когда Эммануэль Шарпантье основала собственную исследовательскую группу в Венском университете, она сосредоточилась на одной из бактерий, наносящей большой вред человечеству: Streptococcus pyogenes.
Ежегодно этот патоген заражает миллионы людей, часто инициируя легко поддающиеся лечению инфекции, такие как тонзиллит и стрептодермию. Однако он также может вызывать опасный для жизни сепсис и разрушать мягкие ткани тела.
Но как можно обезвредить S. pyogenes? Шарпантье начала свою работу с тщательного исследования того, как работают гены этой бактерии.
Тем временем Дженнифер Дудна изучает молекулы РНК, молекулярной сестры ДНК. В 2006 году она становится главой исследовательской группы в Калифорнийском университете в Беркли, имея за плечами двадцатилетний опыт работы с РНК.
Группа Дженнифер изучает РНК-интерференцию, которая играет важную роль в защите клеток от вирусов.
Бактерии и их древняя иммунная система
Однажды Дудна узнаёт от коллеги микробиолога о новом открытии. Исследователи, изучавшие генетический материал совершенно разных бактерий, а также архей, обнаружили в ДНК повторяющиеся фрагменты. Один и тот же код появляется снова и снова, но между этими повторениями есть уникальные последовательности, которые отличаются друг от друга.
Учёные назвали находку CRISPR (сокращение от clustered regularly interspaced short palindromic repeats). Интересно, что неповторяющиеся последовательности при этом были похожи на генетический код различных вирусов. Будто бактерии и археи составляли в своей ДНК архивные записи о пережитых атаках патогенов, перемежая их повторяющимся кодом.
Это навело учёных на мысль, что CRISPR – одна из частей древней иммунной системы, которая защищает бактерии и архей от вирусов.
Коллега Дудны отметила, что механизм, используемый бактериями для нейтрализации вируса, очень уж похож на то, что изучает группа Дженнифер (ту самую РНК-интерференцию).
Комплексная машинерия
Погрузившись в эту тему, Дудна выяснила, что другие исследователи также обнаружили особые гены, которые они назвали CRISPR-ассоциированными (сокращенно Cas).
Дженнифер понимает, что эти гены очень похожи на гены, которые отвечают за работу белков, специализирующихся на раскручивании и разрезании нити ДНК. Может, белки Cas имеют ту же функцию? Может, они расщепляют ДНК вирусов?
Последующие годы работы её научной группы позволили во всех подробностях изучить работу белков Cas.
Тем временем Шарпантье перебирается в университет в Швеции и занимается изучением малых РНК, обнаруженных у бактерий вида S. pyogenes.
Она обнаруживает, что в этой бактерии в больших количествах присутствуют небольшие неизвестные молекулы РНК. И по какой-то причине эти РНК по своему строению очень похожи на последовательности CRISPR в геноме бактерии. Позднее выяснится, что эти молекулы РНК играют очень важную роль.
Пока же становится ясно, что S. pyogenes для расщепления вирусной ДНК нужен белок Cas9.
Шарпантье показывает, что неизвестная молекула РНК необходима, чтобы обычная «длинная» РНК (созданная по шаблону CRISPR) стала активной.
Весной 2011 года на научной конференции в Пуэрто-Рико она знакомится с Дженнифер, после чего учёные решают вместе изучать функции Cas9 у S. pyogenes?
Они подозревают, что CRISPR необходима для идентификации вируса, а Cas9 – это своего рода ножницы, разрезающие молекулу ДНК вируса и тем самым обезвреживающие его.
Однако, когда учёные проводят эксперименты «в пробирке», ничего не происходит. Молекула ДНК патогена остаётся нетронутой.
После долгого мозгового штурма и множества неудачных экспериментов исследовательницы добавляют «в пробирку» те самые неизвестные молекулы РНК. И… система выполняет нужную работу!
На этом история генетических ножниц могла бы и закончиться. Но удача сопутствует подготовленным умам.
Эпохальный эксперимент
Исследовательницы решили использовать открытые ими генетические ножницы для изменения генетического кода. Используя свои новые знания, они получили молекулу, которая позволяла «натравить» ножницы на определённый участок ДНК (так называемый РНК-гид).
Результаты эксперимента были ошеломляющими. Молекулы ДНК были расщеплены именно в нужных местах.
Вскоре после того как в 2012 году Эммануэль Шарпантье и Дженнифер Дудна опубликовали статью об открытии генетических ножниц CRISPR/Cas9, несколько исследовательских групп продемонстрировали, что этот инструмент можно использовать для изменения генома в клетках как мышей, так и людей.
Раньше изменение генов в клетке, растении или организме занимало много времени, а иногда это было попросту невозможно. Теперь же исследователи потенциально могли разрезать любую молекулу ДНК.
Этот инструмент был настолько прост в использовании, что теперь его применяют во многих фундаментальных исследованиях.
Эксперименты на животных показали, что можно доставлять генетические ножницы к нужным клеткам.
Вместе с тем разработка генетических ножниц стала причиной серьёзных этических споров. Ведь потенциально с их помощью вполне можно создавать ребёнка «по заказу» (например, с голубыми глазами, светлыми волосами или другими нужными признаками). Поэтому эта область требует отдельного регулирования.
Однако всё это не отменяет того факта, что огромная многолетняя работа Эммануэль Шарпантье и Дженнифер Дудны позволила разработать химический инструмент, который вывел науки о жизни на совершенно новую ступень развития.
Добавим, что методика CRISPR-Cas9 пока ещё работает не идеально. Но сегодня многие учёные мира предлагают способы её усовершенствования, которые позволят увеличить её эффективность (например, повысить количество отредактированных генов). В 2017 году учёные также предложили инструмент, позволяющий лечить болезни без изменения ДНК.