гемоглобинопатия что это такое
Гемоглобинопатия что это такое
Гемоглобинопатии делятся на две крупные группы. Первая из них, группа качественных гемоглобинопатии, включает те заболевания, в которых генетическая аномалия обусловливает синтез гемоглобина, неполноценного с точки зрения химической структуры.
Ко второй, группе количественных гемоглобинопатии, относятся талассемия, характеризующаяся нарушением скорости синтеза одного или нескольких полипептидных цепей глобина, хотя структура данной цепи сохтаняется в норме.
Учитывая их генетическую природу, гемоглобинопатии неизлечимые болезни, вот почему проводится симптоматическая терапия вызываемых генетическим поражением расстройств, равно как и развивающимися, на протяжении хронического течения осложнениями.
Наследственная передача болезни требует проведение профилактических мероприятий, направленных на ограничение распространения специфических для этого заболевания генетических недостатков.
История изучения гемоглобинопатий
В развитии знаний о гемоглобинопатиях отмечены два достопамятных момента: 1925 год, когда Cooley и Lee описали первые случаи тяжелой талласемий, получивщей в дальнейшем название болезни Cooley, и 1949 год, когда Pauling описал первый ненормальный гемоглобин — HbS —, представляющий основное нарушение при дрепаноцитозе.
С учетом этих двух знаменательных дат развитие знаний о гемоглобинопатиях может быть отнесено к трем периодам: первый — до 1925 г., второй — от 1925 по 1949 гг. и третий — после 1949 г.
До 1925 г. гемоглобинопатия была известна под общим названием «детская ложнолейкемическая анемия», описанная Van Jaksch в 1889 г. При этом следует отметить, что уже в 1866 г. Korber обратил внимание на тот факт, что гемоглобин крови пуповины более устойчив к денатурации щелочами, чем гемоглобин крови взрослых.
Вскоре после сделанного Gooley и Lee описания болезнь была отождествлена и врачами стран ее природного развития, таких как Италия и Греция, которые, при этом, со слов J. Bernard и Ruffie «видимо были немного недовольны тем, что первенство открытия не принадлежало им».
С 1925 по 1949 гг. в американской и итальянской литературах публиковались работы, все лучше определяющие клинические проявления, гематологические сдвиги и наследственный характер болезни. Это период, в течение которого были впервые внедрены термины «талласемия», гетерозигот, гомозигот, легкая талласемия и тяжелая талласемия.
После 1949 г. — год описания первого ненормального гемоглобина и внедрения концепта «болезнь с молекулярными поражениями» — последовал период, характеризующийся поистине взрывным аспектом исследований структуры, синтеза и генетики нормального и патологического гемоглобина, в которые вовлечено значительное число коллективов врачей, биологов и химиков всего мира.
Техника исследования совершенствуется, развиваются новые методы большой тонкости, в связи с этим число выявления новых ненормальных гемоглобинов быстро растет, а исследование частоты заболевания в отдельных географических зонах мира приводит к все более полному ознакомлению с распространенностью этих аболеваний в мировом плане.
Современные данные, которыми располагает в настоящий момент в отношении структуры, функции, синтеза и генетики белков в значительной мере относятся за счет многочисленных исследований в области гемоглобина и гемоглобинопатии.
Вопреки значительным достижениям в этой области остается еще немало неизвестных вопросов, выявление которых принадлежит будущему и на которые нацелены усилия занимающихся этими проблемами. Однако наиболее важной целью дальнейших исследований видимо составляет терапия этих неизлечимых заболеваний, которым не применимо причинное лечение. Теоретически вмешательство на аппарате и генетических поражениях возможно, но на практике надежды возлагаются на будущее.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Эти два условия могут частично совпадать, поскольку некоторые условия, вызывающие нарушения в белках гемоглобина, также влияют на их выработку. Некоторые варианты гемоглобина не вызывают патологии или анемии и поэтому часто не классифицируются как гемоглобинопатии.
СОДЕРЖАНИЕ
Структурная биология гемоглобина
Нормальные гемоглобины человека представляют собой тетрамерные белки, состоящие из двух пар цепей глобина, каждая из которых содержит одну альфа-подобную (α-подобную) цепь и одну бета-подобную (β-подобную) цепь. Каждая глобиновая цепь связана с железосодержащей гемовой составляющей. На протяжении всей жизни синтез альфа-подобных и бета-подобных цепей (также называемых не-альфа-подобными) сбалансирован, так что их соотношение является относительно постоянным и нет избытка любого типа.
Конкретные альфа- и бета-подобные цепи, которые включаются в Hb, сильно регулируются во время развития:
А) Качественный
Структурные аномалии
Основные функциональные последствия структурных вариантов гемоглобина можно классифицировать следующим образом:
Химические отклонения
Б) Количественный
Аномалии производства
Вариация числа копий (например, делеция, дупликация, вставка) также является общей генетической причиной нарушений гемоглобина, также могут происходить сложные перестройки и слияния глобиновых генов.
Варианты гемоглобина
Модели электрофоретической миграции
Щелочной электрофорез
Обычно при щелочном электрофорезе в порядке увеличения подвижности гемоглобины A2, E = O = C, G = D = S = Lepore, F, A, K, J, Bart’s, N, I и H.
Как правило, серповидный тест проводится на аномальных гемоглобинах, мигрирующих в области S, чтобы увидеть, выпадает ли гемоглобин в осадок в растворе бисульфита натрия.
Кислотный электрофорез
Обычно при кислотном электрофорезе в порядке увеличения подвижности гемоглобины F, A = D = G = E = O = Lepore, S и C.
Вот как с помощью этих двух методов выделяются и идентифицируются аномальные варианты гемоглобина. Например, Hgb G-Philadelphia будет мигрировать с S при щелочном электрофорезе и будет мигрировать с A при кислотном электрофорезе, соответственно.
Эволюция
Патология и органические структурные аномалии могут привести к любому из следующих патологических процессов:
ГЕМОГЛОБИНОПАТИИ
Гемоглобинопатии (haemoglobinopathia, ед. ч.; гемоглобин + греч. pathos страдание, болезнь; син. гемоглобиноз) — группа наследственных заболеваний, обусловленных наличием в эритроцитах аномальных гемоглобинов либо угнетением синтеза полипептидных цепей нормальных гемоглобинов. К Гемоглобинопатиям причисляют как выраженные патологические состояния, протекающие чаще с гемолитической анемией (см.), так и многочисленные случаи латентного носительства аномальных гемоглобинов или генов талассемии (см.).
После работ Л. Полинга, Итано (H. A. Itano) и сотр. (1949), посвященных гемоглобину S, и открытий в области биохимической генетики Гемоглобинопатии стали рассматривать как разновидность молекулярной патологии. В 1950 г. Итано и Дж. Нил описали аномальный гемоглобин С, в 1951 г. Итано описал аномальный гемоглобин D. В 1954 г. гемоглобин E одновременно, но независимо друг от друга описали Чернов, Минних и Чонгчареонсук (А. I. Chernoff, V. Minnich, S. Chongchareonsuk) и Итано, Берджер, Стерджен (W. R. Berger, P. Sturgeon). Гемоглобин G описали Эдингтон (G. М. Edington) и Г. Леманн в 1954 г. Известны также аномальные гемоглобины H, I, J, К, L, M, N, О, P, Q и др.
В мире насчитывают ок. 100 млн. человек — носителей аномальных гемоглобинов, однако эти цифры следует, по-видимому, считать заниженными вследствие несовершенства методов выявления аномальных гемоглобинов и недостаточной информации о распространении Гемоглобинопатий в различных областях земного шара.
Содержание
Географическое распространение
В распространении Гемоглобинопатий имеют значение такие факторы, как принадлежность к определенным расовым и этническим группам, частота браков между кровными родственниками, миграция населения, заболеваемость тропической малярией. Вариации в синтезе гемоглобина встречаются преимущественно у жителей стран Южной Европы (побережье Средиземного моря), Африки и Азии или у выходцев из этих стран, среди негритянского населения Северной и Южной Америки. Более распространены Г. в зоне так наз. малярийного пояса земного шара, т. е. тропической, и несколько меньше — в субтропической зоне. Встречаются они и в некоторых южных республиках СССР (Азербайджан, Таджикистан).
Серповидная аномалия эритроцитов наиболее распространена в тропической Африке, странах Средиземноморья, Ближнего и Среднего Востока, Индии. Полагают, что только в тропической Африке насчитывают до 40 млн. человек — носителей аномального гемоглобина S. Не менее частой является, по-видимому, и талассемия. Носительство аномальных гемоглобином С и E более локализовано. Гетерозиготных носителей аномального гемоглобина С — более 7 млн. в Западной Африке и ок. 0,5 млн. среди негров США. В Юго-Восточной Азии (Индокитай, Таиланд, Бирма, Индонезия, Индия, Бангладеш и юж. районы Китая) носителей аномального гемоглобина E более 30 млн. человек. Основной очаг аномального гемоглобина D находится в Северо-Западной Индии, где количество гетерозиготных носителей определяется в несколько миллионов человек. Единичные случаи описаны в Северной и Западной Африке, Малой Азии и среди негритянского населения США. Очаги (бета-талассемии и спорадические случаи гемоглобинопатий S, С, D, E и альфа-талассемии обнаружены среди населения Азербайджана, Таджикистана и некоторых районов Кавказа.
Этиология и патогенез
Аномалия гемоглобина может возникать либо в результате качественных изменений его первичной структуры и функции, либо количественного уменьшения синтеза нормальных цепей глобина (см. Гемоглобин, генетика гемоглобина). Известно свыше 250 аномальных гемоглобинов; теоретически в молекуле гемоглобина возможно более 4000 различных точковых мутаций [Бил (D. Beale), Г. Леманн, 1965], из которых с помощью современных методов могут быть дифференцированы с нормальным гемоглобином только ок. 1500. В это число включены мутации типа чистых аминокислотных замещений, при этом не рассматриваются возможные аномалии вследствие делеций (см.), расщепления полипептидных цепей и др.
Возникновение Гемоглобинопатий обусловлено мутацией на уровне структурных или регуляторных генов, управляющих синтезом полипептидных цепей глобина. Мутации на уровне структурных генов характерны для истинных Г.: серповидноклеточная анемия, С-, D-, E- и М-гемоглобинопатии и заболевания, обусловленные наличием нестабильных гемоглобинов. Мутации на уровне регуляторных генов обнаруживаются при талассемиях, гемоглобинопатиях H и Bart.
У гомозиготных носителей генов обычно продолжительность жизни эритроцитов с патологическим гемоглобином укорочена, а в некоторых случаях нарушен и эритропоэз. Гетерозиготные носители аномальных гемоглобинов, кроме гемоглобинов H и Bart, вариантов M-гемоглобинопатий, а также носители нестабильных гемоглобинов в обычных условиях жизни являются практически здоровыми людьми.
Большинство Г. наследуется в соответствии с законами Менделя по кодоминантному аутосомному типу, не сцепленному с полом.
Классификация гемоглобинопатий
Классификация гемоглобинопатий [по Гюнсу (E. R. Huehns) в модификации Ю. Н. Токарева] создана на основе результатов специальных биохимических и генетических исследований.
I. Гемоглобинопатии, обусловленные аномалией первичной структуры молекулы гемоглобина («качественные» Г.): 1) серповидноклеточная болезнь, ее варианты (S-гемоглобинопатии: S-талассемия, SD, SC и др.); 2) Lepore-гемоглобинопатия, возникающая вследствие расщепления частей бета- и дельта-цепей глобина; 3) Г. гомозиготные (С-, D- и Е-); 4) M-гемоглобинопатии; 5) Г., обусловленные наличием нестабильных гемоглобинов (гемоглобинов, неустойчивых к воздействию окислителей, нагреванию и др.); 6) Г. бессимптомные (G-гемоглобинопатии и др.).
II. Гемоглобинопатии, вызванные нарушением синтеза полипептидных цепей гемоглобинов («количественные» Г., или талассемии): 1) Г., вызванные нарушением синтеза α-цепи глобина (альфа-талассемия и заболевания, обусловленные наличием гемоглобинов H и Bart); 2) Г., вызванные нарушением синтеза β и δ-цепей глобина (β-талассемия, β,δ-талассемия); 3) бессимптомное наследственное персистирование фетального гемоглобина, т. е. генетически обусловленное увеличенное содержание гемоглобина F у взрослых.
III. Смешанная группа — двойные гетерозиготные состояния по гену талассемии и гену одной из «качественных» Г.
Клиническая картина
Клиническая картина отличается выраженным полиморфизмом. Для серповидноклеточной анемии (см.) и талассемии (см.) характерно развитие тяжелой гемолитической анемии. Ряд известных сейчас Г. клинически не проявляется; варианты гемоглобина при них скорее являются необычными (семейными), чем патологическими.
Lepore-гемоглобинопатия клинически сходна с талассемией.
Гомозиготная гемоглобинопатия C (CC) характеризуется легкой гемолитической анемией со спленомегалией, умеренной желтухой и билирубинемией, нормобластной гиперплазией костного мозга. В периферической крови множество мишеневидных клеток и выраженные морфологические изменения эритроцитов (анизо- и пойкилоцитоз, полихроматофилия), аномальный гемоглобин С составляет св. 90%, нормальный гемоглобин А отсутствует, содержание гемоглобина F в пределах нормы или несколько увеличено (5—7%). Гемолитические кризы с анемией возникают чаще у беременных женщин.
Гомозиготная гемоглобинопатия D (DD) протекает бессимптомно. В единичных случаях наличие аномального гемоглобина D (DD) может проявляться легкой анемией, микросфероцитозом эритроцитов, повышением осмотической резистентности, укорочением продолжительности жизни эритроцитов.
Гомозиготная гемоглобинопатия E (ЕЕ) по клиническому течению очень сходна с гомозиготной гемоглобинопатией С.
У больных М-гемоглобинопатиями ведущим клиническим признаком является врожденный цианоз вследствие повышенного метгемоглобинообразования (см. Метгемоглобинемия).
Для большинства вариантов Г., обусловленных наличием нестабильных гемоглобинов, характерны хроническая несфероцитарная гемолитическая анемия с периодическим выделением темной мочи (вследствие наличия в ней дипирролов) и выраженный полиморфизм клин, проявлений — от бессимптомных до тяжелых форм.
В мазках периферической крови — гипохромия и морфол, изменения эритроцитов — анизо- и пойкилоцитоз, мишеневидность, наличие телец Гейнца и базофильная пунктация (см. Эритроциты). Гемолиз внутриклеточного типа происходит преимущественно в селезенке, что клинически выражается спленомегалией. Другие признаки (ретикулоцитоз, повышение непрямого билирубина и др.) неспецифичны. Г., обусловленные нестабильными гемоглобинами, следует дифференцировать с гемолитическими и гипохромными анемиями другой этиологии и прежде всего с железо дефицитными анемиями. Ценными в диагностике последних являются пробы на термолабильность гемоглобина [Дейси (J. V. Dacie) с соавт., 1964], обнаружение телец Гейнца, выявление в моче дипирролов. Интенсивность аутогемолиза повышена, она уменьшается при добавлении к крови in vitro глюкозы [I тип гемолиза по Селвину (J. G. Selwyn) и Дейси]. Электрофорез гемоглобина не всегда позволяет выявить аномалию, т. к. некоторые нестабильные гемоглобины имеют нормальную (как у гемоглобина А) электрофоретическую подвижность.
Диагноз
Диагноз ставится на основании клинических и лабораторных признаков повышенного гемолиза (см.). Имеет значение выявление морфол, изменений эритроцитов. Подтверждается диагноз данными электрофореза гемоглобина (при структурных Г.: S, С, D, E и др.), пробой на щелочную устойчивость эритроцитов (при подозрении на наличие гемоглобина F), на стабильность гемоглобинов (при подозрении на наличие нестабильных гемоглобинов)
Лечение
Лечение больных Г. в основном симптоматическое, причем выбор метода зависит от степени активности и стадии развития (криз, ремиссия) заболевания. Могут быть применены методы терапии наследственных гемолитических анемий, однако с поправками и дополнениями, обусловленными особенностями данной разновидности аномального гемоглобина (изменения в обмене железа, наличие у некоторых больных гемолитического синдрома с признаками гиперспленизма). При Г. в период криза необходим постельный режим, диета, богатая белками и витаминами; гемотрансфузии (предпочтительна эритроцитарная масса) назначают при концентрации гемоглобина ниже 8—9 г%. Введение в организм препаратов, связывающих и экскретирующих железо (десферал и др.), целесообразно для профилактики гемосидероза.
Вопросы лечения гемолитических анемий, обусловленных нестабильными гемоглобинами, недостаточно изучены. Эффективны иногда стероидные гормоны. Показаниями к спленэктомии являются рефрактерность к обычным методам терапии, тяжелое течение заболевания с выраженным гемолизом, признаки гиперспленизма и секвестрации эритроцитов преимущественно в селезенке. В период ремиссии больные Гемоглобинопатией подлежат диспансерному наблюдению с санацией инфекционных очагов и своевременному лечению интеркуррентных инфекций. Наблюдение за больными должно быть усилено при беременности, в стрессовых ситуациях (хирургическая операция и др.).
Прогноз зависит от вида Г. и клинического течения заболевания.
Профилактика
Необходимы медико-генетические консультации с целью предупреждения браков между гетерозиготными носителями генов аномальных гемоглобинов или с целью предупреждения (при согласии родителей) рождения больного ребенка. Согласно рекомендациям ВОЗ в районах, эндемичных по аномальным гемоглобинам, должны быть созданы специализированные клиники (диспансеры) с медико-генетическими консультациями. Такие центры в СССР созданы при институтах гематологии и переливания крови (Москва, Баку, Ташкент, Тбилиси).
Гемоглобинопатии у детей протекают тяжело, особенно гомозиготные формы — серповидноклеточная анемия, большая талассемия. Диагностируются начиная с шестимесячного возраста, т. е. в период замены гемоглобина F гемоглобином А.
Физическое развитие больных Г. детей замедляется. Характерен их внешний вид, обусловленный изменением костей и увеличением живота за счет гепатоспленомегалии.
Лечение
Дети, больные серповидноклеточной анемией, нуждаются в гемотрансфузиях при уменьшении уровня гемоглобина ниже 8— 9 г%. Больным талассемией переливают эритроцитарную массу даже при незначительном уменьшении содержания гемоглобина.
Больные Гемоглобинопатией дети подлежат диспансерному наблюдению гематолога, плановой иммунизации, им профилактически вводят гамма-глобулин й назначают препараты фолиевой к-ты для предупреждения ее дефицита в организме. В лечении (и профилактике кризов) Г. у детей большое значение имеет осведомленность родителей о природе Г. и их контакт с врачом.
Прогноз
Без надлежащего ухода и лечения большинство больных детей погибает в возрасте 2—5 лет. Особенно тяжело протекают Г. при сочетании их с нарушениями питания (белково-калорийная недостаточность, Квашиоркор и др.) и присоединении интеркуррентных инфекций (корь, пневмония, острые респираторные заболевания).
Библиография: Алексеев Г. А. и Токарев Ю. Н. Гемоглобинопатии, М., 1969; Эфроимсон В. П. Иммуногенетика, с. 161, М., 1971; Beale D. a. Lehmann H. Abnormal haemoglobins and the genetic code, Nature (Lond.), v. 207, p. 259, 1965; Hutchison H. E. An introduction to the haemoglobinopathies and the methods used for their recognition, L., 1967; Jonxis J. H. P. a. Huisman Т. H. J. A laboratory manual on abnormal haemoglobins, Oxford, 1968; Lehmann H. a. Huntsman R. G. Man’s haemoglobins, Philadelphia, 1974; Necheles T. F., Allen D. M. a. Finkel H. E. Clinical disorders of hemoglobin, structure and synthesis, N. Y., 1969; Treatment of haemoglobinopathies and allied disorders, techn. rep. ser. № 509, Geneva, WHO, 1972.
Гемоглобинопатии. Причины, симптомы и прогноз при гемоглобинопатиях
1. Что такое гемаглобинопатия?
Гемоглобинопатии – группа заболеваний, характеризующихся нарушением структуры гемоглобина или синтеза глобиновых цепей. Для первого вида самой распространённой является серповидно-клеточная анемия. Гемоглобинопатия количественного типа – это большая талассемия, или анемия Кули. В целом, аномалий гемоглобина насчитывается порядка 500 видов, большинство из которых не имеет клинических проявлений. Однако такие заболевания, как анемия, достаточно опасны и выражены специфическим гипоксическим симптомокомплексом.
Гемоглобинопатия – это наследственное заболевание. Поэтому первоочередные профилактические меры обычно направлены на перинатальную диагностику и медико-генетическое консультирование. Для многих видов гемоглобинопатий характерна распространенность в определённых географических границах (Африка, Западная Азия, Кавказ, Индия, Средиземноморье). Наибольшее распространение гемоглобинопатии получили в так называемом «малярийном поясе» – в районах с тропическим и субтропическим климатом.
Наследование этого заболевания влияет на клиническую картину или отсутствие таковой. Проявление унаследованной гемоглобинопатии не зависит ни от пола ребёнка, ни от пола родителя – носителя гена. Только когда оба родителя передают ребёнку ген гемоглобинопатии одного вида, проявляется ярко выраженная симптоматика. Получение признака аномалии гемоглобина от одного родителя может вообще никак не проявляться, оставаясь рецессивным.
Нередко гомозиготное наследование гемоглобинопатии приводит к гибели плода ещё до рождения. Если же ребёнок выживает, то он становится хронически больным с периодами обострений и относительного благополучия в течение всей жизни.
2. Основные симптомы заболевания
3. Диагностика болезни
Помимо визуального изучения клинической картины, для уточнения диагноза могут проводиться: общий анализ крови, электрофорез гемоглобина, проба на щелочную устойчивость эритроцитов.
Поскольку гемоглобинопатия неизлечима, больные могут лишь получать пожизненную симптоматическую медицинскую помощь и соблюдать ряд предписаний, которые снижают частоту и тяжесть обострений.
4. Лечение гемаглобинопатии
Лечение и поддерживающая терапия включают:
Прогноз для больных гемоглобинопатией во многом зависит от типа патологии и степени её влияния на функции организма. Тяжёлые формы вызывают задержку развития и нередко гибель в детском возрасте. Особенно опасным фоном в периоды обострений становятся инфекции. В любом случае больные гемоглобинопатией постоянно находятся под медицинским наблюдением и требуют регулярного обследования и поддерживающих мер.
Гемоглобинопатия что это такое
Отдельные структурные изменения аномальных гемоглобинов по разному влияют на физико-химические свойства, устойчивость и функцию гемоглобина. В значительной мере это зависит от природы структурного сдвига и уровня, на котором происходит аномалия в трехмерном строении молекулы гемоглобина.
Многие из аномальных гемоглобинов не проявляются клиническими признаками заболевания, поскольку биохимическое изменение в той или иной «несущественной» области молекулы лишь в незначительной мере или совсем не влияет на стойкость и функцию гемоглобина.
Однако замена какой-либо аминокислоты в определенной «критической » области одной из цепей может отрицательно повлиять на целостность и функцию молекулы в целом, при этом клиническая реакция в значительной мере будет отражать структурную аномалию.
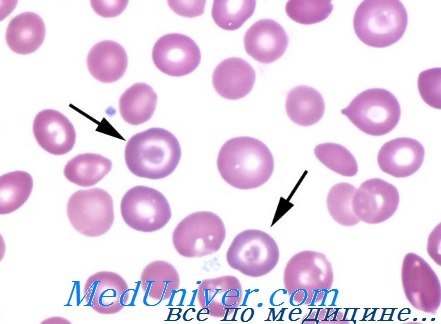
В принципе структурные изменения на поверхности молекулы не влияют на свойства гемоглобина и не вызывают каких-либо клинических последствий. Однако к этой категории относятся и некоторые гемоглобины, структурное изменение которых вызывает глубокие сдвиги физических свойств молекулы, которые, в клиническом плане, проявляются тяжелыми гемолитическими анемиями. Одним из таких примеров служит гемоглобин S.
В нем изменение пространственной конфигурации цепи bs в безкислородной форме обусловливает образование межмолекулярынх связей с цепями ос соседних молекул, а это составляет основу аггрегатов гемоглобина и сиклизации гематий. Другим примером той же категории служит гемоглобин С; заниженная растворимость этого гемоглобина составляет причину изменения формы эритроцитов.
В сохранении устойчивости гемоглобина и нормальной функции переноса О2 особое значение представляют межцепные связи. Структурные аномалии у контакта а1в1г обусловливают утрату молекулярной целостности и развитие гемолитической анемии, характерной отдельным нестойким гемоглобинам (напр. гемоглобин Тасота и гемоглобин Philly).
Обычно внутримолекулярные структурные сдвиги, в частности в отдельных «критических» областях, приводят к неустойчивости молекулы, оседанию в эритроците гемоглобинных подъединиц и образованию телец Гейнца. Связи цепей а1в1 способствуют сохранению явления взаимодействия «гем-гем» и функции переноса О2. Структурные сдвиги на этом уровне изменяют сродство гемоглобина к О2 и его дыхательную функцию (напр. гемоглобин Kempsey, гемоглобин Chesapeake).
Замена аминокислот у места связывания гема с глобином приводит к образованию стойкой связи между «аномальной » аминокислотой и железом гема, при этом Fe2+ преобразуется в Fe3+ и развитию метгемоглобинемии.
В заключении можно утверждать следующее:
а) с клинической точки зрения различные аномальные, известные до настоящего времени, гемоглобины могут обусловить ряд важных синдромов, в том числе, гемолитическую анемию, врожденный цианоз, семейную полицитемию, синдромы, похожие на симптомокомплекс талассемии;
б) клинические аспекты находятся в тесной взаимосвязи с природой и уровнем структурной аномалии в комплексном пространственном строении молекулы гемоглобина.
Ниже приведена схема физиопатогенетической классификации заболеваний гемоглобина, за счет его аномалий.
| Клиническая картина | Гемоглобин | Структурный недостаток | Последствия структурной аномалии |
| I. Гемоглобинопатия в сочетании с гемолитической анемией | Гемоглобин S, гемоглобин С, Гемоглобин Е, гемоглобин D Гемоглобин Zurich Гемоглобин Koln Гемоглобин Hammer-schmith Гемоглобин Gun Hill и т.д. | Снаружи молекулы: — Карман гема — Контакт a1b1 — Пространственная конфигурация цепей глобина | Искажение эритроцита Неустойчивость гемоглобина Образование телец Гейнца |
| II. Гемоглобинопатии в сочетании с наследственной метгемоглобинемией | Гемоглобин М | — Прикрепление гема к глобину | Метгемоглобинизация |
| III. Гемоглобинопатия в сочетании с семейной полицитемией | Гемоглобин Capetown Гемоглобин Yashima Гемоглобин Chesapeake и т.д. | Контакт а1b1 Место связывания 2—3 дифосфоглицерата | Рост сродства к О2 |
| IV. Гемоглобинопатия в сочетании с гемолитической анемией и синюхой | Гемоглобин Kansas | Карман гема | Понижение сродства к О2 |
| V. Гемоглобинопатия в сочетании с клиническим аспектом талассемического синдрома | Гемоглобин Lepore Гемоглобин Constant Spring Гемоглобин Icaria Гемоглобин Коуа Dora | Слияние цепей Гемоглобины удлиннеными цепями | Сокращение коэффициента синтеза гемоглобина |
Диагноз гемоглобинопатии подсказывают данные анамнеза (течение болезни наблюдается уже с детства, наличие одинаковых признаков и у других членов семьи), физические признаки (желтуха или поджелтушное состояние, спленомегалия, цианоз и пр.) и лабораторные исследования (выявляющие анемию, признаки гемолиза, морфологические изменения эритроцитов и пр.).
Клиническое и гематологическое исследование необходимо пополнить специальными обследованиями, способными выявить аномалию гемоглобина. Некоторые из них составлены из простых методов, применение которых доступно любой обычно оснащенной клинической лаборатории, в том числе, реакция сиклизации, определение шелочноустойчивого гемоглобина, окраска для выявления телец Гейнца, тест на тепловую устойчивость и пр.
Все же основным методом в постановке диагноза гемоглобинопатии представляется электрофорез гемоглобина, хотя следует незабывать его пределы (аномальный гемоглобин с похожей на гемоглобин А миграцией, случаи талассемии b и а с электрофорезом в норме и пр.). Способ «fingerprint» и анализ аминокислот, способствующих уточнению структурной аномалии, применяются лишь в специализированных лабораториях. Семейная разведка облегчает диагностирование и уточняет способ наследственной передачи.
Толкование результатов всех отмеченных методов требует опыт специалиста гематолога и сопоставление с полным клиническим и гематологическим обследованием больного.
Течение гемоглобинопатий. В принципе при гетерозиготных формах прогноз хороший и жизнь] больных протекает почти нормально, за исключением отдельных случаев талассемии, при которых может развиться тяжелая гемолитическая анемия. Гетерозиготные формы дрепаноцитоза и талассемии обычно характеризуются тяжелым прогнозом и лишь в небольшом числе случаев больные достигают зрелого возраста.
У гомозиготов в отношении гемоглобина С, Е и D заболевание протекает обычно по виду гемолитической анемии средней тяжести.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021