газ метанол что это такое простыми
Что такое метанол, и как его использовать для повседневного автомобиля!
С одной стороны мы можем «загнать» в цилиндр больше кислорода, но, с другой, вода испаряется, оставляя меньше места для кислорода. Получается, что оба фактора нейтрализуют друг друга! Если бы не одно «но» — вода, испаряясь, увеличивается в объеме, а значит, и увеличивается давление внутри цилиндра, а, значит, наблюдается и прирост мощности — около 10%
Нелишним будет напомнить, что ни одна система не может полноценно использоваться без соответствующей настройки двигателя — это или забеднение смеси, или увеличения давления, или более раннее зажигание.
А теперь про метанол. Законы физики никто не отменял, и спирт горит гораздо медленнее, нежели бензин, благодаря чему давление в цилиндрах нарастает более планомерно, и его пик возникает позже. Что происходит? Увеличивается момент, а, следовательно, и мощность, которая напрямую зависит от соотношения момента и числа оборотов. Вот и еще около 30 лошадок!
Но самое «вкусное» — правильно установленная и настроенная система абсолютно безопасна для двигателя! Даже более — как уже было сказано, вода препятствует отложению карбоновых соединений! Словом, когда сгниет все железо, мотор еще твоим внукам достанется.
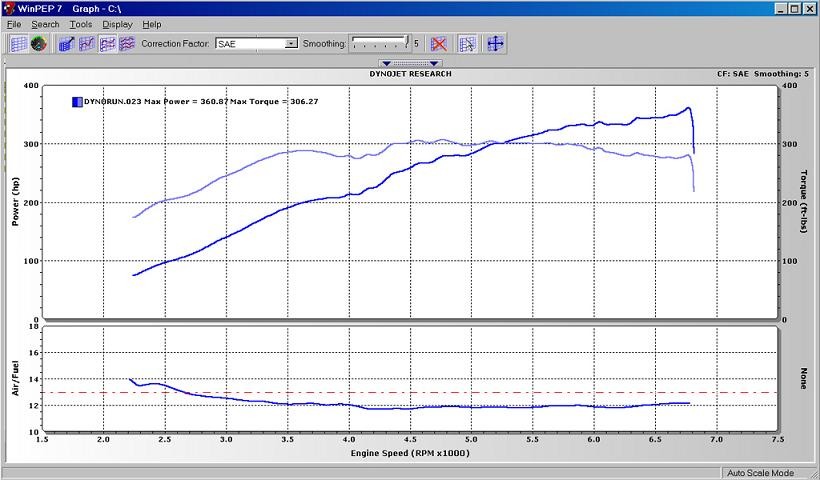
теперь я покажу почему это поможет именно «вам» и почему это на мой взгляд нужно — качества бензина оставляет желать лучшего, потому возникает проблема на турбомоторах с давлением, на этом фото изображен график детонации моей машины из которого отлично видно что уровень детонации упал почти вдвое :
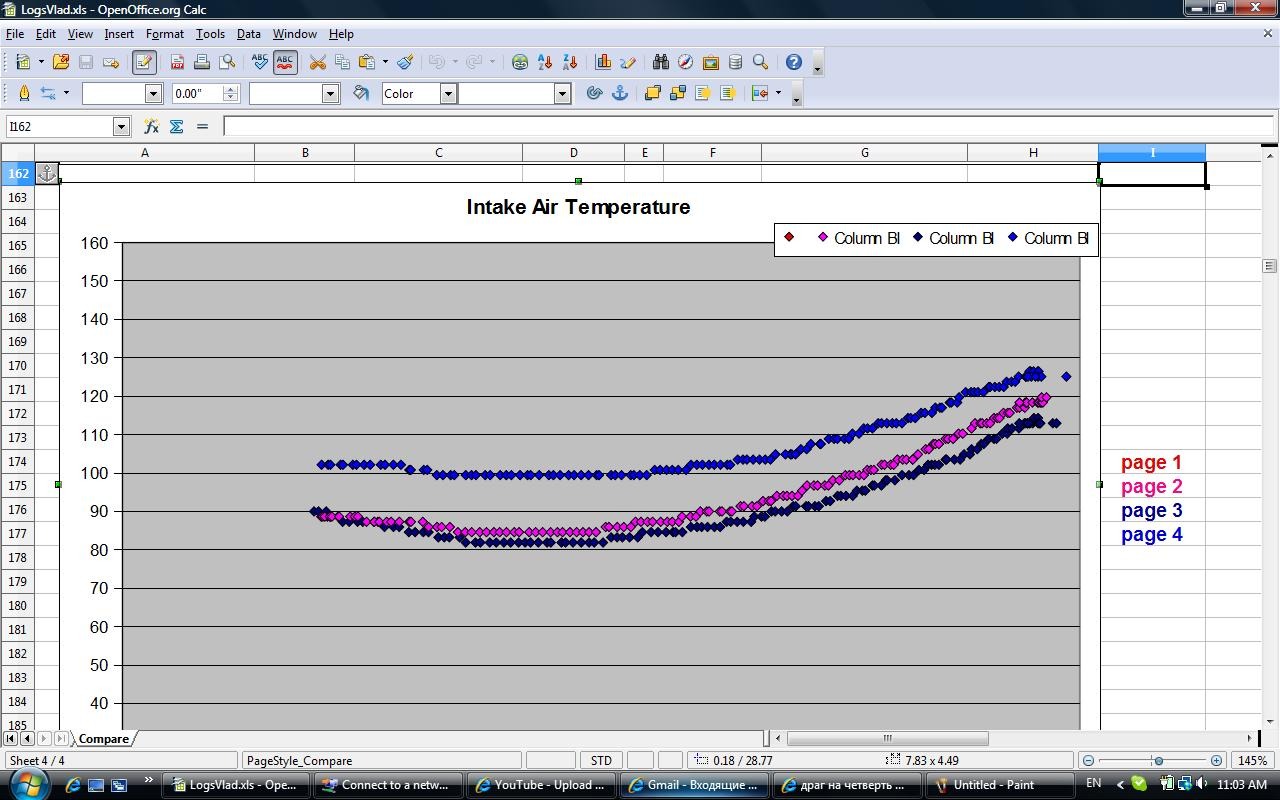
а этот график разницы температуры входящего воздуха в фаренгейтах при разной дозе метанола и воды (доза регулируется прямо из салона автомобиля специальным пультом ):
на следующих фото разница в мощности, причем что примечательно чем больше буст тем больше разница в мощности :
Метанол
Метанол – один из наиболее важных по значению крупнотоннажных продуктов химической промышленности.
На сегодняшний день этот рынок напрямую зависит от мировой конъюнктуры, которая пока остается весьма благоприятной ввиду относительной дешевизны российского природного газа и электроэнергии.
В настоящее время РФ является одним из наиболее крупных игроков на мировом рынке метанола, занимая 4 е место по объемам его выпуска после.
Несмотря на экспортную направленность, многие российские производители метанола в последние годы стали больше внимания уделять глубине переработки продукта.
Переработка метанола в последующие продукты экономически более выгодна, чем продажа его в чистом виде.
Побочные реакции при производстве обуславливают бесполезный расход синтез-газа и удорожают очистку метанола.
Степень превращения СО за проход составляет 15-50%, при этом в контактных газах содержится только –4% метанола.
С целью возможно более полной переработки синтез-газа необходимо его возвращение в цикл после выделения метанола и воды.
При циркуляции в синтез-газе накапливаются инертные примеси, что приводит к снижению давления в системе и повлечет за собой снижение выхода и скорости процесса.
Поэтому концентрацию инертных примесей регулируют частичной отдувкой циркуляционного газа. Отдувка проводится с таким расчетом, чтобы количество инертов, поступающих со свежем синтез-газом, было равно количеству инертов, удаляемых с отдувкой.
В Госдуме предложили запретить продажу метилового спирта в России
«Целесообразности производства и продажи метилового спирта нет»
Член думского Комитета по безопасности и противодействию коррупции Султан Хамзаев обратился к кабмину с инициативой запретить продажу метанола в России. Соответствующее письмо (оно есть в распоряжении «Газеты.Ru») отправлено в адрес премьер-министра Михаила Мишустина.
По его словам, профильные министерства не могут обеспечить безопасность населения в этой сфере.
«В связи с чудовищными последствиями от бесконтрольной реализации метилового спирта, а также наличием аналогов для промышленных, бытовых целей, предлагаю запретить продажу метилового спирта в Российской Федерации»,
— говорит Хамзаев в обращении к правительству.
Парламентарий подчеркивает, что с июня по октябрь 2021 года в Татарстане, Чувашии, Карелии, Ненецком автономном округе, Мордовии, в Кировской, Тамбовской, Ленинградской, Курганской Ярославской областях, а также в Санкт-Петербурге и на Алтае правоохранители возбудили 24 уголовных дела, связанных с оборотом метилового спирта.
Ранее, 16 октября, стало известно о 13 казанских студентах, которые отравились метанолом во время вечеринки – они употребляли алкоголь, купленный у знакомого.
«Метиловый спирт опасен тем, что может привести к летальному исходу. При этом отравиться можно малой дозой: 30-50 мл уже могут привести к необратимой атрофии зрительного нерва и судорожным припадкам», — рассказал нарколог Алексей Казанцев.
По его мнению, запрет продажи метанола, действительно, может оградить людей от опасности.
«Я считаю, что это помогло бы. На днях я участвовал в обсуждении метилового спирта с представителями рынка: и они подчеркнули, что утечки, в основном, происходят с производства. Его выносят оттуда на продажу», — пояснил он.
Однако эксперты в области фальсификации продуктов относятся к инициативе со скепсисом.
«Незаконный оборот этилового спирта (используется для производства алкоголя – «Газета.Ru») тоже запрещен, и тем не менее он есть. И его доля огромна. По некоторым данным, половина всего алкоголя в России находится в тени. При этом метиловый спирт – не предмет розничный торговли, это продукт химической промышленности. Он попадает к потребителю следующим образом: из-за длинной цепочки посредников в обороте незаконного алкоголя в какой-то момент всплывают емкости с метиловым спиртом – его невозможно отличить от этилового по цвету или запаху.
— рассказал эксперт по фальсификации напитков и продуктов питания Андрей Аленичев.
«Метанол – это не подарок»
Полностью запретить оборот метанола не получится, уверен директор клуба профессионалов алкогольного рынка Санкт-Петербурга Максим Черниговский.
«Метиловый спирт широко используется в промышленности: например, в лакокрасочной. Поэтому его полный запрет не представляется возможным. Другой вопрос, что нужно ужесточить контроль за его оборотом», — считает он.
В российском сегменте интернета, по его словам, сегодня работают 3 тыс. сайтов, с контрафактным алкоголем – часть его содержит метиловый спирт.
«Для оборота метилового спирта стоит ввести те же правила регулирования, что существуют для этилового. Под копирку просто. В первую очередь, все, что касается лицензированной торговли и регистрации в Единой государственной автоматизированной информационной системе (ЕГАИС) – она контролирует все этапы производства и продажи этилового спирта. Можно сделать то же самое для метилового», — уточнил он.
Метиловый спирт в промышленном производстве можно заменить, отметил кандидат технических наук, профессор кафедры общей и неорганической химии Губкинского университета Владимир Рыбальченко.
«Например, в лакокрасочной промышленности метиловый спирт используют как растворитель. И здесь, конечно, есть аналоги: любые другие спирты будут вести себя примерно так же. Но в отличие от метилового спирта, более высокомолекулярные спирты — этиловый, изопропиловый, менее токсичны. Ну, и в лакокрасочной промышленности сегодня есть тенденция перехода от токсичных веществ на водную основу», — объяснил он.
Метиловый спирт, добавил он, используется в газовой промышленности. Многие месторождения находятся в зоне вечной мерзлоты, и низкая температура способствует образованию газовых гидратов, когда один объем воды поглощает до 400 объемов газа. В итоге получается снегообразная масса – замершая вода и газ в ней.
«Добывают газ из гидрата при помощи метанола. Но метанол остается в природе, а это не подарок. Метанол проще всего и дешевле всего, но принципиально от этого надо отказываться, мы заливаем природу метанолом», — сказал Рыбальченко.
Найти аналоги для производства действительно можно, согласен Андрей Аленичев. Однако для промышленников это может обернуться огромными тратами на переоснащение предприятий. Кроме того, заменитель метилового спирта может оказаться дороже, чем он сам.
Метанол: химические свойства и получение
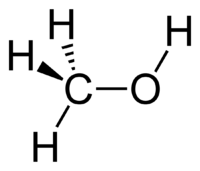
Метанол CH3OH, метиловый спирт – это органическое вещество, предельный одноатомный спирт .
Общая формула предельных нециклических одноатомных спиртов: CnH2n+2O.
Строение метанола
В молекулах спиртов, помимо связей С–С и С–Н, присутствуют ковалентные полярные химические связи О–Н и С–О.
| Электроотрицательность кислорода (ЭО = 3,5) больше электроотрицательности водорода (ЭО = 2,1) и углерода (ЭО = 2,4). |
Электронная плотность обеих связей смещена к более электроотрицательному атому кислорода:
Водородные связи и физические свойства метанола
Спирты образуют межмолекулярные водородные связи. Водородные связи вызывают притяжение и ассоциацию молекул спиртов:
Поэтому метанол – жидкость с относительно высокой температурой кипения (температура кипения метанола +64,5 о С).
Водородные связи образуются не только между молекулами метанола, но и между молекулами метанола и воды. Поэтому метанол очень хорошо растворимы в воде. Молекулы метанола в воде гидратируются:
| Чем больше углеводородный радикал, тем меньше растворимость спирта в воде. Чем больше ОН-групп в спирте, тем больше растворимость в воде. |
Метанол смешивается с водой в любых соотношениях.
Изомерия метанола
Для метанола не характерно наличие структурных изомеров – ни изомеров углеродного скелета, ни изомеров положения гидроксильной группы, ни межклассовых изомеров.
Химические свойства метанола
Метанол – органическое вещество, молекула которого содержит, помимо углеводородной цепи, одну группу ОН.
1. Кислотные свойства метанола
| Метанол – неэлектролит, в водном растворе не диссоциирует на ионы; кислотные свойства у него выражены слабее, чем у воды. |
1.1. Взаимодействие с раствором щелочей
Метанол с растворами щелочей практически не реагирует, т. к. образующиеся алкоголяты почти полностью гидролизуются водой.
Равновесие в этой реакции так сильно сдвинуто влево, что прямая реакция не идет. Поэтому метанол не взаимодействуют с растворами щелочей.
1.2. Взаимодействие с металлами (щелочными и щелочноземельными)
Метанол взаимодействуют с активными металлами (щелочными и щелочноземельными). При этом образуются алкоголяты. При взаимодействии с металлами спирты ведут себя, как кислоты.
Метилаты под действием воды полностью гидролизуются с выделением спирта и гидроксида металла.
| Например, метилат калия разлагается водой: |
CH3OK + H2O → CH3-OH + KOH
2. Реакции замещения группы ОН
2.1. Взаимодействие с галогеноводородами
При взаимодействии метанола с галогеноводородами группа ОН замещается на галоген и образуется галогеналкан.
| Например, метанол реагирует с бромоводородом. |
2.2. Взаимодействие с аммиаком
Гидроксогруппу спиртов можно заместить на аминогруппу при нагревании спирта с аммиаком на катализаторе.
| Например, при взаимодействии метанола с аммиаком образуется метиламин. |
2.3. Этерификация (образование сложных эфиров)
Метанол вступает в реакции с карбоновыми кислотами, образуя сложные эфиры.
| Например, метанол реагирует с уксусной кислотой с образованием метилацетата (метилового эфира уксусной кислоты): |
2.4. Взаимодействие с кислотами-гидроксидами
Спирты взаимодействуют и с неорганическими кислотами, например, азотной или серной.
| Например, метанол взаимодействует с азотной кислотой : |
3. Реакции замещения группы ОН
В присутствии концентрированной серной кислоты от метанола отщепляется вода. Процесс дегидратации протекает по двум возможным направлениям: внутримолекулярная дегидратация и межмолекулярная дегидратация.
3.2. Межмолекулярная дегидратация
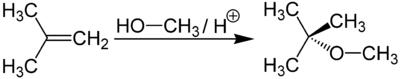
При низкой температуре (меньше 140 о С) происходит межмолекулярная дегидратация по механизму нуклеофильного замещения: ОН-группа в одной молекуле спирта замещается на группу OR другой молекулы. Продуктом реакции является простой эфир.
| Например, при дегидратации метанола при температуре до 140 о С образуется диметиловый эфир: |
4. Окисление метанола
Реакции окисления в органической химии сопровождаются увеличением числа атомов кислорода (или числа связей с атомами кислорода) в молекуле и/или уменьшением числа атомов водорода (или числа связей с атомами водорода).
В зависимости от интенсивности и условий окисление можно условно разделить на каталитическое, мягкое и жесткое.
| Метанол окисляется сначала в формальдегид, затем в углекислый газ: Метанол → формальдегид → углекислый газ |
Типичные окислители — оксид меди (II), перманганат калия KMnO4, K2Cr2O7, кислород в присутствии катализатора.
Легкость окисления спиртов уменьшается в ряду:
метанол
4.1. Окисление оксидом меди (II)
Метанол можно окислить оксидом меди (II) при нагревании. При этом медь восстанавливается до простого вещества. Метанол окисляется до метаналя.
| Например, метанол окисляется оксидом меди до муравьиного альдегида |
4.2. Окисление кислородом в присутствии катализатора
Метанол можно окислить кислородом в присутствии катализатора (медь, оксид хрома (III) и др.). Метанол окисляется до метаналя.
4.3. Жесткое окисление
При жестком окислении под действием перманганатов или соединений хрома (VI) метанол окисляется до углекислого газа.
| Спирт/ Окислитель | KMnO4, кислая среда | KMnO4, H2O, t |
| Метанол СН3-ОН | CO2 | K2CO3 |
| Например, при взаимодействии метанола с перманганатом калия в серной кислоте образуется углекислый газ |
4.4. Горение метанола
При сгорании спиртов образуются углекислый газ и вода и выделяется большое количество теплоты.
| Например, уравнение сгорания метанола: |
5. Дегидрирование спиртов
При нагревании спиртов в присутствии медного катализатора протекает реакция дегидрирования. При дегидрировании метанола образуется альдегид.
Получение метанола
1. Щелочной гидролиз галогеналканов
При взаимодействии галогеналканов с водным раствором щелочей образуются спирты. Атом галогена в галогеналкане замещается на гидроксогруппу.
| Например, при нагревании хлорметана с водным раствором гидроксида натрия образуется метанол |
2. Гидратация алкенов
Гидратация (присоединение воды) алкенов протекает в присутствии минеральных кислот. При присоединении воды к алкенам образуются спирты.
Однако получить метанол гидратацией алкенов нельзя.
3. Гидрирование карбонильных соединений
Присоединение водорода к альдегидам и кетонам протекает при нагревании в присутствии катализатора. При гидрировании альдегидов образуются первичные спирты, при гидрировании кетонов — вторичные спирты, а из формальдегида образуется метанол.
| Например, при гидрировании формальдегида образуется метанол |
CH2=O + H2 → CH3-OH
4. Промышленное получение метанола из «синтез-газа»
Каталитический синтез метанола из монооксида углерода и водорода при 300-400°С и давления 500 атм в присутствии смеси оксидов цинка, хрома и др.
Сырьем для синтеза метанола служит «синтез-газ» (смесь CO и H2), обогащенный водородом:
Метанол
| Метанол | |
 | |
 | |
 | |
| Общие | |
|---|---|
| Систематическое наименование | Метанол |
| Традиционные названия | Метиловый спирт, древесный спирт, карбинол, метилгидрат, гидроксид метила |
| Химическая формула | СН3OH |
| Физические свойства | |
| Состояние (ст. усл.) | жидкость |
| Молярная масса | 32,04 г/моль |
| Плотность | 0,7918 г/см³ |
| Динамическая вязкость (ст. усл.) | 5.9×10 −4 Па·с (при 20 °C) |
| Термические свойства | |
| Температура плавления | -97 °C |
| Температура кипения | 64,7 °C |
| Температура разложения | 320-380 °C |
| Температура вспышки | 11 °C |
| Температура воспламенения | 467 °C |
| Температура самовоспламенения | 436 °C |
| Пределы взрываемости | 6,0-34,7 % |
| Тройная точка | 175,45 K (−97,7°C) |
| Критическая точка | 513,15 K (240 °C), 7,85 МПа |
| Энтальпия образования (ст. усл.) | -201,6 кДж/моль |
| Удельная теплота испарения | 8.43 ккал/моль = 1,101 кДж/г Дж/кг |
| Удельная теплота испарения | 1190 кДж/кг (20 °C) |
| Давление пара | 11,8 кПа (при 20 °С) |
| Химические свойства | |
| pKa | |
| Структура | |
| Дипольный момент | 1,65 Д |
| Классификация | |
| Рег. номер CAS | 67-56-1 |
| SMILES | CO |
| Безопасность | |
| Токсичность |    |
С воздухом в объёмных концентрациях 6,72—36,5% образует взрывоопасные смеси (температура вспышки 15,6 °C). Метанол смешивается в любых соотношениях с водой и большинством органических растворителей.
Содержание
Получение
До 1960-х годов метанол синтезировали только на цинкхромовом катализаторе при температуре 300—400 °C и давлении 25—40 МПа (= 250—400 Бар = 254,9—407,9 кгс/см²). Впоследствии распространение получил синтез метанола на медьсодержащих катализаторах (медьцинкалюмохромовом, медь-цинкалюминиевом или др.) при 200—300 °C и давлении 4—15 МПа (= 40—150 Бар = 40,79—153 кгс/см²).
Современный промышленный метод получения — каталитический синтез из оксида углерода(II) (CO) и водорода (2H2) при следующих условиях:
До промышленного освоения каталитического способа получения метанол получали при сухой перегонке дерева (отсюда его название «древесный спирт»). В данное время этот способ имеет второстепенное значение.
Также известны схемы использования с этой целью отходов нефтепереработки, коксующихся углей.
Молекулярная формула — CH4O или CH3—OH, а структурная: 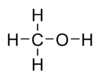

Производство метанола (в тыс. тон):
| год | США | Германия | Мир | Цена продажи($/т) |
|---|---|---|---|---|
| 1928 | 24 | 18 | 140 | 84,7 |
| 1936 | 97 | 93 | 305 | 88,9 |
| 1950 | 360 | 120 | 349 | 83,1 |
| 1960 | 892 | 297 | 3930 | 99,7 |
| 1970 | 2238 | нет данных | 5000 | 89,7 |
| 1980 | 3176 | 870 | 15000 | 236,1 |
| 2004 | 3700 | 2000 | 32000 | 270 |
Крупнейшим производителем метанола в России является ОАО «Метафракс» в Губахе.
Применение
В органической химии метанол используется в качестве растворителя.
Метанол используется в газовой промышленности для борьбы с образованием гидратов (из-за низкой температуры замерзания и хорошей растворимости). В органическом синтезе метанол применяют для выпуска формальдегида, формалина, уксусной кислоты и ряда эфиров (например, МТБЭ и ДМЭ), изопрена и др.
Наибольшее его количество идёт на производство формальдегида, который используется для производства карбамидоформальдегидных и фенолформальдегидных смол. Значительные количества CH3OH используют в лакокрасочной промышленности для изготовления растворителей при производстве лаков. Кроме того, его применяют (ограниченно из-за гигроскопичности и отслаивания) как добавку к жидкому топливу для двигателей внутреннего сгорания. Используется в топливных элементах.
Благодаря высокому октановому числу, что позволяет увеличить степень сжатия до 16 и большей на 20 % энергетической мощностью заряда на основе метанола и воздуха, метанол используется для заправки гоночных мотоциклов и автомобилей. Метанол горит в воздушной среде, и при его окислении образуется двуокись углерода и вода:
Для получения биодизеля растительное масло переэтерифицируется метанолом при температуре 60 °C и нормальном давлении приблизительно так: 1 т масла + 200 кг метанола + гидроксид калия или натрия.
Во многих странах метанол применяется в качестве денатурирующей добавки к этанолу при производстве парфюмерии. В России использование метанола в потребительских товарах запрещено.
При добыче газа гидраты могут образовываться в стволах скважин, промысловых коммуникациях и магистральных газопроводах. Отлагаясь на стенках труб, гидраты резко уменьшают их пропускную способность. Для борьбы с образованием гидратов на газовых промыслах вводят в скважины и трубопроводы различные ингибиторы (метиловый спирт, гликоли).
Работа топливных элементов основана на реакции окисления метанола на катализаторе в диоксид углерода. Вода выделяется на катоде. Протоны (H + ) проходят через протонообменную мембрану к катоду где они реагируют с кислородом и образуют воду. Электроны проходят через внешнюю цепь от анода к катоду снабжая энергией внешнюю нагрузку.
Получение муравьиной кислоты окислением метанола:
Получение диметилового эфира дегидратацией метанола при 300—400 °C и 2-3 МПа в присутствии гетерогенных катализаторов — алюмосиликатов — степень превращения метанола в диметиловый эфир — 60 % или цеолитов — селективность процесса близка к 100 %. Диметиловый эфир (C2H6O) — экологически чистое топливо без содержания серы, содержание оксидов азота в выхлопных газах на 90 % меньше, чем у бензина. Цетановое число диметилового дизеля более 55, при том что у классического нефтяного 38-53.
Метил-трет-бутиловый эфир получается при взаимодействии метанола с изобутиленом в присутствии кислых катализаторов (например, ионообменных смол).
Метил-трет-бутиловый эфир (C5H12O) применяется в качестве добавки к моторным топливам, повышающей октановое число бензинов (антидетонатор). Максимальное законодательное содержание МТБЭ в бензинах Европейского союза — 15 %, в Польше — 5 %. В России в среднем составе бензинов содержание МТБЭ составляет до 12 % для АИ92 и до 15 % для АИ95, АИ98.
Гомологизация метанола
Гомологизация, то есть превращение органического соединения в свой гомолог путём внедрения одной или нескольких метиленовых групп, для спиртов была впервые осуществлена в 1940 году — на основе метанола каталитическим путём под воздействием высокого давления был синтезирован этанол [3] :
Побочными продуктами реакции в случае синтеза этанола будут ацетальдегид, этилен и диэтиловый эфир.
В 1940 году впервые была осуществлена катализируемая оксидом кобальта при давлении 600 атм реакция метанола с синтез-газом с образованием в качестве основного продукта этанола… Впоследствии эта реакция, названная гомологизацией, вызвала огромный интерес у химиков. Ее привлекательность связана с возможностью получения этилена из угольного сырья Применение в качестве катализаторов карбонила кобальта Со2(СО)8 позволило понизить давление до 250 атм, при этом степень превращения метанола составила 70 %, а основной продукт — этанол образовывался с селективностью 40 %. В дальнейшем были предложены более селективные катализаторы на основе соединений кобальта и рутения с добавками фосфиновых лигандов и было установлено, что реакцию можно ускорить с помощью введения промоторов — иодид-ионов. В настоящее время удалось достичь селективности по этанолу 90 %. Хотя механизм гомологизации до конца не установлен, можно считать, что он близок к механизму карбонилирования метанола.
Биометанол
Промышленное культивирование и биотехнологическая конверсия морского фитопланктона рассматривается как одно из наиболее перспективных направлений в области получения биотоплива. [5]
В начале 80-х рядом европейских стран совместно разрабатывался проект, ориентированный на создание промышленных систем с использованием прибрежных пустынных районов. Осуществлению этого проекта помешало общемировое снижение цен на нефть.
Первичное производство биомассы осуществляется путём культивирования фитопланктона в искусственных водоёмах, создаваемых на морском побережье.
Вторичные процессы представляют собой метановое брожение биомассы и последующее гидроксилирование метана с получением метанола.
Основными доводами в пользу использования микроскопических водорослей являются следующие:
С точки зрения получения энергии данная биосистема имеет существенные экономические преимущества по сравнению с другими способами преобразования солнечной энергии.
Метанол в качестве топлива
При применении метанола в качестве топлива следует отметить, что объемная и массовая энергоемкость (теплота сгорания) метанола (удельная теплота сгорания = 22,7 МДж/кг) на 40—50 % меньше, чем бензина, однако при этом теплопроизводительность спиртовоздушных и бензиновых топливовоздушных смесей при их сгорании в двигателе различается незначительно по той причине, что высокое значение теплоты испарения метанола способствует улучшению наполнения цилиндров двигателя и снижению его теплонапряженности, что приводит к повышению полноты сгорания спиртовоздушной смеси. В результате этого рост мощности двигателя повышается на 10—15 %. Двигатели гоночных автомобилей работающих на метаноле с более высоким октановым числом чем бензин имеют степень сжатия, превышающую 15:1, в то время как в обычном ДВС с искровым зажиганием степень сжатия для неэтилированного бензина как правило, не превышает 11,5:1. Метанол может использоваться как в классических двигателях внутреннего сгорания, так и в специальных топливных элементах для получения электричества.
| Топливо | Плотность энергии | Смесь воздуха с топливом | Удельная энергия смеси воздуха | Удельная теплота испарения | Октановое число (RON) | Октановое число (MON) |
|---|---|---|---|---|---|---|
| Бензин | 32 МДж/л | 14,6 | 2,9 МДж/кг воздух | 0,36 МДж/кг | 91—99 | 81—89 |
| Бутиловый спирт | 29,2 МДж/л | 11,1 | 3,2 МДж/кг воздух | 0,43 МДж/кг | 96 | 78 |
| Этанол | 19,6 МДж/л | 9,0 | 3,0 МДж/кг воздух | 0,92 МДж/кг | 132 | 89 |
| Метанол | 16 МДж/л | 6,4 | 3,1 МДж/кг воздух | 1,2 МДж/кг | 156 | 92 |
Низкий уровень примесей метанола может быть использован в топливе существующих транспортных средств с использованием надлежащих ингибиторов коррозии. Т. н. европейская директива качества топлива (European Fuel Quality Directive) позволяет использовать до 3 % метанола с равным количеством присадок в бензине, продаваемoм в Европе. Сегодня в Китае используется более 1000 млн галлонов метанола в год в качестве транспортного топлива в смесях низкого уровня, используемых в существующих транспортных средств, а также высокоуровневые смеси в транспортных средствах, предназначенных для использования метанола в качестве топлива.
Свойства метанола и его реакции
Метанол — бесцветная жидкость с запахом, напоминающим запах этилового спирта, но более слабым. Ощущается как запах вина. Температура кипения 64,7°.
Удельный вес при 0°/0° = 0,8142 (Копп); при 15°/15° = 0,79726; при 25°/25° = 0,78941 (Perkin); при 64,8°/4° = 0,7476 (Шифф); при 0°/4° = 0,81015; при 15,56°/4° = 0,79589 (Dittmar и Fawsitt). Капиллярная постоянная при температуре кипения a ² =5,107 (Шифф); Критическая температура 241,9° (Шмидт). Упругость пара при 15° = 72,4 мм; при 29,3° = 153,4 мм; при 43° = 292,4 мм; при 53° = 470,3 мм; при 65,4° = 756,6 мм (Д. Коновалов). Теплота горения равна 170,6, теплота образования 61,4 (Штоман, Клебер и Лангбейн).
Метанол смешивается во всех отношениях с водой, этиловым спиртом и эфиром; при смешении с водой происходит сжатие и разогревание. Горит синеватым пламенем. Подобно этиловому спирту — сильный растворитель, вследствие чего во многих случаях может заменять этиловый спирт. Безводный метанол, растворяя небольшое количество медного купороса, приобретает голубовато-зеленое окрашивание, поэтому безводным медным купоросом нельзя пользоваться для открытия следов воды в метаноле; но он не растворяет CuSO4.7H2O (Клепль).
Метанол (в отличие от этанола) с водой не образует азеотропной смеси, в результате чего смеси вода-метанол могут быть разделены ректификационной перегонкой. Температура кипения водных растворов метанола:
| Methanol Mole % | Т_кип, 760 мм.рт.ст. °C |
|---|---|
| 0 | 100 |
| 5 | 92.8 |
| 10 | 88.3 |
| 15 | 84.8 |
| 20 | 82 |
| 25 | 80.1 |
| 30 | 78.2 |
| 35 | 76.8 |
| 40 | 75.6 |
| 45 | 74.5 |
| 50 | 73.5 |
| 55 | 72.4 |
| 60 | 71.6 |
| 65 | 70.7 |
| 70 | 69.8 |
| 75 | 68.9 |
| 80 | 68 |
| 85 | 67.1 |
| 90 | 66.3 |
| 95 | 65.4 |
| 100 | 64.6 |
Метанол дает со многими солями соединения, подобные кристаллогидратам (сольваты), например: CuSO4 ∙ 2СН3ОН; LiCl ∙ 3СН3ОН; MgCl2 ∙ 6СН3ОН; CaCl2 ∙ 4СН3ОН представляет собой шестисторонние таблицы, разлагаемые водой, но не разрушаемые нагреванием до 100° (Kane). Соединение ВаО ∙ 2СН3ОН ∙ 2Н2O получается в виде блестящих призм при растворении ВаО в водном Метаноле и испарении на холоде полученной жидкости при комнатной температуре (Форкранд).
С едкими щелочами метанол образует соединения 5NaOH ∙ 6СН3ОН; 3KOH ∙ 5СН3OH (Геттиг). При действии металлических калия и натрия легко дает алкоголяты, присоединяющие к себе кристаллизационный метанол и иногда воду.
При пропускании паров метанола через докрасна накаленную трубку получается C2H2 и др. продукты (Бертло). При пропускании паров метанола над накаленным цинком получается окись углерода, водород и небольшие количества болотного газа (Jahn). Медленное окисление паров метанола при помощи раскаленной платиновой или медной проволоки представляет лучшее средство для получения больших количеств формальдегида: 2СН3ОН+О2=2НСНО+2Н2О. При действии хлористого цинка и высокой температуры метанол дает воду и алканы, а также небольшие количества гексаметилбензола (Лебедь и Грин). Метанол, нагретый с нашатырем в запаянной трубке до 300°, дает моно-, ди- и триметиламины (Бертло).
При пропускании паров метанола над KOH при высокой температуре выделяется водород и образуются последовательно муравьинокислый, щавелевокислый и, наконец, углекислый калий.
Концентрированная серная кислота дает метилсерную кислоту CH3HSO4, которая при дальнейшем нагревании с Метанолом дает метиловый эфир (см.). При перегонке метанола с избытком серной кислоты в отгон переходит диметилсерная кислота (CH3)2SO4. При действии серного ангидрида SO3 получается CH(OH)(SO3H)2 и CH2(SO3H)2 (см. Метилен).
Метанол при действии соляной кислоты, пятихлористого фосфора и хлористой серы дает хлористый метил СН3Cl. Действием HBr и H2SO4 получают бромистый метил. Подкисленный 5%-й серной кислотой и подвергнутый электролизу, метанол дает СО2, СО, муравьинометиловый эфир, метилсерную кислоту и метилаль СН2(ОСН3)2 (Ренар). При нагревании метанола с хлористо-водородными солями ароматических оснований (анилином, ксилидином, пиперидином) легко происходит замещение водорода в бензольном ядре метилом (Гофман, Ладенбург); реакция имеет большое техническое значение при приготовлении метилрозанилина и других искусственных пигментов.
Нахождение в природе
В свободном состоянии [9] метиловый спирт встречается в природе лишь изредка и в очень небольших количествах (например в эфирных маслах), но производные его распространены довольно широко. Так, например, многие растительные масла содержат сложные эфиры метилового спирта: масла гаултерии — метиловый эфир салициловой кислоты С6H4(OH)COOCH3, масло жасмина — метиловый эфир антраниловой кислоты С6H4(NH2)COOCH3. Простые эфиры метилового спирта чрезвычайно часто встречаются среди природных веществ, например природных красителей, алкалоидов и т. п.
В промышленности метиловый спирт раньше получали исключительно путём сухой перегонки дерева. В жидких погонах, так называемом «древесном уксусе», наряду с уксусной кислотой (10 %), ацетоном (до 0,5 %), ацетальдегидом, аллиловым спиртом, метилацетатом, аммиаком и аминами содержится также 1,5-3 % метилового спирта. Для отделения уксусной кислоты продукты сухой перегонки пропускают через горячий раствор известкового молока, задерживающий её в виде уксуснокислого кальция. Значительно труднее отделить метиловый спирт от ацетона, так как температуры кипения их очень близки (ацетон, т.кип.56,5°; метиловый спирт, т.кип. 64,7°). Все же путём тщательной ректификации на соответствующих колоннах в технике удается почти полностью отделить метиловый спирт от сопутствующего ему ацетона. Неочищенный метиловый спирт называется также «древесным спиртом».
Токсичность
Как указано в руководстве для врача скорой медицинской помощи, при отравлении метанолом антидотом является этанол, который вводится внутривенно в форме 10 % раствора капельно или 30—40 % раствора перорально из расчёта 1—2 грамма раствора на 1 кг веса в сутки. [13] Полезный эффект в этом случае обеспечивается отвлечением АДГ I на окисление экзогенного этанола. [14]
Следует учесть, что при недостаточно точном диагнозе за отравление метанолом можно принять алкогольную интоксикацию, отравление дихлорэтаном или четырёххлористым углеродом — в этом случае введение дополнительного количества этилового спирта опасно. [13]